È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Perfusione retrograda e riempimento del sistema vascolare coronarico mouse come preparazione per la Micro Computed Tomography Imaging
In questo articolo
Riepilogo
Visualizzazione dei vasi coronarici è fondamentale per avanzare la nostra comprensione delle malattie cardiovascolari. Qui si descrive un metodo per la perfusione vascolare coronarica murino con una gomma di silicone radiopaco (Microfil), in preparazione per le micro-Tomografia Computerizzata (μCT) imaging.
Abstract
Visualizzazione della vascolarizzazione sta diventando sempre più importante per capire molti stati patologici diversi. Mentre esistono diverse tecniche per l'imaging vascolare, pochi sono in grado di visualizzare la rete vascolare nel suo insieme, mentre si estende a una risoluzione che include il 1,2 imbarcazioni più piccole. Inoltre, molte tecniche di fusione vascolari distruggere il tessuto circostante, impedendo ulteriori analisi del campione 3-5. Un metodo che elude questi temi è micro-Tomografia Computerizzata (μCT). μCT possibile eseguire la scansione di immagini con risoluzione inferiore a 10 micron, è capace di produrre ricostruzioni 3D della rete vascolare, e lascia intatto il tessuto per l'analisi successiva (ad esempio, l'istologia e la morfometria) 6-11. Tuttavia, navi imaging di ex vivo metodi μCT richiede che i vasi da riempire con un composto radiopaco. Come tale, la rappresentazione accurata di vasi prodotta da μCT immagini è subordinatoriempimento affidabile e completa dei vasi. In questo protocollo, si descrive una tecnica per il riempimento di vasi coronarici del mouse in preparazione per l'imaging μCT.
Due tecniche predominano esistono per il riempimento del sistema vascolare coronarico: in vivo via cannulazione e perfusione retrograda dell'aorta (o di un ramo dell'arco aortico) 12-14, o ex vivo mediante un sistema di perfusione Langendorff 15-17. Qui si descrive un metodo in cannulazione aortica vivo che è stato specificamente progettato per garantire il riempimento di tutte le navi. Usiamo un composto a bassa viscosità radiopaco chiamato Microfil che può perfondere attraverso i piccoli vasi per riempire tutti i capillari, nonché entrambi i lati arterioso e venoso della rete vascolare. Le navi sono perfusi con tampone utilizzando un sistema di pressione di perfusione, e poi riempito con Microfil. Per garantire che Microfil riempie i piccoli vasi di resistenza superiori, abbiamo legare i rami di grandi dimensioni emanating dall'aorta, che devia il Microfil nelle coronarie. Una volta che il riempimento è completata, per impedire la natura elastica del tessuto cardiaco da spremere fuori Microfil di alcuni vasi, si legare accessibili i punti importanti uscita vascolari immediatamente dopo il riempimento. Pertanto, la nostra tecnica è ottimizzato per il riempimento completo e la ritenzione massimo dell'agente di riempimento, permettendo la visualizzazione della completa rete vascolare coronarico -, capillari, arterie e vene simili.
Protocollo
1. Preparativi prima di iniziare
- Riempire ciascun lato dell'apparecchio perfusione pressione con tampone Vasodilator (4 mg / L papaverina + 1 g / L adenosina in PBS) o 4% paraformaldeide (PFA) in PBS, rispettivamente.
- Preparare una siringa 1/2cc insulina (con una 29G permanentemente attaccato ½ "needle), riempiendolo con 0,1 ml di eparina 1:100 (stock 5000U/ml) e piegando l'ago ~ 120 gradi con il smussata. Do the stesso con una siringa da 1 ml (con 26G ½ "spillo) riempita con 0,3 ml di soluzione satura di KCl.
2. L'esposizione del cuore e dell'aorta cannulating
- Anestetizzare il mouse utilizzando il anestetico di scelta. (Usiamo una dose eccessiva di una miscela di ketamina / Xylazina:. IP iniezione di 130 mg / kg di ketamina e 8,8 mg / kg Xylazina in soluzione salina)
- Appunta il mouse anestetizzato sul vassoio dissezione, il lato ventrale. Aprire la cavità addominale con un'incisione mediana e ritrarre la pelleper esporre gli organi. Spostare l'intestino da un lato per esporre una regione del posteriore Vena Cava (PVC).
- Iniettare la soluzione di eparina in PVC. Come si estrae l'ago, coprire il foro dell'ago con un cotton-applicatore con la punta per evitare perdite e tenerlo premuto per alcuni secondi fino a quando i coaguli di muro in PVC e guarnizioni. Attendere 2-3 minuti per l'eparina per disperdere tutta la circolazione del mouse.
- Sezionare il diaframma e la gabbia toracica in modo da poter osservare il cuore che batte. Iniettare lentamente soluzione KCl in PVC finché gli arresti cardiaci.
- Rimuovere tutti gli organi sotto il diaframma e accise, la porzione posteriore del mouse, lasciando la regione anteriore del diaframma intatto. Rimuovere il diaframma, avendo cura di tagliare il PVC in prossimità del diaframma porzione prossimale al cuore è facile individuare in fasi successive.
- Individuare l'estremità tagliata dell'aorta. Posizionare una lunghezza lunga di 6-0 sutura di seta intrecciata sotto l'aorta di pochi millimetri anteriori from l'estremità tagliata in modo tale che la sutura è raddoppiata su se stesso. Tagliare questa sutura a metà in modo più ci sono 2 pezzi di sutura sotto l'aorta. Inserire il angiocatheter nell'estremità taglio dell'aorta (Fig. 1A, B) e collegare ogni sutura con un doppio nodo per tenere il angiocatheter in posizione e impedire qualsiasi contropressione all'interno della aorta fuoriuscita.
3. Perfusione e iniezione Microfil
- Collegare il angiocatheter all'apparecchio perfusione pressione (Fig. 2) e iniziare la perfusione dei vasi con tampone vasodilatatore (Fig. 1C) pompando l'apparecchio perfusione ad una pressione di guida 100-110 mmHg. Doppio controllare che buffer viene perfusione attraverso le coronarie, garantendo liquido è uscita dal PVC. Continuare a perfusione per almeno 3 minuti o fino a quando il fluido che esce il PVC è chiaro. (Continua con le fasi successive, mentre perfusione.)
- Staccare le costole e schiena pin (o rimuovere) la gabbia toracica per esporre il cuore. Dopo l'esposizione, essere cacon cautela e precisione per non lasciare che il cuore asciugare dalla spremitura gocce di tampone sul cuore da un buffer imbevuta di pezzo di garza. Sgombrare il timo per esporre l'arco aortico. Legare i tre rami principali dell'aorta 6-0 con sutura intrecciata in seta per garantire il fluido viene deviata attraverso le coronarie piuttosto che attraverso questi, i più grandi vasi a bassa resistenza (Fig. 1D).
- Perfusione del cuore con fissativo per 15 minuti, quindi risciacquare con tampone vasodilatazione per almeno 2 minuti. Nel frattempo, legare sia anteriore vena cava per impedire Microfil di fuoriuscire dal cuore dopo l'iniezione (Figura 1E). Suture Luogo in tutto il PVC e l'aorta, ma non li stringono fino a dopo il riempimento.
- Preparare la Microfil (come specificato nella tabella dei reagenti) e caricarlo in una siringa da 1 ml. Riempire la vaschetta dissezione con acqua sufficiente a coprire il catetere (in modo da impedire l'introduzione di bolle d'aria quando si passa dalla tubazione perfusione alla siringa Microfil). Scollegare la perfusione apparatus dal catetere e collegare la siringa Microfil.
- Iniettare il Microfil nell'aorta fino buon riempimento delle arterie coronarie è evidente (figure 1F, 3A): le arterie si riempirà prima, e poi la si Microfil "cadere" nei capillari come le vampate di tessuto con il colore della Microfil. Una volta sul lato venoso, la natura idrofoba del Microfil causa di apparire inizialmente come sfere indipendenti come emerge dai vasi più piccoli. Continuare ad iniettare il Microfil finché una colonna continua riempie le vene. Riempimento completo sarà evidente quando il Microfil è continua all'interno dei vasi, e si esce attraverso il PVC.
- Dopo il riempimento è completata, rapidamente serrare le suture precedentemente disposte intorno al PVC e aorta per impedire la natura elastica del tessuto cardiaco dalla spremitura del Microfil fuori dei vasi.
- Coprire il cuore con una garza umida (inzuppato d'acqua dal vassoio di dissezione) Per evitare che si secchi, e lasciate riposare per circa 1 ora a temperatura ambiente fino a quando il Microfil è polimerizzato. Evitare pressioni esterne sul cuore durante il processo di polimerizzazione, come sollevamento o ruotando il cuore nel tentativo di ottenere una vista precoce dei vasi pieni nella parte posteriore del cuore. Questo può spremere Microfil da alcuni vasi in una zona più elastica del cuore, causando rotture nel Microfil.
- Rimuovere il cuore e post-fix in 4% PFA notte a 4 ° C. Poi memorizzare in etanolo 70% a 4 ° C. La vascolarizzazione cardiaca è ora pronto per l'imaging μCT.
4. Risultati rappresentativi
Le navi che vengono effettivamente irrorate da Microfil avrà continua, ininterrotta per tutta Microfil i vasi (Fig. 3A). Il grado di riempimento dei vasi coronarici può essere giudicato da occhio; vene si trovano epicardially 18, e può essere facilmente osservato (Fig. 3A, freccia); arterie,che sono più intramiocardico 18, sono anche visibili attraverso la superficie del cuore (Fig. 3A, freccia). Riempimento capillare è anche evidente, come tessuto cardiaco ha una elevata densità di capillari, e pertanto, quando il riempimento capillari, il tessuto cardiaco si filo con il colore del Microfil (Fig. 3A, stella). Così, le reti vascolari che non hanno riempire sarà evidente a causa della mancanza di Microfil (Fig. 3B, C).
Discontinuità nella Microfil (asterischi in Fig. 3B) appaiono spesso perché la natura idrofoba del Microfil lo farà a contrarsi in sé e provocare "infrange" all'interno dei vasi riempiti. Questi "pause" può essere ridotta se la pressione all'interno dei vasi è mantenuta attraverso adeguata tie-off dei punti di uscita vascolari dal cuore. Altre discontinuità può essere causato da bolle d'aria all'interno del Microfil. Per evitare l'introduzione di aria, assicurarsi che il angiocatheter è completamente immerso in acqua quando si passa dalla perfusione ap Paratus alla siringa Microfil. Se una bolla d'aria viene introdotta, spesso può essere rimosso semplicemente continuando la perfusione Microfil finché la bolla è stato spinto attraverso e fuori dei vasi coronarici.
Reti vascolari non può riempire completamente se una porzione del letto vascolare è bloccato (Fig. 3B, freccia). Mentre eparina inibisce la formazione di coaguli di sangue, blocchi occasionali possono ancora verificarsi a causa di perfusione eparina incomplete prima di iniziare la procedura, oa causa di altri fattori sconosciuti. Se si verifica un blocco, non vi è, a nostra conoscenza, nessun metodo per staccare il blocco per completare il riempimento vascolare. Riempimento incompleto può anche causare una pressione troppo poco viene utilizzato durante il riempimento, la Microfil non sarà costretto a tutti i letti vascolari e le reti capillari (Fig. 3C). Al contrario, una pressione eccessiva può causare i capillari a scoppiare e estravasare Microfil nel tessuto circostante (Fig. 3D).
files/ftp_upload/3740/3740fig1.jpg "alt =" Figura 1 "/>
Figura 1. Panoramica del sistema di perfusione Microfil. (A) L'aorta e il PVC vengono tagliati approssimativamente a livello del diaframma. (B) L'aorta ascendente è cannulata con uno angiocatheter. (C) buffer vasodilatazione è perfuso attraverso i vasi, spinti dalla pressione di perfusione l'apparato (non raffigurato), mentre (D) i tre rami principali fuori l'arco aortico vengono legati. (E) 4% PFA è perfuso attraverso le coronarie, mentre entrambe le anteriori Vena Cavas sono legato. (F) usando una siringa, Microfil viene perfuso attraverso le coronarie finché si osserva in uscita dal PVC.
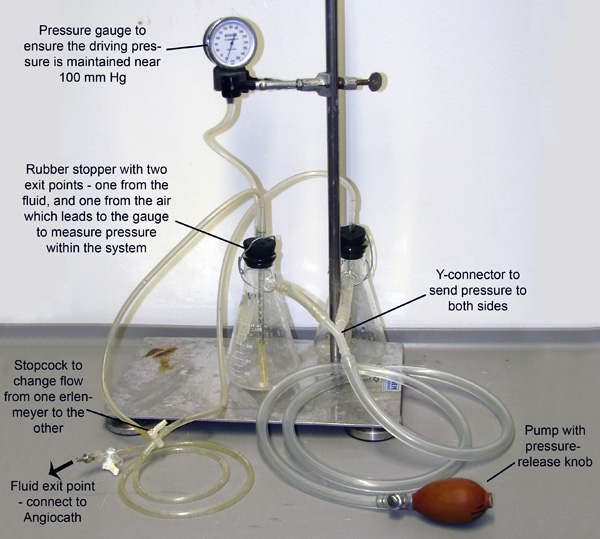
Figura 2. Apparecchiatura di perfusione. Due beute, ciascuna riempita di tampone vasodilatazione o 4% PFA, sono uniti e pressurizzato attraverso tubi collegati alle loro armi bianche. Il sistema viene pressurizzato mediante pompaggio manuale deibulbo, e un manometro è collegato ad uno dei flaconi per consentire il monitoraggio e il mantenimento della pressione. Piccoli tubi si estendono attraverso tappi di gomma e giù nel fluido in ogni contenitore. Pressione in entrata dalla pompe armi bianche del fluido da ciascuna beuta questi tubi più piccoli. I tubi quindi unire ad un rubinetto che consente solo passaggio del fluido da un pallone alla volta.
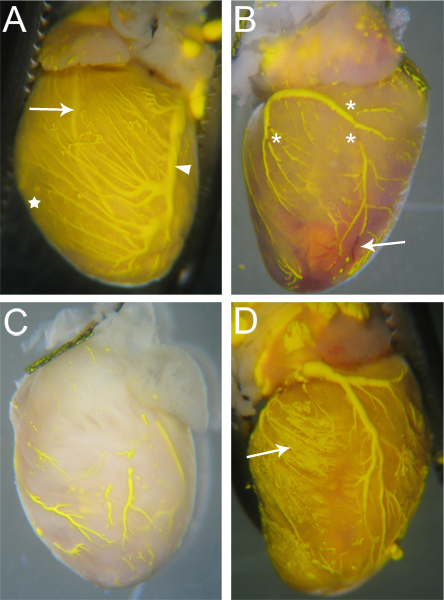
Figura 3. Assaggiate cuori microriempiti. (A) Le navi che vengono riempite ben avranno pochi (se del caso) Soggiorni in Microfil, e il tessuto cardiaco sarà tinge il colore del Microfil a causa della piena capillari (a stella, e si confrontano con C). Entrambe le arterie (freccia - dell'arteria discendente anteriore sinistra) e le vene (punta di freccia - Sinistra Vein coronarica) sono visibili attraverso la superficie del cuore. (B) Un cuore con interruzioni nel Microfil (asterischi) e blocchi in alcuni vasi che impedito Mic completorofil penetrazione. I vasi rimangono bloccati rosso (freccia), come il sangue non è stata lavata durante il processo di perfusione. (C) Un cuore con le navi che sono stati completamente riempiti. Si noti il tessuto non ha preso il colore giallo del Microfil, indicando il Microfil non penetrano nei capillari. (D) Un cuore in cui il burst capillari durante il riempimento, causando la Microfil di perdite nel tessuto circostante (freccia).
Discussione
Tessuto cardiaco ha una forte domanda metabolica, e richiede pertanto un costante rifornimento di sostanze nutritive e ossigeno dal sangue erogata dal sistema vascolare coronarico. Malattie dei vasi coronarici, che riducono la funzione a causa di stenosi coronarica nave e blocco, possono portare a ipossia tissutale e di ischemia, e mettere i pazienti affetti a rischio di infarto miocardico e danni irreparabili al muscolo cardiaco. Una migliore comprensione dello stato di malattia di questi vasi è necessario, e critico ...
Divulgazioni
I topi sono stati trattati con metodi approvati dalla Institutional Animal Care e del Comitato uso della University of Washington e in conformità con la Guida per la cura e l'uso di animali da laboratorio pubblicato dal US National Institutes of Health (NIH Publication No. 85-23, riveduta nel 1996).
Riconoscimenti
Ringraziamo il Dott. Kelly Stevens per le prove iniziali del protocollo, il dottor Michael Simons, Hauch Kip Dr., e membri di entrambi i loro laboratori per la discussione generale.
Questo lavoro è l'assistenza di sovvenzioni NIH HL087513 e P01 HL094374.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reattivo | Azienda | Numero di catalogo | Comments |
| 1 ml siringhe | Becton Dickinson | BD-309602 | |
| Siringhe da insulina 1/2cc con aghi fissi ½ 29G ' | Becton Dickinson | BD-309306 | |
| Garza 2 "x 2" pastiglie | Med101store.com | SKU 2208 | |
| 24G ¾ "Angiocath IV catetere | Becton Dickinson | BD-381112 | |
| 26G ½ "aghi calibro | lank "> Becton Dickinson | BD-305111 | |
| L'adenosina | Sigma | A9251 | 1 g / L in PBS per Buffer Vasodilatazione (con papaverina) |
| Pinze angolari Graefe | Strumenti di Scienza Fine | 11052-10 | |
| Cotton-punte: 6 applicatori "non sterile | Cardinal Health | C15055-006 | |
| Forbici chirurgiche curve | Strumenti di Scienza Fine | 14085-09 | |
| Stereoscopio dissezione e la sorgente di luce | Nikon | NA | NA |
| Vassoio dissezione, 11,5 x 7,5 pollici | Cole-Parmer | YO-10.915-12 | Riempito con tar per appuntare premuto il mouse |
| Fine pinze curve | Aesculap | FD281R | Hai bisogno di due |
| L'eparina, 5000 U / ml magazzino | APP Pharmaceuticals LLC | NDC 63323-047-10 | Diluizione 1:100 in acqua |
| KCl | Pescatore | P217 | Soluzione satura di H2O |
| Ketamina (Ketaset), 100 mg / ml magazzino | Fort Dodge, Overland Park, KS, USA | NDC 0856-2013-01 | Misto di 130 mg / kg di peso corporeo, con Xylazina allo 0,9% sAline |
| Microfil | Flusso Tech | MV-122 (giallo). Altre opzioni di colore sono inoltre disponibili. | Mescolare 01:01 in peso, con il 10% in volume di catalizzatore. Preparare immediatamente prima dell'iniezione, e vortex per assicurarsi che sia ben amalgamato |
| Non sterile di sutura: 6-0, seta intrecciata | Harvard Apparatus | 723287 | |
| Papaverina | Americano Regent Inc. | NDC 0517-4010-01 | 4 mg / L in PBS per Buffer Vasodilatazione (con adenosina) |
| Paraformaldeide | Sigma | P6148 | Preparato come soluzione al 4% |
| Perfusione Apparatus | Vedere la figura 2 | ||
| Primavera Forbici | Strumenti di Scienza Fine | 15018-10 | |
| Xilazina (Anased), 20 mg / gl magazzino | Lloyd Labs | NADA # 139-236 | Misto di 8,8 mg / kg di peso corporeo, con ketamina in soluzione salina 0,9% |
Riferimenti
- Couffinhal, T., Dufourcq, P., Barandon, L., Leroux, L., Duplaa, C. Mouse models to study angiogenesis in the context of cardiovascular diseases. Front. Biosci. 14, 3310-3325 (2009).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Krucker, T., Lang, A., Meyer, E. P. New polyurethane-based material for vascular corrosion casting with improved physical and imaging characteristics. Microsc. Res. Tech. 69, 138-147 (2006).
- Murakami, T. Blood flow patterns in the rat pancreas: a simulative demonstration by injection replication and scanning electron microscopy. Microsc. Res. Tech. 37, 497-508 (1997).
- Icardo, J. M., Colvee, E. Origin and course of the coronary arteries in normal mice and in iv/iv mice. J. Anat. 199, 473-482 (2001).
- Beighley, P. E., Thomas, P. J., Jorgensen, S. M., Ritman, E. L. 3D architecture of myocardial microcirculation in intact rat heart: a study with micro-CT. Adv. Exp. Med. Biol. 430, 165-175 (1997).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, R1267-R1279 (2002).
- Jorgensen, S. M., Demirkaya, O., Ritman, E. L. Three-dimensional imaging of vasculature and parenchyma in intact rodent organs with X-ray micro-CT. Am. J. Physiol. 275, H1103-H1114 (1998).
- Marxen, M. MicroCT scanner performance and considerations for vascular specimen imaging. Med. Phys. 31, 305-313 (2004).
- Zagorchev, L. Micro computed tomography for vascular exploration. J. Angiogenes. Res. 2, 7-7 (2010).
- Heinzer, S. Hierarchical microimaging for multiscale analysis of large vascular networks. Neuroimage. 32, 626-636 (2006).
- Dedkov, E. I. Synectin/syndecan-4 regulate coronary arteriolar growth during development. Dev. Dyn. 236, 2004-2010 (2007).
- Gossl, M. Functional anatomy and hemodynamic characteristics of vasa vasorum in the walls of porcine coronary arteries. Anat. Rec. A. Discov. Mol. Cell. Evol. Biol. 272, 526-537 (2003).
- Rodriguez-Porcel, M. Altered myocardial microvascular 3D architecture in experimental hypercholesterolemia. Circulation. 102, 2028-2030 (2000).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: The Langendorff technique of isolated heart perfusion. J. Mol. Cell. Cardiol. 50, 940-950 (2011).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff---still viable in the new millennium. J. Pharmacol. Toxicol. Methods. 55, 113-126 (2007).
- Toyota, E. Vascular endothelial growth factor is required for coronary collateral growth in the rat. Circulation. 112, 2108-2113 (2005).
- Lavine, K. J., Long, F., Choi, K., Smith, C., Ornitz, D. M. Hedgehog signaling to distinct cell types differentially regulates coronary artery and vein development. Development. 135, 3161-3171 (2008).
- Cheema, A. N. Adventitial microvessel formation after coronary stenting and the effects of SU11218, a tyrosine kinase inhibitor. J. Am. Coll. Cardiol. 47, 1067-1075 (2006).
- Lametschwandtner, A., Lametschwandtner, U., Weiger, T. Scanning electron microscopy of vascular corrosion casts--technique and applications: updated review. Scanning Microsc. 4, 889-941 (1990).
- Schneider, P. Simultaneous 3D visualization and quantification of murine bone and bone vasculature using micro-computed tomography and vascular replica. Microsc. Res. Tech. 72, 690-701 (2009).
- Manelli, A., Sangiorgi, S., Binaghi, E., Raspanti, M. 3D analysis of SEM images of corrosion casting using adaptive stereo matching. Microscopy Research and Technique. 70, 350-354 (2007).
- Alanentalo, T. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Meth. 4, 31-33 (2007).
- Quintana, L., Sharpe, J. . Optical projection tomography of vertebrate embryo development. , 586-594 (2011).
- Walls, J. R., Coultas, L., Rossant, J., Henkelman, R. M. Three-Dimensional Analysis of Vascular Development in the Mouse Embryo. PLoS ONE. 3, e2853-e2853 (2008).
- Chalothorn, D., Clayton, J. A., Zhang, H., Pomp, D., Faber, J. E. Collateral density, remodeling, and VEGF-A expression differ widely between mouse strains. Physiol. Genomics. 30, 179-191 (2007).
- Behm, C. Z. Molecular Imaging of Endothelial Vascular Cell Adhesion Molecule-1 Expression and Inflammatory Cell Recruitment During Vasculogenesis and Ischemia-Mediated Arteriogenesis. Circulation. 117, 2902-2911 (2008).
- Carr, C. L., Lindner, J. R. Myocardial perfusion imaging with contrast echocardiography. Curr. Cardiol. Rep. 10, 233-239 (2008).
- Leong-Poi, H. Assessment of Endogenous and Therapeutic Arteriogenesis by Contrast Ultrasound Molecular Imaging of Integrin Expression. Circulation. 111, 3248-3254 (2005).
- Villanueva, F. S. Microbubbles Targeted to Intercellular Adhesion Molecule-1 Bind to Activated Coronary Artery Endothelial Cells. Circulation. 98, 1-5 (1998).
- Wei, K. Quantification of Myocardial Blood Flow With Ultrasound-Induced Destruction of Microbubbles Administered as a Constant Venous Infusion. Circulation. 97, 473-483 (1998).
- Beckmann, N., Stirnimann, R., Bochelen, D. High-Resolution Magnetic Resonance Angiography of the Mouse Brain: Application to Murine Focal Cerebral Ischemia Models. Journal of Magnetic Resonance. 140, 442-450 (1999).
- Kobayashi, H. 3D MR angiography of intratumoral vasculature using a novel macromolecular MR contrast agent. Magnetic Resonance in Medicine. 46, 579-585 (2001).
- Nezafat, R. B1-insensitive T2 preparation for improved coronary magnetic resonance angiography at 3 T. Magn. Reson. Med. 55, 858-864 (2006).
- Wagner, S., Helisch, A., Ziegelhoeffer, T., Bachmann, G., Schaper, W. Magnetic resonance angiography of collateral vessels in a murine femoral artery ligation model. NMR in Biomedicine. 17, 21-27 (2004).
- Cochet, H. In vivo MR angiography and velocity measurement in mice coronary arteries at 9.4 T: assessment of coronary flow velocity reserve. Radiology. , 254-441 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon