A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
זלוף מדרדר ומילוי בכלי הדם הכליליים עכבר כהכנה מיקרו טומוגרפיה ממוחשבת והדמיה
In This Article
Summary
ויזואליזציה של כלי הכליליים הוא קריטי לקידום ההבנה שלנו של מחלות לב וכלי דם. כאן אנו מתארים שיטה המרוססת בכלי הדם הכליליים Murine עם גומי radiopaque סיליקון (Microfil), לקראת הדמיה ממוחשבת מיקרו (μCT) טומוגרפיה.
Abstract
הדמיה של כלי הדם הופך חשוב יותר ויותר מדינות רבות להבנת מחלות שונות. בעוד מספר טכניקות קיימות הדמיה בכלי הדם, מעטים מסוגלים לדמיין את רשת כלי הדם כולה תוך הרחבת פתרון הכולל 1,2 כלי קטן יותר. בנוסף, רבים טכניקות יציקה כלי הדם להרוס את הרקמה שמסביב, מונע ניתוח נוסף של המדגם 3-5. אחת השיטות אשר עוקף בעיות אלה הוא מיקרו טומוגרפיה ממוחשבת (μCT). μCT הדמיה יכול לסרוק ברזולוציות <10 מיקרון, הוא מסוגל לייצר שחזורים 3D של רשת כלי הדם, ומשאירה רקמות שלמות לצורך ניתוח מאוחר יותר (למשל, היסטולוגיה ו morphometry) 6-11. עם זאת, כלי הדמיה על ידי שיטות לשעבר ב vivo μCT דורש כלי להתמלא מתחם radiopaque. לפיכך, ייצוג מדויק של כלי הדם המיוצר על ידי μCT הדמיה מותניתמילוי אמינות מוחלטת של הכלים. בפרוטוקול זה, אנו מתארים טכניקה למילוי כלי עכבר הכליליים לקראת הדמיה μCT.
שתי טכניקות שולטים קיים למילוי בכלי הדם הכליליים: in vivo באמצעות טפטוף cannulation ו מדרדר של אבי העורקים (או סניף את קשת אבי העורקים) 12-14, או vivo לשעבר באמצעות מערכת טפטוף Langendorff 15-17. כאן אנו מתארים את שיטת אבי העורקים vivo cannulation אשר תוכנן במיוחד כדי להבטיח מילוי של כל כלי. אנו משתמשים צמיגות נמוכה radiopaque תרכובת בשם Microfil אשר יכול perfuse דרך כלי הקטנים ביותר כדי למלא את כל נימי הדם, כמו גם את שני הצדדים העורקים והוורידים של רשת כלי הדם. כלי הם perfused עם המאגר באמצעות מערכת טפטוף בלחץ, ומילא אחר כך עם Microfil. על מנת להבטיח Microfil הממלא את כלי הדם הקטנים עמידות גבוהה יותר, אנו ולקשור את הענפים הגדולים emanating מ אבי העורקים, אשר מסיט את Microfil אל מהתקפי. לאחר מילוי הושלמה, כדי למנוע את האופי האלסטי של רקמת לב מ לסחוט Microfil מתוך כלי מסוימים, אנו ולקשור נגישים הנקודות העיקריות ליציאה של כלי הדם מיד לאחר מילוי. לכן, הטכניקה שלנו מותאמת במיוחד עבור מילוי מלא ושימור מרבי של חומר מילוי, המאפשרת הדמיה של רשת שלמה של כלי הדם הכליליים - עורקי, נימי דם, וורידים כאחד.
Protocol
1. הכנות לפני תחילת
- ממלאים כל צד של מנגנון זלוף לחץ עם חיץ vasodilator (4mg / L Papaverine + 1G / L אדנוזין ב PBS) או Paraformaldehyde 4% (PFA) ב PBS, בהתאמה.
- להכין מזרק אינסולין 1/2cc (עם 29G המצורפת לצמיתות ½ "מחט) על ידי ממלא אותו עם 0.1 מ"ל של הפרין 1:100 (מניות 5000U/ml) וכיפוף את המחט בזווית 120 מעלות ~ עם שיפוע כלפי מעלה. האם אותו הדבר עם המזרק 1 מ"ל (עם מחט 26G "½) מלא פתרון 0.3 מ"ל KCl רוויה.
2. חשיפת לב cannulating אבי העורקים
- להרדים את העכבר באמצעות הרדמה של בחירה. (אנו משתמשים מנת יתר של תערובת קטמין / Xylazine:. הזרקת ה-IP של קטמין מ"ג / ק"ג 130 ו 8.8 מ"ג / ק"ג Xylazine ב מלוחים)
- להצמיד את העכבר הרדים על מגש הניתוחים, את הצד הגחוני. פתח את חלל הבטן עם חתך קו האמצע ו לחזור בו העורכדי לחשוף את האיברים. להעביר את המעיים בצד אחד לחשוף באזור האחורי של הווריד הנבוב (PVC).
- להזריק פתרון הפרין ל PVC. כפי שאתה לחלץ את המחט, מכסים את החור עם מחט המוליך כותנה שקצהו כדי למנוע דליפת והחזק אותו במשך כמה שניות עד קרישי קיר PVC, אטמים. המתן 2-3 דקות הפרין לפזר ברחבי מחזור העכבר.
- לנתח את הסרעפת ואת בית החזה, כך שתוכל לראות את הלב הפועם. לאט לאט להזריק פתרון KCl ב PVC עד המעצרים לב.
- הסר את כל האיברים מתחת לסרעפת, ולהסיר את החלק האחורי של העכבר, עוזבים את האזור הקדמי של הסרעפת ללא פגע. הסר את הסרעפת, נזהר לחתוך PVC ליד הסרעפת כך את החלק הפרוקסימלי ללב קל לאתר בשלבים הבאים.
- אתר את הקצוות של אבי העורקים. מניחים 1 אורך תפר ארוכה של 6-0 משי קלוע אבי העורקים מתחת כמה מילימטרים הקדמי הלוך ושובמ 'בסוף לחתוך כך תפר כפול לאחור על עצמו. חותכים את תפר עוד במחצית אז יש 2 חתיכות של תפר תחת אבי העורקים. הכנס angiocatheter לתוך סוף חתך של אבי העורקים (איור 1 א ', ב') ולקשור כל תפר כפול עם הקשר להחזיק angiocatheter במקום ולמנוע כל גב הלחץ בתוך העורקים מ דולף החוצה.
3. זלוף הזרקת Microfil
- חבר את angiocatheter למנגנון לחץ זלוף (איור 2) ולהתחיל המרוססת כלי עם חיץ vasodilator (איור 1 ג) על ידי שאיבת מנגנון זלוף ללחץ הנהיגה של 100-110 מ"מ כספית. בדוק כי המאגר המרוססת דרך מהתקפי על ידי הבטחת נוזלי היציאה מ-PVC. המשך perfuse לפחות 3 דקות או עד שהנוזל היוצא PVC ברור. (המשך הצעדים הבאים תוך המרוססת.)
- לנתח את הצלעות והגב סיכה (או להסיר) את בית החזה כדי לחשוף את הלב. נחשף פעם אחת, להיות CAreful לא לתת ללב להתייבש על ידי כיווץ טיפות חיץ אל הלב מתוך קטע חיץ ספוג של גזה. לפנות את התימוס לחשוף את קשת אבי העורקים. ולקשור את שלושת הענפים העיקריים אבי העורקים באמצעות 6-0 תפר משי קלוע כדי להבטיח נוזל מוטה דרך מהתקפי ולא באמצעות אלה, כלי גדולים יותר התנגדות נמוכה (איור 1D).
- Perfuse הלב עם מקבע במשך 15 דקות, ואז לשטוף עם חיץ התרחבות לפחות 2 דקות. בינתיים, ולקשור גם Anterior הנבוב Cavae למנוע Microfil מ דולף מן הלב לאחר ההזרקה (איור 1E). מקום התפרים סביב PVC, אבי העורקים, אך לא להדק אותם עד לאחר מילוי.
- הכן Microfil (כמפורט בטבלה של ריאגנטים) ולטעון אותו לתוך מזרק 1 מ"ל. מלאו את מגש לנתיחה עם מים מספיק כדי לכסות את הקטטר (כדי למנוע כניסת בועות אוויר בעת מעבר בין צינורות טפטוף כדי מזרק Microfil). נתק את זלוף APparatus מ קטטר וחבר את המזרק Microfil מוכן.
- מזריקים לתוך אבי העורקים Microfil עד מילוי טוב של העורקים הכליליים ניכר (תאנים 1F, 3A): העורקים ימלא הראשונה ולאחר מכן Microfil יהיה "לשפוך" לתוך הנימים כמו גלי רקמות עם צבע Microfil. פעם אחת בצד ורידים, אופי הידרופובי של Microfil גורם לו בתחילה יהפכו לכדורים עצמאיים כפי שהוא עולה מן הדם הקטנים יותר. המשך להזרים Microfil עד טור מתמשך ממלא את הוורידים. מילוי מלא יהיה לידי ביטוי כאשר Microfil היא רציפה בתוך הכלים, והוא היציאה דרך PVC.
- לאחר מילוי הושלמה, מהר להדק את התפרים שהונחו בעבר סביב PVC, אבי העורקים, כדי למנוע את אופי גמיש של רקמת לב מ לסחוט Microfil את הכלים.
- מכסים את הלב עם גזה רטוב (ספוג עם מים ממגש לנתח) כדי למנוע ייבוש החוצה, ולתת לו לשבת במשך שעה כ 1 בטמפרטורת החדר עד Microfil יש מפולמר. למנוע לחצים חיצוניים על הלב במהלך תהליך פילמור, כמו הרמת או הפיכת לב, בניסיון לקבל תצוגה מוקדמת של כלי מלאים בחלק האחורי של הלב. זה עלול לסחוט Microfil מכלי כמה לאזור גמיש יותר של הלב, גורמת הפסקות Microfil.
- הסר את הלב ופוסט לתקן את זה PFA 4% בין לילה ב 4 ° C. לאחר מכן לאחסן באתנול 70% ב 4 ° C. בכלי הדם בלב מוכן כעת הדמיה μCT.
4. נציג תוצאות
כלי אשר perfused ביעילות Microfil יהיה Microfil מתמשך, רצוף לאורך כל הכלים (איור 3 א). מידת מילוי של כלי הכליליים יכול להישפט על ידי העין, ורידים נמצאים epicardially 18, ניתן להבחין בקלות (איור 3 א ', ראש חץ), עורקים,אשר intramyocardial יותר 18, הם גם נראים דרך פני השטח של הלב (איור 3 א, חץ). מילוי נימי ניכר גם, כמו רקמת לב יש צפיפות גבוהה מאוד של נימי דם, ולכן, כאשר מילוי נימי דם, רקמת לב לא להוריד את המים עם הצבע של Microfil (איור 3 א, כוכב). לכן, כל רשתות כלי דם שלא הצליחו למלא יהיה מורגש בשל היעדר Microfil (איור 3 ב ', ג').
שיבושים ב Microfil (כוכביות איור 3 ב) לעיתים קרובות מופיעים בגלל האופי ההידרופובי של Microfil גורמת לו להתכווץ לתוך עצמו ולגרום "נשבר" בתוך כלי מלא. אלה "הקלות" אפשר לצמצם אם הלחץ בתוך כלי הדם נשמרת דרך נאותה לקשור המראות מנקודות היציאה של כלי הדם של הלב. שיבושים אחרים יכולה להיגרם על ידי בועות אוויר בתוך microfil. כדי למנוע החדרת אוויר, לוודא angiocatheter טבול במים באופן מלא בעת מעבר מ זלוף AP paratus כדי מזרק Microfil. אם בועת אוויר הוא הציג, זה לעתים קרובות ניתן להסיר רק על ידי המשך זלוף Microfil עד הבועה כבר עבר דרכו אל מחוץ לכלי הכליליים.
רשתות כלי דם לא יכול למלא לחלוטין אם חלק של המיטה כלי דם חסום (איור 3 ב, חץ). בעוד הפרין מונע היווצרות קרישי דם, חסימות פה ושם, עדיין עשויים להתרחש עקב זלוף הפרין שלם לפני תחילת ההליך, או עקב גורמים לא ידועים אחרים. אם החסימה מתרחשת, קיימת, למיטב ידיעתנו, אין שיטה פירוק החסימה כדי להשלים את מילוי כלי הדם. מילוי שלם יכולים גם לגרום ללחץ אם מעט מדי נעשה שימוש במהלך מילוי, כמו Microfil לא ייאלצו את כל כלי הדם מיטות ורשתות נימי (איור 3 ג). לעומת זאת, יותר מדי לחץ יכול לגרום נימים לפרוץ ו extravasate Microfil אל הרקמות המקיפות (איור 3D).
files/ftp_upload/3740/3740fig1.jpg "alt =" איור 1 "/>
באיור 1. סקירה של תוכנית זלוף Microfil. (א) אבי העורקים ו PVC נחתכים ברמה של כ הסרעפת. (ב) באבי העורקים עולה הוא cannulated עם angiocatheter. (ג) המאגר הוא התרחבות perfused דרך כלי, המונעים על ידי מנגנון לחץ זלוף (לא בתמונה), בזמן (ד ') שלושה סניפים מרכזיים מחוץ לקשת אבי העורקים הם ligated. (ה) PFA 4% הוא perfused דרך מהתקפי תוך שתי Cavas הקדמי הנבוב הם ligated. (F) באמצעות מזרק, Microfil הוא perfused דרך מהתקפי עד הוא ציין היציאה מ-PVC.
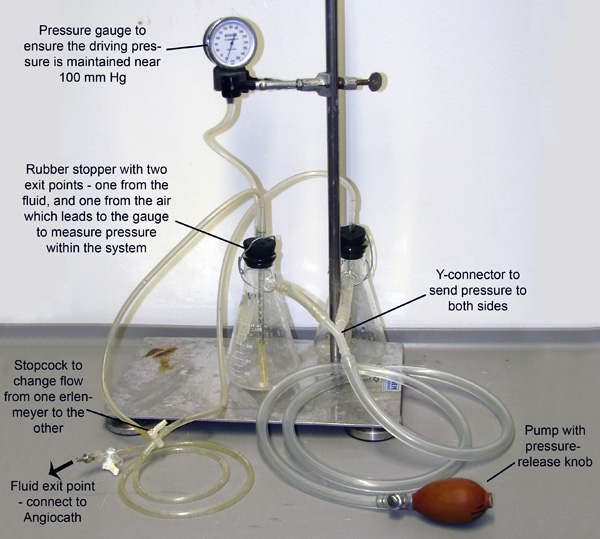
איור 2. Apparatus זלוף. שתי צלוחיות Erlenmeyer, כל אחד מלא חיץ בין התרחבות או 4% PFA, הם הצטרפו בלחץ דרך צינורות המחוברים עדיין אקדחים וכלי נשק שלהם. המערכת נמצאת בלחץ באמצעות שימוש השאיבה שלהנורה, ואת מד הלחץ מחובר אחד הבקבוקים על מנת לאפשר ניטור ותחזוקה של לחץ. צינורות קטנים להרחיב באמצעות פקקים גומי לתוך הנוזל בבקבוק אחד. הלחץ להיכנס מן המשאבות אקדחים נוזל בבקבוק אחד את אלה צינורות קטנים יותר. הצינורות ואז למזג את שסתום בו רק נוזל לזרום בקבוק אחד בכל פעם.
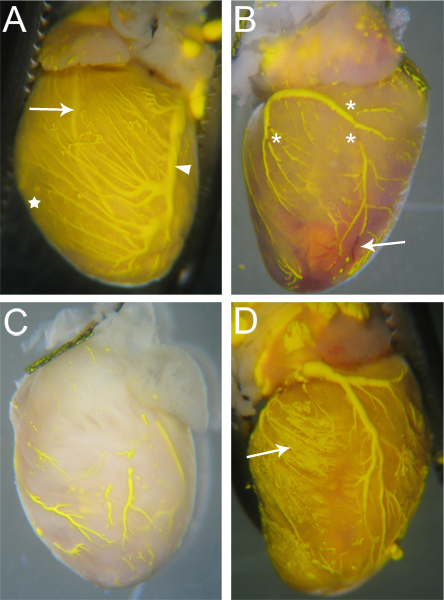
איור 3. לטעום לבבות Microfilled. (א) כלים מלאים גם יהיו כמה (אם בכלל) הפסקות Microfil, ואת רקמת לב יהיה צבע בגוון של Microfil בשל נימים מלא (כוכב, ולהשוות עם C). שני העורקים (חץ - שמאל עורק יורד קדמי) וורידים (ראש חץ - עורק כלילי שמאלי) נראים דרך פני השטח את הלב. (ב) לב עם הפסקות microfil (כוכביות) וכן חסימות כלי כמה שמנע כניסת מיקרופון המלאrofil חדירה. כלי חסומים להישאר אדום (חץ), כמו הדם לא היו סמוקות החוצה בתהליך זלוף. (ג) לב עם כלי שמולאו באופן חלקי. שימו לב רקמות לא לקחה על הצבע הצהוב של Microfil, המציין Microfil לא חדרה אל תוך הנימים. (ד) שם לב נימים פרץ במהלך מילוי, גרימת Microfil לדלוף אל הרקמות המקיפות (החץ).
Discussion
רקמת לב יש דרישה מטבולית גבוהה מאוד, ולכן דורש אספקה קבועה של חומרי מזון וחמצן מהדם מועברים על ידי כלי הדם הכליליים. מחלות של כלי כלילית, אשר להפחית תפקוד כלילית עקב היצרות כלי וסתימת, יכול להוביל לחוסר חמצן לרקמות איסכמיה, ולשים חולים הנגועים בסיכון לאוטם שריר הלב...
Disclosures
העכברים טופלו בשיטות שאושרו על ידי טיפול בבעלי חיים מוסדי ועדת שימוש מאוניברסיטת וושינגטון ועל פי מדריך לטיפול ושימוש בחיות מעבדה שפורסם על ידי המוסד האמריקני הלאומי לבריאות (NIH פרסום מס '85-23, מתוקן 1996).
Acknowledgements
אנו מודים לד"ר קלי סטיבנס לניסויים הראשונים של פרוטוקול, ד"ר מיכאל סימונס, Hauch ד"ר קיפ, וחברי שתי המעבדות שלהם לדיון בכלל.
עבודה זו היא תמיכה על ידי NIH מענקים HL087513 ו P01 HL094374.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | תגובות |
| 1 מ"ל מזרקים | בקטון דיקינסון | BD-309602 | |
| אינסולין מזרקים עם מחטים 1/2cc וחצי 29G "מצורף באופן קבוע | בקטון דיקינסון | BD-309306 | |
| 2 "x 2" גזה רפידות | Med101store.com | מק"ט 2208 | |
| 24G ¾ "Angiocath קטטר IV | בקטון דיקינסון | BD-381112 | |
| 26G ½ "מחטים מד | דליל "> בקטון דיקינסון | BD-305111 | |
| אדנוזין | סיגמא | A9251 | 1G / L ב PBS על מאגר התרחבות (עם Papaverine) |
| גרפה מלקחיים זווית | מדע כלים עדינים | 11052-10 | |
| כותנה שקצהו applicators: 6 "לא סטריליים | הקרדינל הבריאות | C15055-006 | |
| מספריים כירורגיות מעוקלים | מדע כלים עדינים | 14085-09 | |
| Stereoscope לנתח את מקור האור | ניקון | NA | NA |
| מגש לנתח, 11.5 x 7.5 אינץ' | קולמן בן הזוג | YO-10915-12 | מלא זפת על מצמיד את העכבר |
| מלקחיים המעוקל, הנאה | Aesculap | FD281R | צריך 2 |
| הפרין, 5000 U / ml המניות | APP Pharmaceuticals LLC | NDC 63323-047-10 | 1:100 דילול במים |
| KCl | דיג | P217 | פתרון רווי ב H2O |
| Ketamin (Ketaset), 100 מ"ג / מ"ל המניות | Fort Dodge, אוברלנד פארק, קנזס, ארה"ב | NDC 0856-2013-01 | מעורב כמשקל מ"ג / ק"ג 130 הגוף, עם Xylazine ב 0.9% sאלין |
| Microfil | תזרים טק | MV-122 (צהוב). אפשרויות צבע אחרים זמינים אף הם. | מערבבים 01:01 לפי משקל, עם 10% לפי נפח של סוכן ריפוי. להכין ממש לפני ההזרקה, ואת המערבולת על מנת להבטיח את זה היא מעורבת גם |
| לא סטריליים קשירת: 6-0, משי קלוע | הרווארד Apparatus | 723287 | |
| Papaverine | האמריקאי ריג'נט בע"מ | NDC 0517-4010-01 | 4mg / L ב PBS על מאגר התרחבות (עם אדנוזין) |
| Paraformaldehyde | סיגמא | P6148 | הוכן כפתרון 4% |
| זלוף Apparatus | ראה איור 2 | ||
| האביב מספריים | מדע כלים עדינים | 15018-10 | |
| Xylazine (Anased), 20 מ"ג / GL המניות | לויד Labs | נדא # 139-236 | מעורב כמשקל מ"ג / ק"ג 8.8 הגוף, עם Ketamin ב מלוחים 0.9% |
References
- Couffinhal, T., Dufourcq, P., Barandon, L., Leroux, L., Duplaa, C. Mouse models to study angiogenesis in the context of cardiovascular diseases. Front. Biosci. 14, 3310-3325 (2009).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Krucker, T., Lang, A., Meyer, E. P. New polyurethane-based material for vascular corrosion casting with improved physical and imaging characteristics. Microsc. Res. Tech. 69, 138-147 (2006).
- Murakami, T. Blood flow patterns in the rat pancreas: a simulative demonstration by injection replication and scanning electron microscopy. Microsc. Res. Tech. 37, 497-508 (1997).
- Icardo, J. M., Colvee, E. Origin and course of the coronary arteries in normal mice and in iv/iv mice. J. Anat. 199, 473-482 (2001).
- Beighley, P. E., Thomas, P. J., Jorgensen, S. M., Ritman, E. L. 3D architecture of myocardial microcirculation in intact rat heart: a study with micro-CT. Adv. Exp. Med. Biol. 430, 165-175 (1997).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, R1267-R1279 (2002).
- Jorgensen, S. M., Demirkaya, O., Ritman, E. L. Three-dimensional imaging of vasculature and parenchyma in intact rodent organs with X-ray micro-CT. Am. J. Physiol. 275, H1103-H1114 (1998).
- Marxen, M. MicroCT scanner performance and considerations for vascular specimen imaging. Med. Phys. 31, 305-313 (2004).
- Zagorchev, L. Micro computed tomography for vascular exploration. J. Angiogenes. Res. 2, 7-7 (2010).
- Heinzer, S. Hierarchical microimaging for multiscale analysis of large vascular networks. Neuroimage. 32, 626-636 (2006).
- Dedkov, E. I. Synectin/syndecan-4 regulate coronary arteriolar growth during development. Dev. Dyn. 236, 2004-2010 (2007).
- Gossl, M. Functional anatomy and hemodynamic characteristics of vasa vasorum in the walls of porcine coronary arteries. Anat. Rec. A. Discov. Mol. Cell. Evol. Biol. 272, 526-537 (2003).
- Rodriguez-Porcel, M. Altered myocardial microvascular 3D architecture in experimental hypercholesterolemia. Circulation. 102, 2028-2030 (2000).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: The Langendorff technique of isolated heart perfusion. J. Mol. Cell. Cardiol. 50, 940-950 (2011).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff---still viable in the new millennium. J. Pharmacol. Toxicol. Methods. 55, 113-126 (2007).
- Toyota, E. Vascular endothelial growth factor is required for coronary collateral growth in the rat. Circulation. 112, 2108-2113 (2005).
- Lavine, K. J., Long, F., Choi, K., Smith, C., Ornitz, D. M. Hedgehog signaling to distinct cell types differentially regulates coronary artery and vein development. Development. 135, 3161-3171 (2008).
- Cheema, A. N. Adventitial microvessel formation after coronary stenting and the effects of SU11218, a tyrosine kinase inhibitor. J. Am. Coll. Cardiol. 47, 1067-1075 (2006).
- Lametschwandtner, A., Lametschwandtner, U., Weiger, T. Scanning electron microscopy of vascular corrosion casts--technique and applications: updated review. Scanning Microsc. 4, 889-941 (1990).
- Schneider, P. Simultaneous 3D visualization and quantification of murine bone and bone vasculature using micro-computed tomography and vascular replica. Microsc. Res. Tech. 72, 690-701 (2009).
- Manelli, A., Sangiorgi, S., Binaghi, E., Raspanti, M. 3D analysis of SEM images of corrosion casting using adaptive stereo matching. Microscopy Research and Technique. 70, 350-354 (2007).
- Alanentalo, T. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Meth. 4, 31-33 (2007).
- Quintana, L., Sharpe, J. . Optical projection tomography of vertebrate embryo development. , 586-594 (2011).
- Walls, J. R., Coultas, L., Rossant, J., Henkelman, R. M. Three-Dimensional Analysis of Vascular Development in the Mouse Embryo. PLoS ONE. 3, e2853-e2853 (2008).
- Chalothorn, D., Clayton, J. A., Zhang, H., Pomp, D., Faber, J. E. Collateral density, remodeling, and VEGF-A expression differ widely between mouse strains. Physiol. Genomics. 30, 179-191 (2007).
- Behm, C. Z. Molecular Imaging of Endothelial Vascular Cell Adhesion Molecule-1 Expression and Inflammatory Cell Recruitment During Vasculogenesis and Ischemia-Mediated Arteriogenesis. Circulation. 117, 2902-2911 (2008).
- Carr, C. L., Lindner, J. R. Myocardial perfusion imaging with contrast echocardiography. Curr. Cardiol. Rep. 10, 233-239 (2008).
- Leong-Poi, H. Assessment of Endogenous and Therapeutic Arteriogenesis by Contrast Ultrasound Molecular Imaging of Integrin Expression. Circulation. 111, 3248-3254 (2005).
- Villanueva, F. S. Microbubbles Targeted to Intercellular Adhesion Molecule-1 Bind to Activated Coronary Artery Endothelial Cells. Circulation. 98, 1-5 (1998).
- Wei, K. Quantification of Myocardial Blood Flow With Ultrasound-Induced Destruction of Microbubbles Administered as a Constant Venous Infusion. Circulation. 97, 473-483 (1998).
- Beckmann, N., Stirnimann, R., Bochelen, D. High-Resolution Magnetic Resonance Angiography of the Mouse Brain: Application to Murine Focal Cerebral Ischemia Models. Journal of Magnetic Resonance. 140, 442-450 (1999).
- Kobayashi, H. 3D MR angiography of intratumoral vasculature using a novel macromolecular MR contrast agent. Magnetic Resonance in Medicine. 46, 579-585 (2001).
- Nezafat, R. B1-insensitive T2 preparation for improved coronary magnetic resonance angiography at 3 T. Magn. Reson. Med. 55, 858-864 (2006).
- Wagner, S., Helisch, A., Ziegelhoeffer, T., Bachmann, G., Schaper, W. Magnetic resonance angiography of collateral vessels in a murine femoral artery ligation model. NMR in Biomedicine. 17, 21-27 (2004).
- Cochet, H. In vivo MR angiography and velocity measurement in mice coronary arteries at 9.4 T: assessment of coronary flow velocity reserve. Radiology. , 254-441 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved