É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Perfusão retrógrada e enchimento da vasculatura coronariana do rato como preparação para Micro tomografia computadorizada
Neste Artigo
Resumo
Visualização dos vasos coronários é fundamental para avançar na compreensão das doenças cardiovasculares. Descrevemos aqui um método para a perfusão vasculatura coronária murino com uma borracha de silicone radiopaco (Microfil), em preparação para imagiologia Tomografia micro-computadorizada (μCT).
Resumo
Visualização da vasculatura está se tornando cada vez mais importante para compreender muitos estados diferentes da doença. Enquanto existem várias técnicas para geração de imagens vasculatura, poucos são capazes de visualizar a rede vascular como um todo, enquanto se estende a uma resolução que inclui o menor 1,2 navios. Além disso, muitas técnicas de fundição vasculares destruir o tecido circundante, impedindo posterior análise da amostra 3-5. Um método que contorna essas questões é micro-tomografia computadorizada (μCT). μCT imagem pode digitalizar com resoluções menos de 10 mícrons, é capaz de produzir reconstruções 3D da rede vascular, e deixa o tecido intacto para posterior análise (por exemplo, histologia e morfometria) 6-11. Contudo, os navios de imagem por métodos ex vivo μCT exige que os navios ser preenchido com um composto radiopaco. Como tal, a representação precisa da vasculatura produzido por μCT imagem está dependenterecheio fiável e completa dos vasos. Neste protocolo, descrevem uma técnica para encher vasos coronarianos de rato em preparação para a imagem μCT.
Duas técnicas predominam existem para o enchimento da vasculatura coronária: in vivo através de canulação e retrógrada de perfusão da aorta (ou uma ramificação fora do arco aórtico) 12-14, ou ex vivo através de uma perfusão de Langendorff 15-17 sistema. Aqui nós descrevemos um método in vivo canulação aórtica, que foi projetado especificamente para garantir o preenchimento de todos os navios. Usamos um composto radiopaco de baixa viscosidade que pode chamado Microfil perfundir através dos navios mais pequenos para preencher todos os capilares, assim como ambos os lados arteriais e venosas da rede vascular. Os vasos são perfundidos com tampão utilizando um sistema de perfusão pressurizado e, em seguida cheio com Microfil. Para garantir que Microfil enche os pequenos vasos de maior resistência, nós ligadura dos ramos grandes emanating da aorta, que desvia a Microfil nas coronárias. Uma vez que o enchimento é completa, para evitar que a natureza elástica do tecido cardíaco de espremer Microfil fora de alguns vasos, nós ligadura acessíveis principais pontos de saída vasculares imediatamente após o enchimento. Portanto, a nossa técnica é otimizado para o preenchimento completo e máximo de retenção do agente de enchimento, permitindo a visualização da rede vascular coronária completa - artérias, capilares e veias iguais.
Protocolo
1. Os preparativos antes do início
- Encha cada lado do aparelho de perfusão com tampão de pressão vasodilatador (4mg / L Papaverina + 1 g / L adenosina em PBS) ou paraformaldeído a 4% (PFA) em PBS, respectivamente.
- Prepara-se uma seringa de insulina 1/2cc (com um 29G permanentemente ligado ½ "agulha), enchendo-a com 0,1 ml de 1:100 Heparina (estoque 5000U/ml) e dobrando a agulha para ~ ângulo de 120 graus com o bisel para cima. Fazer o mesmo com uma seringa de 1 ml (com uma agulha de 26G ½ ") cheio com 0,3 ml de solução saturada de KCl.
2. A exposição do coração e da canulação da aorta
- Anestesiar o rato usando o anestésico de escolha. (Usamos uma overdose de uma mistura Cetamina / Xilazina:. Injecção IP de 130 mg de cetamina / kg e 8,8 Xilazina mg / kg em solução salina)
- Pin o rato anestesiado no tabuleiro de dissecação, acima do lado ventral. Abra a cavidade abdominal por uma incisão na linha média e retrair a pelepara expor os órgãos. Mover os intestinos para um lado para expor uma região de veia cava posterior (PVC).
- Injectar solução de heparina para o PVC. Como você extrair a agulha, cobrir o buraco da agulha com um aplicador com ponta de algodão para evitar vazamentos e mantenha-o por alguns segundos até que os coágulos de PVC de parede e vedações. Espere 2-3 minutos para a heparina para dispersar através da circulação do rato.
- Dissecar o diafragma e caixa torácica para que você possa observar o coração batendo. Lentamente injetar solução de KCl no PVC até as prisões do coração.
- Remova todos os órgãos abaixo do diafragma e impostos especiais de consumo a parte posterior do mouse, deixando a região anterior do diafragma intacta. Remover o diafragma, tomando cuidado para cortar o PVC perto do diafragma para que a porção proximal para o coração é fácil de localizar em passos subsequentes.
- Localizar a extremidade cortada da aorta. Coloque uma longa duração de 6-0 fio de seda trançada debaixo da aorta alguns milímetros anteriores from da extremidade cortada de tal modo que a sutura é dobrada para trás sobre si mesmo. Corte este tempo de sutura na metade de forma que há 2 pedaços de sutura sob a aorta. Inserir o angiocateter para dentro da extremidade de corte da aorta (Fig. 1A, B) e amarrá cada sutura com um duplo nó para segurar o angiocateter no lugar e evitar qualquer contra-pressão no interior da aorta de vazar para fora.
3. Perfusão e injeção Microfil
- Ligue o angiocateter para o aparelho de perfusão de pressão (Fig. 2) e começar a perfusão dos vasos com tampão de vasodilatador (Fig. 1C) por bombagem do aparelho de perfusão a uma pressão de condução de 100-110 mmHg. Verifique que o buffer está irrigando através das coronárias, assegurando líquido está saindo do PVC. Continuar para perfundir durante pelo menos 3 minutos ou até que o fluido que sai do PVC é clara. (Continue com os passos seguintes enquanto perfusão).
- Dissecar as costelas e costas pino (ou remover) a caixa torácica para expor o coração. Uma vez exposta, seja careful para não deixar o coração secar por espremedura gotas de tampão para o coração de um pedaço de tampão-embebida de gaze. Limpar o timo para expor o arco aórtico. Ligadura dos três principais ramos da aorta, utilizando fio de seda trançado 6-0 para garantir o fluido é desviado através das coronárias, em vez de através dessas embarcações maiores, de baixa resistência (Fig. 1D).
- Perfundir o coração com fixador durante 15 minutos, em seguida, lavar com tampão de vasodilatação durante pelo menos 2 minutos. Enquanto isso, ligadura tanto Anterior veias cavas para evitar Microfil vaze para fora do coração após a injeção (Fig 1E). Suturas em volta da PVC e da aorta, mas não aperte-os até que após o enchimento.
- Preparar o Microfil (tal como especificado na tabela de reagentes) e carregá-lo para uma seringa de 1 ml. Encher o tabuleiro de dissecção com água suficiente para cobrir o cateter (de modo a evitar a introdução de bolhas de ar quando se muda de tubagem de perfusão para a seringa Microfil). Desligue a perfusão apParatus a partir do cateter e ligar a seringa Microfil preparada.
- Injectar a Microfil para a aorta até bom enchimento das artérias coronárias é evidente (Figs 1F, 3A): as artérias vai encher primeiro, e depois o Microfil irá "derramar" para os capilares como as ondas de tecido com a cor do Microfil. Uma vez no lado venoso, a natureza hidrofóbica do Microfil faz com que ele aparecem inicialmente como esferas independentes que emerge a partir dos vasos pequenos. Continue a injectar a Microfil até uma coluna contínua enche as veias. Enchimento completo será evidente quando o Microfil é contínuo dentro dos vasos, e saem através do PVC.
- Após o enchimento está completa, rapidamente apertar as suturas que foram previamente colocadas em torno do PVC e aorta para evitar que a natureza elástica do tecido cardíaco de espremer o Microfil para fora dos vasos.
- Cobrir o coração com gaze húmida (embebido em água a partir da bandeja de dissecação) Para evitar a sua secagem para fora, e deixar repousar durante aproximadamente 1 hora à temperatura ambiente até que a Microfil tem polimerizado. Evitar quaisquer pressões externas sobre o coração durante o processo de polimerização, tais como elevação ou rodando o coração, numa tentativa de obter uma vista precoce dos vasos cheios na parte de trás do coração. Isto pode apertar Microfil a partir de alguns vasos para uma área mais elástica do coração, causando quebras na Microfil.
- Retire o coração e pós-consertá-lo em PFA 4% durante a noite a 4 ° C. Em seguida, armazenar em etanol a 70%, a 4 ° C. A vasculatura coração está agora pronto para imagiologia μCT.
4. Os resultados representativos
Vasos que são efectivamente perfundidos por Microfil terá Microfil, contínua ininterrupta ao longo dos vasos (Fig. 3A). O grau de enchimento dos vasos coronários pode ser julgada pelo olho; veias são epicardially situado a 18, e pode ser facilmente observado (Figura 3A, ponta de seta), artérias,que são mais intramiocárdica 18, são também visíveis através da superfície do coração (Fig. 3A, seta). Enchimento capilar é também evidente, como o tecido cardíaco tem uma densidade muito elevada de capilares, e portanto, quando o preenchimento capilares, o tecido cardíaco irá limpar com a cor do Microfil (Fig. 3A, estrela). Assim, todas as redes vasculares que falharam para encher será perceptível devido à falta de Microfil (Fig. 3B, C).
Descontinuidades na Microfil (asteriscos na Figura 3B), muitas vezes aparecem porque a natureza hidrofóbica da Microfil fará com que ele contraia em si mesmo e fazer com que "quebra" dentro de vasos cheios. Estes "quebra" pode ser reduzida se a pressão dentro dos vasos é mantida através de adequada tie-offs dos pontos de saída vasculares do coração. Outros descontinuidades pode ser causada por bolhas de ar no interior da Microfil. Para evitar a introdução de ar, verifique se o angiocateter está totalmente submerso na água quando se muda da perfusão ap Paratus à seringa Microfil. Se uma bolha de ar é introduzida, que muitas vezes podem ser removidos de forma simples, continuando a perfusão Microfil até que a bolha foi empurrada através e para fora dos vasos coronários.
Redes vasculares podem não encher completamente se uma porção do leito vascular é bloqueado (Fig. 3B, seta). Enquanto Heparina inibe a formação de coágulos sanguíneos, bloqueios ocasionais pode ainda ocorrer devido à perfusão Heparina incompleta antes de se iniciar o processo, ou devido a outros factores desconhecidos. Se ocorre um bloqueio, não existe, a nosso conhecimento, nenhum método para desalojar o bloqueio para completar o enchimento vascular. Enchimento incompleto pode também resultar se a pressão muito pouco é utilizado durante o enchimento, como a Microfil não será forçado em todos os leitos vasculares e as redes de capilares (Fig. 3C). Inversamente, a pressão em excesso pode causar a capilares para rebentar e extravasamento Microfil para o tecido circundante (Fig. 3D).
files/ftp_upload/3740/3740fig1.jpg "alt =" Figura 1 "/>
Figura 1. Visão geral do sistema de perfusão Microfil. (A) A aorta eo PVC são cortadas a aproximadamente o nível do diafragma. (B) da aorta ascendente é canulada com um angiocateter. (C) tampão Vasodilatação é perfundido através dos vasos, impulsionadas pelo aparelho pressão de perfusão (não ilustrado), enquanto (D) os três principais ramos fora do arco aórtico são ligadas. (E) PFA a 4% é perfundido através das coronárias, enquanto ambas as Cavas Anterior Veia são ligados. (F) utilizando uma seringa, a Microfil é perfundido através das coronárias até que seja observado que sai do PVC.
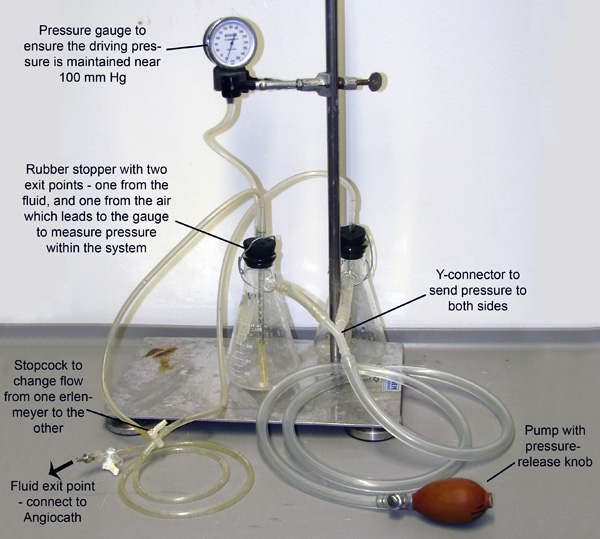
Figura 2. Aparelho de perfusão. Dois balões de Erlenmeyer, cada um preenchido com um tampão de vasodilatação ou 4% PFA, são unidas e pressurizado através de tubos ligados às suas sidearms. O sistema é pressurizado por meio de bombeamento manual dobolbo, e um medidor de pressão está ligada a um dos frascos para permitir o controlo e manutenção da pressão. Pequenos tubos estendem-se através rolhas de borracha e para baixo para dentro do fluido em cada frasco. Pressão de entrada das bombas armas brancas o fluido de cada balão para fora estes tubos de menor diâmetro. Os tubos então fundir a uma torneira de passagem que apenas permite que o fluido flua a partir de um balão de cada vez.
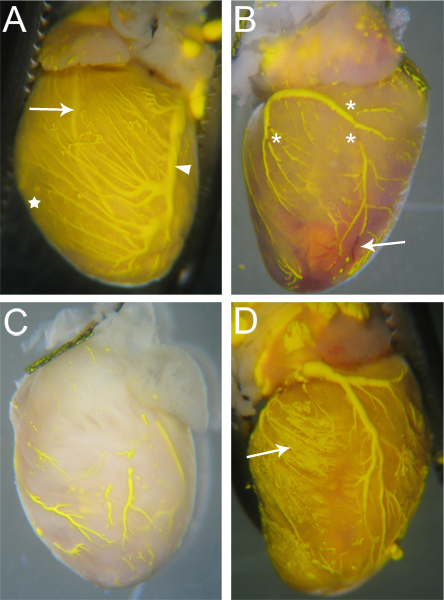
Figura 3. Experimente corações microparticulada. (A) Os navios que são preenchidos bem terá poucos (se houver) quebras na Microfil, eo tecido do coração será cor matizada do Microfil devido aos capilares cheios (estrela, e comparar com C). Ambas as artérias (seta - artéria descendente anterior esquerda) e veias (ponta de seta - Veia coronária esquerda) são visíveis através da superfície do coração. (B) Um coração com quebras na Microfil (asteriscos), bem como os bloqueios em alguns vasos que impedia Mic completarofil penetração. Os vasos bloqueados permanecem vermelho (seta), tal como o sangue não foi purgada durante o processo de perfusão. (C) Um coração com os vasos que foram preenchidos de forma incompleta. Note o tecido não foi tomada sobre a cor amarela da Microfil, indicando a Microfil não penetrar na capilares. (D) Um coração onde o rebentamento de capilares durante o enchimento, fazendo com que o Microfil a vazar para o tecido circundante (seta).
Discussão
Tecido cardíaco tem uma procura muito elevada metabólica, e, portanto, requer um fornecimento constante de nutrientes e oxigénio a partir do sangue entregue pela vasculatura coronária. Doenças dos vasos coronários, que diminuem a função coronária devido a estenose do vaso e bloqueio, podem levar à hipóxia tecidual e isquemia, e colocar em risco pacientes acometidos de infarto do miocárdio e um dano irreparável ao músculo do coração. Uma melhor compreensão do estado de doença destes navios é necessári...
Divulgações
Os ratos foram tratados com métodos aprovados pelo Institutional Animal Care e do Comitê Utilização da Universidade de Washington e de acordo com o Guia para o Cuidado e Uso de Animais de Laboratório publicado pelo National Institutes of Health EUA (NIH Publication No. 85-23, revista em 1996).
Agradecimentos
Agradecemos ao Dr. Kelly Stevens para os ensaios iniciais do protocolo, o Dr. Michael Simons, Hauch Kip Dr., e os membros de ambos os laboratórios para a discussão geral.
Este trabalho é suportado por NIH concede HL087513 e P01 HL094374.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
| Seringas de 1 ml | Becton Dickinson | BD-309602 | |
| 1/2cc seringas de insulina com agulhas fixas ½ 29G " | Becton Dickinson | BD-309306 | |
| 2 "x 2" gaze | Med101store.com | SKU 2208 | |
| 24G ¾ "Angiocath cateter IV | Becton Dickinson | BD-381112 | |
| 26G ½ "bitola agulhas | lank "> Becton Dickinson | BD-305111 | |
| A adenosina | Sigma | A9251 | 1g / L em tampão PBS durante a vasodilatação (com Papaverina) |
| Angled Pinça Graefe | Belas Ferramentas Ciência | 11052-10 | |
| Com ponta de algodão aplicadores: 6 "não-estéril | Cardinal Health | C15055-006 | |
| Curvas tesoura cirúrgica | Belas Ferramentas Ciência | 14085-09 | |
| Dissecando estereoscópio e fonte de luz | Nikon | NA | NA |
| Bandeja de dissecação, 11.5 x 7.5 polegadas | Cole-Parmer | YO-10.915-12 | Cheio de alcatrão para fixando-se o mouse |
| Belas curvas Pinças | Aesculap | FD281R | Precisa de dois |
| Heparina, 5000 estoque U / ml | APP Pharmaceuticals LLC | NDC 63323-047-10 | 1:100 de diluição em água |
| KCl | Pescador | P217 | Solução saturada em H2O |
| A cetamina (Ketaset), 100 ações mg / ml | Fort Dodge, Overland Park, KS, EUA | NDC 0856-2013-01 | Misturados, como peso do corpo 130 mg / kg, com xilazina em 0,9% salinhar |
| Microfil | Fluxo de Tecnologia | MV-122 (amarelo). Outras opções de cores também estão disponíveis. | Misturar 1:1 em peso, com 10% em volume de agente de cura. Prepare-se imediatamente antes da injecção, e vortex para garantir que é bem misturado |
| Não estéril Sutura: 6-0, trançada de seda | Harvard Apparatus | 723287 | |
| Papaverina | Americana Regent Inc. | NDC 0517-4010-01 | 4mg / L em tampão PBS durante a vasodilatação (com adenosina) |
| Paraformaldeído | Sigma | P6148 | Preparado como solução a 4% |
| Aparelho de perfusão | Ver a figura 2 | ||
| Tesoura Primavera | Belas Ferramentas Ciência | 15018-10 | |
| Xilazina (Anased), 20 ações mg / gl | Lloyd Labs | NADA # 139-236 | Misturados, como peso corporal 8,8 mg / kg, com cetamina em solução salina a 0,9% |
Referências
- Couffinhal, T., Dufourcq, P., Barandon, L., Leroux, L., Duplaa, C. Mouse models to study angiogenesis in the context of cardiovascular diseases. Front. Biosci. 14, 3310-3325 (2009).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Krucker, T., Lang, A., Meyer, E. P. New polyurethane-based material for vascular corrosion casting with improved physical and imaging characteristics. Microsc. Res. Tech. 69, 138-147 (2006).
- Murakami, T. Blood flow patterns in the rat pancreas: a simulative demonstration by injection replication and scanning electron microscopy. Microsc. Res. Tech. 37, 497-508 (1997).
- Icardo, J. M., Colvee, E. Origin and course of the coronary arteries in normal mice and in iv/iv mice. J. Anat. 199, 473-482 (2001).
- Beighley, P. E., Thomas, P. J., Jorgensen, S. M., Ritman, E. L. 3D architecture of myocardial microcirculation in intact rat heart: a study with micro-CT. Adv. Exp. Med. Biol. 430, 165-175 (1997).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, R1267-R1279 (2002).
- Jorgensen, S. M., Demirkaya, O., Ritman, E. L. Three-dimensional imaging of vasculature and parenchyma in intact rodent organs with X-ray micro-CT. Am. J. Physiol. 275, H1103-H1114 (1998).
- Marxen, M. MicroCT scanner performance and considerations for vascular specimen imaging. Med. Phys. 31, 305-313 (2004).
- Zagorchev, L. Micro computed tomography for vascular exploration. J. Angiogenes. Res. 2, 7-7 (2010).
- Heinzer, S. Hierarchical microimaging for multiscale analysis of large vascular networks. Neuroimage. 32, 626-636 (2006).
- Dedkov, E. I. Synectin/syndecan-4 regulate coronary arteriolar growth during development. Dev. Dyn. 236, 2004-2010 (2007).
- Gossl, M. Functional anatomy and hemodynamic characteristics of vasa vasorum in the walls of porcine coronary arteries. Anat. Rec. A. Discov. Mol. Cell. Evol. Biol. 272, 526-537 (2003).
- Rodriguez-Porcel, M. Altered myocardial microvascular 3D architecture in experimental hypercholesterolemia. Circulation. 102, 2028-2030 (2000).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: The Langendorff technique of isolated heart perfusion. J. Mol. Cell. Cardiol. 50, 940-950 (2011).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff---still viable in the new millennium. J. Pharmacol. Toxicol. Methods. 55, 113-126 (2007).
- Toyota, E. Vascular endothelial growth factor is required for coronary collateral growth in the rat. Circulation. 112, 2108-2113 (2005).
- Lavine, K. J., Long, F., Choi, K., Smith, C., Ornitz, D. M. Hedgehog signaling to distinct cell types differentially regulates coronary artery and vein development. Development. 135, 3161-3171 (2008).
- Cheema, A. N. Adventitial microvessel formation after coronary stenting and the effects of SU11218, a tyrosine kinase inhibitor. J. Am. Coll. Cardiol. 47, 1067-1075 (2006).
- Lametschwandtner, A., Lametschwandtner, U., Weiger, T. Scanning electron microscopy of vascular corrosion casts--technique and applications: updated review. Scanning Microsc. 4, 889-941 (1990).
- Schneider, P. Simultaneous 3D visualization and quantification of murine bone and bone vasculature using micro-computed tomography and vascular replica. Microsc. Res. Tech. 72, 690-701 (2009).
- Manelli, A., Sangiorgi, S., Binaghi, E., Raspanti, M. 3D analysis of SEM images of corrosion casting using adaptive stereo matching. Microscopy Research and Technique. 70, 350-354 (2007).
- Alanentalo, T. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Meth. 4, 31-33 (2007).
- Quintana, L., Sharpe, J. . Optical projection tomography of vertebrate embryo development. , 586-594 (2011).
- Walls, J. R., Coultas, L., Rossant, J., Henkelman, R. M. Three-Dimensional Analysis of Vascular Development in the Mouse Embryo. PLoS ONE. 3, e2853-e2853 (2008).
- Chalothorn, D., Clayton, J. A., Zhang, H., Pomp, D., Faber, J. E. Collateral density, remodeling, and VEGF-A expression differ widely between mouse strains. Physiol. Genomics. 30, 179-191 (2007).
- Behm, C. Z. Molecular Imaging of Endothelial Vascular Cell Adhesion Molecule-1 Expression and Inflammatory Cell Recruitment During Vasculogenesis and Ischemia-Mediated Arteriogenesis. Circulation. 117, 2902-2911 (2008).
- Carr, C. L., Lindner, J. R. Myocardial perfusion imaging with contrast echocardiography. Curr. Cardiol. Rep. 10, 233-239 (2008).
- Leong-Poi, H. Assessment of Endogenous and Therapeutic Arteriogenesis by Contrast Ultrasound Molecular Imaging of Integrin Expression. Circulation. 111, 3248-3254 (2005).
- Villanueva, F. S. Microbubbles Targeted to Intercellular Adhesion Molecule-1 Bind to Activated Coronary Artery Endothelial Cells. Circulation. 98, 1-5 (1998).
- Wei, K. Quantification of Myocardial Blood Flow With Ultrasound-Induced Destruction of Microbubbles Administered as a Constant Venous Infusion. Circulation. 97, 473-483 (1998).
- Beckmann, N., Stirnimann, R., Bochelen, D. High-Resolution Magnetic Resonance Angiography of the Mouse Brain: Application to Murine Focal Cerebral Ischemia Models. Journal of Magnetic Resonance. 140, 442-450 (1999).
- Kobayashi, H. 3D MR angiography of intratumoral vasculature using a novel macromolecular MR contrast agent. Magnetic Resonance in Medicine. 46, 579-585 (2001).
- Nezafat, R. B1-insensitive T2 preparation for improved coronary magnetic resonance angiography at 3 T. Magn. Reson. Med. 55, 858-864 (2006).
- Wagner, S., Helisch, A., Ziegelhoeffer, T., Bachmann, G., Schaper, W. Magnetic resonance angiography of collateral vessels in a murine femoral artery ligation model. NMR in Biomedicine. 17, 21-27 (2004).
- Cochet, H. In vivo MR angiography and velocity measurement in mice coronary arteries at 9.4 T: assessment of coronary flow velocity reserve. Radiology. , 254-441 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados