Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Ретроградная перфузия и заполнение мыши коронарных артерий, как подготовка к Micro компьютерной томографии изображений
В этой статье
Резюме
Визуализация коронарных сосудов имеет решающее значение для продвижения нашего понимания сердечно-сосудистых заболеваний. Здесь мы опишем метод перфузии мышиных коронарных артерий с резиновой рентгеноконтрастные силиконовые (Microfil), в рамках подготовки к микро-компьютерной томографии (μCT) изображений.
Аннотация
Визуализация сосудистой становится все более важным для понимания различных болезненных состояний. Хотя существует несколько методов для визуализации сосудистой, немногие из них способны визуализировать сосудистую сеть в целом в то время как расширение к резолюции, которая включает в себя более мелкие суда 1,2. Кроме того, многие сосудистые методы литья уничтожать окружающие ткани, предотвращая дальнейший анализ образцов 3-5. Один из методов, который обходит эти вопросы, является микро-компьютерной томографии (μCT). μCT можете сканировать изображения с разрешением <10 мкм, способна производить 3D-реконструкция сосудистой сети, и оставляет нетронутыми ткани для последующего анализа (например, гистологии и морфометрии) 6-11. Тем не менее, изображение суда экс естественных методов μCT требует, чтобы суда заполнена рентгеноконтрастного вещества. Таким образом, точное представление о сосудистой производства μCT визуализация зависит отдостоверного и полного наполнения сосудов. В этом протоколе описываются методики для заполнения мыши коронарных сосудов при подготовке изображений μCT.
Два преобладают методы существуют для заполнения коронарных артерий: в естественных условиях с помощью катетеризации и ретроградной перфузии аорты (или отделение от дуги аорты), 12-14, или бывших естественных условиях через систему Langendorff перфузии 15-17. Здесь мы опишем в естественных условиях катетеризации аорты метод, который был специально разработан, чтобы обеспечить заполнение всех судов. Мы используем низкую вязкость рентгеноконтрастное соединение называется Microfil который может заливать через мельчайшие сосуды, чтобы заполнить все капилляры, а также как артериальных и венозных стороны сосудистой сети. Сосуды озарен буфера с помощью системы перфузии под давлением, а затем заполнены Microfil. Для того, чтобы Microfil заполняет небольшую высших судов сопротивление, мы перевязывать крупные ветви emanatinг от аорты, которая отвлекает Microfil в коронарные артерии. После завершения заполнения, чтобы не допустить упругий характер сердечной ткани от сжатия Microfil из некоторых судов, мы перевязывать доступны основных сосудистых точек выхода сразу после заполнения. Таким образом, наша техника оптимизирована для полного заполнения и сохранения максимальной наполнителя, что позволяет визуализировать полный коронарных сосудов сети - артерий, капилляров, вен и так.
протокол
1. Подготовка перед началом
- Заполнение каждой стороне аппарата перфузионного давления с Сосудорасширяющие буфера (4 мг / л Папаверин + 1 г / л Аденозин в PBS), или 4% параформальдегид (PFA) в PBS, соответственно.
- Подготовить 1/2cc шприц инсулина (с постоянно соединенные 29G ½ "иглы), наполнив ее 0,1 мл 1:100 гепарин (5000U/ml акций) и изгиб иглы до ~ 120 градусов углом наклона вверх. У то же самое с 1 мл шприц (с 26G ½ "игла), заполненную 0,3 мл насыщенного KCl решение.
2. Разоблачение сердца и аорты cannulating
- Анестезию мыши с помощью анестезии выбора. (Мы используем передозировки кетамином / Ксилазин смеси. IP введения 130 мг / кг кетамина и 8,8 мг / кг Ксилазин в физиологическом растворе)
- Прикрепите наркозом мыши на вскрытии лоток, брюшной стороной вверх. Откройте брюшной полости средней линии разреза и убрать кожуподвергать органов. Перемещение кишечник в сторону, чтобы разоблачить области задней полой вены (ПВХ).
- Вводите Гепарин раствор в ПВХ. Как извлечь иглы, игла охватывают отверстие ватным наконечником аппликатором, чтобы предотвратить утечку и удерживайте ее в течение нескольких секунд, пока ПВХ сгустки стены и печатями. Подождите 2-3 минут гепарин для разгона всей мышь обращения.
- Проанализируйте диафрагмы и грудной клетки, таким образом Вы можете наблюдать за бьющееся сердце. Медленно введите KCl решение в ПВХ, пока сердце аресты.
- Удаление всех органов ниже диафрагмы и акцизов задней части мыши, в результате чего область передней мембраны неповрежденными. Удалите диафрагму, стараясь резать ПВХ вблизи диафрагмы, так что часть проксимальных к сердцу легко найти в последующих шагах.
- Найдите срез аорты. Положите одну длинную длину 6-0 плетеный шовный шелк под аорты несколько миллиметров переднюю сюдам срез так, что шов в два раза обратно на себя. Вырезать это больше шов пополам, так есть 2 части шва под аортой. Вставьте ангиокатетер в разрезе конца аорты (рис. 1а, б) и связать каждый шов с двойной узел провести ангиокатетер на месте и предотвращения обратного давления в аорте от утечки.
3. Перфузии и инъекции Microfil
- Подключите ангиокатетер к аппарату перфузионного давления (рис. 2) и начать перфузии сосудов с сосудорасширяющим буфера (рис. 1С) путем закачки перфузии аппарат вождения давление 100-110 мм рт. Дважды проверьте, что буфер перфузии через коронарные артерии, обеспечивая жидкость выходит из ПВХ. Продолжайте заливать в течение 3 минут, пока жидкость не выходя из ПВХ ясно. (Переходите к следующему шагу в то время перфузии.)
- Проанализируйте ребра и пин-код обратно (или удалить) грудной клетки, чтобы разоблачить сердце. После подвергается, быть окreful не допустить, чтобы сердце высыхают, сжимая капли буфера на сердце из буфера пропитанный кусок марли. Очистить от вилочковой железы, чтобы разоблачить дуги аорты. Перевязывать трех основных ветвей аорты использованием 6-0 плетеный шовный шелк для обеспечения жидкость отводится через коронарные артерии, а не через эти большие, низкие сопротивления сосудов (рис. 1D).
- Заливать сердца с фиксатором в течение 15 минут, затем смойте Расширение сосудов буфера в течение 2 минут. Между тем, как перевязывать передней полой вен, чтобы предотвратить утечку Microfil из сердца после инъекции (рис. 1Е). Место вокруг швов ПВХ и аорты, но не затягивайте их до окончания заполнения.
- Подготовка Microfil (как указано в таблице реагентов) и загрузить его в 1 мл шприц. Заполните рассечение лоток с достаточным количеством воды, чтобы покрыть катетер (таким образом, чтобы предотвратить введение пузырьков воздуха при переходе от перфузии трубки к Microfil шприца). Отключите перфузии APparatus от катетера и подключение подготовленный шприц Microfil.
- Вводите Microfil в аорту до хорошего наполнения коронарных артерий видно (рис. 1F, 3А): артерии, заполнить, а затем Microfil будет "проливать" в капиллярах, как ткань жара с цветом Microfil. После того как на венозную стороны, гидрофобный характер Microfil заставляет его сначала появляются как независимые сферы, как он выходит из мелких судов. Продолжайте вводить Microfil до непрерывного столбца наполняет вены. Полное заполнение будет видно, когда Microfil непрерывно в судах, и выходят через ПВХ.
- После заполнения завершена, быстро затянуть швы, которые ранее были размещены вокруг ПВХ и аорты, чтобы предотвратить упругий характер сердечной ткани сжимая Microfil из сосудов.
- Закройте сердце мокрой марлей (пропитанный водой от рассечения лоток) Для предотвращения ее высыхания, и оставьте примерно на 1 час при комнатной температуре до Microfil был полимеризуется. Избегайте любого давления извне на сердце во время процесса полимеризации, такие как подъем или поворот сердца в попытке получить ранний вид заполненных сосудов в задней части сердца. Это может выжать Microfil из некоторых судов в более упругой области сердца, вызывая разрывы в Microfil.
- Удалить сердца и пост-это исправить в 4% PFA в течение ночи при 4 ° C. Затем хранить в 70% этанолом при температуре 4 ° C. Сердце сосудистой готов для работы с изображениями μCT.
4. Представитель Результаты
Суда, которые эффективно перфузии по Microfil будет иметь непрерывный, непрерывный Microfil всем судам (рис. 3А). Степень заполнения коронарных сосудов можно судить на глаз, вены epicardially расположен в 18, и может быть легко наблюдается (рис. 3А, стрелки); артерий,, которые являются более интрамиокардиальной 18, также видны через поверхность сердца (рис. 3А, стрелка). Капиллярная заполнения также очевидна, как сердечная ткань имеет очень высокую плотность капилляров, и поэтому, когда капилляры заполнения, сердечной ткани будут на одном уровне с цветом Microfil (рис. 3А, звезды). Таким образом, любой сосудистой сети, которые не смогли заполнить будет заметно в связи с отсутствием Microfil (рис. 3B, C).
Разрывы в Microfil (звездочки на рис 3B) часто возникают потому, что гидрофобный характер Microfil заставит его заключить в себя и вызвать «разрывов» в заполненный суда. Эти "разрывы" может быть уменьшен, если давление внутри сосудов поддерживается за счет надлежащего тай-офф сосудистых точек выхода из сердца. Другие разрывов может быть вызвано пузырьками воздуха в Microfil. Чтобы избежать введения воздуха, убедитесь, что ангиокатетер полностью погружен в воду при переходе от перфузии AP paratus к Microfil шприц. Если пузырек воздуха вводится, он часто может быть удален только путем продолжения Microfil перфузии, пока пузырь был протолкнул и из коронарных сосудов.
Сосудистая сеть не может заполнить полностью, если часть сосудистого русла блокируется (рис. 3Б, стрелка). В то время как гепарин препятствует образованию тромбов, иногда завалами еще может произойти из-за неполной перфузии гепарин до начала процедуры, или в силу других неизвестных факторов. Если блокировка происходит, то, по нашим сведениям, ни один метод для выбить блокировки для завершения сосудистых заполнения. Неполное заполнение может также возникнуть, если слишком мало давления используется во время наполнения, как Microfil не придется во все сосудистого русла и капиллярной сети (рис. 3в). С другой стороны, слишком сильное давление может привести к капилляры лопаются и вытекать из сосудов в ткань Microfil в окружающие ткани (рис. 3).
files/ftp_upload/3740/3740fig1.jpg "ALT =" Рисунок 1 "/>
Рисунок 1. Обзор Microfil схемы перфузии. (A) аорты и ПВХ сократить примерно на уровне диафрагмы. (B) восходящая аорта канюлю с ангиокатетер. (C) Расширение сосудов буфер перфузии через сосуды, обусловлен аппарат перфузионного давления (не показан), а (D) три основные ветки дуги аорты лигируют. (E) 4% PFA в перфузию через коронарные артерии в то время как передняя Cavas Вена лигируют. (F) с помощью шприца, Microfil в перфузию через коронарные артерии, пока не наблюдается выход из ПВХ.
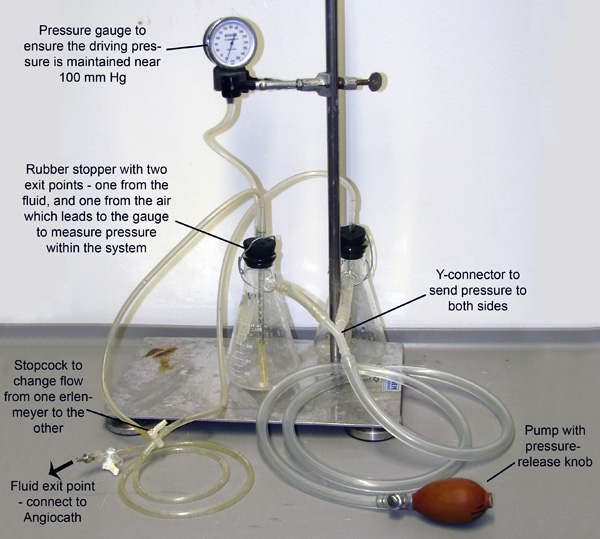
Рисунок 2. Перфузии аппарата. Две колбы Эрленмейера, заполненных либо буфер Расширение сосудов, или 4% PFA, соединяются и под давлением через трубы, связанных с их штыки. Система находится под давлением с помощью ручного накачкилампочки, а манометр подключен к одной из колб для мониторинга и поддержания давления. Малый трубы проходят через резиновые пробки и вниз в жидкости в каждой колбе. Давление, поступающих из личного оружия насосов жидкость из колбы из этих небольших труб. Трубы затем сливаются в кран который только позволяет жидкости течь из одной колбы в то время.
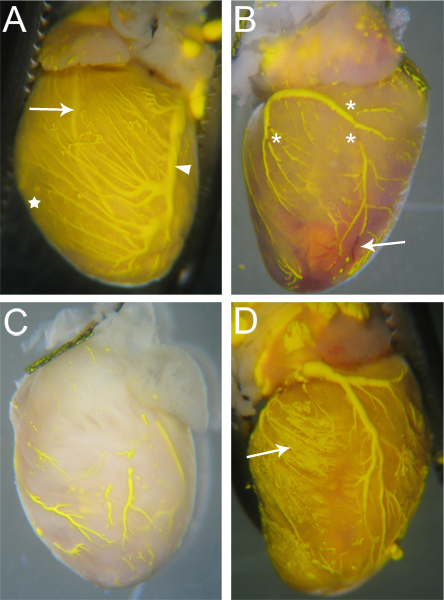
Рисунок 3. Попробуйте Microfilled сердца. (A) судов, которые заполняются и будут иметь несколько (если таковые имеются) перерывы в Microfil и ткани сердца будет оттенком цвета Microfil из-за заполненных капилляров (звезда, и сравнить с C). Обе артерии (стрелка - левой передней нисходящей артерии) и вен (стрелки - левой коронарной вены) видны через сердце поверхности. (B) сердце с перерывами в Microfil (звездочки), а также завалы в некоторых судов, которые помешали полной микрофонаrofil проникновения. Заблокированы суда остаются красные (стрелка), а кровь не смывается во время перфузии процесса. (C) сердце с сосудами, которые были полностью заполнены. Обратите внимание на ткань не принимает на желтый цвет Microfil, с указанием Microfil не проникает в капилляры. (D), где сердце взрыв во время наполнения капилляров, что приводит к Microfil, чтобы просочиться в окружающие ткани (стрелка).
Обсуждение
Сердечная ткань имеет очень высокую метаболическую спрос и, следовательно, требует постоянного поступления питательных веществ и кислорода из крови доставлен в коронарных сосудов. Заболевания коронарных сосудов, которые уменьшают коронарный функции из-за стеноз сосудов и блокировк?...
Раскрытие информации
Мыши были обработаны с помощью методов утвержденным Уходу за животными и использованию комитета Университета Вашингтона и в соответствии с Руководством по уходу и использованию лабораторных животных опубликованы американским Национальным институтом здоровья (NIH публикации № 85-23, пересмотренным в 1996 г.).
Благодарности
Мы благодарим доктора Келли Стивенс для начальных попыток протокола, д-р Майкл Симмонс, доктор Кип Hauch и членов обоих своих лабораториях для общего обсуждения.
Эта работа является поддержка грантов NIH HL087513 и P01 HL094374.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер по каталогу | Комментарии |
| 1 мл шприцев | Becton Dickinson | BD-309602 | |
| 1/2cc шприцы с иглами инсулин постоянно соединенные 29G ½ " | Becton Dickinson | BD-309306 | |
| 2 "х 2" колодки Марли | Med101store.com | Артикул 2208 | |
| 24G ¾ "Angiocath IV катетер | Becton Dickinson | BD-381112 | |
| 26G ½ "иглы калибровочных | худощавый "> Becton Dickinson | BD-305111 | |
| Аденозин | Сигма | A9251 | 1 г / л для PBS буфера Расширение сосудов (с Папаверин) |
| Угловой пинцет Грефе | Изобразительных средств наук | 11052-10 | |
| Ватные аппликаторы: 6 "нестерильные | Cardinal Health | C15055-006 | |
| Изогнутые хирургические ножницы | Изобразительных средств наук | 14085-09 | |
| Анатомический стереоскоп и источник света | Nikon | Не Доступно | Не Доступно |
| Анатомический лоток, 11,5 х 7,5 дюйма | Коул-Parmer | YO-10915-12 | Заполненный смол для закрепления кнопку мыши |
| Изобразительное Изогнутые щипцы | Aesculap | FD281R | Нужно два |
| Гепарин, 5000 ед / мл акции | APP Pharmaceuticals LLC | НДЦ 63323-047-10 | Разведении 1:100 в воде |
| KCl | Рыбак | P217 | Насыщенный раствор в H2O |
| Кетамин (Ketaset), 100 мг / мл акции | Форт Додж, Оверленд Парк, Канзас, США | НДЦ 0856-2013-01 | Смешанные до 130 мг / кг массы тела, с Ксилазин в 0,9% сставить в ряд |
| Microfil | Поток Tech | MV-122 (желтый). Другие варианты цвета также доступны. | Смешать 1:1 по весу, 10% по объему отвердителя. Подготовка перед впрыском, и вихрь, чтобы обеспечить это хорошо смешанных |
| Нестерильные шва: 6-0, плетеные шелковые | Гарвардский аппарата | 723287 | |
| Папаверин | Американская Regent Инк | НДЦ 0517-4010-01 | 4 мг / л для PBS буфера Расширение сосудов (с аденозин) |
| Параформальдегид | Сигма | P6148 | Подготовлено 4% раствор |
| Аппарат перфузии | Смотрите рисунок 2 | ||
| Весна Ножницы | Изобразительных средств наук | 15018-10 | |
| Ксилазин (Anased), 20 мг / GL акции | Ллойд Labs | NADA # 139-236 | Смешанная как 8,8 мг / кг массы тела, с кетамин в 0,9% солевом |
Ссылки
- Couffinhal, T., Dufourcq, P., Barandon, L., Leroux, L., Duplaa, C. Mouse models to study angiogenesis in the context of cardiovascular diseases. Front. Biosci. 14, 3310-3325 (2009).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Krucker, T., Lang, A., Meyer, E. P. New polyurethane-based material for vascular corrosion casting with improved physical and imaging characteristics. Microsc. Res. Tech. 69, 138-147 (2006).
- Murakami, T. Blood flow patterns in the rat pancreas: a simulative demonstration by injection replication and scanning electron microscopy. Microsc. Res. Tech. 37, 497-508 (1997).
- Icardo, J. M., Colvee, E. Origin and course of the coronary arteries in normal mice and in iv/iv mice. J. Anat. 199, 473-482 (2001).
- Beighley, P. E., Thomas, P. J., Jorgensen, S. M., Ritman, E. L. 3D architecture of myocardial microcirculation in intact rat heart: a study with micro-CT. Adv. Exp. Med. Biol. 430, 165-175 (1997).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, R1267-R1279 (2002).
- Jorgensen, S. M., Demirkaya, O., Ritman, E. L. Three-dimensional imaging of vasculature and parenchyma in intact rodent organs with X-ray micro-CT. Am. J. Physiol. 275, H1103-H1114 (1998).
- Marxen, M. MicroCT scanner performance and considerations for vascular specimen imaging. Med. Phys. 31, 305-313 (2004).
- Zagorchev, L. Micro computed tomography for vascular exploration. J. Angiogenes. Res. 2, 7-7 (2010).
- Heinzer, S. Hierarchical microimaging for multiscale analysis of large vascular networks. Neuroimage. 32, 626-636 (2006).
- Dedkov, E. I. Synectin/syndecan-4 regulate coronary arteriolar growth during development. Dev. Dyn. 236, 2004-2010 (2007).
- Gossl, M. Functional anatomy and hemodynamic characteristics of vasa vasorum in the walls of porcine coronary arteries. Anat. Rec. A. Discov. Mol. Cell. Evol. Biol. 272, 526-537 (2003).
- Rodriguez-Porcel, M. Altered myocardial microvascular 3D architecture in experimental hypercholesterolemia. Circulation. 102, 2028-2030 (2000).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: The Langendorff technique of isolated heart perfusion. J. Mol. Cell. Cardiol. 50, 940-950 (2011).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff---still viable in the new millennium. J. Pharmacol. Toxicol. Methods. 55, 113-126 (2007).
- Toyota, E. Vascular endothelial growth factor is required for coronary collateral growth in the rat. Circulation. 112, 2108-2113 (2005).
- Lavine, K. J., Long, F., Choi, K., Smith, C., Ornitz, D. M. Hedgehog signaling to distinct cell types differentially regulates coronary artery and vein development. Development. 135, 3161-3171 (2008).
- Cheema, A. N. Adventitial microvessel formation after coronary stenting and the effects of SU11218, a tyrosine kinase inhibitor. J. Am. Coll. Cardiol. 47, 1067-1075 (2006).
- Lametschwandtner, A., Lametschwandtner, U., Weiger, T. Scanning electron microscopy of vascular corrosion casts--technique and applications: updated review. Scanning Microsc. 4, 889-941 (1990).
- Schneider, P. Simultaneous 3D visualization and quantification of murine bone and bone vasculature using micro-computed tomography and vascular replica. Microsc. Res. Tech. 72, 690-701 (2009).
- Manelli, A., Sangiorgi, S., Binaghi, E., Raspanti, M. 3D analysis of SEM images of corrosion casting using adaptive stereo matching. Microscopy Research and Technique. 70, 350-354 (2007).
- Alanentalo, T. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Meth. 4, 31-33 (2007).
- Quintana, L., Sharpe, J. . Optical projection tomography of vertebrate embryo development. , 586-594 (2011).
- Walls, J. R., Coultas, L., Rossant, J., Henkelman, R. M. Three-Dimensional Analysis of Vascular Development in the Mouse Embryo. PLoS ONE. 3, e2853-e2853 (2008).
- Chalothorn, D., Clayton, J. A., Zhang, H., Pomp, D., Faber, J. E. Collateral density, remodeling, and VEGF-A expression differ widely between mouse strains. Physiol. Genomics. 30, 179-191 (2007).
- Behm, C. Z. Molecular Imaging of Endothelial Vascular Cell Adhesion Molecule-1 Expression and Inflammatory Cell Recruitment During Vasculogenesis and Ischemia-Mediated Arteriogenesis. Circulation. 117, 2902-2911 (2008).
- Carr, C. L., Lindner, J. R. Myocardial perfusion imaging with contrast echocardiography. Curr. Cardiol. Rep. 10, 233-239 (2008).
- Leong-Poi, H. Assessment of Endogenous and Therapeutic Arteriogenesis by Contrast Ultrasound Molecular Imaging of Integrin Expression. Circulation. 111, 3248-3254 (2005).
- Villanueva, F. S. Microbubbles Targeted to Intercellular Adhesion Molecule-1 Bind to Activated Coronary Artery Endothelial Cells. Circulation. 98, 1-5 (1998).
- Wei, K. Quantification of Myocardial Blood Flow With Ultrasound-Induced Destruction of Microbubbles Administered as a Constant Venous Infusion. Circulation. 97, 473-483 (1998).
- Beckmann, N., Stirnimann, R., Bochelen, D. High-Resolution Magnetic Resonance Angiography of the Mouse Brain: Application to Murine Focal Cerebral Ischemia Models. Journal of Magnetic Resonance. 140, 442-450 (1999).
- Kobayashi, H. 3D MR angiography of intratumoral vasculature using a novel macromolecular MR contrast agent. Magnetic Resonance in Medicine. 46, 579-585 (2001).
- Nezafat, R. B1-insensitive T2 preparation for improved coronary magnetic resonance angiography at 3 T. Magn. Reson. Med. 55, 858-864 (2006).
- Wagner, S., Helisch, A., Ziegelhoeffer, T., Bachmann, G., Schaper, W. Magnetic resonance angiography of collateral vessels in a murine femoral artery ligation model. NMR in Biomedicine. 17, 21-27 (2004).
- Cochet, H. In vivo MR angiography and velocity measurement in mice coronary arteries at 9.4 T: assessment of coronary flow velocity reserve. Radiology. , 254-441 (2010).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены