Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mikro Bilgisayarlı Tomografi Görüntüleme için hazırlık olarak retrograd perfüzyon ve Fare Koroner damarları doldurulması
Bu Makalede
Özet
Koroner damarların görüntülenmesi kardiyovasküler hastalıkların bizim anlayışın geliştirilmesi için çok önemlidir. Burada mikro-Bilgisayarlı Tomografi (μCT) görüntüleme için hazırlık, bir radyoopak silikon kauçuk (Microfil) ile sıçan koroner damar perfüze için bir yöntem açıklanmaktadır.
Özet
Damarların görüntülenmesi birçok hastalıktan anlamak için giderek önem kazanmaktadır. Çeşitli teknikler görüntüleme damar için mevcut olmakla birlikte, birkaç küçük gemilere 1,2 içeren bir kararın uzanan bir bütün olarak vasküler ağ görselleştirmek edebiliyoruz. Ayrıca, birçok vasküler döküm teknikleri örnek 3-5 daha fazla analiz önlenmesi, çevre doku yok. Bu konularda circumvents Bir yöntem mikro-Bilgisayarlı Tomografi (μCT) 'dir. μCT görüntüleme, kararlar <10 mikron tarama damar ağının 3D rekonstrüksiyon üretme yeteneğine sahip olduğunu ve (örneğin, histoloji ve morfometri) sonraki analiz için sağlam 6-11 doku bırakır olabilir. Bununla birlikte, ex vivo μCT yöntemlerle görüntüleme damarlarının damarlarının radyoopak bileşiği ile doldurulmuş olması gerekir. Bunun gibi, μCT görüntüleme tarafından üretilen damarların doğru temsili üzerine olurludurgemilerin güvenilir ve tam dolum. Bu protokol, biz μCT görüntüleme için hazırlık fare koroner damarları doldurmak için bir teknik açıklar.
İki hakim teknikler koroner damar doldurmak için var: Bir Langendorff perfüzyon sistemi 15-17 ile kanülasyon ve retrograd aort perfüzyon (veya arkus kapalı bir şube) 12-14 veya ex vivo ile in vivo. Burada özellikle tüm damarlarda dolum sağlamak için tasarlanmıştır vivo aort kanülasyon yöntemi bir tarif. Bütün kılcal gibi vasküler ağın, arter ve ven her iki tarafında, doldurmak için küçük damarlarda serpmek için Microfil denilen düşük viskoziteli radyopak bileşiğin kullanımı. Kaplar basınçlı bir perfüzyon sistemi kullanılarak tamponu ile perfüze ve sonra Microfil ile doldurulur. Bu Microfil küçük yüksek direnç damarları doldurur sağlamak için, büyük dalları emanatin ligatekoroner arterler içine Microfil yönlendirir aorta, gelen g. Bir kez dolum bazı gemilerin Microfil silip atacak gelen kalp dokusunun elastik yapısı önlemek için, tam, biz hemen doldurduktan sonra erişilebilir büyük damar çıkış noktaları ligate. Bu nedenle, bizim teknik komple koroner damar ağı görselleştirme sağlayarak, dolgu ajanı tam dolum ve maksimum kalıcılık için optimize edilmiştir - arterlerin, kılcal damarları ve damarların hem.
Protokol
1. Başlamadan önce hazırlıklar
- , Sırasıyla, PBS içerisinde Vazodilatör tampon (4 mg / L Papaverin + 1 gr / L PBS içinde Adenosin) veya 4% paraformaldehit (PFA) ile basınçlı perfüzyon aparatı her bir tarafında doldurun.
- 1:100 Heparin 0.1 ml (5000U/ml hisse senedi) ile doldurma ve yukarı eğim ile ~ 120 derecelik bir açıyla iğne bükerek bir 1/2cc İnsülin Şırınga (bir srekli 29G ½ "iğne ile) hazırlayın. Mı 0.3 ml doymuş KCl çözeltisi ile doldurulmuş 1 ml şırınga (26G bir ½ "iğne ile) ile aynı.
2. Kalp teşhir ve aort cannulating
- Seçtiğiniz anestezik kullanarak fare uyutmak. (Biz bir Ketamin / Ksilazin karışımı aşırı dozda kullanın:. 130 mg / kg Ketamin ve tuzlu su içinde 8.8 mg / kg Xylazine IP enjeksiyon)
- Anatomi tepsisi, ventral tarafı yukarı üzerine anestezi fare Pin. Orta hat kesi ile karın boşluğu açın ve cildi geriorganları açığa. Posterior Vena Kava (PVC) bir bölge ortaya çıkarmak bir yana bağırsak taşıyın.
- PVC içine heparin solüsyonu enjekte edilir. Eğer iğne ayıklamak gibi, sızıntı önlemek ve PVC duvar pıhtılaşması ve mühürler kadar birkaç saniye tutun için bir pamuk uçlu aplikatör ile iğne deliği kapsar. Fare dolaşımı boyunca dağıtmak için Heparin için 2-3 dakika bekleyin.
- Eğer kalpte gözlemlemek, böylece diyafram ve göğüs kafesini parçalara ayır. Yavaş yavaş kalp tutuklamalar kadar PVC KCl çözeltisi enjekte edilir.
- Diyaframın bölgenin anterior zedelemeden, diyafram ve tüketim fare posterior bölümünün altındaki bütün organları çıkarın. Kalp proksimal kısmı sonraki adımlarda bulmak kolay yani diyafram yakınında PVC kesmek için dikkatli olmanın, diyafram çıkarın.
- Aort kesik ucuna bulun. Aort altında anterior birkaç milimetre sağa sola 6-0 örgü ipek sütür biri uzun boyu yerleştirinm sütür geri kendisini iki katına olduğu gibi kesik uç. Aort altında sütür 2 adet vardır bu nedenle yarısında bu uzun sütür kesin. Aorta (Şekil 1A, B) kesik ucunu angiocatheter yerleştirin ve yerine angiocatheter tutun ve dışarı sızmasını aort içinde herhangi bir geri basıncı önlemek için bir çift düğüm, her dikiş kravat.
3. Perfüzyon ve Microfil enjeksiyon
- Basıncı perfüzyon aparatı (Şekil 2) angiocatheter bağlayın ve 100-110 mmHg bir sürüş basıncına perfüzyon cihazı pompalayarak vazodilatör tamponu (Şekil 1C) gemiler perfüze başlar. Tampon sıvı sağlayarak koroner arterler ile perfüze olup olmadığını kontrol edin çift PVC çıkarken. En az 3 dakika serpmek devam veya PVC çıkan sıvı netleşene kadar. (Perfüze ise sonraki adımlar ile devam edin.)
- Kaburga ve pin geri (veya kaldırmak) kalp duyurmak için göğüs kafesi parçalara ayır. Bir kere maruz kalan, caKalp gazlı bez tampon bulanmış parça kalbimin üstüne tampon damla sıkarak kuruması için değil reful. Aort arkı maruz timus uzak temizleyin. Sıvı sağlamak için 6-0 örgü ipek sütür kullanılarak üç büyük aort dalları Ligate yerine bu büyük, düşük dirençli damarlar (Şekil 1D) aracılığıyla daha koroner arterler üzerinden saptırılır.
- 15 dakika boyunca sabitleştirici ile kalp serpmek, ardından en az 2 dakika süreyle Vazodilatasyon tamponu ile durulanır. Bu arada, enjeksiyon sonrası kalp (1E) dışarı sızmasını Microfil önlemek için hem ön Vena Cavae ligate. Yeri PVC ve aort etrafında dikişler ama doldurduktan sonra kadar onları sıkmayın.
- Microfil hazırlayın (as reaktiflerin tabloda belirtildiği gibi) ve 1 ml şırınganın içine yerleştirin. Kateter (Microfil şırıngaya perfüzyon boru geçerken hava kabarcıklarının girişini önlemek amacıyla) kaplayacak kadar su ile diseksiyon tepsi doldurun. Perfüzyon ap ayırınkateter paratus ve hazırlanmış Microfil şırınga bağlanır.
- Koroner arterlerin iyi dolgu (Şekil 1F, 3A) kanıtlanıncaya kadar aorta Microfil enjekte: arterler ilk dolduracak ve sonra Microfil Microfil rengi ile doku basması gibi kılcal damarlar içine "dökülebilir" olacaktır. Bir kez venöz tarafında, Microfil hidrofobik yapısı nedeniyle küçük gemilere çıkar başlangıçta bağımsız bir küre gibi görünmeye neden olur. Sürekli bir sütun damarları doldurur kadar Microfil enjekte devam edin. Microfil damarlar içinde sürekli olduğunda komple dolum belirgin olacak ve PVC ile çıkarken.
- Dolum işlemi tamamlandıktan sonra, hızlı bir şekilde daha önceden damarlarının dışarı Microfil sıkma gelen kardiyak doku elastik doğası önlemek için PVC ve aorta etrafında yerleştirildi dikişlerle sıkmak.
- (Diseksiyon tepsiden su ile ıslatılmış ıslak gazlı bez ile kalp kapak) Onun kurumasını önlemek ve Microfil polimerize kadar oda sıcaklığında yaklaşık 1 saat bekletin için. Böyle kaldırırken veya kalp arkasında dolu gemilerin erken bir görünüm elde etmek için bir girişim kalp dönüm olarak polimerizasyon işlemi esnasında kalp üzerinde herhangi bir dış baskı, kaçının. Bu Microfil tatili neden kalp bir daha elastik bir alana bazı gemilerin Microfil sıkmak olabilir.
- Kalp çıkarın ve 4 gece 4% PFA post it-fix ° C Daha sonra 4 ° C'de% 70 etanol içinde depolamak Kalp damar artık μCT görüntüleme için hazırdır.
4. Temsilcisi Sonuçlar
Etkili Microfil ile perfüze olan gemiler gemi boyunca sürekli, kesintisiz Microfil (Şekil 3A) olacaktır. Koroner damarlarda dolum kapsamı göz tarafından değerlendirilecek olabilir; damarlar epicardially 18 bulunur ve kolayca (Şekil 3A, ok) görülebilir; arterler,hangi 18 daha intramiyokardiyal olan kalbin yüzeyine (Şekil 3A, ok) ile de görülebilir. Kardiyak doku kılcal damarların çok yüksek bir yoğunluğa sahip olarak kapiller dolum, de bellidir, ve bu nedenle, ne zaman kılcal dolgu, kardiyak doku Microfil rengini (Şekil 3A, yıldız) ile floş olacaktır. Böylece, doldurmak için başarısız herhangi bir damar ağları Microfil eksikliği (Şekil 3B, C) bağlı fark olacaktır.
Microfil hidrofobik doğanın kendi içine kasılmasına ve dolu gemi içinde "sonları" neden neden çünkü Microfil (Şekil 3B'de yıldız) süreksizlikler sık görünür. Damarları içindeki basıncı kalpten damar çıkış noktalarının tie-off'lara uygun yoluyla sürdürüldüğü takdirde, bu "molaları" azaltılabilir. Diğer süreksizliklerin mikrofiltre içinde hava kabarcıkları neden olabilir. Perfüzyon ap geçerken hava girişini önlemek için, angiocatheter tamamen su altında olduğundan emin olun Microfil şırıngaya paratus. Bir hava kabarcığı tanışınca, genellikle balonu koroner damarların üzerinden itti ve dışarı dek Microfil perfüzyon devam ederek basitçe kaldırılabilir.
Vasküler yataklı bir bölümünü (Şekil 3B, ok) bloke halinde vasküler ağlar tamamen dolgu olmayabilir. Heparin kan pıhtısı oluşumunu inhibe ederken, zaman zaman tıkanmalara hala prosedür öncesi veya başka bir bilinmeyen faktörler nedeniyle başlayan eksik heparin perfüzyon nedeniyle oluşabilir. Bir tıkanma meydana gelirse, vasküler dolgu tamamlamak için blokaj yerinden oynatmamaya için hiçbir yöntem, bildiğimiz kadarıyla yok. Çok az basınç Microfil tüm vasküler yatak ve kılcal ağlar (Şekil 3C) zorla olmayacak gibi, dolum esnasında kullanıldığı takdirde eksik bilgi girilmesi de neden olabilir. Tersine, çok fazla basınç kılcal (Şekil 3D) çevredeki dokuya Microfil patlaması ve extravasate neden olabilir.
files/ftp_upload/3740/3740fig1.jpg "alt =" Şekil 1 "/>
Şekil 1.. Microfil perfüzyon düzeninin bakış. (A) aort ve PVC diyaframın yaklaşık seviyesinde kesilir. (B) aort bir angiocatheter ile kanüle edilir. (D) arkus kapalı üç ana kolu bağlandı iken (C) Vazodilatasyon tampon baskı perfüzyon aparatı (Resim mevcut değil) tarafından tahrik olan gemiler, içinden perfüze edilmiştir. Her iki ön Vena Cavas ligate edilir ise (E) 4% PFA koroner içinden perfüze edilmiştir. Bu PVC'den çıkmadan gözlenene kadar (F) bir şırınga kullanılarak, Microfil koroner içinden perfüze edilmiştir.
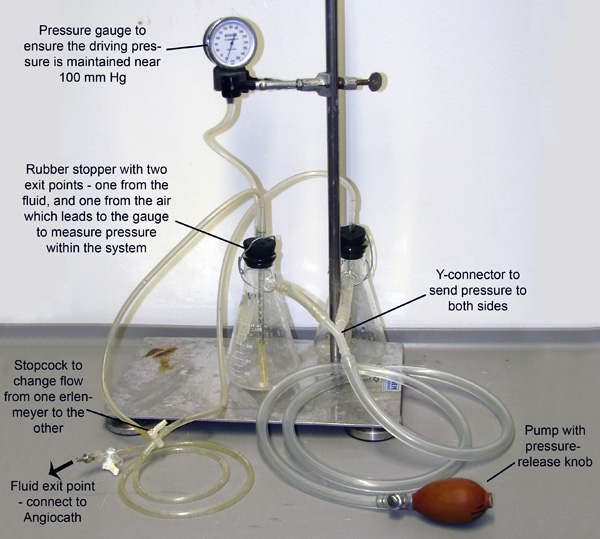
Şekil 2. Perfüzyon Aparatı. İki Erlenmeyer matara, Vazodilatasyon tampon veya% 4 PFA ya dolu, her biri katıldı ve sidearms bağlı borular aracılığıyla tahrik edilmektedir. Sistemin bir pompa aracılığıyla elle basınçlı haletermometre ve bir basınç ölçer izleme ve basınç bakım izin vermek için şişeler birine bağlanır. Küçük tüpler kauçuk tıpa ile ve aşağı her şişede sıvı içine uzatmak. Basınç bu küçük tüpler dışarı her şişesi sidearms pompalar sıvı giren. Tüpler sonra sadece bir kerede bir şişesi akmaya sıvı sağlayan bir musluk de birleştirebilirsiniz.
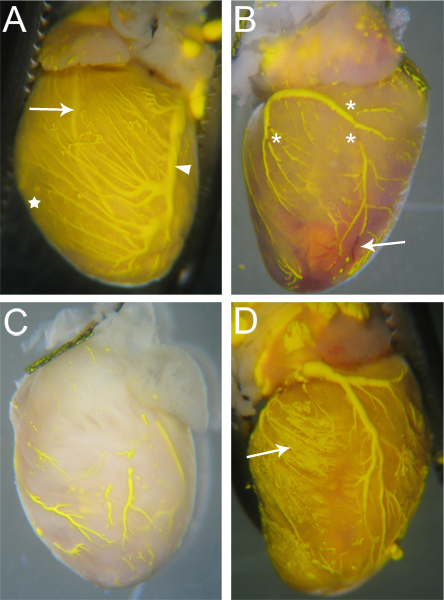
Şekil 3. Microfilled kalpleri tadın. (A) de dolu gemiler (varsa) Microfil tatili kaç olacak ve kalp dokusu dolu kılcal (yıldız, ve C ile karşılaştırmak) nedeniyle Microfil ile tinged rengi olacak. Her iki arter (ok - Sol ön inen arter) ve damarlar (ok - Sol Koroner Damar) kalp yüzey boyunca görülebilir. (B) Tam Mikrofon önlenir bazı damarlarda Microfil in sonlarının (yıldız işareti) yanı sıra, tıkanmalar olan bir kalppenetrasyon rofil. Bloke damarlar kan perfüzyon işlemi sırasında dışarı atılır değildi olarak, kırmızı (ok) kalır. Tam olarak dolduruldu damarları ile (C) bir kalp. Doku Microfil kılcal damarları içine nüfuz etmedi belirten Microfil ve sarı renk üzerine almadığını dikkat edin. (D) Bir kalp burada Microfil çevreleyen doku (ok) içine sızmaya neden dolum esnasında kılcal damarların patlaması.
Tartışmalar
Kardiyak doku çok yüksek metabolik talep vardır ve bu nedenle, koroner damar tarafından sağlanan kandan besin ve oksijen sabit bir besleme gerektirir. Damar darlığı ve tıkanma nedeniyle koroner fonksiyonu azaltmak koroner damarlarında, hastalıkları, doku hipoksisi ve iskemiye yol, myokard infarktüsü ve kalp kası onarılamaz hasar riski etkilenen hastalar koyabilirsiniz. Bu gemilerin hastalıklı devlet daha iyi anlaşılması gereklidir ve koroner damarların çalışma yeteneğimizi kritik damarların g?...
Açıklamalar
Fareler, Washington Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi tarafından ve Sağlık ABD Ulusal Sağlık Enstitüleri (NIH Yayın No 85-23 tarafından yayınlanan Laboratuvar Hayvanları Bakım ve Kullanım Kılavuzu göre onaylanmış yöntemlerle ele alındı ) 1996 revize edilmiştir.
Teşekkürler
Biz protokol, Dr Michael Simons, Dr Kip Hauch ve genel tartışma için laboratuvarlarında her iki üyelerinin ilk denemeleri için Dr Kelly Stevens teşekkür ederim.
Bu çalışma NIH hibe HL087513 ve P01 HL094374 tarafından destek.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reaktif Adı | Şirket | Katalog numarası | Yorumlar |
| 1 ml şırınga | Becton Dickinson | BD-309.602 | |
| Srekli 29G ½ 'iğne ile 1/2cc insülin şırıngaları | Becton Dickinson | BD-309.306 | |
| 2 "x 2" tül pedleri | Med101store.com | SKU 2208 | |
| 24G ¾ "Angiocath IV kateter | Becton Dickinson | BD-381.112 | |
| 26G ½ "insülin iğnesi | sıska "> Becton Dickinson | BD-305.111 | |
| Adenozin | Sigma | A9251 | 1g / Vazodilatasyon Tampon PBS L (Papaverin ile) |
| Açılı Graefe Forseps | Güzel Bilim Araçları | 11052-10 | |
| Pamuk uçlu aplikatörler: 6 "non-steril | Cardinal Health | C15055-006 | |
| Kavisli Cerrahi Makas | Güzel Bilim Araçları | 14085-09 | |
| Kesme stereoskop ve ışık kaynağı | Nikon | NA | NA |
| Kesme Tepsi, 11,5 x 7,5 inç | Cole-Parmer | YO-10.915-12 | Fareyi aşağı iğnelemeyi için tar ile Dolu |
| Güzel Kavisli Forseps | Aesculap | FD281R | Gereken iki |
| Heparin, 5000 U / ml stok | APP İlaç LLC | NDC 63323-047-10 | Su 1:100 |
| KCl | Balıkçı | P217 | H2O Doymuş çözelti |
| Ketamin (Ketaset), 100 mg / ml stok | Fort Dodge, Overland Park, KS, ABD | NDC 0856-2013-01 | % 0.9 's Xylazine ile 130 mg / kg vücut ağırlığı olarak Karışıkdizilmek |
| Microfil | Akış Tech | MV-122 (sarı). Diğer renk seçenekleri de mevcuttur. | Sertleştirici hacim itibariyle% 10 ile, 1:1 karıştırın. Iyi karışık olduğundan emin olmak için sadece enjeksiyon ve vorteks önce hazırlayın |
| Steril olmayan Dikiş: 6-0, örgü ipek | Harvard Apparatus | 723287 | |
| Papaverin | Amerikan Regent A.Ş. | NDC 0517-4010-01 | 4 mg / Vazodilatasyon Tampon PBS L (Adenozin ile) |
| Paraformaldehyde | Sigma | P6148 | 4% solüsyon olarak hazırlandı |
| Perfüzyon Aparatı | Bakınız, şekil 2 | ||
| Bahar Makas | Güzel Bilim Araçları | 15018-10 | |
| Xylazine (Anased), 20 mg / gl stok | Lloyd Labs | ADA # 139-236 | % 0.9 tuzlu su içinde Ketamin ile 8,8 mg / kg vücut ağırlığı gibi karıştırılabilir |
Referanslar
- Couffinhal, T., Dufourcq, P., Barandon, L., Leroux, L., Duplaa, C. Mouse models to study angiogenesis in the context of cardiovascular diseases. Front. Biosci. 14, 3310-3325 (2009).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Krucker, T., Lang, A., Meyer, E. P. New polyurethane-based material for vascular corrosion casting with improved physical and imaging characteristics. Microsc. Res. Tech. 69, 138-147 (2006).
- Murakami, T. Blood flow patterns in the rat pancreas: a simulative demonstration by injection replication and scanning electron microscopy. Microsc. Res. Tech. 37, 497-508 (1997).
- Icardo, J. M., Colvee, E. Origin and course of the coronary arteries in normal mice and in iv/iv mice. J. Anat. 199, 473-482 (2001).
- Beighley, P. E., Thomas, P. J., Jorgensen, S. M., Ritman, E. L. 3D architecture of myocardial microcirculation in intact rat heart: a study with micro-CT. Adv. Exp. Med. Biol. 430, 165-175 (1997).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, R1267-R1279 (2002).
- Jorgensen, S. M., Demirkaya, O., Ritman, E. L. Three-dimensional imaging of vasculature and parenchyma in intact rodent organs with X-ray micro-CT. Am. J. Physiol. 275, H1103-H1114 (1998).
- Marxen, M. MicroCT scanner performance and considerations for vascular specimen imaging. Med. Phys. 31, 305-313 (2004).
- Zagorchev, L. Micro computed tomography for vascular exploration. J. Angiogenes. Res. 2, 7-7 (2010).
- Heinzer, S. Hierarchical microimaging for multiscale analysis of large vascular networks. Neuroimage. 32, 626-636 (2006).
- Dedkov, E. I. Synectin/syndecan-4 regulate coronary arteriolar growth during development. Dev. Dyn. 236, 2004-2010 (2007).
- Gossl, M. Functional anatomy and hemodynamic characteristics of vasa vasorum in the walls of porcine coronary arteries. Anat. Rec. A. Discov. Mol. Cell. Evol. Biol. 272, 526-537 (2003).
- Rodriguez-Porcel, M. Altered myocardial microvascular 3D architecture in experimental hypercholesterolemia. Circulation. 102, 2028-2030 (2000).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: The Langendorff technique of isolated heart perfusion. J. Mol. Cell. Cardiol. 50, 940-950 (2011).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff---still viable in the new millennium. J. Pharmacol. Toxicol. Methods. 55, 113-126 (2007).
- Toyota, E. Vascular endothelial growth factor is required for coronary collateral growth in the rat. Circulation. 112, 2108-2113 (2005).
- Lavine, K. J., Long, F., Choi, K., Smith, C., Ornitz, D. M. Hedgehog signaling to distinct cell types differentially regulates coronary artery and vein development. Development. 135, 3161-3171 (2008).
- Cheema, A. N. Adventitial microvessel formation after coronary stenting and the effects of SU11218, a tyrosine kinase inhibitor. J. Am. Coll. Cardiol. 47, 1067-1075 (2006).
- Lametschwandtner, A., Lametschwandtner, U., Weiger, T. Scanning electron microscopy of vascular corrosion casts--technique and applications: updated review. Scanning Microsc. 4, 889-941 (1990).
- Schneider, P. Simultaneous 3D visualization and quantification of murine bone and bone vasculature using micro-computed tomography and vascular replica. Microsc. Res. Tech. 72, 690-701 (2009).
- Manelli, A., Sangiorgi, S., Binaghi, E., Raspanti, M. 3D analysis of SEM images of corrosion casting using adaptive stereo matching. Microscopy Research and Technique. 70, 350-354 (2007).
- Alanentalo, T. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Meth. 4, 31-33 (2007).
- Quintana, L., Sharpe, J. . Optical projection tomography of vertebrate embryo development. , 586-594 (2011).
- Walls, J. R., Coultas, L., Rossant, J., Henkelman, R. M. Three-Dimensional Analysis of Vascular Development in the Mouse Embryo. PLoS ONE. 3, e2853-e2853 (2008).
- Chalothorn, D., Clayton, J. A., Zhang, H., Pomp, D., Faber, J. E. Collateral density, remodeling, and VEGF-A expression differ widely between mouse strains. Physiol. Genomics. 30, 179-191 (2007).
- Behm, C. Z. Molecular Imaging of Endothelial Vascular Cell Adhesion Molecule-1 Expression and Inflammatory Cell Recruitment During Vasculogenesis and Ischemia-Mediated Arteriogenesis. Circulation. 117, 2902-2911 (2008).
- Carr, C. L., Lindner, J. R. Myocardial perfusion imaging with contrast echocardiography. Curr. Cardiol. Rep. 10, 233-239 (2008).
- Leong-Poi, H. Assessment of Endogenous and Therapeutic Arteriogenesis by Contrast Ultrasound Molecular Imaging of Integrin Expression. Circulation. 111, 3248-3254 (2005).
- Villanueva, F. S. Microbubbles Targeted to Intercellular Adhesion Molecule-1 Bind to Activated Coronary Artery Endothelial Cells. Circulation. 98, 1-5 (1998).
- Wei, K. Quantification of Myocardial Blood Flow With Ultrasound-Induced Destruction of Microbubbles Administered as a Constant Venous Infusion. Circulation. 97, 473-483 (1998).
- Beckmann, N., Stirnimann, R., Bochelen, D. High-Resolution Magnetic Resonance Angiography of the Mouse Brain: Application to Murine Focal Cerebral Ischemia Models. Journal of Magnetic Resonance. 140, 442-450 (1999).
- Kobayashi, H. 3D MR angiography of intratumoral vasculature using a novel macromolecular MR contrast agent. Magnetic Resonance in Medicine. 46, 579-585 (2001).
- Nezafat, R. B1-insensitive T2 preparation for improved coronary magnetic resonance angiography at 3 T. Magn. Reson. Med. 55, 858-864 (2006).
- Wagner, S., Helisch, A., Ziegelhoeffer, T., Bachmann, G., Schaper, W. Magnetic resonance angiography of collateral vessels in a murine femoral artery ligation model. NMR in Biomedicine. 17, 21-27 (2004).
- Cochet, H. In vivo MR angiography and velocity measurement in mice coronary arteries at 9.4 T: assessment of coronary flow velocity reserve. Radiology. , 254-441 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır