Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Perfusion rétrograde et remplissage de la vascularisation coronaire souris comme préparation à l'imagerie par ordinateur Micro tomographie
Dans cet article
Résumé
Visualisation des vaisseaux coronaires est essentielle pour faire progresser notre compréhension des maladies cardio-vasculaires. Nous décrivons ici une méthode pour perfuser murin vasculaire coronaire avec un caoutchouc de silicone radio-opaque (Microfil), en préparation pour les micro-tomographie par ordinateur (μCT) d'imagerie.
Résumé
Visualisation de la vascularisation est de plus en plus important pour la compréhension de nombreux états pathologiques différentes. Bien que plusieurs techniques existent pour l'imagerie vasculaire, quelques-uns sont capables de visualiser le réseau vasculaire dans son ensemble tout en étendant à une résolution qui comprend le plus petit 1,2 navires. En outre, de nombreuses techniques de moulage vasculaires détruire les tissus environnants, ce qui empêche une analyse plus approfondie de l'échantillon 3-5. Une méthode qui contourne ces problèmes est la micro-tomographie par ordinateur (μCT). μCT imagerie permet de numériser à des résolutions de moins de 10 microns, est capable de produire des reconstitutions en 3D du réseau vasculaire, et laisse le tissu intact pour une analyse ultérieure (par exemple, l'histologie et la morphométrie) 6-11. Toutefois, les navires d'imagerie par des méthodes in vivo ex μCT exige que les navires soient remplies avec un composé radio-opaque. En tant que tel, la représentation précise de la vascularisation produite par μCT imagerie est subordonnée àremplissage fiable et complète des vaisseaux. Dans ce protocole, nous décrivons une technique pour remplir des récipients de souris coronaires en préparation pour l'imagerie μCT.
Deux techniques existent prédominent pour le remplissage du système vasculaire coronaire: in vivo par perfusion canulation et rétrograde de l'aorte (ou une branche hors de l'arche aortique) 12-14, ou ex vivo par l'intermédiaire d'un système de perfusion de Langendorff 15-17. Nous décrivons ici une méthode in vivo canulation aortique qui a été spécifiquement conçu pour assurer le remplissage de tous les navires. On utiliser un composé radio-opaque appelé faible viscosité Microfil qui peut perfuser à travers les petits vaisseaux pour remplir tous les capillaires, ainsi que deux des côtés artériels et veineux du réseau vasculaire. Les navires sont perfusées avec le tampon en utilisant un système de perfusion sous pression, puis rempli de Microfil. Pour veiller à ce que Microfil remplit les petits vaisseaux de résistance plus élevés, nous ligaturer les grosses branches emanating à partir de l'aorte, qui dévie le Microfil dans les artères coronaires. Une fois le remplissage terminé, pour empêcher la nature élastique du tissu cardiaque de serrage Microfil sur des vaisseaux, on ligature accessibles principaux points de sortie vasculaires immédiatement après le remplissage. Par conséquent, notre technique est optimisé pour un remplissage complet et la rétention maximale de l'agent de remplissage, permettant la visualisation de l'ensemble du réseau vasculaire coronaire - artères, les capillaires et les veines ressemblent.
Protocole
1. Préparatifs avant de commencer
- Remplir chaque côté de l'appareil de perfusion sous pression avec un tampon vasodilatateur (4 mg / L de papavérine + 1 g / L adénosine dans du PBS) ou paraformaldéhyde 4% (PFA) dans du PBS, respectivement.
- Préparer une seringue à insuline 1/2cc (avec un 29G fixé en permanence ½ "aiguille) en le remplissant avec 0,1 ml de 1:100 héparine (stock 5000U/ml) et de tordre l'aiguille à l'angle ~ 120 degrés avec le biseau vers le haut. Faites le même avec une seringue de 1 ml (avec une 26G ½ "aiguille) remplie avec 0,3 ml de solution de KCl saturé.
2. Exposer le cœur et l'aorte canulation
- Anesthésier la souris en utilisant votre anesthésique de choix. (Nous utilisons une surdose d'un mélange kétamine / xylazine:. Injection IP de 130 mg / kg de kétamine et 8,8 mg / kg de xylazine dans une solution saline)
- Epingler la souris anesthésiée sur le plateau de dissection, jusqu'à la face ventrale. Ouvrez la cavité abdominale par une incision médiane et se rétracter la peauà exposer les organes. Déplacer les intestins d'un côté afin d'exposer une région du postérieur veine cave (PVC).
- Injecter la solution d'héparine dans le PVC. Comme vous extraire l'aiguille, couvrir le trou d'aiguille avec un coton-tige pour empêcher les fuites et maintenez-le pendant quelques secondes jusqu'à ce que les caillots de mur PVC et les joints. Attendre 2-3 minutes pour l'héparine pour disperser tout au long de la circulation de la souris.
- Disséquer le diaphragme et la cage thoracique afin que vous puissiez observer le cœur battant. Injecter lentement une solution de KCl dans le PVC jusqu'à ce que les arrestations de coeur.
- Retirez tous les organes ci-dessous du diaphragme et de l'accise de la partie postérieure de la souris, en laissant la partie antérieure région de la membrane intacte. Enlever la membrane, en prenant soin de couper le PVC à proximité de la membrane de sorte que la partie proximale du cœur est facile à localiser dans des étapes ultérieures.
- Localisez l'extrémité coupée de l'aorte. Placez une grande longueur de 6-0 suture soie tressée sous l'aorte quelques millimètres antérieures vientm l'extrémité coupée de telle sorte que la suture est replié sur lui-même. Couper ce fil de suture plus de moitié il ya donc 2 morceaux de fil de suture sous l'aorte. Insérez le angiocathéter dans l'extrémité coupée de l'aorte (figure 1A, B) et attacher chaque suture avec un double-noeud pour tenir le angiocathéter en place et d'empêcher toute contre-pression dans l'aorte de s'échapper.
3. Perfusion et d'injection Microfil
- Connecter le angiocathéter à l'appareil de perfusion sous pression (Fig 2) et pour commencer à perfuser des vaisseaux avec du tampon vasodilatateur (figure 1C) par pompage de l'appareil de perfusion à une pression de 100-110 mm de Hg conduite. Vérifiez que le tampon est perfuser à travers les artères coronaires en veillant à ce liquide est sortie de la PVC. Continuer à perfuser pendant au moins 3 minutes ou jusqu'à ce que le liquide sortant de la PVC est clair. (Continuer avec les prochaines étapes tout en perfusant.)
- Disséquer les côtes et le dos broches (ou supprimer) la cage thoracique afin d'exposer le cœur. Une fois exposée, soit environreful de ne pas laisser le cœur se dessécher en serrant gouttes de tampon sur le cœur d'un morceau de tampon imbibé de gaze. Dégagez le thymus pour exposer la crosse aortique. Ligaturer les trois branches de l'aorte majeurs en utilisant 6-0 suture en soie tressée pour assurer fluide est détournée par les artères coronaires, plutôt que par ces grands, les bateaux à faible résistance (1d).
- Perfuser le cœur avec un fixateur pendant 15 minutes, puis rincer avec un tampon de vasodilatation pendant au moins 2 minutes. Pendant ce temps, à la fois antérieur ligaturer Vena veines pour empêcher Microfil de s'échapper du cœur après l'injection (figure 1E). Sutures placer autour du PVC et de l'aorte, mais ne les serrez pas jusqu'à ce que après le remplissage.
- Préparer le Microfil (tel que spécifié dans le tableau des réactifs) et le charger dans une seringue de 1 ml. Remplir le bac de dissection avec suffisamment d'eau pour couvrir le cathéter (manière à empêcher l'introduction de bulles d'air lors du passage de tube de perfusion à la seringue Microfil). Débranchez l'AP perfusionparatus du cathéter et connecter la seringue Microfil préparée.
- Injecter le Microfil dans l'aorte jusqu'à un bon remplissage des artères coronaires est évident (fig. 1F, 3A): les artères se remplissent d'abord, puis l'Microfil sera "déborder" dans les capillaires comme les bouffées de tissus avec la couleur de la Microfil. Une fois sur le côté veineux, la nature hydrophobe de la Microfil qu'il occasionne aux initialement apparaître comme des sphères indépendantes comme il ressort des navires plus petits. Continuer à injecter le Microfil jusqu'à une colonne continue remplit les veines. Remplissage complet sera manifeste lorsque le Microfil est continue dans les vaisseaux, et il est sortie par l'intermédiaire du PVC.
- Après remplissage est terminée, rapidement serrer les fils de suture qui ont été précédemment placées autour du PVC et de l'aorte pour empêcher la nature élastique du tissu cardiaque à partir du pressage Microfil hors des vaisseaux.
- Couvrez le coeur avec de la gaze humide (imbibé d'eau à partir du bac de dissection) Pour empêcher sa dessèchement, et laissez-le reposer pendant environ 1 heure à température ambiante jusqu'à ce que le Microfil a polymérisé. Évitez toute pression extérieure sur le coeur pendant le procédé de polymérisation, comme soulever ou le retourner au cœur dans une tentative pour obtenir une vue rapide des récipients remplis à l'arrière du cœur. Cela peut presser Microfil de certains navires dans une zone plus élastique du cœur, provoquant des ruptures dans la Microfil.
- Retirez le cœur et le post-fixer dans 4% PFA une nuit à 4 ° C. Puis stocker dans de l'éthanol 70% à 4 ° C. La vascularisation coeur est maintenant prêt pour l'imagerie μCT.
4. Les résultats représentatifs
Les navires qui sont effectivement irrigués par Microfil auront continue, ininterrompue tout au long de Microfil les vaisseaux (figure 3A). Le degré de remplissage des vaisseaux coronaires peut être jugée par les yeux; veines sont épicardique situé à 18, et peut être facilement observée (figure 3A, tête de flèche); artères,qui sont plus intramyocardique 18, sont également visible à travers la surface du coeur (figure 3A, flèche). Remplissage capillaire est également évident, que le tissu cardiaque a une très forte densité des capillaires et, par conséquent, lorsque le remplissage des capillaires, le tissu cardiaque sera rincer avec de la couleur de la Microfil (Fig. 3A, étoiles). Ainsi, les réseaux vasculaires qui ont échoué à remplir sera perceptible en raison de l'absence de Microfil (Fig. 3B, C).
Les discontinuités dans la Microfil (astérisques dans la figure 3B) apparaissent souvent parce que le caractère hydrophobe de la Microfil le fera se contracter sur lui-même et provoquer "casse" dans les vaisseaux remplis. Ces "casse" peut être réduit si la pression dans les vaisseaux est maintenue grâce à bon tie-offs des points de sortie vasculaires du coeur. Autres discontinuités peuvent être causées par les bulles d'air au sein de la microfiltration. Pour prévenir l'introduction de l'air, assurez-vous que l'angiocathéter est entièrement immergé dans l'eau lors du passage de l'AP perfusion reils à la seringue Microfil. Si une bulle d'air est introduite, elle peut souvent être éliminés simplement en continuant la perfusion Microfil ce que la bulle a été poussé à travers et hors des vaisseaux coronaires.
Réseaux vasculaires peuvent ne pas remplir complètement si une partie du lit vasculaire est bloquée (Fig. 3B, flèche). Bien que l'héparine inhibe la formation de caillots sanguins, les blocages occasionnels peuvent encore se produire en raison de la perfusion d'héparine incomplète avant de commencer la procédure, ou en raison d'autres facteurs inconnus. Si un blocage se produit, il est, à notre connaissance, aucune méthode pour déloger l'obstruction pour compléter le remplissage vasculaire. Remplissage incomplet peut également se produire si la pression est trop peu utilisé au cours du remplissage, comme le Microfil ne seront pas contraints à tous les lits vasculaires et les réseaux capillaires (Fig. 3C). A l'inverse, trop de pression peut causer des capillaires à éclater et s'extravaser Microfil dans le tissu environnant (Fig. 3D).
files/ftp_upload/3740/3740fig1.jpg "alt =" Figure 1 "/>
Figure 1. Vue d'ensemble du régime de perfusion Microfil. (A) l'aorte et le PVC sont coupés à peu près au niveau de la membrane. (B) L'aorte ascendante est une canule avec un angiocathéter. (C) du tampon vasodilatation est perfusé à travers les vaisseaux, poussés par l'appareil de perfusion sous pression (non représenté), tandis que (D) les trois principales branches au large de la crosse de l'aorte sont ligaturés. (E) 4% PFA est perfusé par les artères coronaires alors que les deux Cavas antérieures Vena sont ligaturés. (F) utilisant une seringue, Microfil est perfusé à travers les artères coronaires jusqu'à ce qu'il soit constaté sortant du PVC.
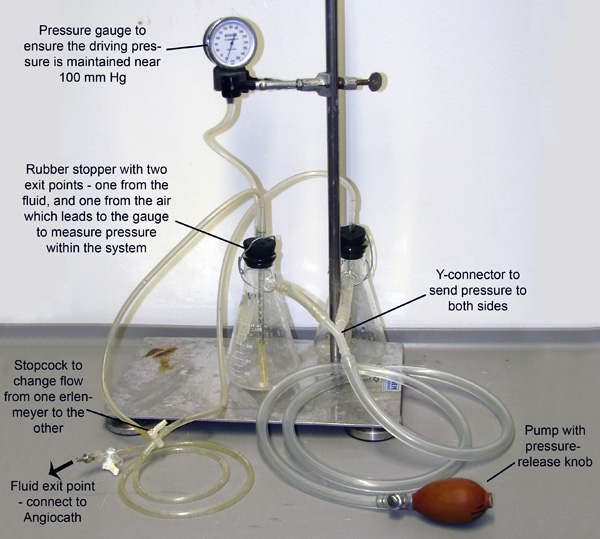
Figure 2. Appareil de perfusion. Deux erlenmeyers, chacun rempli avec le tampon vasodilatation soit ou 4% PFA, sont unis et mis sous pression par des tubes reliés à leurs armes de poing. Le système est pressurisé à travers le pompage manuel de l'ampoule, et une jauge de pression est connecté à l'un des flacons pour permettre la surveillance et l'entretien de la pression. Les petits tubes s'étendent à travers un bouchon en caoutchouc et en bas dans le liquide dans chaque flacon. Pression d'entrer des armes de poing pompes le fluide à partir de chaque flacon de ces petits tubes. Les tubes ensuite fusionner à un robinet d'arrêt qui ne permet au fluide de s'écouler d'un flacon à la fois.
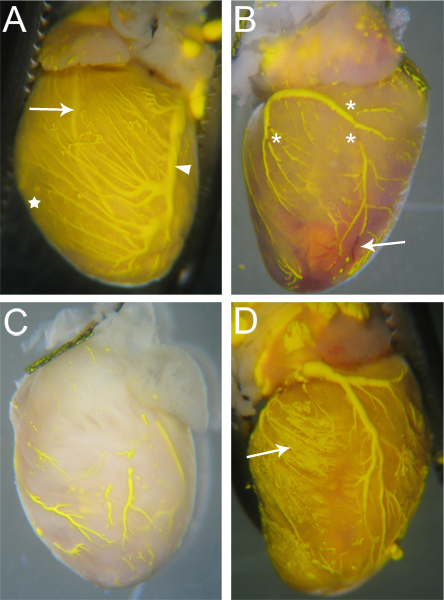
Figure 3. Goûtez cœur microchargés. (A) Les navires qui sont remplis et aura quelques-uns (le cas échéant) des ruptures dans la Microfil, et le tissu cardiaque sera teintée de la couleur de la Microfil en raison de la pleine capillaires (étoiles, et les comparer avec C). Les deux artères (flèche - artère descendante antérieure gauche) et les veines (tête de flèche - gauche veine coronaire) sont visibles à travers la surface du coeur. (B) Un coeur avec des pauses dans la microfiltration (astérisques) ainsi que des blocages dans certains navires qui empêchait Mic complèterofil pénétration. Les navires bloqués restent au rouge (flèche), que le sang n'a pas été purgés pendant le processus de perfusion. (C) Un coeur avec des navires qui ont été partiellement remplis. Notez que le tissu n'a pas pris la couleur jaune de la Microfil, indiquant la Microfil ne pas pénétrer dans les capillaires. (D) Un cœur où l'éclatement de la capillaires pendant le remplissage, provoquant la Microfil de s'infiltrer dans le tissu environnant (flèche).
Discussion
Tissu cardiaque a une très forte demande métabolique, et nécessite donc un apport constant de nutriments et d'oxygène dans le sang fourni par le système vasculaire coronarien. Maladies des vaisseaux coronaires, qui diminuent la fonction coronarienne en raison de sténose du vaisseau et le blocage, peuvent conduire à une hypoxie tissulaire et de l'ischémie, et de mettre les patients affectés au risque d'infarctus du myocarde et des dommages irréparables au muscle cardiaque. Une meilleure compréhensi...
Déclarations de divulgation
Les souris ont été traitées avec des méthodes approuvées par le soin des animaux et du Comité institutionnel utilisation de l'Université de Washington et en conformité avec le Guide pour les soins et l'utilisation des animaux de laboratoire publié par l'Institut national américain de la Santé (NIH Publication No. 85-23, révisée en 1996).
Remerciements
Nous remercions le Dr Kelly Stevens pour les essais initiaux du protocole, le Dr Michael Simons, Hauch Kip Dr, et les membres de leurs deux laboratoires pour la discussion générale.
Ce travail est le soutien par des subventions du NIH HL087513 et P01 HL094374.
matériels
| Name | Company | Catalog Number | Comments |
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires |
| Des seringues de 1 ml | Becton Dickinson | BD-309602 | |
| Des seringues à insuline 1/2cc avec des aiguilles 29G ½ fixé en permanence » | Becton Dickinson | BD-309306 | |
| 2 po x 2 po tampons de gaze | Med101store.com | SKU 2208 | |
| 24G ¾ "Angiocath IV cathéter | Becton Dickinson | BD-381112 | |
| 26G ½ aiguilles de calibre " | maigre "> Becton Dickinson | BD-305111 | |
| L'adénosine | Sigma | A9251 | 1g / L dans du PBS pour le tampon de vasodilatation (avec de la papavérine) |
| Pince Graefe angulaires | Outils belle science | 11052-10 | |
| Coton-tige: 6 "non-stérile | Cardinal Health | C15055-006 | |
| Courbes Ciseaux chirurgicaux | Outils belle science | 14085-09 | |
| Stéréoscope dissection et la source lumineuse | Nikon | NA | NA |
| Plateau de dissection, 11,5 x 7,5 pouces | Cole-Parmer | YO-10915-12 | Rempli avec du goudron pour mettre le doigt sur la souris |
| Beaux Forceps courbes | Aesculap | FD281R | Besoin de deux |
| L'héparine, 5000 U / ml de bouillon | APP Pharmaceuticals LLC | NDC 63323-047-10 | 1:100 de dilution dans l'eau |
| KCl | Pêcheur | P217 | Solution saturée dans H2O |
| Kétamine (Ketaset), 100 mg / ml de bouillon | Fort Dodge, Overland Park, KS, Etats-Unis | NDC 0856-2013-01 | Mélangé à 130 poids corporel mg / kg, avec xylazine à 0,9% saline |
| Microfil | Flow Tech | MV-122 (jaune). Autres options de couleur sont également disponibles. | Mélanger 1:1 en poids, avec 10% en volume d'agent de durcissement. Préparer juste avant l'injection, et le vortex pour s'assurer qu'il est bien mélangé |
| Non stérile Suture: 6-0, tressé de soie | Harvard Apparatus | 723287 | |
| Papavérine | American Regent Inc | NDC 0517-4010-01 | 4mg / L dans du PBS pour le tampon de vasodilatation (avec l'adénosine) |
| Paraformaldéhyde | Sigma | P6148 | Préparé comme solution à 4% |
| Appareil de perfusion | Voir la figure 2 | ||
| Ciseaux de printemps | Outils belle science | 15018-10 | |
| Xylazine (Anased), 20 mg / gl de stock | Labs Lloyd | NADA # 139-236 | Mélangé que 8,8 poids corporel mg / kg, avec la kétamine dans une solution saline à 0,9% |
Références
- Couffinhal, T., Dufourcq, P., Barandon, L., Leroux, L., Duplaa, C. Mouse models to study angiogenesis in the context of cardiovascular diseases. Front. Biosci. 14, 3310-3325 (2009).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Krucker, T., Lang, A., Meyer, E. P. New polyurethane-based material for vascular corrosion casting with improved physical and imaging characteristics. Microsc. Res. Tech. 69, 138-147 (2006).
- Murakami, T. Blood flow patterns in the rat pancreas: a simulative demonstration by injection replication and scanning electron microscopy. Microsc. Res. Tech. 37, 497-508 (1997).
- Icardo, J. M., Colvee, E. Origin and course of the coronary arteries in normal mice and in iv/iv mice. J. Anat. 199, 473-482 (2001).
- Beighley, P. E., Thomas, P. J., Jorgensen, S. M., Ritman, E. L. 3D architecture of myocardial microcirculation in intact rat heart: a study with micro-CT. Adv. Exp. Med. Biol. 430, 165-175 (1997).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, R1267-R1279 (2002).
- Jorgensen, S. M., Demirkaya, O., Ritman, E. L. Three-dimensional imaging of vasculature and parenchyma in intact rodent organs with X-ray micro-CT. Am. J. Physiol. 275, H1103-H1114 (1998).
- Marxen, M. MicroCT scanner performance and considerations for vascular specimen imaging. Med. Phys. 31, 305-313 (2004).
- Zagorchev, L. Micro computed tomography for vascular exploration. J. Angiogenes. Res. 2, 7-7 (2010).
- Heinzer, S. Hierarchical microimaging for multiscale analysis of large vascular networks. Neuroimage. 32, 626-636 (2006).
- Dedkov, E. I. Synectin/syndecan-4 regulate coronary arteriolar growth during development. Dev. Dyn. 236, 2004-2010 (2007).
- Gossl, M. Functional anatomy and hemodynamic characteristics of vasa vasorum in the walls of porcine coronary arteries. Anat. Rec. A. Discov. Mol. Cell. Evol. Biol. 272, 526-537 (2003).
- Rodriguez-Porcel, M. Altered myocardial microvascular 3D architecture in experimental hypercholesterolemia. Circulation. 102, 2028-2030 (2000).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: The Langendorff technique of isolated heart perfusion. J. Mol. Cell. Cardiol. 50, 940-950 (2011).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff---still viable in the new millennium. J. Pharmacol. Toxicol. Methods. 55, 113-126 (2007).
- Toyota, E. Vascular endothelial growth factor is required for coronary collateral growth in the rat. Circulation. 112, 2108-2113 (2005).
- Lavine, K. J., Long, F., Choi, K., Smith, C., Ornitz, D. M. Hedgehog signaling to distinct cell types differentially regulates coronary artery and vein development. Development. 135, 3161-3171 (2008).
- Cheema, A. N. Adventitial microvessel formation after coronary stenting and the effects of SU11218, a tyrosine kinase inhibitor. J. Am. Coll. Cardiol. 47, 1067-1075 (2006).
- Lametschwandtner, A., Lametschwandtner, U., Weiger, T. Scanning electron microscopy of vascular corrosion casts--technique and applications: updated review. Scanning Microsc. 4, 889-941 (1990).
- Schneider, P. Simultaneous 3D visualization and quantification of murine bone and bone vasculature using micro-computed tomography and vascular replica. Microsc. Res. Tech. 72, 690-701 (2009).
- Manelli, A., Sangiorgi, S., Binaghi, E., Raspanti, M. 3D analysis of SEM images of corrosion casting using adaptive stereo matching. Microscopy Research and Technique. 70, 350-354 (2007).
- Alanentalo, T. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Meth. 4, 31-33 (2007).
- Quintana, L., Sharpe, J. . Optical projection tomography of vertebrate embryo development. , 586-594 (2011).
- Walls, J. R., Coultas, L., Rossant, J., Henkelman, R. M. Three-Dimensional Analysis of Vascular Development in the Mouse Embryo. PLoS ONE. 3, e2853-e2853 (2008).
- Chalothorn, D., Clayton, J. A., Zhang, H., Pomp, D., Faber, J. E. Collateral density, remodeling, and VEGF-A expression differ widely between mouse strains. Physiol. Genomics. 30, 179-191 (2007).
- Behm, C. Z. Molecular Imaging of Endothelial Vascular Cell Adhesion Molecule-1 Expression and Inflammatory Cell Recruitment During Vasculogenesis and Ischemia-Mediated Arteriogenesis. Circulation. 117, 2902-2911 (2008).
- Carr, C. L., Lindner, J. R. Myocardial perfusion imaging with contrast echocardiography. Curr. Cardiol. Rep. 10, 233-239 (2008).
- Leong-Poi, H. Assessment of Endogenous and Therapeutic Arteriogenesis by Contrast Ultrasound Molecular Imaging of Integrin Expression. Circulation. 111, 3248-3254 (2005).
- Villanueva, F. S. Microbubbles Targeted to Intercellular Adhesion Molecule-1 Bind to Activated Coronary Artery Endothelial Cells. Circulation. 98, 1-5 (1998).
- Wei, K. Quantification of Myocardial Blood Flow With Ultrasound-Induced Destruction of Microbubbles Administered as a Constant Venous Infusion. Circulation. 97, 473-483 (1998).
- Beckmann, N., Stirnimann, R., Bochelen, D. High-Resolution Magnetic Resonance Angiography of the Mouse Brain: Application to Murine Focal Cerebral Ischemia Models. Journal of Magnetic Resonance. 140, 442-450 (1999).
- Kobayashi, H. 3D MR angiography of intratumoral vasculature using a novel macromolecular MR contrast agent. Magnetic Resonance in Medicine. 46, 579-585 (2001).
- Nezafat, R. B1-insensitive T2 preparation for improved coronary magnetic resonance angiography at 3 T. Magn. Reson. Med. 55, 858-864 (2006).
- Wagner, S., Helisch, A., Ziegelhoeffer, T., Bachmann, G., Schaper, W. Magnetic resonance angiography of collateral vessels in a murine femoral artery ligation model. NMR in Biomedicine. 17, 21-27 (2004).
- Cochet, H. In vivo MR angiography and velocity measurement in mice coronary arteries at 9.4 T: assessment of coronary flow velocity reserve. Radiology. , 254-441 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon