Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Retrograde Perfusion und Abfüllung von Maus Koronargefäße als Vorbereitung für die Mikro-Computertomographie Imaging
In diesem Artikel
Zusammenfassung
Visualisierung der Herzkranzgefäße ist entscheidend für die Erweiterung der Kenntnisse über Herz-Kreislauf-Erkrankungen. Hier beschreiben wir ein Verfahren zum Perfundieren murinen Koronargefäße mit einem röntgendichten Silikonkautschuk (Microfil), in Vorbereitung für die Mikro-Computertomographie (μCT) Bildgebung.
Zusammenfassung
Visualisierung des Gefäßsystems wird immer wichtiger für das Verständnis von vielen verschiedenen Krankheitsstadien. Während verschiedene Techniken zum Abbilden Gefäßsystem vorhanden sind, sind einige fähig, die Blutgefäße als Ganzes zu visualisieren, während sich bis zu einer Auflösung, die den kleineren Gefäßen 1,2 umfasst. Außerdem zerstören viele Gefäßsystem Gusstechniken das umliegende Gewebe, wodurch eine weitere Analyse der Probe 5.3. Eine Methode, die diese Probleme umgeht ist Mikro-Computertomographie (μCT). μCT Bildgebung kann bei einer Auflösung <10 Mikron zu scannen, ist in der Lage, 3D-Rekonstruktionen des Gefäßnetz, und verlässt das Gewebe intakt für die anschließende Analyse (zB Histologie und Morphometrie) 11.06. Allerdings erfordert Bildgebung Schiffe, die von Ex-vivo-Methoden μCT dass die Gefäße mit einem röntgendichten Verbindung gefüllt werden. Als solche ist die genaue Darstellung des Gefäßsystems durch μCT Bildgebung erzeugt abhängigzuverlässige und vollständige Füllung der Gefäße. In diesem Protokoll beschreiben wir eine Technik zum Füllen Maus Herzkranzgefäße in Vorbereitung auf μCT Bildgebung.
Zwei vorherrschenden Techniken existieren zum Füllen der Koronargefäße: in vivo über Kanülierung und retrograde Perfusion der Aorta (oder eine Abzweigung des Aortenbogens) 12-14, oder ex vivo über eine Langendorff-Perfusion System 15-17. Hier beschreiben wir eine In-vivo-Methode, die Aorten-Kanülierung wurde speziell entwickelt, um sicherzustellen, Füllung aller Schiffe. Wir verwenden eine niedrige Viskosität radiopake Verbindung als Microfil die durch die kleinsten Gefäße versorgen kann, um alle Kapillaren sowie sowohl die arteriellen und venösen Seiten des vaskulären Netzes zu füllen. Schiffe werden mit Puffer mit einem unter Druck Perfusionssystem perfundiert und dann mit Microfil gefüllt. Um sicherzustellen, dass Microfil füllt die kleinen Gefäße höheren Widerstand, ligieren wir die großen Äste emanating aus der Aorta, die die Microfil lenkt in die Koronarien. Sobald die Befüllung abgeschlossen, um die elastischen Eigenschaften des Herzgewebes nicht mehr gequetscht Microfil von einigen Gefäßen zu verhindern, unterbinden wir zugänglich vaskulärer Ausgänge unmittelbar nach dem Füllen. Daher wird unsere Technik zur vollständigen Füllung und maximale Retention des Füllmittels optimiert und ermöglicht die Visualisierung des gesamten koronaren vaskulären Netzwerk - Arterien, Kapillaren und Venen gleichermaßen.
Protokoll
1. Vorbereitungen vor dem Start
- Füllen jeder Seite der Druck-Perfusion mit Vasodilator-Puffer (4 mg / l Papaverin + 1 g / l Adenosin in PBS) oder 4% Paraformaldehyd (PFA) in PBS, jeweils.
- Bereiten Sie eine 1/2cc Insulinspritze (mit einer dauerhaft befestigten 29G ½ "Nadel) durch Füllen mit 0,1 ml der 1:100 Heparin (5000 E Lager) und Biegen der Nadel auf ~ 120-Grad-Winkel mit der Fase auf. Haben die dasselbe mit einer 1 ml Spritze (mit einer 26G ½ "Nadel) mit 0,3 ml gesättigter KCl-Lösung gefüllt.
2. Aussetzen des Herzens und Kanülierung der Aorta
- Betäuben die Maus mit Ihrer Narkose der Wahl. (Wir verwenden eine Überdosis eines Ketamin / Xylazin Mischung:. IP-Injektion von 130 mg / kg Ketamin und 8,8 mg / kg Xylazin in Kochsalzlösung)
- Stecken Sie die narkotisierten Maus auf das Sezieren Tablett, ventralen Seite nach oben. Öffnen Sie die Bauchhöhle mit einem Einschnitt an der Mittellinie zurückziehen und die Hautum die Organe zu entlarven. Bewegen Sie den Darm zu einer Seite, um einen Bereich der hinteren Hohlvene (PVC) freizulegen.
- Injizieren Sie Heparin-Lösung in das PVC. Wie Sie die Nadel zu extrahieren, decken Sie die Nadel Loch mit einem Wattestäbchen zu verhindern undicht und halten Sie ihn für einige Sekunden, bis die PVC-Wand Blutgerinnsel und Dichtungen. 2-3 Minuten warten für Heparin auf der ganzen Maus Umlauf zu zerstreuen.
- Präparieren Sie das Zwerchfell und Brustkorb, so dass Sie das schlagende Herz zu beobachten. Langsam injizieren KCl-Lösung in der PVC bis das Herz Verhaftungen.
- Löschen aller Organe unter der Membran und den Verbrauchsteuern der hintere Teil der Maus, so dass der Bereich der vorderen Membran intakt. Entfernen der Membran, wobei darauf geachtet, die PVC in der Nähe der Membran geschnitten, so dass die proximalen Abschnitt zum Herzen ist leicht in den nachfolgenden Schritten zu lokalisieren.
- Suchen Sie das abgeschnittene Ende des Aorta. Setzen Sie einen langen Länge von 6-0 geflochtene Seidenfaden unter der Aorta wenige Millimeter vorderen herm das abgeschnittene Ende, so dass die Naht auf sich selbst zurück verdoppelt. Schneiden Sie diesen länger Naht in der Mitte so gibt es 2 Stück der Naht unter der Aorta sind. Legen Sie die Angiokatheter in das abgeschnittene Ende der Aorta (Abb. 1A, B) und binden jede Naht mit einem Doppel-Knoten, um die Angiokatheter in Position zu halten und verhindern, dass Rücken-Druck in der Aorta ein Auslaufen.
3. Perfusion und Microfil Injektion
- Schließen Sie das Angiokatheter dem Druck Perfusionsapparatur (Abb. 2) und beginnen Perfusion der Gefäße mit gefäßerweiternden Puffer (Abb. 1C) durch Pumpen des Perfusionsapparatur zu einem treibenden Druck von 100-110 mmHg. Überprüfen, dass Puffer wird durch Perfusion der Koronararterien, indem sichergestellt wird Flüssigkeit aus dem PVC austritt. Weiter für mindestens 3 Minuten oder bis die Perfusion Flüssigkeit aus der PVC-frei ist. (Mit den nächsten Schritten fortfahren, während Perfusion.)
- Sezieren die Rippen und Stift zurück (oder entfernen) der Brustkorb um das Herz freizulegen. Einmal ausgesetzt, CA seinumsichtig nicht zu lassen das Herz austrocknen durch Quetschen Tropfen Puffer auf das Herz aus einem Puffer-getränkten Stück Gaze. Räumen Sie den Thymus, um den Aortenbogen aussetzen. Ligieren der drei wichtigsten Aortenäste mit 6-0 geflochtene Seidenfaden, um Flüssigkeit zu gewährleisten wird durch die Koronarien und nicht durch diesen größeren, mit geringem Widerstand Gefäße (Abb. 1D) umgeleitet.
- Perfundieren das Herz mit Fixativ für 15 Minuten, dann mit Vasodilatation Puffer spülen für mindestens 2 Minuten. Unterdessen ligieren sowohl anterior Hohlvene zu Microfil austritt aus dem Herzen nach der Injektion (Abb. 1E) zu verhindern. Ort Nähte rund um die PVC-und der Aorta, aber nicht festziehen, bis sie nach dem Befüllen.
- Bereiten Sie die Microfil (wie in der Tabelle der Reagenzien angegeben) und laden Sie sie in einer 1 ml Spritze. Füllen der Dissektion Tablett mit genügend Wasser, um den Katheter (um die Einführung von Luft zu verhindern, wenn von dem Infusionsschlauch Microfil Spritze) bestimmt. Trennen Sie die Perfusion apparatus aus dem Katheter und verbinden Sie das vorbereitete Microfil Spritze.
- Spritzen Sie die Microfil in die Aorta bis gute Füllung der Koronararterien ist offensichtlich (Abb. 1F, 3A): Die Arterien werden zuerst zu füllen, und dann die Microfil wird "Spill" in die Kapillaren, wie die Gewebe spült mit der Farbe des Microfil. Wenn auf der venösen Seite, bewirkt, dass die hydrophobe Natur des Microfil es zunächst als eigenständige Sphären erscheinen, wie es von den kleineren Gefäßen austritt. Halten Sie die Microfil injizieren, bis eine kontinuierliche Spalte füllt die Adern. Vollständige Füllung wird offensichtlich sein, wenn die Microfil stetig in den Gefäßen, und es wird durch das PVC beendet.
- Nach dem Füllen abgeschlossen ist, schnell ziehen die Fäden, die zuvor in der PVC und Aorta platziert wurden, um die elastischen Eigenschaften des Herzgewebes nicht mehr gequetscht die Microfil aus den Gefäßen zu verhindern.
- Decken Sie das Herz mit feuchter Gaze (getränkt mit Wasser aus dem Sezieren Tablett) Zur Verhinderung seiner Austrocknung, und lassen Sie ihn für etwa 1 Stunde bei Raumtemperatur sitzen, bis der Microfil hat polymerisiert. Vermeiden Sie Druck von außen auf das Herz während der Polymerisation, wie das Anheben oder Drehen des Herzens in einem Versuch, einen frühen Blick auf die gefüllten Gefäße auf der Rückseite des Herzens zu bekommen. Dies kann Microfil von einigen Gefäßen gezielt in einer elastischen Bereich des Herzens, was Brüche in der Microfil.
- Entfernen Sie das Herz und die Post-fix it in 4% PFA über Nacht bei 4 ° C. Dann in 70% Ethanol bei 4 ° C Das Herz Gefäßsystem ist nun bereit für μCT Bildgebung.
4. Repräsentative Ergebnisse
Schiffe, die von einer Microfil perfundiert werden müssen kontinuierlichen, ununterbrochenen Microfil in den Gefäßen (3A). Das Ausmaß der Befüllung der Herzkranzgefäße können mit dem Auge beurteilt werden; Venen werden epikardial 18 befindet, und kann leicht beobachtet werden (Abb. 3A, Pfeilspitze); Arterien,die mehr intramyokardialen 18, sind auch über die Oberfläche des Herzens (3A, Pfeil) sichtbar. Kapillare Befüllung ist auch ersichtlich, wie Herz-Gewebe hat eine sehr hohe Dichte von Kapillaren, und daher, wenn die Kapillaren Füllung, das Herzgewebe mit der Farbe des Microfil (3A, Stern) zu spülen. Somit werden alle Gefäßnetze, die zu füllen nicht wahrnehmbar sein aufgrund des Fehlens der Microfil (3B, C).
Brüche in der Microfil (Sternchen in Abb. 3B) erscheinen oft, weil die hydrophobe Natur des Microfil dazu führt das er in sich selbst zusammenziehen und verursachen "Pausen" im gefüllten Gefäße. Diese "Pausen" kann reduziert werden, wenn der Druck innerhalb der Gefäße durch die richtige Krawatte-offs der vaskulären Ausspeisepunkte aus dem Herzen aufrechterhalten wird. Andere Unterbrechungen können durch Luftblasen innerhalb der Mikrofiltration verursacht werden. Um das Eindringen von Luft zu verhindern, stellen Sie sicher das Angiokatheter vollständig in Wasser getaucht, wenn das Umschalten von der Durchblutung ap paratus dem Microfil Spritze. Wenn eine Luftblase eingeführt wird, kann es oft einfach nur durch die Fortsetzung des Microfil Perfusion bis die Blase wurde durch und schob aus der Herzkranzgefäße entfernt werden.
Vaskuläre Netzen kann nicht vollständig ausfüllt, wenn ein Teil der Strombahn blockiert (3B, Pfeil). Während Heparin hemmt die Bildung von Blutgerinnseln, kann gelegentlich noch Blockaden aufgrund von unvollständigen Heparin Perfusion vor dem Beginn des Verfahrens oder durch andere unbekannte Faktoren auftreten. Wenn eine Verstopfung auftritt, gibt es nach unserem Wissen kein Verfahren zum Lösen der Blockierung des vaskulären Füllung abzuschließen. Unvollständige Füllung kann auch auftreten, wenn zu wenig Druck während der Befüllung, die Microfil nicht in allen Gefäßbetten und Kapillarnetzwerke (3C) gezwungen werden verwendet wird. Umgekehrt kann zu viel Druck verursachen die Kapillaren zu platzen und extravasieren Microfil in das umgebende Gewebe (Abb. 3D).
files/ftp_upload/3740/3740fig1.jpg "alt =" Bild 1 "/>
Abbildung 1. Übersicht über die Perfusion Microfil Schema. (A) Die Aorta und die PVC etwa auf Höhe der Membran geschnitten. (B) Die aufsteigende Aorta ist mit einem Angiokatheter kanüliert. (C) Vasodilatation Puffer wird durch die Gefäße, durch den Druck Perfusionsapparatur (nicht abgebildet) angetrieben, während perfundiert (D) die drei wichtigsten abzweigt des Aortenbogens ligiert werden. (D) 4% PFA wird durch die Koronarien perfundiert, während die beiden vorderen Vena Cava ligiert werden. (F) mit einer Spritze wird durch die Koronararterien Microfil perfundiert, bis es wird beobachtet, Austritt aus der PVC.
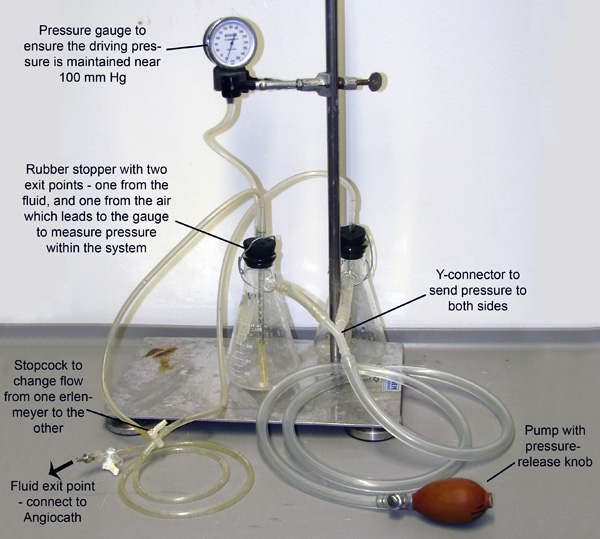
Abbildung 2. Perfusionsapparatur. Zwei Erlenmeyerkolben, die jeweils entweder mit Vasodilatation Puffer oder 4% PFA gefüllt ist, verbunden sind und unter Druck durch Rohre verbunden, um ihre Seitenarme. Das System ist unter Druck durch manuelles Pumpen derGlühlampe und ein Manometer einem der Kolben verbunden ist für die Überwachung und Aufrechterhaltung des Drucks zu ermöglichen. Kleine Rohre erstrecken sich durch Gummistopfen und nach unten in die Flüssigkeit in jeder Flasche. Der Druck der Eingabe von den Seitenarmen pumpt die Flüssigkeit aus jedem Kolben aus dieser kleineren Röhren. Die Rohre dann verschmelzen zu einem Hahn, die nur erlaubt, um von einer Flüssigkeit Kolben zu einem Zeitpunkt, zu fließen.
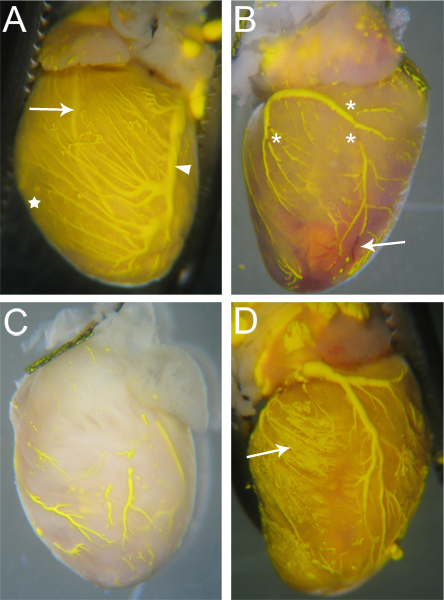
Abbildung 3. Probieren Sie Mikrogefüllte Herzen. (A) Schiffe, die gut gefüllt sind, haben nur wenige (wenn überhaupt) Brüche in der Microfil, und das Herzgewebe wird färbte die Farbe des Microfil aufgrund der gefüllten Kapillaren (Stern, und vergleichen Sie mit C) sein. Beide Arterien (Pfeil - Ramus interventricularis anterior) und Venen (Pfeilspitze - Left Koronarvene) sind sichtbar durch das Herz Oberfläche. (B) Ein Herz mit Brüchen in der Microfil (Sternchen) sowie Blockaden in einigen Gefäßen, die komplette Mic verhindertRofil Penetration. Die blockierten Schiffe bleiben rot (Pfeil), wie das Blut nicht erfolgte während der Perfusion Prozess gespült. (C) Ein Herz mit Schiffen, die unvollständig ausgefüllt wurden. Beachten Sie, das Gewebe nicht auf die gelbe Farbe des Microfil genommen, was auf die Microfil nicht in die Kapillaren eindringen. (D) ein Herz, in dem die Kapillaren Burst während der Befüllung, wodurch die Microfil in das umgebende Gewebe (Pfeil) auslaufen.
Diskussion
Herzgewebe hat einen sehr hohen metabolischen Bedarf, und erfordert daher eine konstante Versorgung mit Nährstoffen und Sauerstoff aus dem Blut durch die Koronargefäße geliefert. Erkrankungen der Herzkranzgefäße, der koronaren Funktion aufgrund Gefäßstenose und Verstopfung zu verringern, kann das Gewebe Hypoxie und Ischämie führen, und setzen die betroffenen Patienten mit einem Risiko für Myokardinfarkt und zu irreparablen Schäden am Herzmuskel. Ein besseres Verständnis des erkrankten Zustand dieser Gefäße...
Offenlegungen
Die Mäuse wurden mit Methoden, die von der Institutional Animal Care und Use Committee der University of Washington und in Übereinstimmung mit dem Leitfaden für die Pflege und Verwendung von Labortieren durch den US National Institutes of Health (NIH Publikation Nr. 85-23 veröffentlicht genehmigt behandelt, überarbeitet 1996).
Danksagungen
Wir danken Dr. Kelly Stevens für erste Versuche des Protokolls, Dr. Michael Simons, Dr. Kip Hauch, und die Mitglieder der beiden ihre Labore für allgemeine Diskussionen.
Diese Arbeit ist die Unterstützung durch Zuschüsse NIH HL087513 und P01 HL094374.
Materialien
| Name | Company | Catalog Number | Comments |
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare |
| 1 ml-Spritzen | Becton Dickinson | BD-309.602 | |
| 1/2cc Insulin Spritzen mit fest 29G ½ "Nadeln | Becton Dickinson | BD-309.306 | |
| 2 "x 2" Gaze-Pads | Med101store.com | SKU 2208 | |
| 24G ¾ "Angiocath IV-Katheter | Becton Dickinson | BD-381.112 | |
| 26G ½ "Gauge-Nadeln | Lank "> Becton Dickinson | BD-305.111 | |
| Adenosin | Sigma | A9251 | 1 g / l in PBS für Vasodilatation Puffer (mit Papaverin) |
| Graefe Pinzette abgewinkelt | Fine Science Tools | 11052-10 | |
| Wattestäbchen: 6 "nicht-sterilen | Cardinal Health | C15055-006 | |
| Gebogene Chirurgische Schere | Fine Science Tools | 14085-09 | |
| Dissecting Stereoskop und Lichtquelle | Nikon | NA | NA |
| Dissecting Tray, 11,5 x 7,5 cm | Cole-Parmer | YO-10915-12 | Gefüllt mit Teer für Pinning Sie die Maustaste |
| Feine einer gebogenen Pinzette | Aesculap | FD281R | Brauchen Sie zwei |
| Heparin, 5000 U / ml Lager | APP Pharmaceuticals LLC | NDC 63323-047-10 | 1:100-Verdünnung in Wasser |
| KCl | Fischer | P217 | Gesättigte Lösung in H2O |
| Ketamin (Ketaset), 100 mg / ml Stammlösung | Fort Dodge, Overland Park, KS, USA | NDC 0856-2013-01 | Gemischt als 130 mg / kg Körpergewicht, mit Xylazin in 0,9% sAline |
| Microfil | Flow Tech | MV-122 (gelb). Andere Optionen sind ebenfalls erhältlich. | Mischen 1:1 nach Gewicht, mit 10 Vol.% Härtungsmittel. Bereiten Sie unmittelbar vor der Injektion und Wirbel zu gewährleisten, ist es gut gemischt |
| Nicht sterile Nahtmaterial: 6-0, geflochtene Seide | Harvard Apparatus | 723287 | |
| Papaverin | American Regent Inc. | NDC 0517-4010-01 | 4 mg / l in PBS für Vasodilatation Buffer (mit Adenosin) |
| Paraformaldehyd | Sigma | P6148 | Vorbereitet als 4% ige Lösung |
| Vorrichtung Perfusion | Siehe Abbildung 2 | ||
| Frühlings-Schere | Fine Science Tools | 15018-10 | |
| Xylazin (Anased), 20 mg / gl Lager | Lloyd Labs | NADA # 139-236 | Gemischt als 8,8 mg / kg Körpergewicht, mit Ketamin in 0,9% iger Kochsalzlösung |
Referenzen
- Couffinhal, T., Dufourcq, P., Barandon, L., Leroux, L., Duplaa, C. Mouse models to study angiogenesis in the context of cardiovascular diseases. Front. Biosci. 14, 3310-3325 (2009).
- Zagorchev, L., Mulligan-Kehoe, M. J. Molecular imaging of vessels in mouse models of disease. Eur. J. Radiol. 70, 305-311 (2009).
- Krucker, T., Lang, A., Meyer, E. P. New polyurethane-based material for vascular corrosion casting with improved physical and imaging characteristics. Microsc. Res. Tech. 69, 138-147 (2006).
- Murakami, T. Blood flow patterns in the rat pancreas: a simulative demonstration by injection replication and scanning electron microscopy. Microsc. Res. Tech. 37, 497-508 (1997).
- Icardo, J. M., Colvee, E. Origin and course of the coronary arteries in normal mice and in iv/iv mice. J. Anat. 199, 473-482 (2001).
- Beighley, P. E., Thomas, P. J., Jorgensen, S. M., Ritman, E. L. 3D architecture of myocardial microcirculation in intact rat heart: a study with micro-CT. Adv. Exp. Med. Biol. 430, 165-175 (1997).
- Bentley, M. D., Ortiz, M. C., Ritman, E. L., Romero, J. C. The use of microcomputed tomography to study microvasculature in small rodents. Am. J. Physiol. Regul. Integr. Comp. Physiol. 282, R1267-R1279 (2002).
- Jorgensen, S. M., Demirkaya, O., Ritman, E. L. Three-dimensional imaging of vasculature and parenchyma in intact rodent organs with X-ray micro-CT. Am. J. Physiol. 275, H1103-H1114 (1998).
- Marxen, M. MicroCT scanner performance and considerations for vascular specimen imaging. Med. Phys. 31, 305-313 (2004).
- Zagorchev, L. Micro computed tomography for vascular exploration. J. Angiogenes. Res. 2, 7-7 (2010).
- Heinzer, S. Hierarchical microimaging for multiscale analysis of large vascular networks. Neuroimage. 32, 626-636 (2006).
- Dedkov, E. I. Synectin/syndecan-4 regulate coronary arteriolar growth during development. Dev. Dyn. 236, 2004-2010 (2007).
- Gossl, M. Functional anatomy and hemodynamic characteristics of vasa vasorum in the walls of porcine coronary arteries. Anat. Rec. A. Discov. Mol. Cell. Evol. Biol. 272, 526-537 (2003).
- Rodriguez-Porcel, M. Altered myocardial microvascular 3D architecture in experimental hypercholesterolemia. Circulation. 102, 2028-2030 (2000).
- Bell, R. M., Mocanu, M. M., Yellon, D. M. Retrograde heart perfusion: The Langendorff technique of isolated heart perfusion. J. Mol. Cell. Cardiol. 50, 940-950 (2011).
- Skrzypiec-Spring, M., Grotthus, B., Szelag, A., Schulz, R. Isolated heart perfusion according to Langendorff---still viable in the new millennium. J. Pharmacol. Toxicol. Methods. 55, 113-126 (2007).
- Toyota, E. Vascular endothelial growth factor is required for coronary collateral growth in the rat. Circulation. 112, 2108-2113 (2005).
- Lavine, K. J., Long, F., Choi, K., Smith, C., Ornitz, D. M. Hedgehog signaling to distinct cell types differentially regulates coronary artery and vein development. Development. 135, 3161-3171 (2008).
- Cheema, A. N. Adventitial microvessel formation after coronary stenting and the effects of SU11218, a tyrosine kinase inhibitor. J. Am. Coll. Cardiol. 47, 1067-1075 (2006).
- Lametschwandtner, A., Lametschwandtner, U., Weiger, T. Scanning electron microscopy of vascular corrosion casts--technique and applications: updated review. Scanning Microsc. 4, 889-941 (1990).
- Schneider, P. Simultaneous 3D visualization and quantification of murine bone and bone vasculature using micro-computed tomography and vascular replica. Microsc. Res. Tech. 72, 690-701 (2009).
- Manelli, A., Sangiorgi, S., Binaghi, E., Raspanti, M. 3D analysis of SEM images of corrosion casting using adaptive stereo matching. Microscopy Research and Technique. 70, 350-354 (2007).
- Alanentalo, T. Tomographic molecular imaging and 3D quantification within adult mouse organs. Nat. Meth. 4, 31-33 (2007).
- Quintana, L., Sharpe, J. . Optical projection tomography of vertebrate embryo development. , 586-594 (2011).
- Walls, J. R., Coultas, L., Rossant, J., Henkelman, R. M. Three-Dimensional Analysis of Vascular Development in the Mouse Embryo. PLoS ONE. 3, e2853-e2853 (2008).
- Chalothorn, D., Clayton, J. A., Zhang, H., Pomp, D., Faber, J. E. Collateral density, remodeling, and VEGF-A expression differ widely between mouse strains. Physiol. Genomics. 30, 179-191 (2007).
- Behm, C. Z. Molecular Imaging of Endothelial Vascular Cell Adhesion Molecule-1 Expression and Inflammatory Cell Recruitment During Vasculogenesis and Ischemia-Mediated Arteriogenesis. Circulation. 117, 2902-2911 (2008).
- Carr, C. L., Lindner, J. R. Myocardial perfusion imaging with contrast echocardiography. Curr. Cardiol. Rep. 10, 233-239 (2008).
- Leong-Poi, H. Assessment of Endogenous and Therapeutic Arteriogenesis by Contrast Ultrasound Molecular Imaging of Integrin Expression. Circulation. 111, 3248-3254 (2005).
- Villanueva, F. S. Microbubbles Targeted to Intercellular Adhesion Molecule-1 Bind to Activated Coronary Artery Endothelial Cells. Circulation. 98, 1-5 (1998).
- Wei, K. Quantification of Myocardial Blood Flow With Ultrasound-Induced Destruction of Microbubbles Administered as a Constant Venous Infusion. Circulation. 97, 473-483 (1998).
- Beckmann, N., Stirnimann, R., Bochelen, D. High-Resolution Magnetic Resonance Angiography of the Mouse Brain: Application to Murine Focal Cerebral Ischemia Models. Journal of Magnetic Resonance. 140, 442-450 (1999).
- Kobayashi, H. 3D MR angiography of intratumoral vasculature using a novel macromolecular MR contrast agent. Magnetic Resonance in Medicine. 46, 579-585 (2001).
- Nezafat, R. B1-insensitive T2 preparation for improved coronary magnetic resonance angiography at 3 T. Magn. Reson. Med. 55, 858-864 (2006).
- Wagner, S., Helisch, A., Ziegelhoeffer, T., Bachmann, G., Schaper, W. Magnetic resonance angiography of collateral vessels in a murine femoral artery ligation model. NMR in Biomedicine. 17, 21-27 (2004).
- Cochet, H. In vivo MR angiography and velocity measurement in mice coronary arteries at 9.4 T: assessment of coronary flow velocity reserve. Radiology. , 254-441 (2010).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten