Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Propiedades de superficie de carbono nanoporosos sintetizada y Matrices de sílice
En este artículo
Resumen
Aquí divulgamos la síntesis y caracterización de carbón nanoporosa ordenada (con un tamaño de poro 4,6 nm) y SBA-15 (con un tamaño de poro 5.3 nm). El trabajo describe la superficie y propiedades texturales de tamices moleculares nanoporosos, su mojabilidad y el comportamiento de fusión de D2O en los materiales.
Resumen
En este trabajo se reporta la síntesis y caracterización de ordenaron a nanoporoso material de carbón (también llamado material de carbón mesoporoso ordenado [Mac]) con un tamaño de poro de nm 4,6 y matriz porosa de sílice ordenado, SBA-15, con un tamaño de poro 5.3 nm. Este trabajo describe las propiedades superficiales de tamices moleculares nanoporosos, su mojabilidad y el comportamiento de fusión de D2O confinados en los materiales porosos ordenados diferentemente con similares tamaños de poro. Para ello, OMC y SBA-15 con altamente ordenados nanoporosos estructuras son sintetizan mediante la impregnación de la matriz de sílice aplicando un precursor de carbono y por el método sol-gel, respectivamente. La estructura porosa de los sistemas investigados se caracteriza por un análisis de adsorción-desorción de N2 a 77 K. Para determinar el carácter electroquímico de la superficie de los materiales sintetizados, se llevan a cabo las medidas de valoración potenciométrica; los resultados obtenidos para Mac muestra un cambio depzc pH significativo hacia los valores más altos de pH, en comparación con SBA-15. Esto sugiere que la OMC investigado tiene propiedades superficiales relacionadas con grupos funcionales a base de oxígeno. Para describir las propiedades superficiales de los materiales, también se determinan los ángulos de contacto de líquidos penetrante las camas porosas estudiadas. El método de ascenso capilar ha confirmado la mayor humectabilidad de las paredes de sílice con respecto a las paredes de carbón y una influencia de la rugosidad de poro en las interacciones del líquido/de la pared, que es mucho más pronunciada para el sílice que para carbono mesoporos. También hemos estudiado el comportamiento de fusión de D2O confinado en OMC y SBA-15 aplicando el método dieléctrico. Los resultados muestran que la depresión de la temperatura de fusión de D2O en los poros de la OMC es unos 15 K más altos en relación con la depresión de la temperatura de fusión en SBA-15 poros con un tamaño comparable de nm 5. Esto es causado por la influencia de las interacciones adsorbato/adsorbente de las matrices estudiadas.
Introducción
En 1992, se obtuvieron materiales de silicona nanoporosa ordenada por primera vez, con una plantilla orgánica; desde entonces, un gran número de publicaciones relacionadas con diferentes aspectos de estas estructuras, métodos de síntesis, la investigación de sus propiedades, sus modificaciones, y diferentes aplicaciones han aparecido en la literatura1,2 ,3. El interés en SBA-15 nanoporosos sílice matriz4 es debido a su calidad único: un elevada área superficial amplia los poros con una distribución de tamaño de poro uniforme y buenas propiedades químicas y mecánicas. Materiales de sílice nanoporoso con poros cilíndricos, como SBA-155, se utilizan a menudo como una matriz porosa para catalizadores como eficientes catalizadores en las reacciones orgánicas6,7. El material puede sintetizarse con una amplia gama de métodos que pueden influir en sus características8,9,10. Por lo tanto, es crucial optimizar estos métodos para posibles aplicaciones en muchos campos: Dispositivos electroquímicos, nanotecnología, biología y medicina, sistemas de administración, la droga o en la adhesión y tribología. En el presente estudio, se presentan dos tipos diferentes de estructuras nanoporosos, matrices porosas es decir sílice y carbón. Para comparar sus propiedades, se sintetiza la matriz de SBA-15 utilizando el método de sol gel, y el material de carbono nanoporosa ordenada es preparado por la impregnación de la matriz resultante de sílice con un precursor de carbono.
Materiales de carbono poroso son importantes en muchas aplicaciones debido a su alta área superficial y sus propiedades fisicoquímicas únicas y bien definidas6,11,12. Típica preparación da lugar a materiales con porosidad distribuido al azar y una estructura desordenada; También hay una posibilidad limitada para el cambio de los parámetros generales del poro, y por lo tanto, las estructuras con las distribuciones de tamaño de poro relativamente amplio se obtienen13. Esta posibilidad se amplió para los materiales de carbono nanoporoso con una alta superficie y ordenó sistemas de interconectivos. Más predijeron geometría y un mayor control de los procesos fisicoquímicos dentro del espacio de poro son importantes en muchas aplicaciones: como catalizadores, sistemas de separación de los medios de comunicación, materiales electrónicos y nanoreactors en muchos campos científicos14 avanzados , 15.
Para obtener las réplicas de carbono porosos, los silicatos ordenados pueden actuar como una matriz sólida que precursores de carbono se introducen directamente. El método se puede dividir en varias etapas: la selección del material de sílice ordenado; la deposición de un precursor de carbono en una matriz de sílice; carbonización; entonces, la eliminación de la matriz de sílice. Diferentes tipos de materiales carbonosos pueden obtenerse por este método, pero no todos los materiales no porosos tienen una estructura ordenada. Un elemento importante del proceso es la selección de una matriz adecuada cuya interconectivos deben formar una estructura tridimensional estable16.
En este trabajo se investiga la influencia del tipo de las paredes del poro en las propiedades superficiales de matrices sintetizadas nanoporosos. Las propiedades superficiales del material de la OMC se reflejan en las propiedades superficiales de sílice analógico (SBA-15) de la OMC. Las propiedades texturales y estructurales de ambos tipos de materiales (OMC y SBA-15) son caracterizadas por mediciones de adsorción/desorción de baja temperatura N2 (a 77 K), microscopía electrónica de transmisión (TEM) y energía dispersiva por rayos x () análisis EDX).
Medida de adsorción/desorción de gas de baja temperatura es una de las técnicas más importantes en la caracterización de materiales porosos. Gas nitrógeno se utiliza como un adsorbato debido a su alta pureza y a la posibilidad de crear una interacción fuerte con adsorbentes sólidos. Importantes ventajas de esta técnica están fácil de usar equipo comercial y procedimientos de procesamiento de datos relativamente fáciles. La determinación de isotermas de adsorción/desorción de nitrógeno se basa en la acumulación de las moléculas del adsorbato a la superficie del adsorbente sólido a 77 K en una amplia gama de presión (P/P0). Se aplica el procedimiento para el cálculo de la distribución de tamaño de poro de isotermas de adsorción o desorción experimentales Barrett, Joyner y Halenda (BJH). Los supuestos más importantes del método BJH incluyen una superficie plana y una distribución uniforme del adsorbato a la superficie investigada. Sin embargo, esta teoría se basa en la ecuación de Kelvin y es la forma más ampliamente utilizada para el cálculo de la distribución de tamaño de poro en el rango de los mesoporos.
Para evaluar el carácter electroquímico de las muestras, se aplica un método de valoración potenciométrica. La química superficial del material depende de la carga de superficie relacionado con la presencia de heteroátomos o grupos funcionales en la superficie. Las características superficiales también son investigadas por análisis de ángulo de contacto. La humedad dentro de los poros proporciona información sobre las interacciones adsorbato-adsorbente. Se estudia la influencia de la rugosidad de la pared en la temperatura de fusión del agua en dos muestras con la técnica de espectroscopia (DRS) de relajación dieléctrica. Las mediciones de la constante dieléctrica permiten la investigación de fenómenos de fusión como la polarizabilidad del líquido y las fases sólidas son diferentes unos de otros. Un cambio en la pendiente de la dependencia de la temperatura de la capacitancia muestra que la fusión ocurre en el sistema.
Protocolo
1. preparación de los materiales de la OMC
-
Síntesis de una matriz de sílice como precursor de la OMC
- Preparar 360 mL de 1.6 M HCl agregando 50 mL de HCl (36% - 38%) en un matraz de fondo redondo de 500 mL y, entonces, agregar 310 mL de agua ultrapura (resistividad de 18,2 MΩ·cm).
- A eso, añadir 10 g de PE 10500 polímero (6.500 g/mol).
- Coloque el matraz en un baño ultrasónico. La solución a 35 ° C de calor y revuelva hasta que el polímero sólido se haya disuelto completamente, haciendo una mezcla homogénea.
- Añadir 10 g de 1.3.5-trimetilbenceno al matraz y mezclar el contenido (a una velocidad de agitación de 220 rpm) manteniendo a 35 ° C en el baño de agua.
- Después de revolver por 30 min, añadir 34 g de Tetraetilo ortosilicato (TEOS) en el matraz. Añadir el TEOS lentamente y gota a gota con agitación constante. Asegúrese de que toma 10 minutos añadir 34 g de TEOS.
- Revolver la mezcla de la solución nuevamente por 20 h a la misma temperatura (35 ° C).
- Transferir el contenido del matraz a un cartucho de politetrafluoroetileno y colocarlo en el autoclave. Dejar la solución por 24 h a 90 ° C.
- Filtrar el precipitado resultante, utilizando un embudo Büchner y lavar con agua destilada, utilizando por lo menos 1 L.
- Secar el sólido obtenido a temperatura ambiente y aplicar un tratamiento térmico a la muestra a 500 º C, utilizando un horno de mufla en una atmósfera de aire durante 6 h.
-
Impregnación de la matriz resultante de sílice, con un precursor de carbono
- Preparar soluciones de impregnación (IS1 y IS2) con proporciones adecuadas de agua, el ácido sulfúrico de 3 M (VI) y azúcar (glucosa), donde la glucosa desempeña el papel de precursor de carbono y el ácido sulfúrico actúa como catalizador.
PRECAUCIÓN: El ácido sulfúrico es muy tóxico, causa quemaduras severas de la piel y daños oculares.- Preparar IS1. Por cada gramo de silicona, mezclar 5 g de agua, 0,14 g de 3 M ácido sulfúrico (VI) y 1,25 g de azúcar.
- Preparar IS2. Por cada gramo de silicona, mezclar 5 g de agua, 0,08 g de 3 M ácido sulfúrico (VI) y 0.75 g de azúcar.
- Coloque el material de silicona (1 g) y la solución preparada IS1 del precursor de carbono y el catalizador en un matraz de 500 mL. Calienta la mezcla en un secador de vacío a 100 ° C por 6 h.
Nota: En este paso, utilice sólo IS1. IS2 debe aplicarse en el siguiente paso. - Añadir la IS2 a la mezcla en el vacío secador (a la solución con el precursor de carbono parcialmente carbonizado). Calienta la mezcla en el secador de vacío a 160 ° C por 12 h.
- Preparar soluciones de impregnación (IS1 y IS2) con proporciones adecuadas de agua, el ácido sulfúrico de 3 M (VI) y azúcar (glucosa), donde la glucosa desempeña el papel de precursor de carbono y el ácido sulfúrico actúa como catalizador.
-
Temple/carbonización
- Transferir el compuesto obtenido a un mortero para la fragmentación de las partículas más grandes y una homogeneización del material.
- Coloque el producto obtenido en el horno de flujo y calentar a 700 ° C (a una velocidad de calentamiento de 2,5 ° C/min) y al calor por 6 horas a esta temperatura. Calentar el material en una atmósfera de nitrógeno.
- Deje que la solución se enfríe antes de abrir el horno.
-
Eliminación de la matriz de sílice por aguafuerte
- Preparar 100 mL de solución (ES) de la aguafuerte. Mezclar 50 mL de alcohol etílico de 95% y 50 mL de agua. Añadir 7 g de hidróxido de potasio y mezclar hasta que se disuelva.
- Todos obtuvieron material carbonizado (menos de 1 g) en un matraz de fondo redondo de 250 mL y añadir 100 mL de CE.
- Suministrar el sistema con un refrigerante de reflujo y agitador magnético y calor para hervir mientras se revuelve constantemente. Hervir la mezcla durante 1 hora.
- Transferir el material obtenido en el embudo de Büchner, lávelo con al menos 4 L de agua destilada y secar.
2. preparación de la matriz de sílice SBA-15
- Sintetizan una matriz de sílice.
- Preparar 150 mL de HCl M 1,6.
- Disolver 4 g de polímero PE 6400 (EO13PO70EO13) en 150 mL de solución ácida en un matraz de fondo redondo.
- Coloque el matraz en un baño ultrasónico. Calentar la solución a 40 ° C y agitar para que puede disolver el polímero (al menos por 30 min).
- Añadir lentamente 8,5 g de TEOS en el matraz, gota a gota, con agitación constante. Revolver la mezcla de la solución por 24 h a la misma temperatura (40 ° C).
- Transferir el contenido del matraz a un cartucho de politetrafluoroetileno. Deje la solución durante 24 h en un horno de 120 ° C.
- Filtrar el precipitado resultante, utilizando un embudo Büchner y lavarlo con agua destilada (por lo menos 1 L).
- Secar el sólido obtenido a temperatura ambiente y calcina por 6 horas a 600 ° C, utilizando un horno de mufla en una atmósfera de aire.
3. métodos de caracterización
- Mediciones de adsorción/desorción de nitrógeno de baja temperatura
- Utilice un analizador de absorción automática para obtener N2 isotermas de adsorción/desorción en 77 K.
- Utilice un tubo de vidrio apropiado para mediciones de absorción de nitrógeno. Antes de añadir la muestra porosa para el tubo de vidrio, limpie el tubo en una lavadora ultrasónica y enjuagar primero con agua destilada y, a continuación, con etanol anhidro.
- Calentar el tubo de vidrio a 150 ° C durante 3 horas y llenar el tubo con nitrógeno comprimido. Pesar el tubo de cristal vacío en las condiciones de nitrógeno antes de la medición para reducir al mínimo el error de peso.
- Colocar la muestra en el tubo de vidrio y pesa la masa total (masa de la muestra con el tubo de cristal).
- Antes de las mediciones, desgasificar la muestra. Coloque el tubo de vidrio con la muestra en el puerto de desgasificación del analizador de absorción. Aplicar las siguientes condiciones de proceso: una presión de al menos 0.01 mmHg, una temperatura de 423 K y una duración de 24 h. En el puerto de desgasificación, conectar la muestra al vacío y calentar hasta la temperatura establecida (423 K). Después de la desgasificación, la muestra se llenan de nitrógeno y traslado hacia el puerto de análisis.
- Microscopía electrónica de transmisión
- Utilizar el microscopio TEM con 120 kV (para SBA-15) y 200 kV (para el material de la OMC) aceleración voltajes para recoger las imágenes TEM de buena calidad.
- Para la preparación de una película monodispersa de la muestra, se dispersa la muestra (1 mg) en etanol (1 mL). Realice el procedimiento de dispersión en un tubo de microcentrífuga colocando en un baño ultrasónico durante 3 minutos.
- Colocar dos gotas de la dispersión en una cuadrícula TEM cobre utilizando una micropipeta. Transferir la rejilla TEM al microscopio TEM y comienza la proyección de imagen de TEM.
- Espectroscopia de rayos x dispersiva de energía
- Usar un microscopio equipado con un detector de rayos x para obtener un espectro de rayos x dispersivo de energía de las muestras.
- Aplique un voltaje de aceleración de 15 kV para el espectro de la cosecha. Seleccione el silicio como elemento de optimización para la SBA-15 y el carbono de la muestra de la OMC.
- Medición valoración potenciométrica
- Usar una bureta automática para realizar el experimento de valoración potenciométrica. Añadir el Titulador en porciones pequeñas y controladas (según el software de valoración y procedimiento). Proporcionar el incremento más pequeño, por lo menos 1 μL, un instrumento de dosificación automática.
- Dispersar a 0,1 g de la muestra en 30 mL de una solución electrolítica (agua solución de 0.1 M NaCl). Usar el agitador magnético y condiciones isotérmicas (293 ± 0,1 K) durante el proceso de dispersión.
- Añadir 1-2 mL del titulador (solución de NaOH de 0.1 M) a la suspensión.
Nota: Realice el agregado en pequeñas alícuotas (cada aproximadamente 0,05 ml). La bureta automática el procedimiento debe proporcionar al menos una docena de puntos experimentales en el rango de pH de 1 a 14. - Calcular la densidad superficial de carga Qs, utilizando la siguiente fórmula.
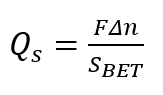 (1)
(1)
Aquí,
Δn = el cambio en H+/OH– equilibrio reducido por masa de la muestra;
Sapuesta = la superficie de Brunauer-Emmett-Teller (BET) de estado sólido poroso;
F = número de Faraday.
- Método de ascenso capilar para la medición de humedad
- Para determinar el ángulo de contacto dentro de los poros de las muestras estudiadas, utilice el método de ascenso capilar.
Nota: Este método se basa en la medición del aumento de masa del líquido, que es penetrar el lecho poroso, como función del tiempo. La asunción principal de este método está basado en el hecho de que líquido penetrante está avanzando en la columna porosa y que esta columna consta de intergranulares capilares con un radio determinado promedio. Así, cada relación derivada para capilar solo es válida para la capa del polvo poroso. En un sola vertical capilar, el líquido humectante flota contra las fuerzas gravitatorias como resultado de la diferencia de presión entre el líquido y el vapor en los poros (presión capilar). En este sentido, la penetración del líquido en el lecho poroso permite la determinación del ángulo contacto avance dinámico dentro de los poros. - Aplicar ecuación17,18, expresado como sigue de Washburn modificado.
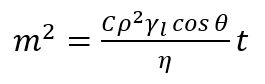 (2)
(2)
Aquí,
m = masa de líquido medido;
C = el parámetro geométrico depende de la distribución, forma y tamaño de los poros;
Ρ = la densidad;
Γl= la tensión de superficie;
Η = viscosidad del líquido penetrante;
Θ = el ángulo de contacto;
t = tiempo. - Utilizando la ecuación (2), calcular los valores de los ángulos de contacto avance dentro de los poros estudiados.
- Preparar el tensiómetro de la fuerza. Para polvo, use un tubo de vidrio con un diámetro de 3 mm y una cerámica sinterizada; para el líquido, use un recipiente con un diámetro de 22 mm y un volumen máximo de 10 mL.
- Medida 0,017 g de la muestra.
- Inicie el programa de ordenador conectado con el tensiómetro. Poner un recipiente con el líquido sobre una platina motorizada y suspender el tubo de vidrio con la muestra en una balanza electrónica.
- Arrancar el motor y acercarse al líquido en el recipiente con la muestra a una velocidad constante baja de 10 mm/min; Ajuste la profundidad de inmersión del tubo de muestra en el líquido igual a 1 mm.
- A partir de este momento, la dependencia m2 = f(t) registros en el programa de computadora.
- Detener el experimento cuando la dependencia m2 = f(t) empieza a mostrar la meseta característica.
- Busque precisión repitiendo este procedimiento 3 x - 5 x.
- Para determinar el ángulo de contacto dentro de los poros de las muestras estudiadas, utilice el método de ascenso capilar.
- Espectroscopía de relajación dieléctrica
- Para describir el comportamiento de fusión de agua confinado dentro de las matrices porosas estudiadas, realizar las mediciones de temperatura de la capacitancia eléctrica C de la muestra en un condensador de placas paralelas de acero inoxidable19, 20 , 21. para medir la capacitancia C como la función de la temperatura y la frecuencia del campo eléctrico aplicado cíclica, utilice un analizador de la impedancia.
Nota: La compleja permitividad eléctrica se define como ε * = ε' + iε'', donde ε' = CC0 es real y ε'' = δ·ε tg'es una parte imaginaria de la permitividad, donde C0 es la capacitancia de la vacía condensador y tgδ son las pérdidas dieléctricas. - Poner la muestra medida en el condensador de la placa.
- Seleccionar un rango de frecuencias de 100 Hz a 1 MHz y una temperatura de 140 K a 305 K. Control la tasa de temperatura cambia con el regulador de temperatura; establecer la tasa de temperatura como igual a 0,8 K/min durante el enfriamiento y K de 0,6/min durante el proceso de calentamiento.
- Para describir el comportamiento de fusión de agua confinado dentro de las matrices porosas estudiadas, realizar las mediciones de temperatura de la capacitancia eléctrica C de la muestra en un condensador de placas paralelas de acero inoxidable19, 20 , 21. para medir la capacitancia C como la función de la temperatura y la frecuencia del campo eléctrico aplicado cíclica, utilice un analizador de la impedancia.
Resultados
Para caracterizar la estructura porosa de las muestras investigadas de OMC y SBA-15, la adsorción-desorción de N2 isotermas se registraron en 77 K. El experimental N2 gas desorción adsorción isotermas de caracterizar los sistemas investigados, así como las distribuciones de tamaño de poro (PSD) obtenidas de los datos de adsorción y desorción, se presentan en la figura 1A-D. La posición de los puntos de inflexió...
Discusión
Los pasos críticos durante la preparación del material de carbón mesoporoso ordenado incluyen la preparación de los materiales de sílice mesoporoso ordenado como la plantilla con las características estructurales bien definidas que afectan las propiedades de los materiales finales y un paso de recocido/carbonización en atmósfera de nitrógeno. La modificación del método típico de preparación de los mesoporosos ordenados Silicatos con poros cilíndricos28 preocupaciones la aplicación d...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer el Centro Nacional de ciencia para proporcionar apoyo financiero a grant no. DEC-2013/09/B/ST4/03711 y UMO-2016/22/ST4/00092. Los autores también agradecemos el apoyo parcial del programa operativo de Polonia Capital humano PO KL 4.1.1, así como el Centro Nacional de investigación y desarrollo, bajo investigación subsidio no. PBS1 A9/13/2012. Los autores Agradecemos especialmente por Prof. L. Hołysz de la división de fenómenos Interfacial, Facultad de química, Universidad del Curie-Skłodowska de Maria, Lublin, Polonia, por su bondad y que permite las mediciones de la humectabilidad en la SBA-15 interconectivos.
Materiales
| Name | Company | Catalog Number | Comments |
| 1,3,5-trimethylbenzene | Sigma-Aldrich, Poland | M7200 Sigma-Aldrich | Mesitylene, also known as 1,3,5-trimethylbenzene, reagent grade, assay: 98%. |
| anhydrous ethanol | POCH, Avantor Performance Materials Poland S.A. | 396480111 | Assay, min. 99.8 %, analysis-pur (a.p.) |
| ASAP 2020. Accelerated Surface Area and Porosimetry System | Micromeritics Instrument Corporation, Norcross, GA, USA | Samples were outgassed before analysis at 120 oC for 24 hours in degas port of analyzer. The dead space volume was measured for calibration on experimental measurement using helium as a adsorbate. | |
| Automatic burette Dosimat 665 | Metrohm, Switzerland | The surface charge properties were experimentally determined by potentiometric titration of the suspension at constant temperature 20°C maintained by the thermostatic device. Prior to potentiometric titration measurements, the solid samples were dried by 24 hours at 120 oC. The initial pH was established by addition of 0.3 cm3 of 0.2 mol/L HCl. T The 0.1 mol/L NaOH solution was used as a titrant, added gradually by using automatic burette. | |
| Digital pH-meter pHm-240 | Radiometer, Copenhagen | Device coupled with automatic burette | |
| ethyl alcohol | POCH, Avantor Performance Materials Poland S.A. | 396420420 | Assay, min. 96 %.analysis-pur (a.p.) |
| glucose | POCH, Avantor Performance Materials Poland S.A. | 459560448 | assay 99.5% |
| Hydrochloric acid | POCH, Avantor Performance Materials Poland S.A. | 575283115 | Hydrochloric acid, 35 - 38% analysis-pur (a.p.) |
| HOPG graphite substrate | Spi Supplies | LOT#1170906 | HOPG SPI-2 Grade, 20x20x1 mm |
| Impedance analyzer Solartron 1260 | Solartron | ||
| Pluronic PE 6400 polymer | BASF (Polska) | (EO13PO70EO13) | |
| Pluronic PE10500 | BASF Canada Inc. | Molar mass 6500 g/mol | |
| potassium hydroxide | Sigma-Aldrich, Poland | P5958 Sigma-Aldrich | BioXtra, ≥85% KOH basis |
| SEM microscope | JEOL JSM-7001F | Scanning Electron Microscope with EDS detector | |
| Sigma Force Tensiometer 701 | KSV, Sigma701, Biolin Scientific | force tensiometer | |
| Sulfuric acid (VI) | POCH, Avantor Performance Materials Poland S.A. | 575000115 | |
| surface glass type KS 324 Kavalier | Megan Poland | 80 % of SiO2 , 11% of Na2O and 9% of CaO | |
| Tecnai G2 T20 X-TWIN | FEI, USA | Transmission Electron Microscope with EDX detector. | |
| TEM microscope | JEOL JEM-1400 | ||
| temperature controller ITC503 | Oxford Instruments | ||
| Tetraethylorthosilicate | Sigma-Aldrich, Poland | 131903 | Tetraethyl silicate, TEOS, reagent grade, assay 98% |
| Ultrapure water | Millipore, Merck KGaA, Darmstadt, Germany | SIMSV0001 | Simplicity Water Purification SystemUltrapure Water: 18.2 MegOhm·cm, TOC: <5 ppb |
Referencias
- Tao, Y., Kanoh, H., Abrams, L., Kaneko, K. Mesopore-Modified Zeolites: Preparation, Characterization, and Applications. Chemical Reviews. , 896-910 (2006).
- Wan, Y., Zhao, D. On the Controllable Soft-Templating Approach to Mesoporous Silicates. Chemical Reviews. 107, 2821-2860 (2007).
- Khder, A. E. S., Hassan, H. M. A., El-Shall, M. S. Acid catalyzed organic transformations by heteropolytungstophosphoric acid supported on MCM-41. Applied Catalysis A. 411, 77-86 (2012).
- Zhao, D. D., et al. Triblock Copolymer Syntheses of Mesoporous Silica with Periodic 50 to 300 Angstrom Pores. Science. 279, 548-552 (1998).
- Linssen, T., Cassiers, K., Cool, P., Vansant, E. Mesoporous templated silicates: an overview of their synthesis, catalytic activation and evaluation of the stability. Advances in Colloid and Interface Science. 103, 121-147 (2003).
- Eftekhari, A., Fan, Z. Ordered mesoporous carbon and its applications for electrochemical energy storage and conversion. Materials Chemistry Frontiers. 1, 1001-1027 (2017).
- Sing, K. Characterization of porous materials: past, present and future. Colloids and Surfaces A. 241, 3-7 (2004).
- Huo, Q., Margolese, D. I. Generalized synthesis of periodic surfactant/inorganic composite materials. Nature. 368, 317-321 (1994).
- Selvaraj, M., Kawi, S., Park, D. W., Ha, C. S. Synthesis and characterization of GaSBA-15: Effect of synthesis parameters and hydrothermal stability. Microporous and Mesoporous Materials. , 586-595 (2009).
- Leonard, A., et al. Toward a better control of internal structure and external morphology of mesoporous silicas synthesized using a nonionic surfactant. Langmuir. 19, 5484-5490 (2003).
- Liang, C., Li, Z., Dai, S. Mesoporous Carbon Materials: Synthesis and Modification. Angewandte Chemie International Edition. 47, 3696-3717 (2008).
- Babić, B., et al. New mesoporous carbon materials synthesized by a templating procedure. Ceramics International. 39 (4), 4035-4043 (2013).
- Allen, S. J., Whitten, L., Mckay, G. The Production and Characterization of Activated Carbons: A Review. Developments in Chemical Engineering and Mineral Processing. 6, 231-261 (1998).
- Kwak, G., et al. Preparation Method of Co3O4 Nanoparticles Using Ordered Mesoporous Carbons as a Template and Their Application for Fischer-Tropsch Synthesis. The Journal of Physical Chemistry C. 117 (4), 1773-1779 (2013).
- Koo, H. M., et al. Effect of the ordered meso-macroporous structure of Co/SiO2 on the enhanced activity of hydrogenation of CO to hydrocarbons. Catalysis Science and Technology. 6, 4221-4231 (2016).
- Jun, S., Joo, S. H., Ryoo, R., Kruk, M., Jaroniec, M. Synthesis of New, Nanoporous Carbon with Hexagonally Ordered Mesostructure. Journal of the American Chemical Society. 122 (43), 10712-10713 (2000).
- Washburn, E. W. The dynamics of capillary flow. Physical Review Series2. 17, 273 (1921).
- Śliwińska-Bartkowiak, M., Sterczyńska, A., Long, Y., Gubbins, K. E. Influence of Microroughness on the Wetting Properties of Nano-Porous Silica Matrices. Molecular Physics. 112, 2365-2371 (2014).
- Śliwińska-Bartkowiak, M., et al. Melting/freezing behavior of a fluid confined in porous glasses and MCM-41: dielectric spectroscopy and molecular simulation. Journal of Chemical Physics. 114, 950-962 (2001).
- Coasne, B., Czwartos, J., Śliwińska-Bartkowiak, M., Gubbins, K. E. Freezing of mixtures confined in silica nanopores: experiment and molecular simulation. Journal of Chemical Physics. 133, 084701-084709 (2010).
- Chełkowski, A. . Dielectric Physics. , (1990).
- Radhakrishnan, R., Gubbins, K. E., Śliwińska-Bartkowiak, M. Global phase diagrams for freezing in porous media. Journal of Chemical Physics. 116, 1147-1155 (2002).
- Gubbins, K. E., Long, Y., Śliwińska-Bartkowiak, M. Thermodynamics of confined nano-phases. Journal of Chemical Thermodynamics. 74, 169-183 (2014).
- Radhakrishnan, R., Gubbins, K. E., Śliwińska-Bartkowiak, M. Effect of the fluid-wall interaction on freezing of confined fluids: Toward the development of a global phase diagram. Journal of Chemical Physics. 112, 11048 (2000).
- Cassie, A. B. D., Baxter, S. Wettability of porous surfaces. Transactions of the Faraday Society. 40, 546 (1944).
- Sing, K. Adsorption methods for the characterization of porous materials. Advances in Colloid and Interface Science. 76, 3-11 (1998).
- Sing, K. The use of nitrogen adsorption for the characterisation of porous materials. Colloids and Surfaces A. 187, 3-9 (2001).
- Yu, C., Fan, J., Tian, B., Zhao, D. Morphology Development of Mesoporous Materials: a Colloidal Phase Separation Mechanism. Chemistry of Materials. 16 (5), 889-898 (2004).
- Liu, D., et al. Enhancement of Electrochemical Hydrogen Insertion in N-Doped Highly Ordered Mesoporous Carbon. The Journal of Physical Chemistry C. 118 (5), 2370-2374 (2014).
- Choi, W. C., et al. Platinum Nanoclusters Studded in the Microporous Nanowalls of Ordered Mesoporous Carbon. Advanced Materials. 17, 446-451 (2005).
- Rouquerol, F., Rouquerol, J., Sing, K. . Adsorption by Powders and Porous Solids: Principles, Methodology and Application. , (1999).
- Gregg, S. J., Sing, K. S. W. . Adsorption, Surface Area and Porosity. , (1982).
- Llewellyn, P. L., Rouquerol, F., Rouquerol, J., Sing, K. S. W., Unger, K. K., Kreysa, G., Baselt, J. P. Critical appraisal of the use of nitrogen adsorption for the characterization of porous carbons. Characterization of Porous Solids V. , 421-427 (2000).
- Sing, K. S. W. The use of gas adsorption for the characterization of porous solids. Colloids and Surfaces. 38, 113-124 (1989).
- Rouquerol, J. Recommendations for the characterization of porous solids. Pure & Applied Chemistry. 66, 1739-1758 (1994).
- Marega, C. A direct SAXS approach for the determination of specific surface area of clay in polymer-layered silicate nanocomposites. The Journal of Physical Chemistry B. 116, 7596-7602 (2012).
- Tsao, C. S., et al. Neutron Scattering Methodology for Absolute Measurement of Room-Temperature Hydrogen Storage Capacity and Evidence for Spillover Effect in a Pt-Doped Activated Carbon. The Journal of Physical Chemistry Letters. 1, 1569-1573 (2010).
- Mattson, J. S., Mark, H. B. . Activated Carbon: Surface Chemistry and Adsorption from Solution. , (1971).
- László, K., Szucs, A. Surface characterization of polyethyleneterephthalate (PET) based activated carbon and the effect of pH on its adsorption capacity from aqueous phenol and 2,3,4-trichlorophenol solutions. Carbon. 39, 1945-1953 (2001).
- Garten, V. A., Weiss, D. E., Willis, J. B. A new interpretation of the acidic and basic structures in carbons. Australian Journal of Chemistry. 10, 309-328 (1957).
- Boehm, H. P. Surface oxides on carbon and their analysis: A critical assessment. Carbon. 40, 145-149 (2002).
- Menendez, J. A., Phillips, J., Xia, B., Radovic, L. R. On the modification and characterization of chemical surface properties of activated carbon: In the search of carbons with stable basic properties. Langmuir. 12, 4404-4410 (1996).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados