È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Proprietà della superficie di sintetizzato nanoporosi carbonio e matrici di silice
In questo articolo
Riepilogo
Qui segnaliamo la sintesi e la caratterizzazione di carbonio nanoporosi ordinato (con un diametro dei pori nm 4,6) e SBA-15 (con un diametro dei pori nm 5,3). L'opera descrive la superficie e proprietà tessiturali dei setacci molecolari nanoporosi, loro bagnabilità ed il comportamento in fusione di D2O confinato nei materiali.
Abstract
In questo lavoro, segnaliamo la sintesi e la caratterizzazione di ordinato nanoporosi materiale di carbonio (chiamato anche materiale di carbonio mesoporosi ordinati [MCA]) con una dimensione dei pori nm 4,6 e matrice porosa di silice ordinato, SBA-15, con un diametro dei pori nm 5,3. Questo lavoro descrive le proprietà di superficie di setacci molecolari nanoporosi, loro bagnabilità, e il comportamento in fusione di D2O confinati nei materiali porosi diversamente ordinati con simili dimensioni dei pori. Per questo scopo, OMC e SBA-15 con altamente ordinati nanoporosi strutture sono sintetizzati tramite impregnazione della matrice di silice applicando un precursore di carbonio ed il metodo sol-gel, rispettivamente. La struttura porosa dei sistemi indagati è caratterizzata da un'analisi di adsorbimento-desorbimento N2 a 77 K. Per determinare il carattere elettrochimico della superficie dei materiali sintetizzati, titolazione potenziometrica misurazioni sono effettuate; i risultati ottenuti per OMC Mostra uno spostamento dipzc pH significativo verso i valori più elevati di pH, rispetto al SBA-15. Ciò suggerisce che indagate OMC ha superficie proprietà correlate a base di ossigeno gruppi funzionali. Per descrivere le proprietà della superficie dei materiali, gli angoli di contatto di liquidi penetranti i letti porosi studiati sono anche determinati. Il metodo di risalita capillare ha confermato la maggiore bagnabilità delle pareti silice rispetto le pareti di carbonio e un'influenza della rugosità dei pori sulle interazioni fluido/parete, che è molto più pronunciata per la silice rispetto per carbonio mesopori. Inoltre abbiamo studiato il comportamento in fusione di D2O confinato in MCA e SBA-15 applicando il metodo dielettrico. I risultati mostrano che la depressione della temperatura di fusione di D2O nei pori della OMC è superiore rispetto alla depressione della temperatura di fusione in SBA-15 circa 15K pori con dimensioni paragonabili 5 nm. Questo è causato dall'influenza delle interazioni di adsorbato/adsorbente delle matrici studiate.
Introduzione
Nel 1992, materiali nanoporosi ordinato in silice sono stati ottenuti per la prima volta, utilizzando un modello di organico; da allora, un gran numero di pubblicazioni relative a diversi aspetti di queste strutture, metodi sintetici, lo studio delle loro proprietà, loro modifiche, e diverse applicazioni sono apparsi in letteratura1,2 ,3. L'interesse di SBA-15 nanoporosi silice matrice4 è a causa della loro qualità unica: un'elevata area superficiale, vasta i pori con una distribuzione delle dimensioni dei pori uniforme e le buone proprietà meccaniche e chimiche. Materiali di silice nanoporosi con pori cilindrici, ad esempio SBA-155, sono spesso utilizzati come una matrice porosa per catalizzatori come sono catalizzatori efficienti in reazioni organiche6,7. Il materiale può essere sintetizzato con una vasta gamma di metodi che possono influire sulla loro caratteristiche8,9,10. Pertanto, è fondamentale ottimizzare questi metodi per potenziali applicazioni in molti campi: dispositivi elettrochimici, nanotecnologie, biologia e medicina, drug delivery systems, o in adesione e tribologia. Nello studio presente, due diversi tipi di strutture nanoporose sono presentati, vale a dire silice e carbonio matrici porose. Per confrontare le loro proprietà, la matrice di SBA-15 è sintetizzata utilizzando il metodo sol-gel, e il materiale di carbonio nanoporosi ordinata viene preparato dall'impregnazione della matrice risultante di silice con un precursore di carbonio.
Materiali di carbonio poroso sono importanti in molti apparecchi a causa della loro elevata area superficiale e loro proprietà fisico-chimiche uniche e ben definito6,11,12. Preparazione tipica si traduce in materiali con porosità distribuiti in modo casuale e una struttura disordinata; C'è anche una possibilità limitata per il cambiamento dei parametri generali dei pori, e così, si ottengono13strutture con distribuzioni di dimensione del poro relativamente ampia. Questa possibilità è ampliata per materiali di carbonio nanoporosi con una superficie alta e ordinata sistemi di nanopori. Più predetto geometria e un maggiore controllo dei processi fisico-chimici all'interno dello spazio dei pori sono importanti in molte applicazioni: come catalizzatori, sistemi di separazione media, avanzati materiali elettronici e nanoreattori in molti campi scientifici14 , 15.
Per ottenere le repliche di carbonio poroso, i silicati ordinati possono agire come una matrice solida a cui i precursori di carbonio sono introdotti direttamente. Il metodo può essere suddiviso in diverse fasi: la selezione del materiale ordinato silice; la deposizione di un precursore di carbonio in una matrice di silice; carbonizzazione; quindi, la rimozione della matrice di silice. Molti tipi differenti di materiali carboniosi possono essere ottenuti da questo metodo, ma non tutti i materiali non porosi hanno una struttura ordinata. Un elemento importante del processo è la selezione di una matrice adatta cui nanopori devono formare una struttura tridimensionale stabile16.
In questo lavoro, l'influenza del tipo di poro pareti le proprietà di superficie delle matrici nanoporosi sintetizzato è studiata. Le proprietà della superficie del materiale OMC vengono riflesse dalle proprietà superficiali di silice analogica (SBA-15) dell'OMC. Proprietà tessiturale e strutturali di entrambi i tipi di materiali (OMC e SBA-15) sono caratterizzate da misure di adsorbimento/desorbimento di basso-temperatura N2 (a 77 K), microscopia elettronica a trasmissione (TEM) ed energia dispersiva (analisi di raggi x EDX).
Misura di adsorbimento/desorbimento di bassa temperatura gas è una delle tecniche più importanti durante la caratterizzazione dei materiali porosi. Azoto gassoso è usato come un adsorbato a causa della sua elevata purezza e la possibilità di creare una forte interazione con adsorbenti solidi. Importanti vantaggi di questa tecnica sono l'attrezzatura commerciale facile da usare e relativamente facili procedure di elaborazione dei dati. La determinazione delle isoterme di adsorbimento/desorbimento di azoto si basa sull'accumulo di molecole di adsorbato sulla superficie del solido adsorbente a 77 K in una vasta gamma di pressione (P/P0). La procedura di Barrett, Joyner e Halenda (BJH) per calcolare la distribuzione delle dimensioni dei pori da isoterme di adsorbimento o desorbimento sperimentale viene applicata. Le ipotesi più importanti del metodo BJH comprendono una superficie planare e una distribuzione uniforme di adsorbato sulla superficie oggetto dell'inchiesta. Tuttavia, questa teoria è basata sull'equazione di Kelvin e rimane il modo più usato per calcolare la distribuzione delle dimensioni dei pori nella gamma mesoporosi.
Per valutare il carattere elettrochimico dei campioni, viene applicato un metodo di titolazione potenziometrica. La chimica di superficie del materiale dipende dalla carica superficiale legata alla presenza di eteroatomi o gruppi funzionali sulla superficie. Le proprietà della superficie sono anche studiate dall'analisi di angolo di contatto. La bagnabilità all'interno dei pori fornisce informazioni circa le interazioni di adsorbato-adsorbente. L'influenza della rugosità parete sulla temperatura di fusione dell'acqua confinata in entrambi gli esempi è studiata con la tecnica di spettroscopia (DRS) rilassamento dielettrico. La misura della costante dielettrica permette l'indagine sui fenomeni di fusione come la polarizzabilità del liquido e fasi solide sono diversi gli uni dagli altri. Un cambiamento nella pendenza della dipendenza dalla temperatura della capacità Mostra che di fusione si verifica nel sistema.
Protocollo
1. preparazione dei materiali OMC
-
Sintesi di una matrice di silice come precursore OMC
- Preparare 360 mL di 1,6 M HCl aggiungendo 50 mL di HCl (36-38%) in un pallone da 500 mL e, quindi, l'aggiunta di 310 mL di acqua ultrapura (resistività di MΩ·cm 18,2).
- A ciò, aggiungere 10 g di PE 10500 polimero (6.500 g/mol).
- Mettere il pallone in un bagno ad ultrasuoni. Riscaldare la soluzione a 35 ° C e mescolare fino a quando il polimero solido è completamente sciolto, fare un impasto omogeneo.
- Aggiungere 10 g di 1, 3,5-trimetilbenzene al pallone e mescolare il contenuto (a una velocità di agitazione di 220 giri/min) di mantenerlo a 35 ° C nel bagno d'acqua.
- Dopo agitazione per 30 min, aggiungere 34 g di ortosilicato (TEOS) al pallone. Aggiungere il TEOS lentamente e goccia a goccia con agitazione costante. Assicurarsi che ci vogliono 10 minuti per aggiungere 34 g di TEOS.
- Mescolare la miscela di soluzione ancora per 20 h alla stessa temperatura (35 ° C).
- Trasferire il contenuto del pallone in una cartuccia di politetrafluoroetilene e metterlo in autoclave. Lasciare agire la soluzione per 24 h a 90 ° C.
- Filtrare il precipitato risultante, utilizzando un imbuto Büchner e lavarlo con acqua distillata, utilizzando almeno 1 L.
- Asciugare il solido ottenuto a temperatura ambiente e applicare un trattamento termico al campione a 500 ° C, con un forno a muffola in atmosfera aria per 6 h.
-
Impregnazione della matrice risultante di silice, utilizzando un precursore di carbonio
- Preparare soluzioni di impregnazione (IS1 e IS2) con proporzioni adeguate di acqua, acido solforico 3M (VI) e lo zucchero (glucosio), dove glucosio svolge il ruolo di precursore di carbonio e acido solforico agisce come catalizzatore.
Attenzione: L'acido solforico è molto tossico, provoca gravi ustioni cutanee e gravi lesioni oculari.- Preparare IS1. Per ogni grammo di silice, mescolare 5 g di acqua, 0,14 g di acido solforico 3M (VI) e 1,25 g di zucchero.
- Preparare IS2. Per ogni grammo di silice, mescolare 5 g di acqua, 0,08 g di acido solforico 3M (VI) e 0,75 g di zucchero.
- Posizionare il materiale di silice (1 g) e la soluzione preparata IS1 il precursore di carbonio e il catalizzatore in un matraccio da 500 mL. Riscaldare la miscela in un essiccatoio sottovuoto a 100 ° C per 6 h.
Nota: In questo passaggio, utilizzare solo IS1. IS2 deve essere applicato nel passaggio successivo. - Aggiungere il IS2 la miscela nel vuoto asciugatrice (per la soluzione con il precursore di carbonio parzialmente carbonizzato). Scaldare il composto nuovamente in essiccatoio sottovuoto a 160 ° C per 12 h.
- Preparare soluzioni di impregnazione (IS1 e IS2) con proporzioni adeguate di acqua, acido solforico 3M (VI) e lo zucchero (glucosio), dove glucosio svolge il ruolo di precursore di carbonio e acido solforico agisce come catalizzatore.
-
Tempera/carbonizzazione
- Trasferire il composto ottenuto ad un mortaio per la frammentazione delle particelle più grandi e un'omogeneizzazione del materiale.
- Posizionare il prodotto ottenuto nella fornace flusso e riscaldare fino a 700 ° C (a una velocità di riscaldamento di 2,5 ° C/min) e calore per 6 ore a questa temperatura. Riscaldare il materiale in atmosfera di azoto.
- Lasciare la soluzione a raffreddare prima di aprire il forno.
-
Rimozione della matrice di silice di acquaforte
- Preparare 100 mL di soluzione (ES) di incisione. Miscelare 50 mL di alcol etilico 95% e 50 mL di acqua. Aggiungere 7 g di idrossido di potassio e mescolare fino a che è sciolto.
- Posto tutti ottenuti materiale carbonizzato (almeno 1 g) in un pallone da 250 mL e aggiungere 100 mL di ES.
- Fornitura del sistema con un condensatore a riflusso, agitatore magnetico e calore ad ebollizione continuando a mescolare. Far bollire la miscela per 1 h.
- Trasferire il materiale ottenuto all'imbuto Büchner, lavarlo con almeno 4 L di acqua distillata e asciugarlo.
2. preparazione della matrice silice SBA-15
- Sintetizzare una matrice di silice.
- Preparare 150 mL di HCl di 1,6 M.
- Sciogliere 4 g di polimero PE 6400 (EO13PO70EO13) in 150 mL di soluzione acida in un pallone.
- Mettere il pallone in un bagno ad ultrasuoni. Riscaldare la soluzione a 40 ° C e mescolare affinché il polimero può sciogliere (almeno per 30 min).
- Lentamente aggiungere 8,5 g di TEOS al pallone, goccia a goccia, con agitazione costante. Mescolare la miscela di soluzione per 24 ore alla stessa temperatura (40 ° C).
- Trasferire il contenuto del matraccio a una cartuccia di politetrafluoroetilene. Lasciare agire la soluzione per 24 h in forno a 120 ° C.
- Filtrare il precipitato risultante, utilizzando un imbuto Büchner e lavarlo con acqua distillata (almeno 1 L).
- Asciugare il solido ottenuto a temperatura ambiente e calcine per 6 h a 600 ° C, con un forno a muffola in atmosfera aria.
3. metodi di caratterizzazione
- Misure di adsorbimento/desorbimento di azoto a bassa temperatura
- Utilizzare un analizzatore di assorbimento automatico per ottenere N2 isoterme di adsorbimento/desorbimento a 77 K.
- Utilizzare un tubo di vetro adatto per misure di assorbimento di azoto. Prima di aggiungere il campione poroso per il tubo di vetro, pulire il tubo in una lavatrice ad ultrasuoni e risciacquare prima con acqua distillata e, accanto, con etanolo anidro.
- Riscaldare il tubo di vetro a 150 ° C per 3 h e riempire il tubo con azoto compresso. Pesare il tubo di vetro vuota sotto le condizioni di azoto prima della misurazione per minimizzare l'errore di peso.
- Posizionare il campione nel tubo di vetro e pesare la massa totale (la massa del campione con il tubo di vetro).
- Prima le misurazioni, degassare il campione. Posizionare il tubo di vetro con il campione nella porta di degassamento di analizzatore di assorbimento. Applicano le seguenti condizioni di processo: una pressione di almeno 0,01 mm Hg, una temperatura di 423 K e una durata di 24 ore. Nel porto degasaggio, collegare il campione al vuoto e calore alla temperatura impostata (423K). Dopo degasaggio, riempire il campione con azoto e trasferimento per il porto di analisi.
- Microscopia elettronica a trasmissione
- Usare il microscopio TEM con il 120 kV (per SBA-15) e 200 kV (per il materiale OMC) accelerazione tensioni per raccogliere le immagini TEM di buona qualità.
- Per la preparazione di un film di monodisperse del campione, disperdere il campione (1 mg) in etanolo (1 mL). Eseguire la procedura di dispersione in un tubo del microcentrifuge collocandolo in un bagno ad ultrasuoni per 3 min.
- Mettere due gocce della dispersione su una griglia TEM rame utilizzando una micropipetta. Trasferire la griglia TEM al microscopio TEM e avviare l'imaging di TEM.
- Spettroscopia a raggi x dispersiva di energia
- Utilizzare un microscopio elettronico a scansione dotato di un rivelatore di raggi x per acquisire uno spettro di raggi x dispersivo di energia dei campioni.
- Applicare una tensione di accelerazione di 15 kV per raccogliere lo spettro. Selezionare il silicio come elemento di ottimizzazione per SBA-15 e il carbonio per l'esempio OMC.
- Misurazione di titolazione potenziometrica
- Utilizzare una buretta automatica per eseguire l'esperimento di titolazione potenziometrica. Aggiungere la soluzione titolata in porzioni piccole e controllate (secondo il software di titolazione e procedura). Fornire il più piccolo incremento, almeno 1 μL, un intrument dosaggio automatico.
- Disperdere 0,1 g del campione in 30 mL di una soluzione elettrolitica (soluzione acquosa di 0.1 M NaCl). Utilizzare l'agitatore magnetico e condizioni isotermiche (293 ± 0,1 K) durante la procedura di dispersione.
- Aggiungere 1-2 mL di soluzione titolata (soluzione di NaOH 0,1 M) alla sospensione.
Nota: Eseguire l'aggiunta in piccole aliquote (ciascuno per essere circa 0,05 mL). La buretta automatica la procedura dovrebbe fornire almeno una dozzina di punti sperimentale nella gamma di pH da 1 a 14. - Calcolare la densità superficiale di carica Qs, utilizzando la seguente formula.
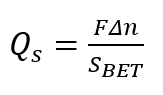 (1)
(1)
Qui,
ΔN = la variazione del saldo di mommy H+– ridotto per massa del campione;
SBET = l'area della superficie Brunauer-Emmett-Teller (BET) dello stato solido poroso;
F = il numero di Faraday.
- Metodo di risalita capillare per misure di bagnabilità
- Per determinare l'angolo di contatto all'interno dei pori dei campioni studiati, utilizzare il metodo di risalita capillare.
Nota: Questo metodo si basa sulla misura dell'aumento massa del liquido, che sta penetrando il letto poroso, come funzione del tempo. Il principale presupposto di questo metodo è basato sul fatto che liquido penetrante sta avanzando nella colonna porosa e che questa colonna è costituito da capillari intergranulare con un determinato raggio medio. Così, ogni relazione derivata per singolo capillare è valido per il livello della polvere porosa. In un singolo capillare verticale, il liquido di bagnatura galleggianti contro le forze gravitazionali a causa della differenza di pressione fra il liquido e il vapore nei pori (pressione capillare). In questo senso, la penetrazione del liquido nel letto poroso permette di determinare l'angolo di contatto dinamico avanzamento all'interno dei pori. - Applicare equazione17,18, espresso come segue di Washburn modificate.
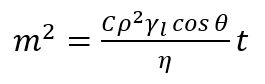 (2)
(2)
Qui,
m = massa del liquido misurato;
C = parametro geometrico dipendono la distribuzione, la forma e la dimensione dei pori;
Ρ = densità;
Γl= la tensione superficiale;
Η = viscosità del liquido penetrante;
Θ = l'angolo di contatto;
t = tempo. - Utilizzando l'equazione (2), stimare i valori degli angoli di contatto avanzanti all'interno dei pori studiati.
- Preparare il tensiometro di forza. Per polveri, utilizzare un tubo di vetro con un diametro di 3 mm e un sinter in ceramica; per il liquido, è necessario utilizzare un vaso con un diametro di 22 mm e un volume massimo di 10 mL.
- Misura 0,017 g del campione.
- Avviare il programma di computer connesso per il tensiometro. Mettere un recipiente con il liquido su un palco motorizzata e sospendere il tubo di vetro con il campione su una bilancia elettronica.
- Avviare il motore e avviare avvicinando il liquido nel recipiente con il campione a bassa velocità costante di 10 mm/min; impostare la profondità di immersione della provetta del campione in uguale a 1 mm.
- Da questo momento, la dipendenza m2 = f(t) registri nel programma del computer.
- Interrompere l'esperimento quando la dipendenza m2 = f(t) inizia a mostrare l'altopiano caratteristico.
- Verifica per precisione ripetendo questa procedura 3 x - 5.
- Per determinare l'angolo di contatto all'interno dei pori dei campioni studiati, utilizzare il metodo di risalita capillare.
- Spettroscopia dielettrica relax
- Per descrivere il comportamento in fusione di acque confinate all'interno delle matrici porose studiate, eseguire misure di temperatura di capacità elettrica C del campione presente in un condensatore della piastra parallela fatto di acciaio inossidabile19, 20 , 21. per misurare la capacità C come la funzione della temperatura e la frequenza del campo elettrico ciclico applicato, utilizzare un analizzatore di impedenza.
Nota: La permittività elettrica complessa è definita come ε * = ε' + iε cm, dove ε' = C/C0 è il real e ε cm = tgδ·ε' è una parte immaginaria della costante dielettrica, dove C0 è la capacità del vuoto condensatore e tgδ sono le perdite dielettriche. - Mettere il campione misurato nel condensatore della piastra.
- Selezionare un intervallo di frequenza da 100 Hz a 1 MHz e una temperatura da 140 mila a 305 K. controllo il tasso di temperatura cambia con il regolatore di temperatura; impostare la velocità di temperatura come uguale a 0,8 K/min durante il raffreddamento e 0,6 K/min durante il processo di riscaldamento.
- Per descrivere il comportamento in fusione di acque confinate all'interno delle matrici porose studiate, eseguire misure di temperatura di capacità elettrica C del campione presente in un condensatore della piastra parallela fatto di acciaio inossidabile19, 20 , 21. per misurare la capacità C come la funzione della temperatura e la frequenza del campo elettrico ciclico applicato, utilizzare un analizzatore di impedenza.
Risultati
Per caratterizzare la struttura porosa dei campioni esaminati di OMC e SBA-15, l'adsorbimento-desorbimento N2 isoterme sono state registrate a 77 K. La sperimentale isoterme di adsorbimento-desorbimento N2 gas che caratterizzano i sistemi studiati, come pure le distribuzioni di dimensione del poro (PSD) ottenute dai dati di adsorbimento e desorbimento, sono presentate in Figura 1A-D. La posizione dei punti di flesso le i...
Discussione
I passaggi critici durante la preparazione del materiale carbonio mesoporosi ordinati includono la preparazione dei materiali mesoporosi ordinati silice come il modello con ben definite proprietà strutturali che influenzano le proprietà del materiale finale e un passo di rinvenimento/carbonizzazione sotto atmosfera di azoto. La modifica del metodo tipico del preparato dei mesoporosi ordinato silicati con pori cilindrici28 riguarda l'applicazione di un agente di struttura-dirigere atipico che è ...
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori vorrei ringraziare il centro nazionale delle scienze, per fornire un sostegno finanziario con grant no. DEC-2013/09/B/ST4/03711 e UMO-2016/22/ST4/00092. Gli autori sono anche grati per il sostegno parziale da la Polonia programma operativo Capitale umano PO KL 4.1.1, anche a partire dal centro nazionale per ricerca e sviluppo, nell'ambito della ricerca concedere no. PBS1/A9/13/2012. Gli autori sono particolarmente grati per la Prof. ssa L. Hołysz da interfacciale fenomeni Division, facoltà di chimica, Università Maria Curie-Sk łodowska, Lublin, Polonia, per la sua gentilezza e consentendo la misure di bagnabilità nei nanopori SBA-15.
Materiali
| Name | Company | Catalog Number | Comments |
| 1,3,5-trimethylbenzene | Sigma-Aldrich, Poland | M7200 Sigma-Aldrich | Mesitylene, also known as 1,3,5-trimethylbenzene, reagent grade, assay: 98%. |
| anhydrous ethanol | POCH, Avantor Performance Materials Poland S.A. | 396480111 | Assay, min. 99.8 %, analysis-pur (a.p.) |
| ASAP 2020. Accelerated Surface Area and Porosimetry System | Micromeritics Instrument Corporation, Norcross, GA, USA | Samples were outgassed before analysis at 120 oC for 24 hours in degas port of analyzer. The dead space volume was measured for calibration on experimental measurement using helium as a adsorbate. | |
| Automatic burette Dosimat 665 | Metrohm, Switzerland | The surface charge properties were experimentally determined by potentiometric titration of the suspension at constant temperature 20°C maintained by the thermostatic device. Prior to potentiometric titration measurements, the solid samples were dried by 24 hours at 120 oC. The initial pH was established by addition of 0.3 cm3 of 0.2 mol/L HCl. T The 0.1 mol/L NaOH solution was used as a titrant, added gradually by using automatic burette. | |
| Digital pH-meter pHm-240 | Radiometer, Copenhagen | Device coupled with automatic burette | |
| ethyl alcohol | POCH, Avantor Performance Materials Poland S.A. | 396420420 | Assay, min. 96 %.analysis-pur (a.p.) |
| glucose | POCH, Avantor Performance Materials Poland S.A. | 459560448 | assay 99.5% |
| Hydrochloric acid | POCH, Avantor Performance Materials Poland S.A. | 575283115 | Hydrochloric acid, 35 - 38% analysis-pur (a.p.) |
| HOPG graphite substrate | Spi Supplies | LOT#1170906 | HOPG SPI-2 Grade, 20x20x1 mm |
| Impedance analyzer Solartron 1260 | Solartron | ||
| Pluronic PE 6400 polymer | BASF (Polska) | (EO13PO70EO13) | |
| Pluronic PE10500 | BASF Canada Inc. | Molar mass 6500 g/mol | |
| potassium hydroxide | Sigma-Aldrich, Poland | P5958 Sigma-Aldrich | BioXtra, ≥85% KOH basis |
| SEM microscope | JEOL JSM-7001F | Scanning Electron Microscope with EDS detector | |
| Sigma Force Tensiometer 701 | KSV, Sigma701, Biolin Scientific | force tensiometer | |
| Sulfuric acid (VI) | POCH, Avantor Performance Materials Poland S.A. | 575000115 | |
| surface glass type KS 324 Kavalier | Megan Poland | 80 % of SiO2 , 11% of Na2O and 9% of CaO | |
| Tecnai G2 T20 X-TWIN | FEI, USA | Transmission Electron Microscope with EDX detector. | |
| TEM microscope | JEOL JEM-1400 | ||
| temperature controller ITC503 | Oxford Instruments | ||
| Tetraethylorthosilicate | Sigma-Aldrich, Poland | 131903 | Tetraethyl silicate, TEOS, reagent grade, assay 98% |
| Ultrapure water | Millipore, Merck KGaA, Darmstadt, Germany | SIMSV0001 | Simplicity Water Purification SystemUltrapure Water: 18.2 MegOhm·cm, TOC: <5 ppb |
Riferimenti
- Tao, Y., Kanoh, H., Abrams, L., Kaneko, K. Mesopore-Modified Zeolites: Preparation, Characterization, and Applications. Chemical Reviews. , 896-910 (2006).
- Wan, Y., Zhao, D. On the Controllable Soft-Templating Approach to Mesoporous Silicates. Chemical Reviews. 107, 2821-2860 (2007).
- Khder, A. E. S., Hassan, H. M. A., El-Shall, M. S. Acid catalyzed organic transformations by heteropolytungstophosphoric acid supported on MCM-41. Applied Catalysis A. 411, 77-86 (2012).
- Zhao, D. D., et al. Triblock Copolymer Syntheses of Mesoporous Silica with Periodic 50 to 300 Angstrom Pores. Science. 279, 548-552 (1998).
- Linssen, T., Cassiers, K., Cool, P., Vansant, E. Mesoporous templated silicates: an overview of their synthesis, catalytic activation and evaluation of the stability. Advances in Colloid and Interface Science. 103, 121-147 (2003).
- Eftekhari, A., Fan, Z. Ordered mesoporous carbon and its applications for electrochemical energy storage and conversion. Materials Chemistry Frontiers. 1, 1001-1027 (2017).
- Sing, K. Characterization of porous materials: past, present and future. Colloids and Surfaces A. 241, 3-7 (2004).
- Huo, Q., Margolese, D. I. Generalized synthesis of periodic surfactant/inorganic composite materials. Nature. 368, 317-321 (1994).
- Selvaraj, M., Kawi, S., Park, D. W., Ha, C. S. Synthesis and characterization of GaSBA-15: Effect of synthesis parameters and hydrothermal stability. Microporous and Mesoporous Materials. , 586-595 (2009).
- Leonard, A., et al. Toward a better control of internal structure and external morphology of mesoporous silicas synthesized using a nonionic surfactant. Langmuir. 19, 5484-5490 (2003).
- Liang, C., Li, Z., Dai, S. Mesoporous Carbon Materials: Synthesis and Modification. Angewandte Chemie International Edition. 47, 3696-3717 (2008).
- Babić, B., et al. New mesoporous carbon materials synthesized by a templating procedure. Ceramics International. 39 (4), 4035-4043 (2013).
- Allen, S. J., Whitten, L., Mckay, G. The Production and Characterization of Activated Carbons: A Review. Developments in Chemical Engineering and Mineral Processing. 6, 231-261 (1998).
- Kwak, G., et al. Preparation Method of Co3O4 Nanoparticles Using Ordered Mesoporous Carbons as a Template and Their Application for Fischer-Tropsch Synthesis. The Journal of Physical Chemistry C. 117 (4), 1773-1779 (2013).
- Koo, H. M., et al. Effect of the ordered meso-macroporous structure of Co/SiO2 on the enhanced activity of hydrogenation of CO to hydrocarbons. Catalysis Science and Technology. 6, 4221-4231 (2016).
- Jun, S., Joo, S. H., Ryoo, R., Kruk, M., Jaroniec, M. Synthesis of New, Nanoporous Carbon with Hexagonally Ordered Mesostructure. Journal of the American Chemical Society. 122 (43), 10712-10713 (2000).
- Washburn, E. W. The dynamics of capillary flow. Physical Review Series2. 17, 273 (1921).
- Śliwińska-Bartkowiak, M., Sterczyńska, A., Long, Y., Gubbins, K. E. Influence of Microroughness on the Wetting Properties of Nano-Porous Silica Matrices. Molecular Physics. 112, 2365-2371 (2014).
- Śliwińska-Bartkowiak, M., et al. Melting/freezing behavior of a fluid confined in porous glasses and MCM-41: dielectric spectroscopy and molecular simulation. Journal of Chemical Physics. 114, 950-962 (2001).
- Coasne, B., Czwartos, J., Śliwińska-Bartkowiak, M., Gubbins, K. E. Freezing of mixtures confined in silica nanopores: experiment and molecular simulation. Journal of Chemical Physics. 133, 084701-084709 (2010).
- Chełkowski, A. . Dielectric Physics. , (1990).
- Radhakrishnan, R., Gubbins, K. E., Śliwińska-Bartkowiak, M. Global phase diagrams for freezing in porous media. Journal of Chemical Physics. 116, 1147-1155 (2002).
- Gubbins, K. E., Long, Y., Śliwińska-Bartkowiak, M. Thermodynamics of confined nano-phases. Journal of Chemical Thermodynamics. 74, 169-183 (2014).
- Radhakrishnan, R., Gubbins, K. E., Śliwińska-Bartkowiak, M. Effect of the fluid-wall interaction on freezing of confined fluids: Toward the development of a global phase diagram. Journal of Chemical Physics. 112, 11048 (2000).
- Cassie, A. B. D., Baxter, S. Wettability of porous surfaces. Transactions of the Faraday Society. 40, 546 (1944).
- Sing, K. Adsorption methods for the characterization of porous materials. Advances in Colloid and Interface Science. 76, 3-11 (1998).
- Sing, K. The use of nitrogen adsorption for the characterisation of porous materials. Colloids and Surfaces A. 187, 3-9 (2001).
- Yu, C., Fan, J., Tian, B., Zhao, D. Morphology Development of Mesoporous Materials: a Colloidal Phase Separation Mechanism. Chemistry of Materials. 16 (5), 889-898 (2004).
- Liu, D., et al. Enhancement of Electrochemical Hydrogen Insertion in N-Doped Highly Ordered Mesoporous Carbon. The Journal of Physical Chemistry C. 118 (5), 2370-2374 (2014).
- Choi, W. C., et al. Platinum Nanoclusters Studded in the Microporous Nanowalls of Ordered Mesoporous Carbon. Advanced Materials. 17, 446-451 (2005).
- Rouquerol, F., Rouquerol, J., Sing, K. . Adsorption by Powders and Porous Solids: Principles, Methodology and Application. , (1999).
- Gregg, S. J., Sing, K. S. W. . Adsorption, Surface Area and Porosity. , (1982).
- Llewellyn, P. L., Rouquerol, F., Rouquerol, J., Sing, K. S. W., Unger, K. K., Kreysa, G., Baselt, J. P. Critical appraisal of the use of nitrogen adsorption for the characterization of porous carbons. Characterization of Porous Solids V. , 421-427 (2000).
- Sing, K. S. W. The use of gas adsorption for the characterization of porous solids. Colloids and Surfaces. 38, 113-124 (1989).
- Rouquerol, J. Recommendations for the characterization of porous solids. Pure & Applied Chemistry. 66, 1739-1758 (1994).
- Marega, C. A direct SAXS approach for the determination of specific surface area of clay in polymer-layered silicate nanocomposites. The Journal of Physical Chemistry B. 116, 7596-7602 (2012).
- Tsao, C. S., et al. Neutron Scattering Methodology for Absolute Measurement of Room-Temperature Hydrogen Storage Capacity and Evidence for Spillover Effect in a Pt-Doped Activated Carbon. The Journal of Physical Chemistry Letters. 1, 1569-1573 (2010).
- Mattson, J. S., Mark, H. B. . Activated Carbon: Surface Chemistry and Adsorption from Solution. , (1971).
- László, K., Szucs, A. Surface characterization of polyethyleneterephthalate (PET) based activated carbon and the effect of pH on its adsorption capacity from aqueous phenol and 2,3,4-trichlorophenol solutions. Carbon. 39, 1945-1953 (2001).
- Garten, V. A., Weiss, D. E., Willis, J. B. A new interpretation of the acidic and basic structures in carbons. Australian Journal of Chemistry. 10, 309-328 (1957).
- Boehm, H. P. Surface oxides on carbon and their analysis: A critical assessment. Carbon. 40, 145-149 (2002).
- Menendez, J. A., Phillips, J., Xia, B., Radovic, L. R. On the modification and characterization of chemical surface properties of activated carbon: In the search of carbons with stable basic properties. Langmuir. 12, 4404-4410 (1996).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon