Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Oberflächeneigenschaften von synthetisierten nanoporöse Carbon und Silica-Matrizen
In diesem Artikel
Zusammenfassung
Hier berichten wir über die Synthese und Charakterisierung von bestellten nanoporöse Carbon (mit einer 4,6 nm Porengröße) und SBA-15 (mit einem 5,3 nm Porengröße). Das Werk beschreibt die Oberfläche und strukturelle Eigenschaften von nanoporösen Molekularsiebe, ihrer Benetzbarkeit und das Schmelzverhalten von D2O in den Materialien beschränkt.
Zusammenfassung
In dieser Arbeit, wir berichten die Synthese und Charakterisierung von bestellten nanoporöse Carbon-Material (auch genannt bestellten mesoporösen Carbonmaterial [OMC]) mit 4,6 nm Porengröße und bestellten Kieselsäure porösen Matrix, SBA-15, mit einem 5,3 nm Porengröße. Diese Arbeit beschreibt die Oberflächeneigenschaften von nanoporösen Molekularsiebe, deren Benetzbarkeit und das Schmelzverhalten von D2O in anders bestellten porösen Materialien mit ähnlichen Porengrößen beschränkt. Zu diesem Zweck synthetisiert OMC und SBA-15 mit hochgeordnete nanoporösen Strukturen sind über Imprägnierung der Silica-Matrix durch die Anwendung eines Kohlenstoff-Vorläufer und von der Sol-Gel-Methode bzw.. Die poröse Struktur des untersuchten Systeme zeichnet sich durch eine N2 Adsorption Desorption Analyse bei 77 K. Um die elektrochemische Charakter der Oberfläche des synthetisierten Materialien zu bestimmen, sind die potentiometrische Titration Messungen durchgeführt; die erzielten Ergebnisse für OMC zeigt eine signifikante pHPzc Verlagerung hin zu den höheren Werten von pH, bezogen auf SBA-15. Dies deutet darauf hin, dass untersuchten OMC Oberflächeneigenschaften, die im Zusammenhang mit Sauerstoff-basierte Funktionsgruppen hat. Um die Oberflächeneigenschaften der Materialien zu beschreiben, werden auch die Kontaktwinkel von Flüssigkeiten durchdringen die untersuchten poröse Betten bestimmt. Die kapillare Aufstieg Methode hat bestätigt, die erhöhte Benetzbarkeit der Kieselsäure Wände im Vergleich zu den Carbon-Wänden und Einfluss die Pore Rauheit auf der Flüssigkeit/Wand-Wechselwirkungen, die für Kieselsäure als für Kohlenstoff Mesopores viel ausgeprägter ist. Wir haben auch das Schmelzverhalten von D2O beschränkt im OKM und SBA-15 mit der dielektrischen Methode untersucht. Die Ergebnisse zeigen, dass die Depression der Schmelztemperatur des D2O in den Poren des OKM ist ca. 15 K höher im Vergleich zu der Depression der Schmelztemperatur im SBA-15 mit einer vergleichbaren 5 nm Größe Poren. Dies wird durch den Einfluss von adsorptiv/Adsorbens Interaktionen der untersuchten Matrizen verursacht.
Einleitung
Im Jahr 1992 wurden bestellten nanoporösen Kieselsäure Materialien zum ersten Mal erhalten mithilfe einer organischen Vorlage; Seit dieser Zeit eine große Anzahl von Publikationen im Zusammenhang mit verschiedenen Aspekten dieser Strukturen, synthetischen Methoden, die Untersuchung ihrer Eigenschaften, ihrer Änderungen und verschiedene Anwendungen sind in der Literatur1,2 erschienen ,3. Das Interesse an SBA-15 nanoporösen Kieselsäure Matrix4 ist durch ihre einzigartige Qualität: eine große Oberfläche, große Poren mit einer einheitlichen Größe Porenverteilung und guten chemischen und mechanischen Eigenschaften. Nanoporösen Kieselsäure Materialien mit zylindrischen Poren, z. B. SBA-155, werden häufig als poröse Matrix für Katalysatoren verwendet, sind effiziente Katalysatoren in organischen Reaktionen6,7. Das Material kann mit einer breiten Palette von Methoden synthetisiert werden, die ihre Eigenschaften8,9,10beeinflussen können. Daher ist es entscheidend, diese Methoden für potenzielle Anwendungen in vielen Bereichen zu optimieren: elektrochemische Geräte, Nanotechnologie, Biologie und Medizin, drug Delivery-Systeme oder in Haftung und Tribologie. In der vorliegenden Studie, zwei verschiedene Arten von nanoporösen Strukturen werden vorgestellt, nämlich Silizium und Kohlenstoff poröse Matrizen. Um ihre Eigenschaften zu vergleichen, die SBA-15-Matrix mit der Sol-Gel-Methode synthetisiert wird, und die bestellten nanoporöse Carbon-Material wird vorbereitet, indem die Imprägnierung der daraus resultierenden Silica-Matrix mit einer Kohlenstoff-Vorläufer.
Poröse Kohlenstoffmaterialien sind wichtig für viele Geräte aufgrund ihrer großen Oberfläche und ihre einzigartigen und gut definierte physikalisch-chemischen Eigenschaften6,11,12. Typische Zubereitung ergibt Materialien mit zufällig verteilten Porosität und eine ungeordnete Struktur; Es gibt auch eine begrenzte Möglichkeit für die Änderung der allgemeinen Pore Parameter und Strukturen mit relativ breiten Pore Größenverteilung sind somit13erhalten. Diese Möglichkeit ist für nanoporöse Kohlenstoffmaterialien mit hohen Flächen erweitert und Systeme der Nanoporen bestellt. Mehr vorhergesagt, Geometrie und mehr Kontrolle über die physikalisch-chemischen Prozesse im Inneren der Porenraum sind in vielen Anwendungen wichtig: als Katalysatoren, Trennung Mediensysteme, fortschrittliche elektronische Materialien und Nanoreaktoren in vielen Wissenschaftsgebieten14 , 15.
Um die porösen Kohlenstoff-Replikate zu erhalten, können einer festen Matrix bestellten Silikate fungieren, die Kohlenstoff-Vorstufen direkt eingeführt werden. Die Methode kann in mehrere Phasen unterteilt werden: die Auswahl der bestellten Kieselsäure Material; die Ablagerung von Kohlenstoff Vorläufer in einer Silica-Matrix; Karbonisierung; dann die Entfernung der Silica-Matrix. Viele verschiedene Arten von kohlenstoffhaltigen Materialien erhalten Sie mit dieser Methode, aber nicht alle nicht porös Materialien haben eine geordnete Struktur. Ein wichtiges Element des Prozesses ist die Auswahl einer geeigneten Matrix deren Nanoporen eine stabile, dreidimensionale Struktur16bilden müssen.
In dieser Arbeit wird der Einfluss der Art der Pore Wände auf die Oberflächeneigenschaften der synthetisierten nanoporöse Matrizen untersucht. Die Oberflächeneigenschaften von OMC Material sind die Oberflächeneigenschaften der Kieselsäure analog (SBA-15) von OMC wider. Die strukturellen und strukturellen Eigenschaften der beiden Arten von Materialien (OMC und SBA-15) zeichnen sich durch Niedertemperatur-N2 Adsorption/Desorption Messungen (bei 77 K), Transmissionselektronenmikroskopie (TEM) und Energy dispersive x-ray Analyse () EDX).
Niedertemperatur-Gas Adsorption/Desorption Messung ist eine der wichtigsten Techniken bei der Charakterisierung von porösen Materialien. Stickstoffgas dient als ein adsorptiv aufgrund seiner hohen Reinheit und die Möglichkeit, um eine starke Interaktion mit festen Adsorbentien zu erstellen. Wesentliche Vorteile dieser Technik sind die benutzerfreundliche Handelsausrüstung und relativ einfache EDV-Verfahren. Die Bestimmung von Stickstoff Adsorption/Desorption isothermen basiert auf die Anhäufung von adsorptiv Moleküle auf der Oberfläche der festen Adsorptionsmittel bei 77 K in einer Vielzahl von Druck (P/P0). Das Barrett, Joyner und Halenda (BJH) Verfahren zur Berechnung der Pore Größenverteilung von experimentellen Adsorption und Desorption isothermen wird angewendet. Die wichtigsten Annahmen der BJH-Methode gehören eine planare Fläche und eine gleichmäßige Verteilung der adsorptiv an der untersuchten Oberfläche. Aber diese Theorie basiert auf der Kelvin-Gleichung und es bleibt die am weitesten verbreitete Art und Weise für die Berechnung der Größe Porenverteilung im Bereich von mesoporösen.
Um die elektrochemische Charakter der Proben zu bewerten, ist eine potentiometrische Titration-Methode angewendet. Die Oberflächenchemie des Materials hängt die Oberflächenladung, die im Zusammenhang mit dem Vorhandensein von Heteroatomen oder funktionelle Gruppen auf der Oberfläche. Die DGM-Eigenschaften werden auch durch Kontaktwinkel Analyse untersucht. Die Benetzbarkeit in den Poren informiert über die adsorptiv Adsorbens-Interaktionen. Der Einfluss der Wandrauigkeit auf die Schmelztemperatur des Wassers in beiden Proben beschränkt wird mit der dielektrischen Spektroskopie (DRS) Entspannungstechnik untersucht. Messungen von der Dielektrizitätskonstante ermöglichen die Untersuchung der Phänomene wie die Polarisierbarkeit der Flüssigkeit schmelzen und feste Phasen unterscheiden sich voneinander. Eine Änderung in der Steigung der Temperaturabhängigkeit der Kapazität zeigt, dass schmelzen im System auftritt.
Protokoll
1. Vorbereitung der OMK Materialien
-
Synthese einer Silica-Matrix als OMC-Vorstufe
- Bereiten Sie 360 mL von 1,6 M HCl durch Zugabe von 50 mL HCl (36-38 %) in einem 500 mL Rundboden Kolben und, dann, das Hinzufügen von 310 mL Reinstwasser (Widerstand von 18,2 MΩ·cm).
- Dazu fügen Sie 10 g PE 10500 Polymer (6.500 g/Mol).
- Legen Sie die Flasche in ein Ultraschallbad. Erhitzen Sie die Lösung auf 35 ° C und rühren Sie, bis die solid Polymer vollständig gelöst ist, so dass eine homogene Mischung.
- Der Kolben 10 g 1,3,5-Trimethylbenzene hinzu und rühren Sie den Inhalt (mit einer mitreißenden Geschwindigkeit von 220 u/min) durch die Aufrechterhaltung es bei 35 ° C im Wasserbad.
- Fügen Sie nach 30 min rühren 34 g Tetraethylblei Orthosilicate (TEOS) in den Kolben. Die TEOS langsam und tropfenweise unter ständigem Rühren hinzufügen. Sicherstellen Sie, dass es 10 Minuten dauert, 34 g TEOS hinzuzufügen.
- Rühren Sie die Lösung-Mischung wieder für 20 h bei der gleichen Temperatur (35 ° C).
- Übertragen Sie den Inhalt des Kolbens in eine Polytetrafluorethylen-Patrone und legen Sie sie in einem Autoklaven. Lassen Sie die Lösung für 24 h bei 90 ° C.
- Filtern Sie den entstehenden Niederschlag, mit einem Büchner-Trichter, und waschen Sie ihn mit destilliertem Wasser, mit mindestens 1 L.
- Die erhaltenen Solid bei Raumtemperatur trocknen und anwenden einer thermischen Behandlung der Probe bei 500 ° C, mit einem Muffelofen in einer Luftatmosphäre für 6 h.
-
Imprägnierung der resultierende Silica-Matrix, mit einem Kohlenstoff-Vorläufer
- Bereiten Sie Imprägnierung Lösungen (IS1 IS2) mit einem entsprechenden Anteil an Wasser, 3 M Schwefelsäure (VI) und Zucker (Glukose), wo Glukose spielt die Rolle des Kohlenstoff-Vorläufer und Schwefelsäure als Katalysator wirkt.
Achtung: Schwefelsäure ist sehr giftigund verursacht schwere Verbrennungen und Schädigungen des Auges.- IS1 vorzubereiten. Vermischen Sie für jedes Gramm an Kieselsäure 5 g Wasser, 0,14 g von 3 M Schwefelsäure (VI) und 1,25 g Zucker.
- IS2 vorzubereiten. Vermischen Sie für jedes Gramm an Kieselsäure 5 g Wasser, 0,08 g von 3 M Schwefelsäure (VI) und 0,75 g Zucker.
- Legen Sie das Silikon-Material (1 g) und die fertige Lösung IS1 der Kohlenstoff-Vorläufer und der Katalysator in eine 500 mL-Flasche. Erhitzen Sie die Mischung in einem Vakuum Trockner bei 100 ° C für 6 h.
Hinweis: In diesem Schritt verwenden Sie nur IS1. IS2 sollte im nächsten Schritt angewendet werden. - Fügen Sie die IS2 hinzu, die Mischung in die Vakuumtrockner (auf die Lösung mit der teilweise verkohlte Kohlenstoff-Vorläufer). Erhitzen Sie die Mischung wieder in den Vakuum Trockner bei 160 ° C für 12 h.
- Bereiten Sie Imprägnierung Lösungen (IS1 IS2) mit einem entsprechenden Anteil an Wasser, 3 M Schwefelsäure (VI) und Zucker (Glukose), wo Glukose spielt die Rolle des Kohlenstoff-Vorläufer und Schwefelsäure als Katalysator wirkt.
-
Anlassen/Karbonisierung
- Übertragen des erhaltenen Verbundes zu einem Mörtel für die Fragmentierung von größeren Partikeln und eine Homogenisierung des Materials.
- Platzieren Sie das erhaltene Produkt in den Fluss-Ofen und 700 ° C (bei einer Heizrate von 2,5 ° C/min) und Hitze für 6 h bei dieser Temperatur erhitzen. Erhitzen Sie das Material unter Stickstoffatmosphäre.
- Lassen Sie die Lösung abkühlen vor dem Öffnen des Gerätes.
-
Entfernung von der Silica-Matrix durch Ätzen
- Bereiten Sie 100 mL Lösung (ES) Ätzen vor. Mischen Sie 50 mL von 95 % Ethylalkohol und 50 mL Wasser. 7 g Kaliumhydroxid und rühren Sie, bis es sich auflöst.
- Statt alle erhaltenen karbonisiert Material (mindestens 1 g) in einem 250 mL Rundboden Kolben und 100 mL ES.
- Liefern Sie das System mit einem Reflux Kondensator und Magnetrührer und Hitze zum Kochen bringen, unter ständigem Rühren. Kochen Sie die Mischung für 1 h.
- Übertragen Sie das erhaltene Material auf den Büchner-Trichter, mit mindestens 4 L destilliertes Wasser waschen Sie und trocknen.
2. Vorbereitung der Kieselsäure SBA-15 Matrix
- Eine Silica-Matrix zu synthetisieren.
- 150 mL von 1,6 M HCl vorzubereiten.
- Lösen Sie 4 g PE 6400 Polymer (EO13PO70EO13) in 150 mL Säurelösung in einem Rundboden-Kolben.
- Legen Sie die Flasche in ein Ultraschallbad. Die Lösung auf 40 ° C erhitzen und umrühren, damit das Polymer auflösen kann (mindestens 30 min).
- Fügen Sie langsam 8,5 g von TEOS in den Kolben hinzu, tropfenweise, unter ständigem Rühren. Rühren Sie die Lösung-Mischung für 24 h bei gleicher Temperatur (40 ° C).
- Übertragen Sie den Inhalt des Kolbens auf Polytetrafluorethylen Patrone. Lassen Sie die Lösung für 24 h im Ofen 120 ° C.
- Filtern Sie den entstehenden Niederschlag, mit einem Büchner-Trichter, und waschen Sie es mit destilliertem Wasser (mindestens 1 L).
- Trocknen Sie die erhaltenen Solid bei Raumtemperatur und eingekauftes 6 h bei 600 ° C, mit einem Muffelofen in einer Luftatmosphäre.
3. Methoden zur Charakterisierung
- Niedertemperatur-Stickstoff Adsorption/Desorption Messungen
- Verwenden Sie einen automatisches Sorption Analysator N2 Adsorption/Desorption isothermen bei 77 K.
- Verwenden Sie eine geeignete Glasrohr für Stickstoff Sorption Messungen. Reinigen Sie bevor die Glasröhre die poröse Probe hinzufügen das Rohr in eine Ultraschall-Waschmaschine und spülen Sie ihn zunächst mit destilliertem Wasser und nächsten, mit wasserfreiem Ethanol.
- Erhitzen Sie das Glasrohr bei 150 ° C für 3 h und füllen Sie das Rohr mit komprimiertem Stickstoff. Wiegen Sie leere Glasröhrchen unter Stickstoff Bedingungen vor der Messung den Gewicht-Fehler zu minimieren.
- Legen Sie die Probe in die Glasröhre und wiegen Sie die Gesamtmasse (die Masse der Probe mit dem Glasrohr).
- Vor den Messungen Entgasen der Probenmaterials. Platzieren Sie das Glasrohr mit der Probe in der Entgasung der Sorption Analyzer. Gelten die folgenden Bedingungen: ein Druck von mindestens 0,01 MmHg, eine Temperatur von 423 K und eine Dauer von 24 h. Verbinden Sie in der Entgasung Port die Probe auf das Vakuum und erhitzen Sie es auf die eingestellte Temperatur (423 K). Füllen Sie nach der Entgasung die Probe mit Stickstoff und überträgt es auf die Analyse-Port.
- Transmissions-Elektronenmikroskopie
- Verwenden Sie die TEM-Mikroskop mit der 120 kV (für SBA-15) und 200 kV (für das OKM Material) zunehmende Spannungen die gute Bildqualität TEM zu sammeln.
- Zerstreuen Sie für die Vorbereitung eines monodispersen Films der Probe die Probe (1 mg) in Ethanol (1 mL). Führen Sie die Dispersion in einem Microcentrifuge Schlauch indem man sie in ein Ultraschallbad für 3 min.
- Geben Sie zwei Tropfen der Dispersion auf TEM Kupfer Raster mit einer Mikropipette. Übertragen Sie das TEM-Raster auf TEM Mikroskop und starten Sie die TEM-Imaging.
- Energie energiedispersiver Röntgenspektroskopie
- Verwenden Sie ein Raster-Elektronenmikroskop mit einer Röntgen-Detektor ausgestattet, um ein dispersive x-ray Energiespektrum der Proben zu erwerben.
- Anwenden einer Beschleunigungsspannung von 15 kV, das Spektrum zu ernten. Wählen Sie das Silizium als Element Optimierung für SBA-15 und der Kohlenstoff für die OMC-Probe.
- Potentiometrische Titration Messung
- Verwenden Sie eine automatische Bürette die potentiometrische Titration Experiment durchführen. Fügen Sie das Titriermittel in kleinen und kontrollierten Teile (nach dem Titration Software und Verfahren). Bieten Sie das kleinste Inkrement, mindestens 1 μL durch eine automatische Dosierung Intrument.
- 0,1 g der Probe in 30 mL eine Elektrolyt-Lösung (Wasser-Lösung von 0,1 M NaCl) zu verteilen. Verwenden Sie Magnetrührer und isothermen Bedingungen (293 ± 0,1 K) während der Dispergierung Prozedur.
- 1-2 mL Titriermittel (0,1 M NaOH-Lösung) zur Aussetzung hinzugeben.
Hinweis: Führen Sie den Zusatz in kleinen Aliquote (jeweils ca. 0,05 mL sein). Die automatische Bürette soll das Verfahren mindestens ein Dutzend experimentellen Punkte im pH-Bereich von 1 bis 14. - Berechnen Sie die Flächendichte der Ladung Qs, mithilfe der folgenden Formel.
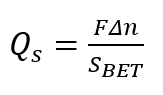 (1)
(1)
Hier,
Δn = die Änderung in der H+Gesamtchloridgehalt– Balance reduziert pro Masse der Probe;
SWette = Brunauer, Emmett-Teller (BET)-Oberfläche der poröse Festkörper;
F = Faraday-Nummer.
- Kapillare Aufstieg Methode zur Messung der Benetzbarkeit
- Um der Kontaktwinkel in den Poren der untersuchten Proben zu bestimmen, verwenden Sie die kapillare Aufstieg-Methode.
Hinweis: Diese Methode basiert auf der Messung der Masse Aufstieg der Flüssigkeit, die das poröse Bett als Funktion der Zeit Eindringen ist. Die wichtigste Annahme dieser Methode ist beruht auf der Tatsache, daß eindringende Flüssigkeit schreitet in die poröse Spalte, die diese Spalte besteht aus interkristalline Kapillaren mit einem bestimmten durchschnittlichen Radius. Somit ist jedes Verhältnis für einzelne Kapillare abgeleitet für die Schicht des porösen Pulvers gültig. In einer einzigen vertikalen Kapillare schwebt der benetzenden Flüssigkeit gegen die Schwerkraft durch den Unterschied des Drucks zwischen der Flüssigkeit und der Dampf in den Poren (Kapillaren Druck). In diesem Sinne erlaubt das Eindringen von Flüssigkeit in das poröse Bett die Bestimmung des dynamischen vorrückenden Kontaktwinkels in den Poren. - Gelten Sie die geänderten Washburn Gleichung17,18, wie folgt ausgedrückt.
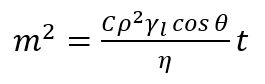 (2)
(2)
Hier,
m = Masse der gemessenen Flüssigkeit;
C = die geometrischen Parameter abhängig von der Verteilung, Form und Größe der Poren;
Ρ = die Dichte;
Γ-l= Oberflächenspannung;
Η = die Viskosität der eindringende Flüssigkeit;
Θ = Kontaktwinkel;
t = Zeit. - Mittels Gleichung (2), schätzen Sie die Werte der vorrückenden Kontaktwinkel in den untersuchten Poren.
- Bereiten Sie das Tensiometer Kraft. Verwenden Sie für Pulver ein Glasrohr mit einem Durchmesser von 3 mm und einer keramischen Sinter; Verwenden Sie für flüssige ein Gefäß mit einem Durchmesser von 22 mm und einem maximalen Volumen von 10 mL.
- 0,017 g der Probe zu messen.
- Starten Sie das Computerprogramm verbunden, das Tensiometer. Setzen Sie ein Gefäß mit der Flüssigkeit auf eine motorische Bühne und Aussetzen der Glasröhre mit der Probe auf eine elektronische Waage.
- Starten Sie des Motors und nähert sich die Flüssigkeit im Behälter mit der Probe mit einer niedrigen konstanten Rate von 10 mm/min; die Eintauchtiefe des Probenröhrchens in der Flüssigkeit gleich 1 mm gesetzt.
- Ab diesem Zeitpunkt die Abhängigkeit m2 = f(t) Registern in dem Computerprogramm.
- Das Experiment zu stoppen wenn der Abhängigkeit m2 = f(t) beginnt, die charakteristische Plateau zu zeigen.
- Durch Wiederholung dieses Vorgangs 3 x - 5 X auf ihre Richtigkeit überprüfen.
- Um der Kontaktwinkel in den Poren der untersuchten Proben zu bestimmen, verwenden Sie die kapillare Aufstieg-Methode.
- Entspannung der dielektrischen Spektroskopie
- Um das Schmelzverhalten von Freiwasser innerhalb der untersuchten poröse Matrizen beschreiben, führen Sie die Temperaturmessungen der elektrischen Kapazität C der Probe anwesend in einem parallelen Platten Kondensator gebildet von Edelstahl19, 20 , 21. zur Messung der Kapazität C als Funktion der Temperatur und der Frequenz des angewandten zyklische elektrischen Feldes verwenden einen Impedanz-Analyzer.
Hinweis: Die komplexe elektrische Permittivität ist definiert als ε * ε = "+ Iε'', wo ε' = C/C0 ist Real, und ε'' = tgδ·ε" ist der Imaginärteil der Permittivität, wo C0 die Kapazität des leeren ist Kondensator und tgδ sind die dielektrischen Verluste. - Legen Sie die gemessene Probe in der Platte Kondensator.
- Wählen Sie einen Frequenzbereich von 100 Hz bis 1 MHz und einer Temperatur von 140 K bis 305 K. Kontrolle die Rate der Temperatur ändert sich mit dem Temperaturregler; Legen Sie die Temperatur-Rate als gleich 0,8 K/min während der Abkühlung und 0,6 K/min während der Aufheizvorgang.
- Um das Schmelzverhalten von Freiwasser innerhalb der untersuchten poröse Matrizen beschreiben, führen Sie die Temperaturmessungen der elektrischen Kapazität C der Probe anwesend in einem parallelen Platten Kondensator gebildet von Edelstahl19, 20 , 21. zur Messung der Kapazität C als Funktion der Temperatur und der Frequenz des angewandten zyklische elektrischen Feldes verwenden einen Impedanz-Analyzer.
Ergebnisse
Die poröse Struktur des untersuchten Proben der OMK und SBA-15, die N-2 Adsorption Desorption charakterisieren verzeichneten isothermen bei 77 K. Die experimentelle N2 Gas Adsorption Desorption isothermen Charakterisierung der untersuchten Systeme sowie die Pore Partikelgrößenverteilungen (PSD) die Adsorption und Desorption Daten entnommen werden in Abbildung 1A-Dvorgestellt. Die Position der die Wendepunkte auf die S...
Diskussion
Die entscheidenden Schritte bei der Vorbereitung des bestellten mesoporösen Carbon Materials sind die Vorbereitung der Kieselsäure bestellten mesoporösen Materialien wie die Vorlage mit klar definierten strukturellen Eigenschaften, die die Eigenschaften der endgültigen Materialien beeinflussen und eine Anlassen/Karbonisierung Schritt unter Stickstoffatmosphäre. Die Änderung der typische Methode der Vorbereitung der mesoporösen bestellt Silikate mit zylindrischen Poren28 betrifft die Anwendu...
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren möchten National Center of Science für die finanzielle Unterstützung mit Grant danken nicht. DEC-2013/09/B/ST4/03711 und UMO-2016/22/ST4/00092. Die Autoren sind auch dankbar für die partielle Unterstützung von den Polen Operational Program Humankapital PO KL 4.1.1, sowie ab dem nationalen Zentrum für Forschung und Entwicklung, unter Forschung gewähren keine. PBS1/A9/13/2012. Die Autoren sind besonders dankbar für Prof. L. Hołysz von Grenz-Phänomene Division, Fakultät für Chemie, Maria Curie-Skłodowska-Universität Lublin, Polen, für ihre Freundlichkeit und damit die Messungen der Benetzbarkeit im SBA-15 Nanoporen.
Materialien
| Name | Company | Catalog Number | Comments |
| 1,3,5-trimethylbenzene | Sigma-Aldrich, Poland | M7200 Sigma-Aldrich | Mesitylene, also known as 1,3,5-trimethylbenzene, reagent grade, assay: 98%. |
| anhydrous ethanol | POCH, Avantor Performance Materials Poland S.A. | 396480111 | Assay, min. 99.8 %, analysis-pur (a.p.) |
| ASAP 2020. Accelerated Surface Area and Porosimetry System | Micromeritics Instrument Corporation, Norcross, GA, USA | Samples were outgassed before analysis at 120 oC for 24 hours in degas port of analyzer. The dead space volume was measured for calibration on experimental measurement using helium as a adsorbate. | |
| Automatic burette Dosimat 665 | Metrohm, Switzerland | The surface charge properties were experimentally determined by potentiometric titration of the suspension at constant temperature 20°C maintained by the thermostatic device. Prior to potentiometric titration measurements, the solid samples were dried by 24 hours at 120 oC. The initial pH was established by addition of 0.3 cm3 of 0.2 mol/L HCl. T The 0.1 mol/L NaOH solution was used as a titrant, added gradually by using automatic burette. | |
| Digital pH-meter pHm-240 | Radiometer, Copenhagen | Device coupled with automatic burette | |
| ethyl alcohol | POCH, Avantor Performance Materials Poland S.A. | 396420420 | Assay, min. 96 %.analysis-pur (a.p.) |
| glucose | POCH, Avantor Performance Materials Poland S.A. | 459560448 | assay 99.5% |
| Hydrochloric acid | POCH, Avantor Performance Materials Poland S.A. | 575283115 | Hydrochloric acid, 35 - 38% analysis-pur (a.p.) |
| HOPG graphite substrate | Spi Supplies | LOT#1170906 | HOPG SPI-2 Grade, 20x20x1 mm |
| Impedance analyzer Solartron 1260 | Solartron | ||
| Pluronic PE 6400 polymer | BASF (Polska) | (EO13PO70EO13) | |
| Pluronic PE10500 | BASF Canada Inc. | Molar mass 6500 g/mol | |
| potassium hydroxide | Sigma-Aldrich, Poland | P5958 Sigma-Aldrich | BioXtra, ≥85% KOH basis |
| SEM microscope | JEOL JSM-7001F | Scanning Electron Microscope with EDS detector | |
| Sigma Force Tensiometer 701 | KSV, Sigma701, Biolin Scientific | force tensiometer | |
| Sulfuric acid (VI) | POCH, Avantor Performance Materials Poland S.A. | 575000115 | |
| surface glass type KS 324 Kavalier | Megan Poland | 80 % of SiO2 , 11% of Na2O and 9% of CaO | |
| Tecnai G2 T20 X-TWIN | FEI, USA | Transmission Electron Microscope with EDX detector. | |
| TEM microscope | JEOL JEM-1400 | ||
| temperature controller ITC503 | Oxford Instruments | ||
| Tetraethylorthosilicate | Sigma-Aldrich, Poland | 131903 | Tetraethyl silicate, TEOS, reagent grade, assay 98% |
| Ultrapure water | Millipore, Merck KGaA, Darmstadt, Germany | SIMSV0001 | Simplicity Water Purification SystemUltrapure Water: 18.2 MegOhm·cm, TOC: <5 ppb |
Referenzen
- Tao, Y., Kanoh, H., Abrams, L., Kaneko, K. Mesopore-Modified Zeolites: Preparation, Characterization, and Applications. Chemical Reviews. , 896-910 (2006).
- Wan, Y., Zhao, D. On the Controllable Soft-Templating Approach to Mesoporous Silicates. Chemical Reviews. 107, 2821-2860 (2007).
- Khder, A. E. S., Hassan, H. M. A., El-Shall, M. S. Acid catalyzed organic transformations by heteropolytungstophosphoric acid supported on MCM-41. Applied Catalysis A. 411, 77-86 (2012).
- Zhao, D. D., et al. Triblock Copolymer Syntheses of Mesoporous Silica with Periodic 50 to 300 Angstrom Pores. Science. 279, 548-552 (1998).
- Linssen, T., Cassiers, K., Cool, P., Vansant, E. Mesoporous templated silicates: an overview of their synthesis, catalytic activation and evaluation of the stability. Advances in Colloid and Interface Science. 103, 121-147 (2003).
- Eftekhari, A., Fan, Z. Ordered mesoporous carbon and its applications for electrochemical energy storage and conversion. Materials Chemistry Frontiers. 1, 1001-1027 (2017).
- Sing, K. Characterization of porous materials: past, present and future. Colloids and Surfaces A. 241, 3-7 (2004).
- Huo, Q., Margolese, D. I. Generalized synthesis of periodic surfactant/inorganic composite materials. Nature. 368, 317-321 (1994).
- Selvaraj, M., Kawi, S., Park, D. W., Ha, C. S. Synthesis and characterization of GaSBA-15: Effect of synthesis parameters and hydrothermal stability. Microporous and Mesoporous Materials. , 586-595 (2009).
- Leonard, A., et al. Toward a better control of internal structure and external morphology of mesoporous silicas synthesized using a nonionic surfactant. Langmuir. 19, 5484-5490 (2003).
- Liang, C., Li, Z., Dai, S. Mesoporous Carbon Materials: Synthesis and Modification. Angewandte Chemie International Edition. 47, 3696-3717 (2008).
- Babić, B., et al. New mesoporous carbon materials synthesized by a templating procedure. Ceramics International. 39 (4), 4035-4043 (2013).
- Allen, S. J., Whitten, L., Mckay, G. The Production and Characterization of Activated Carbons: A Review. Developments in Chemical Engineering and Mineral Processing. 6, 231-261 (1998).
- Kwak, G., et al. Preparation Method of Co3O4 Nanoparticles Using Ordered Mesoporous Carbons as a Template and Their Application for Fischer-Tropsch Synthesis. The Journal of Physical Chemistry C. 117 (4), 1773-1779 (2013).
- Koo, H. M., et al. Effect of the ordered meso-macroporous structure of Co/SiO2 on the enhanced activity of hydrogenation of CO to hydrocarbons. Catalysis Science and Technology. 6, 4221-4231 (2016).
- Jun, S., Joo, S. H., Ryoo, R., Kruk, M., Jaroniec, M. Synthesis of New, Nanoporous Carbon with Hexagonally Ordered Mesostructure. Journal of the American Chemical Society. 122 (43), 10712-10713 (2000).
- Washburn, E. W. The dynamics of capillary flow. Physical Review Series2. 17, 273 (1921).
- Śliwińska-Bartkowiak, M., Sterczyńska, A., Long, Y., Gubbins, K. E. Influence of Microroughness on the Wetting Properties of Nano-Porous Silica Matrices. Molecular Physics. 112, 2365-2371 (2014).
- Śliwińska-Bartkowiak, M., et al. Melting/freezing behavior of a fluid confined in porous glasses and MCM-41: dielectric spectroscopy and molecular simulation. Journal of Chemical Physics. 114, 950-962 (2001).
- Coasne, B., Czwartos, J., Śliwińska-Bartkowiak, M., Gubbins, K. E. Freezing of mixtures confined in silica nanopores: experiment and molecular simulation. Journal of Chemical Physics. 133, 084701-084709 (2010).
- Chełkowski, A. . Dielectric Physics. , (1990).
- Radhakrishnan, R., Gubbins, K. E., Śliwińska-Bartkowiak, M. Global phase diagrams for freezing in porous media. Journal of Chemical Physics. 116, 1147-1155 (2002).
- Gubbins, K. E., Long, Y., Śliwińska-Bartkowiak, M. Thermodynamics of confined nano-phases. Journal of Chemical Thermodynamics. 74, 169-183 (2014).
- Radhakrishnan, R., Gubbins, K. E., Śliwińska-Bartkowiak, M. Effect of the fluid-wall interaction on freezing of confined fluids: Toward the development of a global phase diagram. Journal of Chemical Physics. 112, 11048 (2000).
- Cassie, A. B. D., Baxter, S. Wettability of porous surfaces. Transactions of the Faraday Society. 40, 546 (1944).
- Sing, K. Adsorption methods for the characterization of porous materials. Advances in Colloid and Interface Science. 76, 3-11 (1998).
- Sing, K. The use of nitrogen adsorption for the characterisation of porous materials. Colloids and Surfaces A. 187, 3-9 (2001).
- Yu, C., Fan, J., Tian, B., Zhao, D. Morphology Development of Mesoporous Materials: a Colloidal Phase Separation Mechanism. Chemistry of Materials. 16 (5), 889-898 (2004).
- Liu, D., et al. Enhancement of Electrochemical Hydrogen Insertion in N-Doped Highly Ordered Mesoporous Carbon. The Journal of Physical Chemistry C. 118 (5), 2370-2374 (2014).
- Choi, W. C., et al. Platinum Nanoclusters Studded in the Microporous Nanowalls of Ordered Mesoporous Carbon. Advanced Materials. 17, 446-451 (2005).
- Rouquerol, F., Rouquerol, J., Sing, K. . Adsorption by Powders and Porous Solids: Principles, Methodology and Application. , (1999).
- Gregg, S. J., Sing, K. S. W. . Adsorption, Surface Area and Porosity. , (1982).
- Llewellyn, P. L., Rouquerol, F., Rouquerol, J., Sing, K. S. W., Unger, K. K., Kreysa, G., Baselt, J. P. Critical appraisal of the use of nitrogen adsorption for the characterization of porous carbons. Characterization of Porous Solids V. , 421-427 (2000).
- Sing, K. S. W. The use of gas adsorption for the characterization of porous solids. Colloids and Surfaces. 38, 113-124 (1989).
- Rouquerol, J. Recommendations for the characterization of porous solids. Pure & Applied Chemistry. 66, 1739-1758 (1994).
- Marega, C. A direct SAXS approach for the determination of specific surface area of clay in polymer-layered silicate nanocomposites. The Journal of Physical Chemistry B. 116, 7596-7602 (2012).
- Tsao, C. S., et al. Neutron Scattering Methodology for Absolute Measurement of Room-Temperature Hydrogen Storage Capacity and Evidence for Spillover Effect in a Pt-Doped Activated Carbon. The Journal of Physical Chemistry Letters. 1, 1569-1573 (2010).
- Mattson, J. S., Mark, H. B. . Activated Carbon: Surface Chemistry and Adsorption from Solution. , (1971).
- László, K., Szucs, A. Surface characterization of polyethyleneterephthalate (PET) based activated carbon and the effect of pH on its adsorption capacity from aqueous phenol and 2,3,4-trichlorophenol solutions. Carbon. 39, 1945-1953 (2001).
- Garten, V. A., Weiss, D. E., Willis, J. B. A new interpretation of the acidic and basic structures in carbons. Australian Journal of Chemistry. 10, 309-328 (1957).
- Boehm, H. P. Surface oxides on carbon and their analysis: A critical assessment. Carbon. 40, 145-149 (2002).
- Menendez, J. A., Phillips, J., Xia, B., Radovic, L. R. On the modification and characterization of chemical surface properties of activated carbon: In the search of carbons with stable basic properties. Langmuir. 12, 4404-4410 (1996).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten