É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Propriedades de superfície de carbono de Nanoporous sintetizado e matrizes de sílica
Neste Artigo
Resumo
Aqui nós relatamos a síntese e caracterização de carbono nanoporous ordenada (com um tamanho de poro 4.6 nm) e SBA-15 (com um tamanho de poro 5.3 nm). O trabalho descreve a superfície e propriedades texturais de peneiras moleculares nanoporous, sua molhabilidade e o comportamento de derretimento de D2O confinado nos materiais.
Resumo
Neste trabalho, relatamos a síntese e caracterização de ordenou nanoporous material de carbono (também chamado de mesoporos ordenada material de carbono [Mac]) com um tamanho de poro nm 4,6 e matriz porosa de sílica ordenada, SBA-15, com um tamanho de poro 5.3 nm. Este trabalho descreve as propriedades da superfície de peneiras moleculares nanoporous, sua molhabilidade, e o comportamento de derretimento de D2O confinado nos materiais porosos diferentemente ordenados com tamanhos de poros semelhantes. Para este efeito, Mac e SBA-15 com altamente ordenada nanoporous estruturas são sintetizados através da impregnação da matriz de sílica aplicando um precursor de carbono e pelo método sol-gel, respectivamente. A estrutura porosa de investigados sistemas caracteriza-se por uma análise de adsorção-dessorção N2 em 77 K. Para determinar o caráter eletroquímico de superfície de materiais sintetizados, são realizadas medições de titulação potenciométrica; os resultados obtidos para o método aberto de coordenação mostra uma mudança dePzcE de pH significativa para os valores mais elevados de pH, em relação ao SBA-15. Isto sugere que Mac investigada tem superfície propriedades relacionadas a grupos de funcionais à base de oxigénio. Para descrever as propriedades da superfície dos materiais, os ângulos de contato de líquidos penetrando as camas porosas estudadas também são determinados. O método da ascensão capilar confirmou a aumentada molhabilidade das paredes sílica em relação as paredes de carbono e uma influência da rugosidade do poro sobre as interações de líquido/parede, que é muito mais pronunciada para sílica do que para mesopores de carbono. Também estudamos o comportamento de derretimento de D2O confinado no Mac e SBA-15 aplicando o método dielétrico. Os resultados mostram que a depressão da temperatura de fusão de D2O nos poros da OMC é cerca de 15 K mais elevados em relação a depressão da temperatura de derretimento no SBA-15 os poros com um tamanho comparável de nm 5. Isso é causado pela influência de interações adsorbate/adsorvente de matrizes estudadas.
Introdução
Em 1992, ordenada nanoporous sílica materiais foram obtidos pela primeira vez, usando um modelo orgânico; Desde então, um grande número de publicações relacionadas a diferentes aspectos destas estruturas, métodos sintéticos, a investigação de suas propriedades, suas modificações, e diferentes aplicações têm aparecido na literatura1,2 ,3. O interesse no SBA-15 nanoporous sílica matriz4 é devido a sua qualidade única: uma alta área de superfície, larga os poros com uma distribuição de tamanho de poro uniforme e boas propriedades químicas e mecânicas. Materiais de sílica nanoporous com poros cilíndricos, tais como SBA-155, frequentemente são utilizados como uma matriz porosa para catalisadores como eles são eficientes catalisadores em reações orgânicas6,7. O material pode ser sintetizado com uma grande variedade de métodos que possam influenciar suas características8,9,10. Portanto, é fundamental otimizar esses métodos para potenciais aplicações em muitos campos: dispositivos eletroquímicos, nanotecnologia, biologia e medicina, sistemas de entrega, de drogas ou em adesão e tribologia. No presente estudo, apresentam-se dois tipos diferentes de estruturas nanoporous, nomeadamente sílica e carbono matrizes porosas. Para comparar suas propriedades, a matriz de SBA-15 é sintetizada usando o método sol-gel, e o material de carbono nanoporous ordenada é preparado pela impregnação da matriz resultante de sílica com um precursor de carbono.
Materiais de carbono poroso são importantes em muitos aparelhos devido à sua elevada área superficial e suas propriedades físico-químicas únicas e bem definidos,6,11,12. Preparação típica resulta em materiais com porosidade distribuída aleatoriamente e uma estrutura desordenada; Há também uma possibilidade limitada para que a alteração dos parâmetros gerais do pore, e assim, estruturas com distribuições de tamanho de poros relativamente amplo são obtidas13. Esta possibilidade é ampliada para materiais de carbono nanoporous com áreas de superfície elevadas e ordenou sistemas de nanoporos. Mais previram a geometria e maior controle dos processos físico-químicos dentro do espaço de pore são importantes em muitas aplicações: como catalisadores, sistemas de mídia de separação, avançados materiais eletrônicos e nanoreactors em muitos campos científicos14 , 15.
Para obter as réplicas de carbono poroso, silicatos ordenados podem atuar como uma matriz sólida ao qual precursores de carbono são introduzidos diretamente. O método pode ser dividido em várias etapas: a seleção do material de sílica ordenada; a deposição de um precursor de carbono em uma matriz de sílica; carbonização; em seguida, a remoção da matriz de sílica. Muitos tipos diferentes de materiais carbonáceos podem ser obtidos por esse método, mas nem todos os materiais não porosas têm uma estrutura ordenada. Um elemento importante do processo é a seleção de uma matriz adequada cujos nanoporos devem formar uma estrutura tridimensional estável,16.
Neste trabalho, a influência do tipo de poros paredes sobre as propriedades da superfície de matrizes nanoporous sintetizado é investigada. As propriedades da superfície do material do método aberto de coordenação são refletidas pelas propriedades de superfície de sílica analógica (SBA-15) da OMC. As propriedades texturais e estruturais de ambos os tipos de materiais (Mac e SBA-15) caracterizam-se por energia dispersiva (de análise de raios-x, microscopia eletrônica de transmissão (TEM) e baixa temperatura N2 medidas de adsorção/dessorção (a 77 K) EDX).
Medição de adsorção/dessorção do gás de baixa temperatura é uma das técnicas mais importantes durante a caracterização de materiais porosos. Gás nitrogênio é usado como um adsorbate devido ao seu elevado grau de pureza e a possibilidade de criar uma forte interação com adsorventes sólidos. Importantes vantagens desta técnica são a user-friendly equipamento comercial e relativamente fácil procedimentos de processamento de dados. A determinação de isotermas de adsorção/dessorção de nitrogênio é baseada no acúmulo das moléculas na superfície do sólido adsorvente a 77 K em uma ampla gama de pressão (P/P0) adsorbate. O procedimento de Barrett, Joyner e Halenda (BJH) para calcular a distribuição de tamanho de poro de isotermas de adsorção ou dessorção experimentais é aplicado. Os pressupostos mais importantes do método BJH incluem uma superfície plana e uma distribuição uniforme do adsorbate na superfície investigada. No entanto, esta teoria é baseada na equação de Kelvin e continua a ser a forma mais amplamente utilizada para o cálculo da distribuição de tamanho de poro na faixa de mesoporos.
Para avaliar o caráter eletroquímico das amostras, é aplicado um método de titulação potenciométrica. A química de superfície do material varia de acordo com a carga superficial, relacionada com a presença de heteroátomos ou grupos funcionais na superfície. Propriedades de superfície também são investigadas por análise de ângulo de contato. A molhabilidade dentro dos poros fornece informações sobre as interações adsorbate-adsorvente. A influência da rugosidade da parede sobre a temperatura de fusão da água confinada em ambas as amostras é estudada com a técnica de espectroscopia (DRS) de relaxação dielétrica. Medições da constante dieléctrica permitem a investigação de fenômenos de fusão como a polarização do líquido e fases sólidas são diferentes uns dos outros. Uma mudança na inclinação da dependência da temperatura da capacitância mostra que derretimento ocorre no sistema.
Protocolo
1. preparação dos materiais do método aberto de coordenação
-
Síntese de uma matriz de sílica como precursor do método aberto de coordenação
- Prepare-se 360 mL de 1,6 M de HCl adicionando 50 mL de HCl (36-38%) em um balão de fundo redondo de 500 mL e, em seguida, adicionando 310 mL de água ultrapura (resistividade de MΩ·cm 18.2).
- Para isso, adicionar 10 g de PE 10500 polímero (6.500 g/mol).
- Coloque o frasco em um banho ultra-sônico. Aquecer a solução a 35 ° C e agite-o até o polímero sólido é dissolvido completamente, fazendo uma mistura homogénea.
- Adicionar 10 g de 1, 3,5-trimetilbenzeno para o frasco e agitar o conteúdo (a uma taxa de agitação de 220 rpm), mantendo-a 35 ° C em banho-maria.
- Após agitação por 30 min, adicione 34g de orthosilicate tetraetila (TEOS) no balão. Adicione o TEOS lentamente e gota a gota, com agitação constante. Certifique-se de que leva 10 min para adicionar 34g de TEOS.
- Agite a mistura de solução novamente para 20 h na mesma temperatura (35 ° C).
- Transferir o conteúdo do frasco para um cartucho de politetrafluoroetileno e colocá-lo em uma autoclave. Deixe a solução por 24 h a 90 ° C.
- Filtrar o precipitado resultante, usando um funil de Büchner e lave-o com água destilada, usando pelo menos 1 L.
- Secar o sólido Obtido em temperatura ambiente e aplicar um tratamento térmico para a amostra a 500 ° C, usando um forno de mufla em uma atmosfera de ar para 6 h.
-
Impregnação da matriz resultante de sílica, usando um precursor de carbono
- Preparar soluções de impregnação (IS1 e IS2) com proporções adequadas de água, ácido sulfúrico de 3M (VI) e açúcar (glicose), onde a glicose desempenha o papel de precursor de carbono e ácido sulfúrico atua como catalisador.
Cuidado: O ácido sulfúrico é muito tóxico, causa queimaduras graves e lesões oculares.- Prepare IS1. Para cada grama de sílica, misture 5 g de água, 0,14 g de ácido sulfúrico de 3M (VI) e 1,25 g de açúcar.
- Prepare IS2. Para cada grama de sílica, misture 5 g de água, 0,08 g de ácido sulfúrico de 3M (VI) e 0,75 g de açúcar.
- Coloque o material de sílica (1g) e a solução preparada IS1 do precursor do carbono e o catalisador em um balão de 500 mL. Aqueça a mistura em um secador de vácuo a 100 ° C, durante 6 h.
Nota: Nesta etapa, use somente IS1. IS2 deve ser aplicado na próxima etapa. - Adicione o IS2 à mistura no vácuo secador (para a solução com o precursor de carbono parcialmente carbonizado). Aqueça a mistura novamente na secadora vácuo a 160 ° C, durante 12 h.
- Preparar soluções de impregnação (IS1 e IS2) com proporções adequadas de água, ácido sulfúrico de 3M (VI) e açúcar (glicose), onde a glicose desempenha o papel de precursor de carbono e ácido sulfúrico atua como catalisador.
-
Têmpera/carbonização
- Transferi o composto obtido para um almofariz para a fragmentação das partículas maiores e uma homogeneização do material.
- Coloque o produto obtido para a fornalha de fluxo e aquecê-lo a 700 ° C (a uma taxa de aquecimento de 2,5 ° C/min) e calor para 6 h a esta temperatura. Aqueça o material em uma atmosfera de nitrogênio.
- Deixe a solução esfriar antes de abrir o forno.
-
Remoção da matriz de sílica por gravura
- Prepare 100 mL de solução (ES) de gravura. Misture 50 mL de álcool etílico a 95% e 50 mL de água. Adicionar 7 g de hidróxido de potássio e agitar até que esteja dissolvido.
- Todo o material carbonizado (pelo menos 1 g) Obtido em um balão de fundo redondo de 250 mL e adicionar 100 mL de ES.
- Fornecemos o sistema com um condensador de refluxo e agitador magnético e calor para ferver, agitando constantemente. Ferva a mistura por 1h.
- Transferir o material obtido para o funil de Büchner, lavá-lo pelo menos 4 L de água destilada e seque-o.
2. preparação da matriz de sílica SBA-15
- Sintetiza uma matriz de sílica.
- Prepare-se 150 mL de HCl de 1,6 M.
- Dissolva 4 g de polímero PE 6400 (70EO EO13PO13) em 150 mL de solução de ácido em um balão de fundo redondo.
- Coloque o frasco em um banho ultra-sônico. Aquecer a solução a 40 ° C e agite-o para que o polímero pode dissolver-se (pelo menos por 30 min).
- Lentamente Adicione 8,5 g de TEOS para o balão, gota a gota, com agitação constante. Agite a mistura de solução por 24 h na mesma temperatura (40 ° C).
- Transferi o conteúdo do frasco para um cartucho de politetrafluoretileno. Deixe a solução por 24 h no forno a 120 ° C.
- Filtrar o precipitado resultante, usando um funil de Büchner e lave-o com água destilada (pelo menos 1L).
- Seca o sólido Obtido em temperatura ambiente e calcina para 6 h a 600 ° C, usando um forno de mufla em uma atmosfera de ar.
3. métodos de caracterização
- Medições de adsorção/dessorção de nitrogênio de baixa temperatura
- Use um analisador automático de sorção para obter N2 isotérmicas de adsorção/dessorção em 77 K.
- Use um tubo de vidro adequado para medições de sorção de nitrogênio. Antes de adicionar a amostra porosa para o tubo de vidro, limpe o tubo em um aparelho de ultra-sons e enxaguá-lo primeiro com água destilada e, na próxima, com o etanol anidro.
- Aqueça o tubo de vidro a 150 ° C por 3 h e encher o tubo com nitrogênio comprimido. Pese o tubo de vidro vazio sob as condições de nitrogênio antes da medição para minimizar o erro de peso.
- Coloque a amostra no tubo de vidro e pesar a massa total (massa da amostra com o tubo de vidro).
- Antes as medições, desgaseifica a amostra. Coloca o tubo de vidro com a amostra no porto de desgaseificação do analisador sorção. Aplicam-se as seguintes condições de processo: uma pressão de pelo menos 0,01 mmHg, temperatura de 423 K e uma duração de 24 h. No porto de desgaseificação, conectar-se a amostra para o vácuo e aquecê-lo para a temperatura ajustada (423 K). Após a desgaseificação, encher a amostra com nitrogênio e transferi-lo para o porto de análise.
- Microscopia eletrônica de transmissão
- Usar o microscópio TEM com a 120 kV (para SBA-15) e 200 kV (para o material do método aberto de coordenação) tensões de aceleração para coletar as imagens TEM de boa qualidade.
- Para a preparação de um filme de monodisperso da amostra, disperse a amostra (1 mg) em etanol (1 mL). Execute o procedimento de dispersão em um tubo de microcentrifugadora, colocando-o em um banho ultra-sônico por 3 min.
- Coloque duas gotas de dispersão em uma grade TEM cobre utilizando uma micropipeta. A grade TEM de transferência para o microscópio TEM e começar a imagem TEM.
- Espectroscopia de raios-x de energia dispersiva
- Use um microscópio eletrônico, equipado com um detector de raios-x para adquirir um espectro de raio-x de dispersão de energia das amostras.
- Aplicar uma tensão de aceleração de 15 kV para colher o espectro. Selecione o silício como elemento de otimização para SBA-15 e o carbono para o exemplo do método aberto de coordenação.
- Medição de titulação potenciométrica
- Use uma bureta automática para realizar o experimento de titulação potenciométrica. Adicione o titulante em porções pequenas e controladas (de acordo com a titulação software e procedimento). Fornece o menor incremento, pelo menos 1 μL, por um meio automático de dosagem.
- Disperse a 0,1 g de amostra em 30 mL de uma solução de eletrólito (solução de água de 0.1 M de NaCl). Use o agitador magnético e condições isotérmicas (293 ± 0,1 K) durante o procedimento de dispersão.
- Adicione 1 a 2 mL de titulante (solução de NaOH 0,1 M) para a suspensão.
Nota: Realize a adição em pequenas alíquotas (cada ser cerca de 0,05 mL). Bureta automática o procedimento deve fornecer pelo menos uma dúzia de pontos experimentais na faixa de pH de 1 a 14. - Calcule a densidade da superfície da carga Q,s, usando a seguinte fórmula.
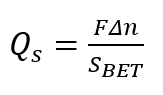 (1)
(1)
Aqui,
Δn = a mudança no equilíbrio /OH H+– reduzido pela massa da amostra;
Saposta = área de superfície Brunauer-Emmett-Teller (aposta) de estado sólido poroso;
F = o número de Faraday.
- Método da ascensão capilar para medições de molhabilidade
- Para determinar o ângulo de contato dentro dos poros das amostras estudadas, use o método de ascensão capilar.
Nota: Este método baseia-se na medição da ascensão em massa de líquido, que está penetrando a cama porosa, como a função do tempo. A suposição principal deste método é baseado no fato de que o líquido penetrante está avançando na coluna porosa e que essa coluna consiste em intergranular capilares com um determinado raio médio. Assim, cada relação derivada para único capilar é válida para a camada do pó porosa. Em um único capilar vertical, o líquido molhante flutua contra as forças gravitacionais como resultado da diferença de pressão entre o líquido e o vapor nos poros (pressão capilar). Neste significado, a penetração do líquido no leito poroso permite a determinação do ângulo de contacto dinâmico avanço dentro dos poros. - Aplica equação17,18, expressado da seguinte forma do Washburn modificados.
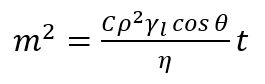 (2)
(2)
Aqui,
m = massa do líquido medido;
C = parâmetro geométrico dependente da distribuição, forma e tamanho dos poros;
Ρ = densidade;
Γl= a tensão de superfície;
Η = viscosidade do líquido penetrante;
Θ = ângulo de contato;
t = tempo. - Usando a equação (2), estime os valores dos ângulos de contato de avanço dentro dos poros estudados.
- Prepare o tensiómetro de força. Para pós, usar um tubo de vidro com um diâmetro de 3 mm e uma queima de cerâmica; para o líquido, use um vaso com um diâmetro de 22 mm e um máximo de volume de 10 mL.
- Medida 0,017 g da amostra.
- Inicie o programa de computador conectado para o tensiómetro. Coloque um recipiente com o líquido em um palco motorizado e suspender o tubo de vidro com a amostra em uma balança eletrônica.
- Acione o motor e começar a aproximar-se o líquido no recipiente com a amostra a uma baixa taxa constante de 10 mm/min; Defina a profundidade de imersão do tubo de amostra para o líquido igual a 1 mm.
- A partir deste momento, a dependência m2 = f(t) registra no programa de computador.
- Parar o experimento quando a dependência m2 = f(t) começa a mostrar o planalto característico.
- Verificar exatidão, repetindo este procedimento 3 x - 5x.
- Para determinar o ângulo de contato dentro dos poros das amostras estudadas, use o método de ascensão capilar.
- Espectroscopia dieléctrica relaxamento
- Para descrever o comportamento de derretimento de águas confinadas dentro as matrizes estudadas porosas, realizar as medições de temperatura de capacitância elétrica C da amostra presente em um capacitor paralelo chapa feito de aço inoxidável19, 20 , 21. para medir a capacitância C como a função da temperatura e da frequência do campo elétrico aplicado cíclica, usar um analisador de impedância.
Nota: A permissividade elétrica complexa é definida como * ε = ε' + iε ', onde ε' = C/C0 é o real e ε ' = tgδ·ε' é a parte imaginária da permissividade, onde C0 é a capacitância do empty capacitor e tgδ são as perdas dielétricas. - Colocar a amostra medida dentro do capacitor de placa.
- Selecione uma faixa de frequência de 100 Hz a 1 MHz e uma temperatura de 140 K a 305 K. controle da taxa de temperatura mudar com o controlador de temperatura; Defina a taxa de temperatura como igual a 0,8 K/min durante o resfriamento e 0,6 K/min durante o processo de aquecimento.
- Para descrever o comportamento de derretimento de águas confinadas dentro as matrizes estudadas porosas, realizar as medições de temperatura de capacitância elétrica C da amostra presente em um capacitor paralelo chapa feito de aço inoxidável19, 20 , 21. para medir a capacitância C como a função da temperatura e da frequência do campo elétrico aplicado cíclica, usar um analisador de impedância.
Resultados
Para caracterizar a estrutura porosa das amostras investigadas de Mac e SBA-15, N2 adsorção-dessorção isotermas foram gravadas no 77 K. As experimental N2 gás adsorção-dessorção isotérmicas caracterizando os sistemas investigados, bem como as distribuições de tamanho de poro (PSD) obtidas a partir dos dados de adsorção e dessorção, são apresentadas na figura 1A-D. A posição dos pontos de inflexão sobr...
Discussão
Os passos críticos durante a preparação do material mesoporoso ordenada carbono incluem a preparação dos materiais sílica mesoporos ordenada como o modelo com propriedades estruturais bem definidas que afetam as propriedades dos materiais finais e um passo de têmpera/carbonização sob uma atmosfera de nitrogênio. A modificação do método de preparação de mesoporos o típico ordenou silicatos com poros cilíndricos28 preocupações a aplicação de um agente de estrutura-direcionando a...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores gostaria de agradecer o centro nacional de ciência, para a prestação de apoio financeiro com o grant não. DEC/09-2013/B/ST4/03711 e UMO-2016/22/ST4/00092. Os autores também são gratos pelo apoio parcial de a Polónia operacional programa Capital humano PO KL 4.1.1, bem como a partir do centro nacional de pesquisas e desenvolvimento, sob investigação conceder n. PBS1/A9/13/2012. Os autores agradecem especialmente por Prof L. Hołysz da divisão de fenômenos de interfaces, da faculdade de química, Universidade de Skłodowska-Curie de Maria, Lublin, Polónia, por sua bondade e permitindo que as medições da molhabilidade em nanoporos o SBA-15.
Materiais
| Name | Company | Catalog Number | Comments |
| 1,3,5-trimethylbenzene | Sigma-Aldrich, Poland | M7200 Sigma-Aldrich | Mesitylene, also known as 1,3,5-trimethylbenzene, reagent grade, assay: 98%. |
| anhydrous ethanol | POCH, Avantor Performance Materials Poland S.A. | 396480111 | Assay, min. 99.8 %, analysis-pur (a.p.) |
| ASAP 2020. Accelerated Surface Area and Porosimetry System | Micromeritics Instrument Corporation, Norcross, GA, USA | Samples were outgassed before analysis at 120 oC for 24 hours in degas port of analyzer. The dead space volume was measured for calibration on experimental measurement using helium as a adsorbate. | |
| Automatic burette Dosimat 665 | Metrohm, Switzerland | The surface charge properties were experimentally determined by potentiometric titration of the suspension at constant temperature 20°C maintained by the thermostatic device. Prior to potentiometric titration measurements, the solid samples were dried by 24 hours at 120 oC. The initial pH was established by addition of 0.3 cm3 of 0.2 mol/L HCl. T The 0.1 mol/L NaOH solution was used as a titrant, added gradually by using automatic burette. | |
| Digital pH-meter pHm-240 | Radiometer, Copenhagen | Device coupled with automatic burette | |
| ethyl alcohol | POCH, Avantor Performance Materials Poland S.A. | 396420420 | Assay, min. 96 %.analysis-pur (a.p.) |
| glucose | POCH, Avantor Performance Materials Poland S.A. | 459560448 | assay 99.5% |
| Hydrochloric acid | POCH, Avantor Performance Materials Poland S.A. | 575283115 | Hydrochloric acid, 35 - 38% analysis-pur (a.p.) |
| HOPG graphite substrate | Spi Supplies | LOT#1170906 | HOPG SPI-2 Grade, 20x20x1 mm |
| Impedance analyzer Solartron 1260 | Solartron | ||
| Pluronic PE 6400 polymer | BASF (Polska) | (EO13PO70EO13) | |
| Pluronic PE10500 | BASF Canada Inc. | Molar mass 6500 g/mol | |
| potassium hydroxide | Sigma-Aldrich, Poland | P5958 Sigma-Aldrich | BioXtra, ≥85% KOH basis |
| SEM microscope | JEOL JSM-7001F | Scanning Electron Microscope with EDS detector | |
| Sigma Force Tensiometer 701 | KSV, Sigma701, Biolin Scientific | force tensiometer | |
| Sulfuric acid (VI) | POCH, Avantor Performance Materials Poland S.A. | 575000115 | |
| surface glass type KS 324 Kavalier | Megan Poland | 80 % of SiO2 , 11% of Na2O and 9% of CaO | |
| Tecnai G2 T20 X-TWIN | FEI, USA | Transmission Electron Microscope with EDX detector. | |
| TEM microscope | JEOL JEM-1400 | ||
| temperature controller ITC503 | Oxford Instruments | ||
| Tetraethylorthosilicate | Sigma-Aldrich, Poland | 131903 | Tetraethyl silicate, TEOS, reagent grade, assay 98% |
| Ultrapure water | Millipore, Merck KGaA, Darmstadt, Germany | SIMSV0001 | Simplicity Water Purification SystemUltrapure Water: 18.2 MegOhm·cm, TOC: <5 ppb |
Referências
- Tao, Y., Kanoh, H., Abrams, L., Kaneko, K. Mesopore-Modified Zeolites: Preparation, Characterization, and Applications. Chemical Reviews. , 896-910 (2006).
- Wan, Y., Zhao, D. On the Controllable Soft-Templating Approach to Mesoporous Silicates. Chemical Reviews. 107, 2821-2860 (2007).
- Khder, A. E. S., Hassan, H. M. A., El-Shall, M. S. Acid catalyzed organic transformations by heteropolytungstophosphoric acid supported on MCM-41. Applied Catalysis A. 411, 77-86 (2012).
- Zhao, D. D., et al. Triblock Copolymer Syntheses of Mesoporous Silica with Periodic 50 to 300 Angstrom Pores. Science. 279, 548-552 (1998).
- Linssen, T., Cassiers, K., Cool, P., Vansant, E. Mesoporous templated silicates: an overview of their synthesis, catalytic activation and evaluation of the stability. Advances in Colloid and Interface Science. 103, 121-147 (2003).
- Eftekhari, A., Fan, Z. Ordered mesoporous carbon and its applications for electrochemical energy storage and conversion. Materials Chemistry Frontiers. 1, 1001-1027 (2017).
- Sing, K. Characterization of porous materials: past, present and future. Colloids and Surfaces A. 241, 3-7 (2004).
- Huo, Q., Margolese, D. I. Generalized synthesis of periodic surfactant/inorganic composite materials. Nature. 368, 317-321 (1994).
- Selvaraj, M., Kawi, S., Park, D. W., Ha, C. S. Synthesis and characterization of GaSBA-15: Effect of synthesis parameters and hydrothermal stability. Microporous and Mesoporous Materials. , 586-595 (2009).
- Leonard, A., et al. Toward a better control of internal structure and external morphology of mesoporous silicas synthesized using a nonionic surfactant. Langmuir. 19, 5484-5490 (2003).
- Liang, C., Li, Z., Dai, S. Mesoporous Carbon Materials: Synthesis and Modification. Angewandte Chemie International Edition. 47, 3696-3717 (2008).
- Babić, B., et al. New mesoporous carbon materials synthesized by a templating procedure. Ceramics International. 39 (4), 4035-4043 (2013).
- Allen, S. J., Whitten, L., Mckay, G. The Production and Characterization of Activated Carbons: A Review. Developments in Chemical Engineering and Mineral Processing. 6, 231-261 (1998).
- Kwak, G., et al. Preparation Method of Co3O4 Nanoparticles Using Ordered Mesoporous Carbons as a Template and Their Application for Fischer-Tropsch Synthesis. The Journal of Physical Chemistry C. 117 (4), 1773-1779 (2013).
- Koo, H. M., et al. Effect of the ordered meso-macroporous structure of Co/SiO2 on the enhanced activity of hydrogenation of CO to hydrocarbons. Catalysis Science and Technology. 6, 4221-4231 (2016).
- Jun, S., Joo, S. H., Ryoo, R., Kruk, M., Jaroniec, M. Synthesis of New, Nanoporous Carbon with Hexagonally Ordered Mesostructure. Journal of the American Chemical Society. 122 (43), 10712-10713 (2000).
- Washburn, E. W. The dynamics of capillary flow. Physical Review Series2. 17, 273 (1921).
- Śliwińska-Bartkowiak, M., Sterczyńska, A., Long, Y., Gubbins, K. E. Influence of Microroughness on the Wetting Properties of Nano-Porous Silica Matrices. Molecular Physics. 112, 2365-2371 (2014).
- Śliwińska-Bartkowiak, M., et al. Melting/freezing behavior of a fluid confined in porous glasses and MCM-41: dielectric spectroscopy and molecular simulation. Journal of Chemical Physics. 114, 950-962 (2001).
- Coasne, B., Czwartos, J., Śliwińska-Bartkowiak, M., Gubbins, K. E. Freezing of mixtures confined in silica nanopores: experiment and molecular simulation. Journal of Chemical Physics. 133, 084701-084709 (2010).
- Chełkowski, A. . Dielectric Physics. , (1990).
- Radhakrishnan, R., Gubbins, K. E., Śliwińska-Bartkowiak, M. Global phase diagrams for freezing in porous media. Journal of Chemical Physics. 116, 1147-1155 (2002).
- Gubbins, K. E., Long, Y., Śliwińska-Bartkowiak, M. Thermodynamics of confined nano-phases. Journal of Chemical Thermodynamics. 74, 169-183 (2014).
- Radhakrishnan, R., Gubbins, K. E., Śliwińska-Bartkowiak, M. Effect of the fluid-wall interaction on freezing of confined fluids: Toward the development of a global phase diagram. Journal of Chemical Physics. 112, 11048 (2000).
- Cassie, A. B. D., Baxter, S. Wettability of porous surfaces. Transactions of the Faraday Society. 40, 546 (1944).
- Sing, K. Adsorption methods for the characterization of porous materials. Advances in Colloid and Interface Science. 76, 3-11 (1998).
- Sing, K. The use of nitrogen adsorption for the characterisation of porous materials. Colloids and Surfaces A. 187, 3-9 (2001).
- Yu, C., Fan, J., Tian, B., Zhao, D. Morphology Development of Mesoporous Materials: a Colloidal Phase Separation Mechanism. Chemistry of Materials. 16 (5), 889-898 (2004).
- Liu, D., et al. Enhancement of Electrochemical Hydrogen Insertion in N-Doped Highly Ordered Mesoporous Carbon. The Journal of Physical Chemistry C. 118 (5), 2370-2374 (2014).
- Choi, W. C., et al. Platinum Nanoclusters Studded in the Microporous Nanowalls of Ordered Mesoporous Carbon. Advanced Materials. 17, 446-451 (2005).
- Rouquerol, F., Rouquerol, J., Sing, K. . Adsorption by Powders and Porous Solids: Principles, Methodology and Application. , (1999).
- Gregg, S. J., Sing, K. S. W. . Adsorption, Surface Area and Porosity. , (1982).
- Llewellyn, P. L., Rouquerol, F., Rouquerol, J., Sing, K. S. W., Unger, K. K., Kreysa, G., Baselt, J. P. Critical appraisal of the use of nitrogen adsorption for the characterization of porous carbons. Characterization of Porous Solids V. , 421-427 (2000).
- Sing, K. S. W. The use of gas adsorption for the characterization of porous solids. Colloids and Surfaces. 38, 113-124 (1989).
- Rouquerol, J. Recommendations for the characterization of porous solids. Pure & Applied Chemistry. 66, 1739-1758 (1994).
- Marega, C. A direct SAXS approach for the determination of specific surface area of clay in polymer-layered silicate nanocomposites. The Journal of Physical Chemistry B. 116, 7596-7602 (2012).
- Tsao, C. S., et al. Neutron Scattering Methodology for Absolute Measurement of Room-Temperature Hydrogen Storage Capacity and Evidence for Spillover Effect in a Pt-Doped Activated Carbon. The Journal of Physical Chemistry Letters. 1, 1569-1573 (2010).
- Mattson, J. S., Mark, H. B. . Activated Carbon: Surface Chemistry and Adsorption from Solution. , (1971).
- László, K., Szucs, A. Surface characterization of polyethyleneterephthalate (PET) based activated carbon and the effect of pH on its adsorption capacity from aqueous phenol and 2,3,4-trichlorophenol solutions. Carbon. 39, 1945-1953 (2001).
- Garten, V. A., Weiss, D. E., Willis, J. B. A new interpretation of the acidic and basic structures in carbons. Australian Journal of Chemistry. 10, 309-328 (1957).
- Boehm, H. P. Surface oxides on carbon and their analysis: A critical assessment. Carbon. 40, 145-149 (2002).
- Menendez, J. A., Phillips, J., Xia, B., Radovic, L. R. On the modification and characterization of chemical surface properties of activated carbon: In the search of carbons with stable basic properties. Langmuir. 12, 4404-4410 (1996).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados