Method Article
En la generación de Vitro del Somite derivados humanos inducida por células madre pluripotentes
En este artículo
Resumen
Presentamos aquí un protocolo para la diferenciación de células madre humanas pluripotentes inducidas en cada derivado del somite (miotoma sclerotome, dermatoma y syndetome) en condiciones químicamente definidas, que tiene aplicaciones en modelos futuros de la enfermedad y terapias basadas en células en cirugía ortopédica.
Resumen
En respuesta a señales como WNTs, ósea las proteínas morfogenéticas (BMPs) y sonic hedgehog (SHH), secretado de los tejidos circundantes, somitas (SMs) dan lugar a múltiples tipos de células, incluyendo el miotoma (MYO) sclerotome (SCL), dermatoma (D) y syndetome (SYN) , que a su vez se convierten en músculo esquelético, esqueleto axial, dermis dorsal y tendón/ligamento axial, respectivamente. Por lo tanto, la generación de SMs y sus derivados de las células madre humanas pluripotentes inducidas (iPSCs) es fundamental para obtener células pluripotentes (PSC) para su aplicación en medicina regenerativa y la investigación de enfermedades en el campo de la cirugía ortopédica. Aunque los protocolos de inducción para MYO y SCL de PSCs se han divulgado previamente por varios investigadores, ningún estudio todavía ha demostrado la inducción de la síntesis y la D de iPSCs. Por lo tanto, inducción eficiente de SMs completamente competentes sigue siendo un desafío importante. Aquí, nos recapitular patrones humanos de SM con iPSCs humano in vitro imitando el entorno señalización durante el desarrollo de SM de pollo y ratón e Informe sobre métodos de inducción sistemática de SM derivados (MYO, SCL, D y SYN) iPSCs humano bajo químicamente condiciones definidas a través de los Estados de SM y mesoderm presomitic (PSM). Conocimiento sobre el desarrollo de SM de chick y el ratón fue aplicado con éxito a la inducción de SMs con iPSCs humana. Este método podría ser una herramienta novedosa para estudiar somitogenesis humana y patrones sin el uso de embriones y para terapia basada en células y modelos de enfermedad.
Introducción
Desarrollo de un método de diferenciación dirigida para un tipo de célula deseada del PSC es un paso necesario para convertir el estudio de las células derivadas de PSC en aplicaciones clínicas. Forzada expresión de genes clave es una estrategia prometedora para la diferenciación de células del órgano del PSC y ha mejorado nuestra comprensión de la regulación genética de la determinación de destino celular, morfogénesis órgano y organización durante la embriogénesis1. Además, recapitulando los ambientes señalización endógenos, mediante el desarrollo de embriones de ratón y pollo como hoja de ruta, se considera esencial para la diferenciación dirigida de PSCs. Sin embargo, dada la aplicación de las células derivadas de PSC en estudios clínicos como terapias celulares, la última estrategia es más conveniente porque no requiere la manipulación de genes.
Varios estudios han reportado la inducción del mesodermo de humano y ratón PSCs en químicamente definición condiciones. Por lo general, estos métodos han dependido de activina/nodal/transformación de factor de crecimiento β (TGFβ) señalización y hueso proteínas morfogenéticas (BMP) de señalización, se cree para llevar a cabo la diferenciación meso-endodermo y mesodermo, dando por resultado una eficacia baja inducción de el paraxial mesodermo (aproximadamente 20%)2. En otras palabras, el mesodermo derivado PSC inducido por estas vías de señalización fue principalmente mesoderm lateral de la placa y no paraxial mesodermo. Recientemente, algunos estudios han demostrado la producción eficiente de mesodermo paraxial PSC derivados basado en diferentes estrategias3,4,5,6,7,8 . En estos estudios, PSC fueron cultivada con concentraciones relativamente altas de cinasa de glicógeno sintasa 3 (GSK3) inhibidores (activadores de señalización de WNT), por lo tanto la eficacia de la inducción del mesodermo paraxial alcanzó el 70%-95%6,7 .
En somitogenesis, el mesodermo paraxial primero forma el mesoderm presomitic (PSM) posteriorly y luego somitas (SMs) en la parte anterior a través de mesénquima en epitelio de transición9,10. Ligando de Notch 1 Delta-like (DLL1) se sabe que tienen un papel fundamental durante la somitogenesis, como control oscilatorio de DLL1 expresión, tanto en nivel de mRNA y proteína, regula segmentación de SM. SMs tiempo subdividen en dos partes, dando lugar al dermomyotome (DM) dorsalmente y sclerotome (SCL) ventralmente11. Posteriormente, la DM se distingue en el dermatome (D), un precursor de la dermis y miotoma (MYO), un precursor del músculo esquelético; Además, una porción ventral del SCL forma syndetome (SYN), un precursor de los tendones y los ligamentos12 (figura 1). Algunos investigadores han reportado la inducción de derivados derivados del PSC SM como MYO4,13 y14de la SCL; sin embargo, existen varias limitaciones en estos estudios. En particular, puesto que nuestro conocimiento de los entornos de señalización de D y SYN es fragmentario, protocolos de inducción para D y SYN no todavía se han sistemáticamente establecidos. Para demostrar la competencia completa de SMs inducida del PSC, es esencial para demostrar la diferenciación múltiple capacidad de SMs inducidos en todos los cuatro derivados (D, MYO, SCL y SYN), mientras que estudios previos se han centrado sólo en específicos derivados de SM. Aquí, Divulgamos sobre cómo generar todos los cuatro derivados SM, incluyendo D y SYN, a través de PSM y SM sinos de iPSCs humana15. Creemos que establecer un método progresivo in vitro modelos el proceso de desarrollo de SM podría contribuir al estudio de SM como humano se desarrolla durante la embriogénesis, sin usar embriones.
Protocolo
Todos los protocolos experimentales que implican iPSCs humana fueron aprobados por el Comité de ética del Departamento de medicina y postgrado Facultad de medicina, Universidad de Kyoto.
1. humano iPSCs preparación antes de la inducción
Nota: Cultura humana iPSCs (201B7-PAX3-GFP) en el alimentador SNL de las células16 con primates ES celular suplementado con 4 ng/mL del factor de crecimiento del fibroblasto básico humano recombinante (FGF2) y 0.5% penicilina y estreptomicina (en adelante referido como medio de hESC, ver Tabla 1). Cuando alcanza la proporción de la confluencia de 70% – 80%, paso las células como se describió anteriormente17.
-
Pases de iPSCs humano en SNL alimentador células17
- Para pases, añadir PBS en el plato de cultivo de células y enjuague las células. Luego, retire el PBS (en adelante, este proceso hará referencia a como lavado con PBS).
- Añadir 1 mL de solución CTK (ver tabla 1) a temperatura ambiente (RT) y espere hasta que las células de alimentador SNL empezar a extraer desde el fondo del plato.
- Retirar la solución CTK y lavar dos veces con PBS.
- Añadir 1 mL de medio de hESCs (ver tabla 1) en el plato, luego raspar las células usando un raspador y recoger en un tubo cónico de 15 mL.
- Pipetee suavemente el contenido cinco veces utilizando un 1.000 μl y luego se transfieren a una nueva placa con medio de hESCs. Utilizan una relación de split de 1:4 a 1:10, dependiendo de la relación de confluencia antes de pases. Además, variar el volumen de medio de células dependiendo de la escala del plato (por ejemplo, 3 mL en un plato de 6 cm, 8 mL para un plato de 10 cm).
- Incubar las iPSCs humano a 37 ° C y 5% CO2.
- Cambiar el medio todos los días (excepto el día después de pases) y las células de la cultura hasta el siguiente procedimiento passaging.
-
Alimentador-libre cultivo de iPSCs humana antes de la inducción de PSM
Nota: para minimizar el efecto de factores de crecimiento secretados de las células de alimentador SNL, cultura la iPSCs humana en condiciones libres de alimentador con un medio de cultivo de célula libre de alimentador (ver tabla 1) en las soluciones de la matriz extracelular (ECM) (ver tabla 1) plato recubierto por 3 días antes de la inducción de PSM.- Día -4 (4 días antes de iniciar la inducción del PSM)
- Para preparar el plato cubierto de solución ECM, añadir 4 mL de solución de ECM en un plato de 10 cm a 4 ° C durante la noche.
Nota: Coloque solución ECM en hielo mientras se prepara.
- Para preparar el plato cubierto de solución ECM, añadir 4 mL de solución de ECM en un plato de 10 cm a 4 ° C durante la noche.
- Día -3
- En primer lugar, retirar la solución de ECM desde el plato y añadir 8 mL de medio de cultivo celular libre de alimentador.
- Para iniciar la alimentación libre cultivo, lavar una vez con PBS para enjuagar las células cultivadas.
- Añadir 1 mL de solución CTK a temperatura ambiente hasta las células de alimentador SNL empiezan a separar de la parte inferior del plato.
Nota: Utilice microscopía para confirmar que todas las células del alimentador son desprendidas de la parte inferior. - Retirar la solución CTK y lavar con PBS dos veces, para que todas las células de alimentador SNL se eliminan completamente.
- Añadir 1 mL de medio de cultivo celular libre de alimentador en el plato, luego raspar las células usando un raspador y recoger en un tubo cónico de 15 mL.
- Suavemente pipetear el contenido tres veces utilizando una punta de 1.000 μl y transferir a un nuevo ECM recubierto solución 10 cm plato (preparado en el paso 1.2.1). Utilizan una relación de split de aproximadamente 1:2 1:4, dependiendo de la relación de confluencia antes de cultivo libre de alimentador.
- Incubar las iPSCs humano a 37 ° C y 5% de CO2 durante 3 días, cambiando el medio día -1.
- Día -4 (4 días antes de iniciar la inducción del PSM)
2. PSM diferenciación y aislamiento de células activado por fluorescencia (FACS) de clasificación
-
Diferenciación de PSM (día 0-día 4)
- Aspirar el medio de cultivo de célula libre de alimentador y añadir 8 mL de medio de inducción de PSM (CDM básico suplementado con el μm 10 SB431542, 10 μm CHIR99021, 2 μm DMH1 y 20 ng/mL FGF2, ven tabla 1).
Nota: Confluencia de células en la iniciación de la diferenciación de la PSM es crítico para la eficacia de la inducción. Utilice microscopía para confirmar que la relación confluente es aproximadamente 30%. - Incube las células a 37 ° C, con 5% CO2, durante 4 días, cambiando el medio en el día 3.
- Cosecha de células para la FACS en el día 4 (sección 2.2, a continuación).
- Aspirar el medio de cultivo de célula libre de alimentador y añadir 8 mL de medio de inducción de PSM (CDM básico suplementado con el μm 10 SB431542, 10 μm CHIR99021, 2 μm DMH1 y 20 ng/mL FGF2, ven tabla 1).
-
Aislamiento de células PSM positivo DLL1 por celular activado por fluorescencia (FACS) de clasificación
Nota: a continuación es un procedimiento para la preparación de la célula antes de la FACS clasificación de las células positivas DLL1. Realizar FACS clasificación utilizando un citómetro de flujo, según protocolo del fabricante.- Aspire el medio, luego lavar con PBS. Posteriormente, añadir 1 mL de reactivo de disociación celular y deje durante 3 min a TA.
- Añadir 4 mL de medio basal de CDM, raspar las células usando un raspador y recoger en un tubo cónico de 15 mL.
- Contar el número de células usando un contador de células automatizado, luego centrifugar a 280 x g durante 3 minutos.
- Cuidadosamente Quite el sobrenadante por aspiración y resuspender las células en solución tampón FACS (ver tabla 1) en una concentración de 1.0 x 107 células/mL. Una muestra de control negativo (control de isotipo, o en el Convenio sin anticuerpos), transfiera 50 μL en un tubo cónico de 15 mL y luego suspender con 450 μl de tampón FACS.
- Añadir anticuerpo DLL1 (véase Tabla de materiales) en una proporción de 1/200. Proteger el tubo de la luz y mantener en hielo durante 30 minutos.
- Centrifugar a 280 x g durante 3 minutos.
- Cuidadosamente aspirar el sobrenadante y resuspender en tampón FACS (1.0 x 107 células/mL) suplementado con 1 mg/mL DAPI.
- Transferencia en un tubo de colección, con una malla de nylon de 35 μm en la tapa para el filtrado, luego coloque el tubo en hielo hasta completar la clasificación. Realizar el mismo procedimiento con la muestra control negativa (paso 2.2.4).
- Realizar la clasificación utilizando un citómetro de flujo según protocolo del fabricante.
- Recoger las células positivas de DLL1 ordenadas en un tubo cónico de 15 mL, que contiene 4 mL de medio basal de MDL complementado con el μm 10 de Y27632. Para extracción de RNA total, centrifugar a 280 x g durante 3 min y resuspender en tampón de lisis de RNA y almacenar a-30 ° C. Ver extracción de RNA, transcripción inversa y procedimientos de RT-qPCR (sección 5.1) para obtener información más detallada.
- Realizar la diferenciación de SM utilizando las células clasificadas según el siguiente protocolo (sección 3).
3. SM diferenciación de PSM
-
Diferenciación de SM de las células clasificadas DLL1 positivas PSM (día 4-día 8)
Nota: preparar las placas de 12 pozos recubiertos solución ECM el día antes de la clasificación de FACS. Para preparar una placa de 12 pozos recubiertos solución ECM, añadir 1 mL de solución de ECM en cada pozo a 4 ° C y dejar durante la noche. Mantener la solución de ECM en el hielo mientras se prepara.- Siguiente paso 2.2.10, centrifugar a 280 x g durante 3 minutos.
- Cuidadosamente aspirar el sobrenadante y resuspender en 1 mL de medio de inducción de SM (CDM básico suplementado con el μm 10 SB431542 y 5 μm CHIR99021, ver tabla 1).
- Contar el número de células usando un contador de células automatizado.
- Células en cada pozo de las ECM solución-12 bien las placas revestidas que contiene 1 mL de SM inducción suplementado con 10 μm de Y27632 en semillas 1.0 x 105 .
- Incubar a 37 ° C con 5% CO2 4 días hasta el día 8. Cambiar el medio de no con Y27632 en día 5 (el día después de su clasificación de FACS) y 7 días.
- Realizar la diferenciación de derivados de SM utilizando células inducidas de SM según los protocolos más abajo. Para la extracción de RNA total de células inducidas de SM, recoger las células en un tubo cónico de 15 mL y centrifugar a 280 x g durante 3 min, luego resuspender en tampón de lisis de RNA y almacenar a-30 ° C.
4. SM derivados (DM MYO D, SCL, SYN) diferenciación de SM
Nota: Para demostrar la competencia completa de células de SM, cabo primero DM (dermomyotome) y SCL (sclerotome) inducción del parto por consiguiente las células derivadas de iPSC de SM. Posteriormente, MYO (miotoma) y D (dermatome) inducción de parto que las células de DM y realizar inducción de SYN (syndetome) usando las células SCL. A continuación se presentan los protocolos para la inducción de cada derivado (DM, MYO, D, SCL y SYN) células SM inducidas in vitro.
-
DM la diferenciación de las células de SM (día 8-día 11)
- Aspire el medio, a continuación, añadir 1 mL de medio de inducción de DM (CDM básico suplementado con 5 μm CHIR99021 y 10 ng/mL BMP4, ver tabla 1).
- Incube las células a 37 ° C, con 5% CO2, por 3 días hasta el día 11. Cambiar el medio en el día 10 (día 2 de DM inducción).
- Realizar MYO y D diferenciación usando inducida por células de DM según los protocolos más abajo.
-
Diferenciación de MYO de DM células (día 11 – día 41)
- Aspire el medio, a continuación, añadir 1 mL de medio de inducción de MYO (CDM básico suplementado con 5 μm CHIR99021, ver tabla 1).
- Incube las células a 37 ° C, con 5% CO2, durante 30 días hasta 41 días. Cambiar el medio cada 3 días.
-
Diferenciación de D de las células de la DM (día 11 – día 20)
- Aspire el medio, a continuación, añadir 1 mL de medio de inducción D (CDM básico suplementado con 5 μm CHIR99021 y 10 ng/mL BMP4, ver tabla 1).
- Incubar las células a 37 ° C, con 5% CO2, 9 días hasta el día 20. Cambiar el medio cada 3 días.
-
Diferenciación de las células de SM (día 8-día 11) SCL
- Aspire el medio, a continuación, añadir 1 mL de medio de inducción de SCL (CDM básico suplementado con 100 nM SAG y 0,6 μm LDN193189, ver tabla 1)14.
- Incube las células a 37 ° C, con 5% CO2, por 3 días. Cambiar el medio en 10 días (inducción del día 2 de SCL).
- Realizar la diferenciación de SYN utilizando células SCL inducidas según el protocolo siguiente.
-
Diferenciación de la síntesis de células SCL (día 11 – día 32)
Nota: preparar las placas de 24 pocillos recubiertos solución ECM el día antes de iniciar la inducción de la síntesis. Para preparar una placa de 24 pocillos recubiertos solución de ECM, Añadir 0,5 mL de solución de ECM en cada pozo a 4 ° C y dejar durante la noche. Mantener la solución de ECM en el hielo mientras se prepara.- Aspirar el medio de lavar con PBS, luego agregar 0,2 mL del reactivo de la disociación de células a cada pozo y dejar durante 3 min a TA.
- Agregar 0,8 mL de medio basal de MDL a cada pozo y luego raspar y recoger todas las células en un tubo cónico de 15 mL.
- Centrifugar a 280 x g durante 3 minutos.
- Cuidadosamente aspirar el sobrenadante y resuspender en 1 mL de medio de inducción de SYN-1 (CDM básico suplementado con 20 ng/mL FGF8, ver tabla 1), luego contar el número de células usando un contador de células automatizado.
- 4 células de semilla 5.0 x 10 en cada pocillo de las ECM solución-24-bien las placas revestidas que contiene 1 mL de medio de inducción de SYN-1.
- Incubar a 37 ° C, con 5% CO2, por 3 días.
- El día 14 (inducción de 3 día de SYN), sustituir el medio con SYN inducción medio-2 (CDM básico suplementado con BMP7 de 10 ng/mL y 10 ng/mL TGFβ3, ver tabla 1).
- Incubar a 37 ° C, con 5% CO2, durante 18 días hasta el día 32. Cambiar el medio cada 3 días.
5. Caracterización de productos derivados de iPSC
Nota: En diferenciación, caracterizar iPSCs humano derivados mediante PCR cuantitativa en tiempo real (RT-qPCR), inmunocitoquímica (ICC), análisis enzima-ligado del inmunosorbente (ELISA) y pruebas de estímulo de estiramiento mecánico, por consiguiente.
-
Células, extracción de RNA total, reversa de la transcripción y análisis en tiempo real cuantitativo de la polimerización en cadena (RT-qPCR)
- Recolectar las muestras de la célula (procedimientos 2.2.10, 3.1.6, 5.4.3) en un tubo de 1.5 mL y centrifugar a 280 x g durante 3 minutos.
- Quite el sobrenadante y resuspender en 350 μl de tampón de lisis de RNA, proporcionada por un kit de extracción de RNA total adecuado.
- Extracto de RNA total mediante el kit según protocolo del fabricante.
- Reversa transcribir el aislado 1 μg de ARN a ADNc, según protocolo del fabricante.
- Realizar RT-qPCR utilizando enzimas adecuadas, reactivos y cartillas según protocolo del fabricante. Las secuencias de la cartilla utilizadas en este estudio se enumeran en la tabla 2.
-
Inmunocitoquímica (ICC)
- Antes de realizar la inmunocitoquímica con anticuerpos, fijar las células con paraformaldehido de 2% a 4 ° C por 10 min y lavar dos veces con PBS.
- Para permeabilización, incubar con metanol de 0.2% o 0.2% polisorbato 20/PBS (en lo sucesivo, PBS-T) a 4 ° C por 15 minutos.
- Eliminar los reactivos de permeabilización y tratar las células con un adecuado bloqueo buffer o 1% bovinos albúmina sérica/PBS a 4 ° C durante 60 min.
- Añadir el primer anticuerpo diluido con solución amortiguadora de bloqueo 10% en PBS-T y coloque en una máquina de agitación a 4 ° C durante la noche.
- Lavar tres veces con PBS-T (Añadir PBS-T y coloque en la máquina agitación a temperatura ambiente durante 10 min).
- Añade el segundo anticuerpo, diluido con solución amortiguadora de bloqueo 10% en PBS-T y lugar en la máquina agitación a temperatura ambiente durante 60 minutos. Los anticuerpos primeros y segundo para ICC utilizados en este estudio se enumeran en la tabla 3.
Nota: De este paso adelante, envolviéndolo en papel de aluminio para proteger el plato/placa de la luz. - Lavar dos veces con PBS-T.
- Para la tinción de contador, añadir 1/5000 DAPI diluido con PBS y lugar en la máquina agitación a temperatura ambiente durante 5 minutos.
- Retirar la solución DAPI y añadir PBS en cada pocillo.
- Observar la tinción de células usando un microscopio de fluorescencia. Alternativamente, guarde el plato/placa a 4 ° C durante 1 mes.
-
Análisis del inmunosorbente ligado a enzimas (ELISA) para el análisis funcional de iPSC derivado D
Nota: las células de fibroblastos dérmicos humanos (HDF) están disponibles en el mercado. Cultura HDF en DMEM suplementado con suero bovino fetal 10% (ver tabla 1).- Semillas 1.0 x 105 células iPSC derivados D y HDF en placas de 24 pocillos que contienen 1 mL de cada medio de cultivo (medio de inducción D D:, HDF: DMEM suplementado con suero bovino fetal 10%).
- Después de 3 días de cultivo celular, recoger 100 μl de cada medio, coloque en un tubo de 1,5 mL y almacenar a 4 ° C.
- Realizar la serie de procedimientos, tales como la adición de la detección de anticuerpos y secundario, según las instrucciones del fabricante y cuantificar el número de objetivos, generando una curva estándar frente a la concentración del control muestras del analito.
-
Análisis de estímulo de estiramiento mecánico para el análisis funcional de síntesis derivados de iPSC
Nota: tenocytes humanos adulto están disponible comercialmente (véase Tabla de materiales). Cultura humana deriva de iPSC SYN y tenocytes humana adulta en una célula que dispositivo para el ensayo de estímulo estiramiento mecánico como se describe abajo18,19. Medio uso SYN inducción media 2 y tenocytes crecimiento (véase Tabla de materiales) como medio de cultivo para cada derivado de iPSC SYN y tenocytes humano adulto, respectivamente.- A las 24 h antes de estirar, cámaras de placa de 1.0 x 105 células de síntesis derivados de iPSC y tenocytes humana en el caucho del silicio de pozo tipo multi recubierto solución ECM, cada uno con una superficie de cultivo de 1,5 cm x 1,5 cm (véase Tabla de materiales).
- Configurar las cámaras en el dispositivo para el estiramiento de la célula y fuerza de tensión cíclica monoaxiales (0.5 Hz, 5%) para 12 h.
- Para la extracción de RNA total, agregue 350 μl de tampón de lisis de RNA, luego raspar y recoger las células en un tubo de 1,5 mL para la extracción de RNA total y posterior análisis de RT-qPCR (véase procedimiento 5.1).
Resultados
Todas las figuras en este informe se obtuvieron con iPSCs 201B7-PAX3-GFP, en la que un alelo de la secuencia de codificación de PAX3 en el exón 1 reemplaza a EGFP. Establecimiento de 201B7-PAX3-GFP iPSCs será descrito en otra parte (H. Sakurai, comunicación personal). La significación estadística se evaluó mediante el software estadístico. Los valores de P inferiores a 0,05 se consideraron significativos.
Caracterización de derivados de iPSC PSM y SM células humanas
Para evaluar la diferenciación de iPSCs humana hacia la SM a través del estado PSM (figura 2A), análisis FACS, se realizaron análisis de ICC y RT-qPCR. Como se muestra en la figura 2B, más 85% de las células eran positivo para DLL1, un marcador del PSM, pero negativa para PAX3, un marcador del SM, después de 4 días de inducción PSM con iPSCs humana. Posteriormente, esta población se convirtió en PAX3 células positivas de SM después de 4 días de inducción de SM. La transición del PSM SM también fue confirmada por RT-qPCR (Figura 2D) y ICC (figura 2). TBX6, MSGN1 y WNT3A, marcadores PSM fueron expresados en el estado PSM (día 4), pero no expresados en el estado de SM (día 8). PARAXIS, MEOX1 y PAX3, marcadores de SM, se expresó en SM, pero no expresado en el PSM. Además, sólo manchas de CDH11, un marcador de SM epithelialized, acumularon en la ensambladura de la célula, después de la adición de SB431542 con CHIR99021 (Figura 2E).
Caracterización de derivados de SM inducida de células derivadas de iPSC humanas de SM
Para evaluar la potencia de diferenciación de SM humano derivados de iPSC, diferenciación hacia DM, MYO D, SCL y SYN (Figura 3A) se evaluó por análisis del ICC y PAX3 (GFP)-fluorescencia. Como se muestra en la figura 3B, diferenciación de DM fue confirmada por ALX4 y EN1 tinción y PAX3 (GFP)-fluorescencia; Diferenciación de MYO fue confirmada por MYOD, MYOG y miosina cadena pesada (MHC) de tinción; D diferenciación fue confirmada por EN1 y PDGFRa tinción. SCL la diferenciación fue confirmada por PAX1, PAX9 y NKX3.2 tinción. y SYN diferenciación fue confirmada por SCX, MKX, COL1A1 y COL1A2 tinción.
Caracterización de inducido D y SYN
1. Análisis de enzima-ligado del inmunosorbente (ELISA) para el análisis funcional de iPSC derivado D
En el cuerpo humano, una de las principales funciones de los fibroblastos dérmicos es secretan proteínas de matriz extracelular (MEC), como el colágeno y ácido hialurónico que hidrata la piel y ayudar a mantener la estructura de la piel. Para demostrar que una cantidad comparable de proteínas de colágeno de tipo 1 y el ácido hialurónico se secretan en el medio de cultivo de iPSC-D y HDF, ELISA se realizó, como se muestra en la Figura 4A.
2. mecánica del estiramiento ensayo de estimulación para el análisis funcional de síntesis derivados de iPSC
Como ya han reportado varios estudios, estimulación mecánica afecta tendón desarrollo antes y después del nacimiento y promueve la diferenciación de los tenocytes del precursor células18,19. Por lo tanto, es bien sabido que la reactividad al estrés mecánico es una de las características de los tenocytes. Para demostrar la reactividad comparable de SYN humano derivado de iPSC y tenocytes adulto humano, se realizó un análisis de estímulo de estiramiento mecánico como se muestra en la Figura 4B.
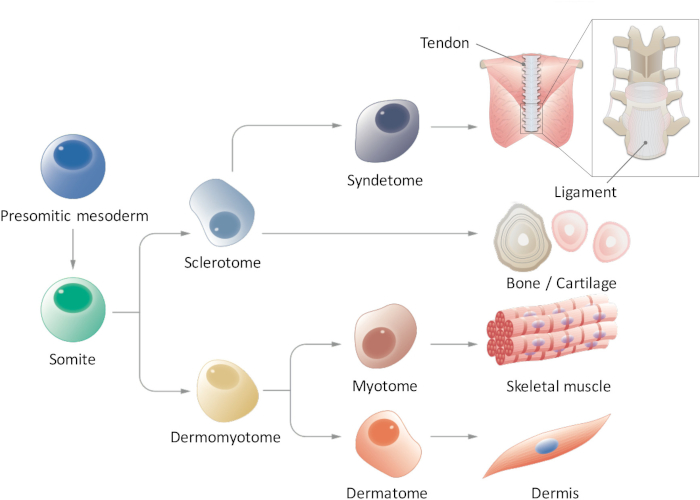
Figura 1: vista esquemática de la diferenciación jerárquica de mesodermo paraxial. Mesoderm presomitic es una población celular que transitoriamente emerge durante la embriogénesis temprana y sufre segmentación en a somitas forma. Somitas son una población transitoria de células que da lugar a múltiples tipos celulares, como células sclerotome, dermomyotome, syndetome, dermatoma y miotoma, que finalmente se diferencian en la dermis, tendón/ligamento, hueso/cartílago y músculo esquelético células. Haga clic aquí para ver una versión más grande de esta figura.
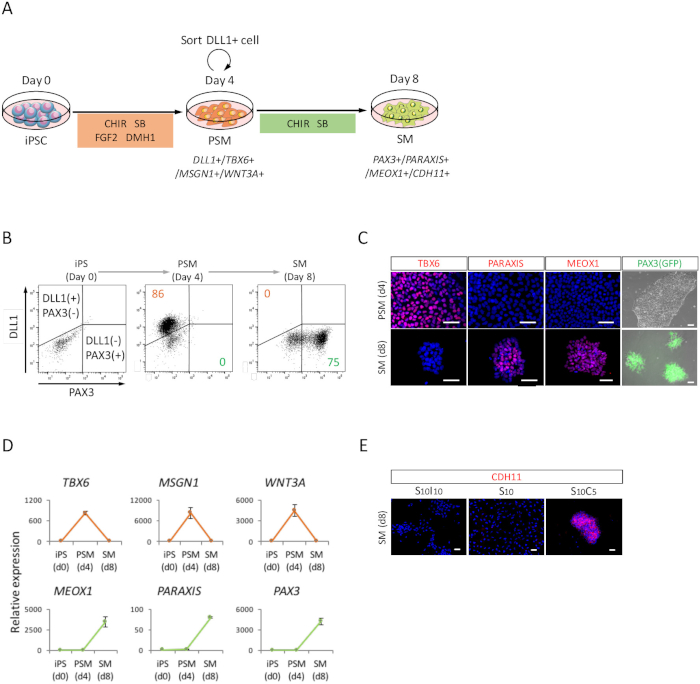
Figura 2: análisis FACS, RT-qPCR y ICC de PSM humano derivado de iPSC y SM (A) vista esquemática de un protocolo para la diferenciación de la SM a través de PSM. (B) trama de punto representativo de tinción DLL1 y PAX3 (GFP)-fluorescencia en 4 de inducción de PSM y día 4 (día 8 de iPSC) de inducción de SM. (C) representante immunocytochemical imágenes y PAX3 (GFP)-fluorescencia en 4 de inducción de PSM y día 4 (día 8 de iPSC) de inducción de SM. Las células se tiñeron con anti-TBX6, PARAXIS y MEOX1 (rojo) los anticuerpos detectados con PAX3 (GFP) y co teñido con DAPI (azul)-fluorescencia (verde). (D) análisis de RT-qPCR de marcadores de PSM y SM en iPSC, PSM y SM. Se muestran lo medios ± error de estándar (S.E.) de tres series de experimentos. (E) representante immunocytochemical imágenes el día 4 (día 8 de iPSC) de SM, cultivado en S10I10 (combinación de SB431542 y IWR1, un inhibidor de la WNT de señalización), S10 (SB431542) y S10C5 condiciones (combinación de SB431542 y CHIR99021). Las células fueron teñidas con anticuerpos anti-CDH11 (rojo) y co teñidas con DAPI (azul). iPS, células pluripotentes inducidas; PSM, mesoderm presomitic; SM, somite; S10, SB431542 10 ΜM; C5, CHIR99021 5 ΜM; I10, IWR1 10 ΜM; Barras de escala = 50 μm. Esta figura ha sido modificada de Nakajima et al., (2018)15. Haga clic aquí para ver una versión más grande de esta figura.
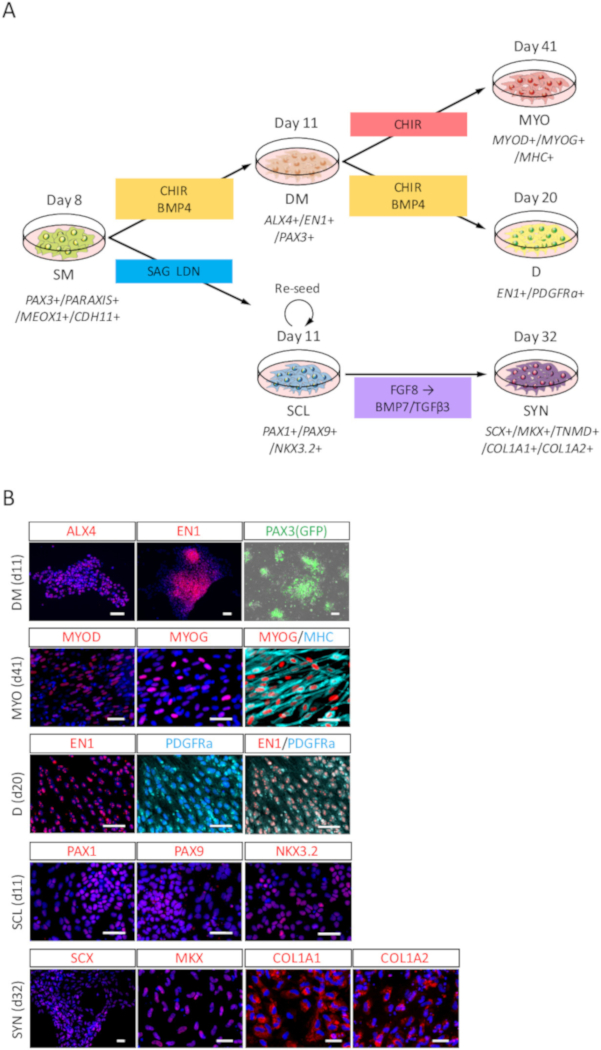
Figura 3: análisis del ICC de DM, MYO D, SCL y SYN distinguen de humano derivado de iPSC SM (A) vista esquemática de los protocolos de diferenciación derivados de SM. (B) representante immunocytochemical imágenes y PAX3 (GFP)-fluorescencia en día 3 (día 11 de iPSC) de inducción de DM, día 30 (día 41 de iPSC) de inducción de MYO, día 9 (día 20 de iPSC) de inducción D, día 3 (día 11 de iPSC) de inducción de SCL y día 21 (día 32 de iPSC) de inducción de la síntesis. DM, las células teñidas con anti-ALX4 y EN1 anticuerpos (rojo) y co teñidas con DAPI (azul) o detectadas con PAX3 (GFP)-fluorescencia (verde); MYO, las células se tiñeron con anti-MYOD, MYOG (rojo) y anticuerpos de MHC (cian), también co teñidos con DAPI (azul); D, las células teñidas con anti-EN1 (rojo) y los anticuerpos de PDGFRa (cyan) y co teñidas con DAPI (azul); SCL, las células fueron teñidas con anti-PAX1, PAX9 y NKX3.2 anticuerpos (rojo) y co teñido con DAPI (azul); SYN, las células fueron teñidas con anti-SCX, MKX, COL1A1 y COL1A2 anticuerpos (rojo) y co teñido con DAPI (azul). DM, dermomyotome; MYO, miotoma; D, dermatoma; SCL, sclerotome; SYN, syndetome; Barras de escala = 50 μm. Esta figura ha sido modificada de Nakajima et al., (2018)15. Haga clic aquí para ver una versión más grande de esta figura.
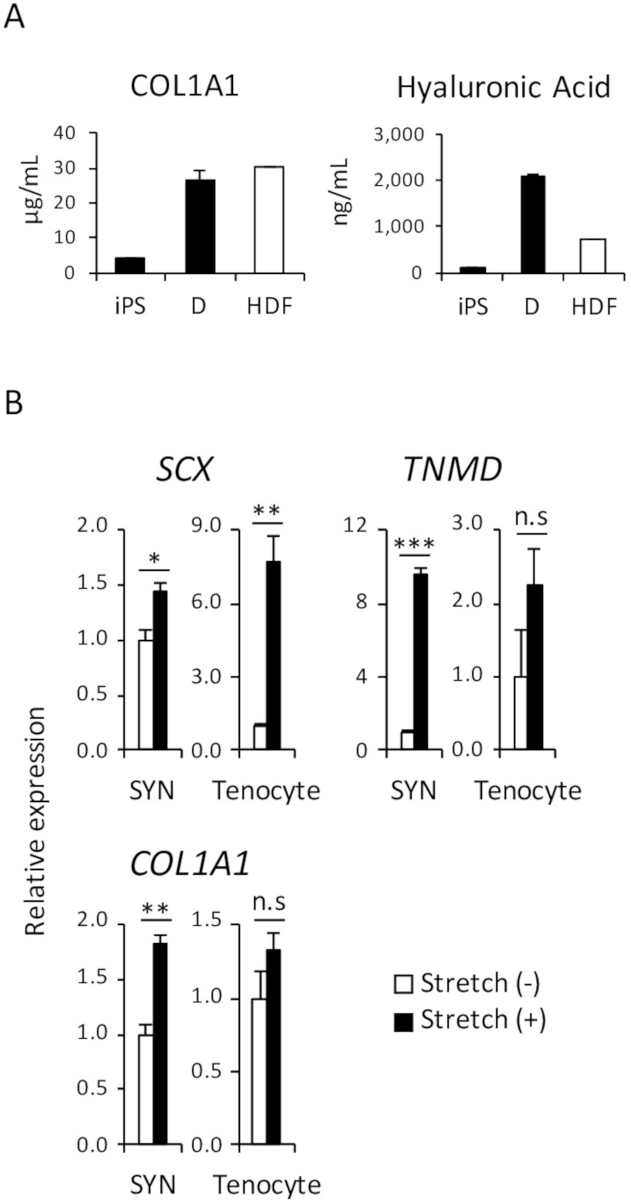
Figura 4: análisis funcional de inducido D y SYN. (A) la cantidad de colágeno tipo 1 e hialurónico ácido las proteínas en el medio de cultivo se analizaron por ELISA. (B) el efecto del estiramiento mecánico estimulación inducida SYN y tenocytes adulto humano fue evaluada por RT-qPCR. Se muestran lo medios ± error de estándar (S.E.) de tres series de experimentos. * p < 0.05; ** p < 0.01; p < 0.001 por comparaciones t-prueba múltiple de Dunnett en comparación con el tramo (-); NS, no significativo, HDF, fibroblastos dérmicos adultos humanos. Esta figura ha sido modificada de Nakajima et al., (2018)15. Haga clic aquí para ver una versión más grande de esta figura.
| Medio de solución | Reagant | Concentración |
| Medio basal de MDL | Iscove modificado F12 medio/Ham de Dulbecco | 1:1 |
| Penicilina/estreptomicina | 0.5% | |
| Químicamente definido concentrado de lípidos | 1% | |
| APO-transferrina | 15 mg/mL | |
| Monothioglycerol | 450 mM | |
| Albúmina de suero bovino | 5 mg/mL | |
| Insulina | 7 mg/mL | |
| Solución CTK | Agua | - |
| Tripsina | 0.25% | |
| Colagenasa IV | 0,1 mg/mL | |
| Cloruro de calcio | 1 mM | |
| Golpe de gracia SR | 20% | |
| Medio de inducción de D | Medio basal de MDL | - |
| CHIR99021 | 5 ΜM | |
| BMP4 | 10 ng/mL | |
| Medio de inducción de DM | Medio basal de MDL | - |
| CHIR99021 | 5 ΜM | |
| BMP4 | 10 ng/mL | |
| Solución de ECM | Matriz extracelular artificial | 0,3 mg/mL |
| DMEM/F12 | - | |
| Tampón FACS | PBS | - |
| Albúmina de suero bovino | 0.1% | |
| Medio de cultivo celular libre de alimentador | mTeSR1 | - |
| Penicilina/estreptomicina | 0.5% | |
| Medio de cultivo HDF | DMEM | - |
| Suero bovino fetal | 10% | |
| medio de hESC | Medio de primate ES celular | - |
| Penicilina/estreptomicina | 0.5% | |
| FGF2 | 4 ng/mL | |
| Medio de inducción de MYO | Medio basal de MDL | - |
| CHIR99021 | 5 ΜM | |
| Medio de inducción de PSM | Medio basal de MDL | - |
| SB431542 | 10 ΜM | |
| CHIR99021 | 10 ΜM | |
| DMH1 | 2 ΜM | |
| FGF2 | 20 ng/mL | |
| Medio de inducción de SCL | Medio basal de MDL | - |
| SAG | 100 nM | |
| LDN193189 | 0,6 ΜM | |
| Medio de inducción de SM | Medio basal de MDL | - |
| SB431542 | 10 ΜM | |
| CHIR99021 | 5 ΜM | |
| Medio de inducción de SYN-1 | Medio basal de MDL | - |
| FGF8 | 20 ng/mL | |
| Medio de inducción de SYN-2 | Medio basal de MDL | - |
| BMP7 | 10 ng/mL | |
| TGFΒ3 | 10 ng/mL |
Tabla 1: Recetas de solución y los medios de comunicación.
| NOMBRE | Hacia adelante | Marcha atrás |
| ACTB | CACCATTGGCAATGAGCGGTTC | AGGTCTTTGCGGATGTCCACGT |
| COL1A1 | GGACACAGAGGTTTCAGTGGT | GCACCATCATTTCCACGAGC |
| MEOX1 | GAGATTGCGGTAAACCTGGA | GAACTTGGAGAGGCTGTGGA |
| MSGN1 | GGAGAAGCTCAGGATGAGGA | GTCTGTGAGTTCCCCGATGT |
| PARAXIS | TCCTGGAGAGCTGTGAGGAT | CACACCCTGTCACCAACAGT |
| PAX3 | AGGAAGGAGGCAGAGGAAAG | CAGCTGTTCTGCTGTGAAGG |
| SCX | CCCAAACAGATCTGCACCTTC | GCGAATCGCTGTCTTTCTGTC |
| TBX6 | AGCCTGTGTCTTTCCATCGT | AGGCTGTCACGGAGATGAAT |
| TNMD | CCCTTCATGCTGAAGCCACTT | CTCACTTTCAGCAGAATTGGGG |
| WNT3A | CAAGATTGGCATCCAGGAGT | ATGAGCGTGTCACTGCAAAG |
Tabla 2: Secuencias de la cartilla para el análisis de RT-qPCR.
| Concentración | ||
| 1 º Anticuerpo | ALX4_Goat | 1/50 |
| CDH11_Mouse | 1/1000 | |
| COL1A1_Rabbit | 1/100 | |
| COL2A1_Mouse | 1-2 μg/mL | |
| EN1_Rabbit | 1/50 | |
| MEOX1_Rabbit | 1/50 | |
| MHC_Rabbit | 1/200 | |
| MKX_Rabbit | 1/50 | |
| MYOD_Rabbit | 1/500 | |
| MYOG_Mouse | 1/400 | |
| NKX3.2_Rabbit | 1/50 | |
| PARAXIS_Rabbit | 1/50 | |
| PAX1_Rabbit | 1/50 | |
| PAX9_Rabbit | 1/50 | |
| PDGFRa_Goat | 1/100 | |
| SCX_Rabbit | 1/50 | |
| TBX6_Goat | 1/50 | |
| 2 º Anticuerpo | Burro anti antibody555 secundario IgG(H+L) de cabra | 1/500 |
| Burro anti antibody647 secundario IgG(H+L) de cabra | 1/500 | |
| Cabra anti ratón IgG(H+L) secundaria antibody555 | 1/500 | |
| Cabra anti conejo IgG(H+L) secundaria antibody555 | 1/500 | |
| Cabra anti conejo IgG(H+L) secundaria antibody647 | 1/500 |
Tabla 3: Primer y segundo anticuerpos para ICC.
Discusión
Un método bien conocido para la inducción de SM derivados del CPS a través de PSM es la combinación de CHIR99021 + A83-01 (inhibidor de TGFβ) durante la inducción del PSM de PSC, pero no durante el PSM maduración proceso6. En el presente estudio, señalización WNT/beta-catenina se inhibió con C59 para inducir SM de PSM. Sin embargo, introdujo el uso de CHIR99021 para activar la vía de WNT durante la diferenciación de SM. Esta decisión fue hecha basada en el hallazgo que WNTs varios son expresados en los tejidos circundantes de SM y dados el hecho de que reporteros WNT son activos en SM20. Como resultado, observamos epitelización, una característica del SM en vivo, sólo bajo la condición de CHIR99021, basado en la acumulación de CDH11 en ensambladuras de la célula (Figura 2E). Esta observación indica que la implicación crítica de WNT de señalización durante la diferenciación de PSM y epitelización del SM, por lo tanto que nuestro protocolo mejor puede recapitular el ambiente señalización endógeno. Sin embargo, también implica otra posibilidad de ajuste fino de la WNT/beta-catenina vía de señalización durante la diferenciación, debido a robustez y eficiencia de la diferenciación pueden variar significativamente dependiendo de los tipos de células, líneas celulares y varios compuestos químicos de la WNT-inductores utilizados por cada investigador.
Este método también nos permite generar los cuatro SM derivados, MYO, D, SCL y SYN, de iPSCs humana. Nuestros protocolos paso a paso utilizando el MDL pueden ser utilizados para identificar los requisitos de señalización durante el somitogenesis humano/somite patrones y proporcionan penetraciones importantes en desarrollo humano de la SM. Por ejemplo, nuestros métodos podrían ser útiles para el estudio de mecanismos de reloj de segmentación, un sistema de oscilación molecular que regula la formación de SM. Ha sido bien investigado en ratones, pollos y peces cebra, pero no en seres humanos debido a la falta de herramientas experimentales apropiadas.
Además, nuestro método puede ser aplicable a futuro clínicas terapias basadas en células. Por ejemplo, humano D derivados de iPSC o SYN puede trasplantarse en piel severamente dañada o roto los tendones para la regeneración y tratamiento. Sin embargo, varias limitaciones deben ser resueltos antes de que este método puede ser aplicado prácticamente. Aunque en el presente estudio, se utilizaron células de alimentador SNL para iPSC mantenimiento y solución de ECM, que se extrae de lo sarcoma de ratón de Engelbreth-Holm-Swarm, como una capa superficial sobre el plato durante la inducción, estos reactivos derivados de animales no humanos deben ser eliminado para mejorar la calidad clínica. Además, celular cantidad y calidad, que incluye la pureza y la maduración de las células deseadas, deben también ser mejorados. Además, no sólo el número de células, sino también la fuerza de la célula es una característica importante para la regeneración del tendón/ligamento. Además, el desarrollo de marcadores de superficie para la purificación y un nuevo método para la reconstitución 3D son indispensables para avanzar en nuestros protocolos clínicos terapias basadas en células.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer Dr. Junya Toguchida (CiRA) por su ayuda con la administración de proyectos y financiación de la adquisición, Sr. Mitsuaki Shibata (CiRA) y Sra. Mei Terashima (CiRA) para la asistencia técnica, el Dr. Yayoi Toyooka (CiRA) y el Dr. Daisuke Kamiya (CiRA) su revisión del manuscrito y el Sr. Masaya Todani (CiRA) para proporcionar una ilustración (figura 1). También agradecemos a todos los miembros de los laboratorios de Ikeya y Toguchida (CiRA) por su apoyo durante este estudio. Este trabajo fue financiado por subvenciones para la investigación científica de la sociedad japonesa para la promoción de la ciencia (JSP) (26670661), el programa de células iPS de insuperable enfermedades investigación utilizando enfermedades específicas de la japonesa de ciencia y tecnología Agencia (JST) y la Agencia de Japón para investigación médica y desarrollo (AMED), el centro de la base para la investigación de células iPS de la red de centros de investigación para la realización de la medicina regenerativa (JST/AMED) y las iPS del fondo de investigación de la célula (en parte a Makoto Ikeya y Junya Toguchida). Makoto Ikeya también fue apoyado por subvenciones para la investigación científica (JSP) (16H 05447) y el programa de aceleración para la investigación de enfermedades utilizando células iPS de enfermedades específicas (AMED).
Materiales
| Name | Company | Catalog Number | Comments |
| ALX4_Goat antibody | Santacruz | sc-22066 | |
| Apo-transferrin | Sigma | T1147 | |
| BMP4 | R&D | 314-BP-010 | |
| BMP7 | R&D | 354-BP-010 | |
| Bovine serum albumin | Sigma | A8806 | |
| Calcium chloride | Nacalai tesque | 067730-15 | |
| CDH11_Mouse antibody | Cell signaling | 13577 | |
| Cell streching device | Strex | STB-140 | |
| Chemically defined lipid concentrate | Gibco | 11905-031 | |
| CHIR99021 | Axon | 1386 | |
| COL1A1_Rabbit antibody | Abcam | ab34710 | |
| COL2A1_Mouse antibody | Thermo scientific | MS-235 | |
| Collagenase IV | Thermofisher | 17104019 | |
| DLL1 APC-conjugated_Mouse antibody | R&D | FAB1818A | For FACS |
| DMEM | Sigma | D6046 | |
| DMEM/F12 | Gibco | 11320-082 | |
| DMH1 | Tocris | 4126 | |
| EN1_Rabbit antibody | Abcam | ab70993 | |
| Fetal bovine serum | Nichirei | 171012 | |
| FGF2 | Wako | 060-04543 | |
| FGF8 | Peprotech | 100-25 | |
| Human dermal fibroblast | Cell applications | 160-05a | |
| Human tenocyte | Angio proteomie | cAP-0041 | |
| Insulin | Wako | 090-06474 | |
| Iscove’s modified Dulbecco’s medium/Ham’s F12 | Gibco | 21056023 | |
| Knockout SR | Gibco | 10828028 | |
| LDN193189 | Axon | 1509 | |
| Matrigel | BD bioscience | 354230 | Artificial extracellular matrix |
| MEOX1_Rabbit antibody | Abcam | ab75895 | |
| MHC_Rabbit antibody | Santacruz | sc-20641 | |
| MKX_Rabbit antibody | Atlas antibodies | A83377 | |
| Monothioglycerol | Sigma | M6145 | |
| mTeSR1 | Stemcell tech | 85850 | |
| Multi well-type silicon rubber chamber | Strex | STB-CH-4W | |
| MYOD_Rabbit antibody | Abcam | ab133627 | |
| MYOG_Mouse antibody | Santacruz | sc-12732 | |
| NKX3.2_Rabbit antibody | Sigma | HPA027564 | |
| Novex Donkey anti Goat IgG(H+L) secondary antibody555 | Invitrogen | A21432 | |
| Novex Donkey anti Goat IgG(H+L) secondary antibody647 | Invitrogen | A21447 | |
| Novex Goat anti Mouse IgG(H+L) secondary antibody555 | Invitrogen | A21422 | |
| Novex Goat anti Rabbit IgG(H+L) secondary antibody555 | Invitrogen | A21428 | |
| Novex Goat anti Rabbit IgG(H+L) secondary antibody647 | Invitrogen | A21245 | |
| PARAXIS_Rabbit antibody | Santacruz | sc-98796 | |
| PAX1_Rabbit antibody | Abcam | ab95227 | |
| PAX9_Rabbit antibody | Gene tex | GTX104454 | |
| PBS | - | - | |
| PDGFRa_Goat | R&D | AF307 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| Primate ES cell medium | Reprocell | RCHEMD001 | |
| SAG | Calbiochem | 566661 | |
| SB431542 | Selleckchem | SEL-S1067-10 | |
| SCX_Rabbit antibody | Abcam | ab58655 | |
| TBX6_Goat antibody | R&D | AF4744 | |
| Tendon cell growth medium | Angio-proteomie | cAP-40 | Tenocytes growth medium |
| TGFβ3 | R&D | 243-B3-200 | |
| Trypsin | Gibco | 15090046 |
Referencias
- Tanaka, A., et al. Efficient and reproducible myogenic differentiation from human iPS cells: prospects for modeling Miyoshi Myopathy in vitro. PLoS One. 8 (4), e61540 (2013).
- Sakurai, H., et al. In vitro modeling of paraxial mesodermal progenitors derived from induced pluripotent stem cells. PLoS One. 7 (10), e47078 (2012).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocl. 11 (10), 1833-1850 (2016).
- Chal, J., et al. Differentiation of pluripotent stem cells to muscle fiber to model Duchenne muscular dystrophy. Nature Biotechnology. 33 (9), 962-969 (2015).
- Umeda, K., et al. Human chondrogenic paraxial mesoderm, directed specification and prospective isolation from pluripotent stem cells. Scientific Reports. 2, 455 (2012).
- Loh, K. M., et al. Mapping the Pairwise Choices Leading from Pluripotency to Human Bone, Heart, and Other Mesoderm Cell Types. Cell. 166 (2), 451-467 (2016).
- Xi, H., et al. In Vivo Human Somitogenesis Guides Somite Development from hPSCs. Cell Reports. 18 (6), 1573-1585 (2017).
- Chal, J., Pourquie, O. Making muscle: skeletal myogenesis in vivo and in vitro. Development. 144 (12), 2104-2122 (2017).
- Tam, P. P., Beddington, R. S. The formation of mesodermal tissues in the mouse embryo during gastrulation and early organogenesis. Development. 99 (1), 109-126 (1987).
- Aulehla, A., Pourquie, O. Signaling gradients during paraxial mesoderm development. Cold Spring Harbor Perspectives in Biology. 2 (2), a000869 (2010).
- Christ, B., Scaal, M. Formation and differentiation of avian somite derivatives. Advances in Experimental Medicine and Biology. 638, 1-41 (2008).
- Brent, A. E., Schweitzer, R., Tabin, C. J. A somitic compartment of tendon progenitors. Cell. 113 (2), 235-248 (2003).
- Sakurai, H., et al. Bidirectional induction toward paraxial mesodermal derivatives from mouse ES cells in chemically defined medium. Stem Cell Research. 3 (2-3), 157-169 (2009).
- Zhao, J., et al. Small molecule-directed specification of sclerotome-like chondroprogenitors and induction of a somitic chondrogenesis program from embryonic stem cells. Development. 141 (20), 3848-3858 (2014).
- Nakajima, T., et al. Modeling human somite development and fibrodysplasia ossificans progressiva with induced pluripotent stem cells. Development. 145 (16), (2018).
- McMahon, A. P., Bradley, A. The Wnt-1 (int-1) proto-oncogene is required for development of a large region of the mouse brain. Cell. 62 (6), 1073-1085 (1990).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Suzuki, H., et al. targeting of the transcription factor Mohawk in rats causes heterotopic ossification of Achilles tendon via failed tenogenesis. Proceedings of the National Academy of Sciences of the United States of America. 113 (28), 7840-7845 (2016).
- Marturano, J. E., Arena, J. D., Schiller, Z. A., Georgakoudi, I., Kuo, C. K. Characterization of mechanical and biochemical properties of developing embryonic tendon. Proceedings of the National Academy of Sciences of the United States of America. 110 (16), 6370-6375 (2013).
- Maretto, S., et al. Mapping Wnt/beta-catenin signaling during mouse development and in colorectal tumors. Proceedings of the National Academy of Sciences of the United States of America. 100 (6), 3299-3304 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados