Method Article
Na geração de Vitro do Somite derivados de humanos induzida por células tronco pluripotentes
Neste Artigo
Resumo
Apresentamos aqui um protocolo para a diferenciação de células-tronco pluripotentes induzidas humanas em cada derivado do somite (Miótomo, sclerotome, dermátomo e syndetome) em condições quimicamente definidas, que tem aplicações em modelagem de doenças futuras e terapias baseadas em células em cirurgia ortopédica.
Resumo
Em resposta a sinais tais como WNTs, comer proteínas morfogenéticas (BMPs) e sonic hedgehog (SHH) secretada de tecidos circundantes, somitas (SMs) dão origem a vários tipos de células, incluindo o Miótomo (MYO), sclerotome (SCL), dermátomo (D) e syndetome (SYN) , que por sua vez desenvolvem em músculo esquelético, esqueleto axial, derme dorsal e axial do tendão/ligamento, respectivamente. Portanto, a geração de SMs e de seus derivados de células-tronco humanas pluripotentes induzidas (iPSCs) é fundamental para obter células-tronco pluripotentes (EPS) para aplicação em medicina regenerativa e para a investigação da doença no campo da cirurgia ortopédica. Embora os protocolos de indução para MYO e SCL de EPS foram anteriormente relatados por vários pesquisadores, nenhum estudo demonstrou ainda a indução de SYN e D de iPSCs. Portanto, indução eficiente de SMs totalmente competentes continua a ser um grande desafio. Aqui, podemos recapitular padronização de SM humana com humano iPSCs in vitro imitando o ambiente de sinalização durante o desenvolvimento de SM garota/rato e relatório sobre os métodos de indução sistemática de derivados de SM (MYO, SCL, D e SYN) de iPSCs humana sob quimicamente condições definidas através do mesoderm presomitic (PSM) e Estados de SM. Conhecimento a respeito de filhote de rato/SM desenvolvimento foi aplicado com êxito para a indução de SMs com iPSCs humano. Esse método pode ser uma nova ferramenta para estudar a somitogenesis humana e padronização sem o uso de embriões e para terapia baseada em células e modelagem de doença.
Introdução
Desenvolver um método de diferenciação direcionado para um tipo de célula desejado do EPS é um passo necessário para traduzir o estudo de PSC-derivado de células para aplicações clínicas. Expressão forçada de genes-chave é uma estratégia promissora para a diferenciação de células-órgão de EPS e melhorou a nossa compreensão do Regulamento genético de determinação do destino de celular, morfogênese de órgão e organização durante a embriogênese1. Além disso, recapitulando os ambientes de sinalização endógenos, usando o desenvolvimento de embriões de rato e pintinho como um roteiro, é considerada essencial para a diferenciação direcionada das EPS. No entanto, dada a aplicação do PSC-derivado de células em estudos clínicos, tais como terapias baseadas em células, a segunda estratégia é mais adequada porque não requer manipulação genética.
Vários estudos têm relatado a indução da mesoderme do humano e do mouse PSCs em condições quimicamente definidas. Normalmente, esses métodos têm confiado na União/nodal/transformar o fator de crescimento β (TGFβ) sinalização e osso Proteína morfogenética (BMP) de sinalização, acredita-se que realizar diferenciação meso-endoderme e mesoderme, resultando em uma eficiência baixa indução de o paraxial mesoderm (aproximadamente 20%)2. Em outras palavras, o PSC-derivados mesoderme induzida por essas vias de sinalização foi principalmente mesoderme lateral da placa e não paraxial mesoderm. Recentemente, alguns estudos têm demonstrado a produção eficiente de mesoderme paraxial PSC-derivado com base em estratégias diferentes3,4,5,6,7,8 . Nestes estudos, EPS foram cultivados com concentrações relativamente altas de quinase de glicogénio sintase 3 (GSK3) inibidores (ativadores de sinalização WNT), consequentemente a eficiência de indução da mesoderme paraxial atingiu 70% – 95%6,7 .
Em somitogenesis, a mesoderme paraxial primeiro forma o mesoderm presomitic (PSM) posteriormente e então forma somitas (SMs) na parte anterior a transição mesênquima-para-epiteliais9,10. Ligante de entalhe Delta-like 1 (DLL1) é conhecido por ter um papel crucial durante a somitogenesis, como controle oscilatório de DLL1 expressão, tanto no nível de mRNA e proteína, regula a segmentação de SM. SMs de eventualmente se subdivide em duas partes, dando origem à dermomyotome (DM) dorsalmente e sclerotome (SCL) ventralmente11. Posteriormente, o DM diferencia no dermátomo (D), um precursor da derme e Miótomo (MYO), um precursor do músculo esquelético; Além disso, uma porção ventral do SCL forma o syndetome (SYN), um precursor de tendões e ligamentos12 (Figura 1). Alguns pesquisadores têm relatado a indução de derivados de PSC-derivado SM como MYO4,13 e SCL14; no entanto, existem várias limitações nestes estudos. Notavelmente, uma vez que nosso conhecimento dos ambientes sinalização de D e SYN é fragmentário, protocolos de indução para D e SYN ainda não foram sistematicamente estabelecidos. Para demonstrar a cheio-competência da SMs induzida de EPS, é essencial para mostrar a diferenciação multi capacidade de SMs induzidas em todos os quatro derivados (D, MYO, SCL e SYN), enquanto estudos anteriores focaram-se apenas a específicos derivados de SM. Aqui, nós relatamos sobre como gerar todos os quatro derivados de SM, incluindo D e SYN, através do PSM e SM fates de iPSCs humana15. Acreditamos que estabelecer um método in vitro gradual que os modelos do processo de desenvolvimento de SM poderia contribuir para o estudo da SM como humano desenvolve-se durante a embriogênese, sem o uso de embriões.
Protocolo
Todos os protocolos experimentais envolvendo humanos iPSCs foram aprovados pelo Comitê de ética do departamento de medicina e pós-graduação faculdade de medicina, Universidade de Kyoto.
1. humana iPSCs preparação antes da indução
Nota: Cultura humana iPSCs (201B7-PAX3-GFP) no alimentador de SNL células16 com suplementado com 4 ng/mL fator de crescimento fibroblástico básico humano recombinante (FGF2) e 0,5% de penicilina e estreptomicina célula Primaz ES (doravante como meio de hESC, consulte A tabela 1). Quando a proporção de confluência atinge 70%-80%, passagem as células como descrito anteriormente,17.
-
Passagem de iPSCs humana no SNL alimentador células17
- Para passagem, adicionar PBS para o prato de cultivo celular e enxágue as células. Em seguida, remover a PBS (daqui por diante, este processo será referido como lavagem com PBS).
- Adicionar 1 mL de solução CTK (ver tabela 1) a temperatura (RT) e espere até que as células de alimentador SNL começam a desanexação da parte inferior do prato.
- Remover a solução CTK e então lave duas vezes com PBS.
- Adicionar 1 mL de meio de hESC (ver tabela 1) para o prato, então raspar as células com uma espátula e coletar em um tubo cônico de 15 mL.
- Pipetar delicadamente o conteúdo cinco vezes com uma ponta de µ l a 1.000 e então transfira para um prato novo, repleto de hESC médio. Use uma relação de divisão de 1:4 para 01:10, dependendo a proporção de confluência antes de passagem. Além disso, varia o volume de meio hESC dependendo da escala do prato (por exemplo, 3 mL para um prato de 6 cm, 8 mL para um prato de 10 cm).
- Incube as iPSCs humano em 37 ° C e 5% de CO2.
- Mudar o médio todos os dias (exceto o dia após a passagem) e cultura de células até o próximo procedimento passaging.
-
Alimentador-livre de cultivo de iPSCs humano antes da indução de PSM
Nota: para minimizar o efeito de fatores de crescimento secretados de células de alimentador SNL, cultura a iPSCs humana sob condições de alimentador-livre com um meio de cultura celular livre de alimentador (ver quadro 1) em soluções de matriz extracelular (ECM) (ver tabela 1) prato revestido por 3 dias antes da indução de PSM.- Dia -4 (4 dias antes do início da indução do PSM)
- Para preparar o prato revestido solução de ECM, adicione 4 mL de solução de ECM sobre um prato de 10 cm a 4 ° C durante a noite.
Nota: Coloque a solução de ECM no gelo enquanto prepara.
- Para preparar o prato revestido solução de ECM, adicione 4 mL de solução de ECM sobre um prato de 10 cm a 4 ° C durante a noite.
- Dia -3
- Primeiro, remova a solução de ECM do prato e adicionar 8 mL de meio de cultura celular livre de alimentador.
- Para iniciar o alimentador-livre cultivo, lave uma vez com PBS para lavar as células cultivadas.
- Adicione 1 mL de solução CTK em RT até as células de alimentador SNL começam a desanexação da parte inferior do prato.
Nota: Utilização de microscopia para confirmar todas as células do alimentador são desanexados do fundo. - Remover a solução CTK e lave com PBS duas vezes, para que todas as células de alimentador SNL são totalmente removidas.
- Adicionar 1 mL de meio de cultura celular alimentador-livre para o prato, em seguida, raspar as células com uma espátula e recolhê-los em um tubo cônico de 15 mL.
- Gentilmente Pipetar três vezes usando uma ponta de 1.000 µ l o conteúdo e, em seguida, transferir para um novo prato de 10cm revestidos solução ECM (preparado durante a etapa 1.2.1). Use uma relação de divisão de aproximadamente 1:2 para 1:4, dependendo do rácio de confluência antes livre de alimentador de cultivo.
- Incube as iPSCs humano em 37 ° C e 5% de CO2 por 3 dias, alterando o meio dia -1.
- Dia -4 (4 dias antes do início da indução do PSM)
2. PSM diferenciação e isolamento por fluorescência-ativado da pilha (FACS) de classificação
-
Diferenciação de PSM (dia 0-dia 4)
- Aspire o meio de cultura celular livre de alimentador e adicionar 8 mL de meio de indução de PSM (meio basal CDM, suplementado com 10 µM SB431542, 10 µM CHIR99021, 2 µM, DMH1 e 20 ng/mL FGF2, ver tabela 1).
Nota: Confluência de célula na iniciação de diferenciação PSM é fundamental para a eficiência de indução. Utilização de microscopia para confirmar a relação confluente é aproximadamente 30%. - Incube as células a 37 ° C, com 5% de CO2, 4 dias, alterando o meio no dia 3.
- Colheita de células para FACS no dia 4 (seção 2.2, abaixo).
- Aspire o meio de cultura celular livre de alimentador e adicionar 8 mL de meio de indução de PSM (meio basal CDM, suplementado com 10 µM SB431542, 10 µM CHIR99021, 2 µM, DMH1 e 20 ng/mL FGF2, ver tabela 1).
-
Isolamento de células positivas de PSM DLL1 por fluorescência-ativado da pilha (FACS) de classificação
Nota: abaixo é um procedimento para a preparação da pilha antes de FACS classificação de células positivas DLL1. Execute o FACS classificação usando um citômetro de fluxo, de acordo com o protocolo do fabricante.- Aspire o meio e, em seguida, lave com PBS. Posteriormente, adicionar 1 mL do reagente de dissociação de célula e deixe por 3 min em RT
- Adicionar 4 mL de meio base de MDL, raspar as células com uma espátula e recolhê-los em um tubo cônico de 15 mL.
- Contar o número de células, usando um contador automatizado de células e, em seguida, centrifugar a 280 x g durante 3 min.
- Cuidadosamente Retire o sobrenadante por aspiração e ressuspender as células em buffer FACS (ver tabela 1) na concentração de 1,0 x 107 células/mL. Para uma amostra de controlo negativo (isotipo controle, ou na Convenção, sem anticorpos), transferir 50 µ l em um tubo cônico de 15 mL e então suspenda com 450 µ l de tampão de FACS.
- Adicionar DLL1 anticorpo (ver Tabela de materiais) na proporção de 1/200. Proteger o tubo de luz e manter em gelo por 30 min.
- Centrifugar a 280 x g por 3 min.
- Cuidadosamente, aspirar o sobrenadante e ressuspender em buffer FACS (1.0 x 107 células/mL) suplementado com 1 mg/mL DAPI.
- Transferência num tubo de colheita, incorporado com uma malha de nylon de 35 µm na tampa para filtragem, em seguida, coloque o tubo no gelo até classificação for concluído. Execute o mesmo procedimento com a amostra de controlo negativo (etapa 2.2.4).
- Execute a classificação usando um citômetro de fluxo de acordo com o protocolo do fabricante.
- Colete as células positivas de DLL1 classificadas em um tubo cônico de 15 mL, contendo 4 mL de meio basal CDM, suplementado com 10 µM de Y27632. Para a extração de RNA total, centrifugar a 280 x g durante 3 min depois Resuspenda em tampão de lise de RNA e armazenar a-30 ° C. Consulte a extração do RNA e transcrição reversa RT-qPCR procedimentos (seção 5.1) para obter informações mais detalhadas.
- Executar a diferenciação de SM usando as células classificadas de acordo com o abaixo protocolo (secção 3).
3. SM diferenciação do PSM
-
Diferenciação de SM de DLL1 células PSM classificadas positivas (dia 4 – dia 8)
Nota: preparar as placas de 12 Poços revestidos solução ECM anteontem FACS classificação. Para preparar um prato de 12-Poços revestidos solução ECM, adicionar 1 mL de solução de ECM em cada poço a 4 ° C e deixar durante a noite. Manter a solução de ECM no gelo enquanto prepara.- A seguir passo 2.2.10, centrifugar a 280 x g por 3 min.
- Cuidadosamente aspirar o sobrenadante e ressuspender em 1 mL de meio de indução de SM (meio basal CDM, suplementado com 10 µM SB431542 e 5 µM CHIR99021, ver tabela 1).
- Conte o número de células, usando um contador automatizado de células.
- Semente de 1,0 x 105 células para cada poço das placas 12-poços de ECM revestidas solução contendo 1 mL de meio de indução de SM suplementado com 10 µM de Y27632.
- Incube a 37 ° C com 5% de CO2 por 4 dias até o dia 8. Mude o meio não contendo Y27632 no dia 5 (o dia depois da classificação de FACS) e dia 7.
- Execute a diferenciação de derivados de SM usando células de SM induzidas de acordo com os protocolos abaixo. Para extração de RNA total de células de SM induzidas, coletar as células em um tubo cônico de 15 mL e centrifugar 280 x g por 3 min, em seguida, resuspenda em tampão de lise de RNA e armazenar a-30 ° C.
4. SM derivados (DM, MYO, D, SCL, SYN) diferenciação de SM
Nota: Para demonstrar a competência-cheia de células de SM, primeiro execute o DM (dermomyotome) e indução de SCL (sclerotome) nesse sentido, utilizando células de SM iPSC-derivado. Posteriormente, realizar MYO (Miótomo) e indução de D (dermátomo) usando as células do DM e realizar a indução de SYN (syndetome) usando as células SCL. Abaixo estão os protocolos para a indução de cada derivado (DM, MYO, D, SCL e SYN) de células de SM induzidas in vitro.
-
DM de diferenciação de células SM (dia 8 – dia 11)
- Aspire o meio e, em seguida, adicionar 1 mL de meio de indução de DM (meio basal de MDL suplementado com 5 µM CHIR99021 e 10 ng/mL BMP4, ver tabela 1).
- Incube as células a 37 ° C, com 5% de CO2, 3 dias até dia 11. Mude o médio no dia 10 (dia 2 de DM indução).
- Executar MYO e D diferenciação usando induzido DM células de acordo com os protocolos abaixo.
-
Diferenciação de MYO de células DM (dia 11-dia 41)
- Aspire o meio e, em seguida, adicionar 1 mL de meio de indução de MYO (meio basal de MDL suplementado com 5 µM CHIR99021, ver tabela 1).
- Incube as células a 37 ° C, com 5% de CO2, durante 30 dias até 41 dias. Altere o meio em 3 dias.
-
Diferenciação de D de células DM (dia 11-dia 20)
- Aspire o meio e, em seguida, adicionar 1 mL de meio de indução D (meio basal de MDL suplementado com 5 µM CHIR99021 e 10 ng/mL BMP4, ver tabela 1).
- Incube as células a 37 ° C, com 5% de CO2, durante 9 dias até o dia 20. Altere o meio em 3 dias.
-
Diferenciação de SCL de células SM (dia 8 – dia 11)
- Aspire o meio e, em seguida, adicionar 1 mL de meio de indução de SCL (meio basal de MDL suplementado com 100 nM SAG e 0,6 µM LDN193189, ver tabela 1)14.
- Incube as células a 37 ° C, com 5% de CO2, 3 dias. Mude o médio no dia 10 (indução de dia 2 do SCL).
- Execute a diferenciação de SYN usando células SCL induzidas de acordo com o protocolo abaixo.
-
Diferenciação de SYN de células SCL (dia 11-dia 32)
Nota: preparar as placas de 24 Poços revestidos solução ECM no dia antes de iniciar a indução de SYN. Para preparar um prato de 24-bem revestidos solução ECM, adicionar 0,5 mL de solução de ECM em cada poço a 4 ° C e deixar durante a noite. Manter a solução de ECM no gelo enquanto prepara.- Aspire o meio depois lave com PBS, em seguida, adicionar 0,2 mL de reagente de dissociação de célula para cada poço e deixe por 3 min em RT
- Adicionar 0,8 mL de meio base de MDL a cada poço em seguida, raspar e coletar todas as células em um tubo cônico de 15 mL.
- Centrifugar a 280 x g por 3 min.
- Cuidadosamente aspirar o sobrenadante e ressuspender em 1 mL de meio de indução de SYN-1 (meio basal de MDL suplementado com 20 ng/mL FGF8, ver tabela 1), em seguida, contar o número de células, usando um contador automatizado de células.
- Semente 5.0 x 104 células em cada poço das ECM solução-revestido 24-bem placas contendo 1 mL de meio de indução de SYN-1.
- Incube a 37 ° C, com 5% de CO2, por 3 dias.
- No dia 14 (indução do dia 3 de SYN), substitua o meio médio de indução de SYN-2 (meio basal CDM, suplementado com 10 ng/mL BMP7 e 10 ng/mL TGFβ3, ver tabela 1).
- Incube a 37 ° C, com 5% de CO2, 18 dias até dia 32. Altere o meio em 3 dias.
5. caracterização de produtos derivados de iPSC
Nota: Após diferenciação, caracteriza derivados de iPSCs humana usando PCR quantitativo em tempo real (RT-qPCR), imunocitoquímica (ICC), ensaios imunoenzimático (ELISA) e ensaios de estimulação mecânica de estiramento, conformemente.
-
Colheita de células, extração de RNA total, transcrição reversa e análise quantitativa de PCR (RT-qPCR) em tempo real
- Coletar as amostras de células (procedimentos 2.2.10, 3.1.6, 5.4.3) em um tubo de 1,5 mL e, em seguida, centrifugar a 280 x g durante 3 min.
- Remover o sobrenadante e ressuspender em 350 µ l de tampão de lise de RNA, fornecida por um kit de extração de RNA total apropriado.
- Extraia o RNA total usando o kit de acordo com o protocolo do fabricante.
- Reverso transcrever o isolado 1 µ g de RNA total de cDNA, de acordo com o protocolo do fabricante.
- Execute RT-qPCR usando apropriadas enzimas, reagentes e primeiras demão de acordo com o protocolo do fabricante. Sequências de cartilha utilizadas neste estudo estão listadas na tabela 2.
-
Imunocitoquímica (ICC)
- Antes de executar a imunocitoquímica com anticorpos, consertar as células com 2% paraformaldeído a 4 ° C por 10 min e lave duas vezes com PBS.
- Para permeabilização, incube com 0,2% de metanol ou 0,2% polissorbato 20/PBS (adiante designado PBS-T) a 4 ° C por 15 min.
- Remover os reagentes de permeabilização e tratar as células com um apropriado bloqueio buffer ou 1% bovina albumina de soro/PBS a 4 ° C por 60 min.
- Adicione o primeiro anticorpo diluído com tampão de bloqueio de 10% em PBS-T e o lugar em uma máquina de agitação a 4 ° C durante a noite.
- Lavar três vezes com PBS-T (adicione PBS-T e coloque na máquina de agitação em RT por 10 min).
- Adicione o segundo anticorpo, diluído em tampão de bloqueio de 10% em PBS-T e coloque na máquina de agitação em RT por 60 min. Os anticorpos de primeiros e segundo para ICC utilizado neste estudo são listados na tabela 3.
Nota: Desta etapa em diante, protege o placa/prato da luz por envolvê-lo em papel alumínio. - Lave duas vezes com PBS-T.
- Para contador de coloração, adicione 1/5000 DAPI diluído com PBS e coloque na máquina de agitação em RT por 5 min.
- Remover a solução DAPI e adicionar PBS em cada poço.
- Observe a coloracao celular usando um microscópio de fluorescência. Alternativamente, armazene o prato/placa a 4 ° C por até 1 mês.
-
Enzima-lig da imunoabsorção ensaio (ELISA) para a análise funcional de iPSC-derivado D
Nota: células de fibroblastos dérmicos humanos (HDF) estão disponíveis comercialmente. Cultura de HDF em DMEM suplementado com 10% de soro fetal bovino (ver tabela 1).- Semente de 1,0 x 105 células de iPSC-derivado D e HDF em placas de 24 poços contendo 1 mL de cada meio de cultura (meio de indução: d: D, HDF: DMEM suplementado com 10% de soro fetal bovino).
- Depois de 3 dias de cultivo celular, coletar 100 µ l de cada meio, coloque em um tubo de 1,5 mL e armazenar a 4 ° C.
- Executar a série de procedimentos, tais como a adição de anticorpos de deteção e anticorpos secundários, de acordo com as instruções do fabricante e quantificar o número de destinos, gerando uma curva padrão contra a concentração do controle amostras de analito.
-
Ensaio de estimulação mecânica de estiramento para análise funcional de iPSC-derivado SYN
Nota: adultos humanos tenocytes são comercialmente disponíveis (ver Tabela de materiais). Cultura humana iPSC-derivado SYN e tenocytes humano adulto em uma célula de dispositivo para o ensaio de estimulação mecânica de estiramento de alongamento, conforme descrito abaixo de18,19. Uso SYN indução médio-2 e tenocytes crescimento médio (ver Tabela de materiais) como um meio de cultivo para cada derivado de iPSC SYN e tenocytes humano adulto, respectivamente.- A 24 h antes de esticar, células de placa 1,0 x 105 de iPSC-derivado SYN e tenocytes humana em borracha de silicone bem-tipo ECM solução-revestido multi câmaras, cada uma com uma superfície de cultura de 1,5 x 1,5 cm (ver a Tabela de materiais).
- Definir as câmaras no dispositivo para alongamento da célula e forçar monoaxiais tensão cíclica (0,5 Hz, 5%) para 12h.
- Para a extração de RNA total, adicionar 350 µ l de tampão de lise de RNA, em seguida, raspar e coletar as células em um tubo de 1,5 mL para extração de RNA total e posterior análise de RT-qPCR (veja procedimento 5.1).
Resultados
Todas as figuras neste relatório foram obtidas com 201B7-PAX3-GFP iPSCs, no qual EGFP substitui um alelo da sequência de codificação PAX3 no exon 1. Estabelecimento de iPSCs 201B7-PAX3-GFP será descrito em outro lugar (H. Sakurai, comunicação pessoal). A significância estatística foi avaliada utilizando o software estatístico. P-valores inferiores 0,05 foram considerados significativos.
Caracterização de células humanas de iPSC-derivado PSM e SM
Para avaliar a diferenciação das iPSCs humana em direção a SM através do estado PSM (Figura 2A), análise de FACS, foram realizadas análises de ICC e análise de RT-qPCR. Como mostrado na Figura 2B, mais 85% das células foram positivas para DLL1, um marcador de PSM, mas negativo para PAX3, um marcador de SM, depois de 4 dias de indução de PSM com iPSCs humano. Subsequentemente, esta população tornou-se células positivas de SM PAX3 após 4 dias de indução de SM. A transição de PSM-SM também foi confirmada pelo TPI (Figura 2) e RT-qPCR (Figura 2D). Marcadores PSM TBX6, MSGN1 e WNT3A, foram expressas no estado PSM (dia 4), mas não expressa no estado SM (dia 8). PARAXIS, MEOX1 e PAX3, marcadores de SM, foram expressas em SM, mas não expressa no PSM. Além disso, só mancha de CDH11, um marcador de epithelialized SM, acumulado na junção celular, após a adição de SB431542 com CHIR99021 (Figura 2E).
Caracterização de SM derivados induzidas de células humanas de SM derivado de iPSC
Para avaliar a potência de diferenciação dos humano SM iPSC-derivado, diferenciação na direção de DM, MYO, D, SCL e SYN (Figura 3A) foi avaliada por análise de ICC e PAX3 (GFP)-fluorescência. Como mostrado na Figura 3B, diferenciação de DM foi confirmada pelo ALX4 e EN1 manchando e PAX3 (GFP)-fluorescência; Diferenciação de MYO foi confirmada por MYOD, MYOG e miosina cadeia pesada (MHC) mancha; Diferenciação de D foi confirmada pela EN1 e PDGFRa mancha; Diferenciação de SCL foi confirmada por PAX1, PAX9 e NKX3.2 mancha; e diferenciação de SYN foi confirmada pela SCX, MKX, COL1A1 e COL1A2 coloração.
Caracterização de induzido D e SYN
1. ensaio imunoenzimático (ELISA) para análise funcional de iPSC-derivado D
No corpo humano, uma das principais funções dos fibroblastos dérmicos é secretam proteínas de matriz extracelular (ECM), tais como colágeno e ácido hialurônico que hidrata a pele e ajudar a sustentar a estrutura da pele. Para demonstrar que uma quantidade comparável de proteínas de colágeno tipo 1 e ácido hialurônico foram secretadas no meio de cultura de iPSC-derivado D e HDF, ELISA foi realizada, conforme mostrado na Figura 4A.
2. mecânica esticar ensaio de estimulação para análise funcional de iPSC-derivado SYN
Como vários estudos já relataram, estimulação mecânica afeta o tendão desenvolvimento antes e após o nascimento e promove a diferenciação de tenocytes de precursor células18,19. Portanto, é sabido que a reatividade ao estresse mecânico é uma das características de tenocytes. Para demonstrar a reatividade comparável de SYN iPSC-derivado humano e humano adulto tenocytes, realizou-se um ensaio de estimulação mecânica de estiramento como mostrado na Figura 4B.
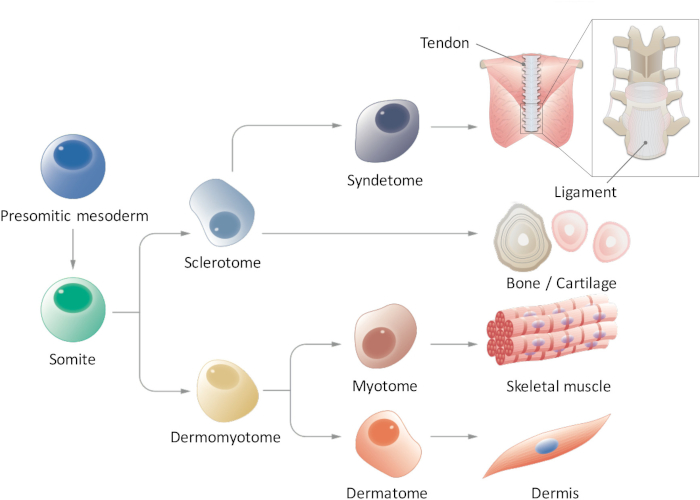
Figura 1: visão esquemática da diferenciação hierárquica da mesoderme paraxial. Mesoderm presomitic é uma população de células que transitoriamente surge durante a embriogênese precoce e segmentação de somitas formulário é submetido. Somitas são uma população de células-tronco transitória que dá origem a vários tipos de células, como células sclerotome, dermomyotome, syndetome, Miótomo e dermátomo, que eventualmente se diferenciar em tendão/ligamento, osso/cartilagem, músculo esquelético e derme células. Clique aqui para ver uma versão maior desta figura.
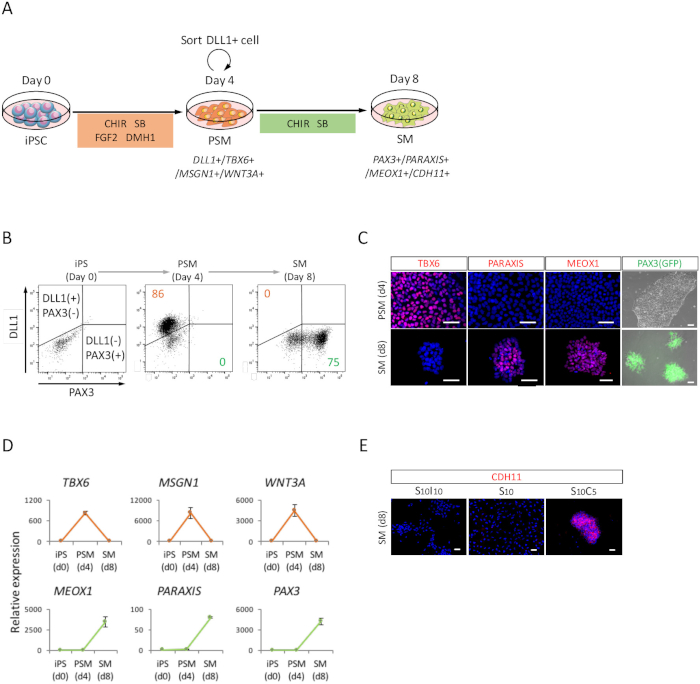
Figura 2: análise FACS, RT-qPCR e ICC de PSM iPSC-derivado humano e SM (A) visão esquemática de um protocolo para diferenciação de SM através do PSM. (B) trama do ponto representativo de DLL1 manchando e PAX3 (GFP)-fluorescência no dia 4 de indução de PSM e dia 4 (dia 8 de iPSC) de indução de SM. (C) representante immunocytochemical imagens e PAX3 (GFP)-fluorescência no dia 4 de indução de PSM e dia 4 (dia 8 de iPSC) de indução de SM. As células foram coradas com anti-TBX6, PARAXIS, MEOX1 e anticorpos (vermelho) e co manchado com DAPI (azul) ou detectado com PAX3 (GFP)-fluorescência (verde). (D) análise de RT-qPCR de marcadores para PSM e SM no iPSC, PSM e SM. Significa ± erro padrão (S.E.) de três conjuntos de experimentos são mostrados. (E) representante immunocytochemical imagens no dia 4 (dia 8 de iPSC) do SM, cultivadas em S10I10 (combinação de SB431542 e IWR1, um inibidor de sinalização de WNT), S10 (SB431542) e S10C5 condições (combinação de SB431542 e CHIR99021). As células foram coradas com anticorpo anti-CDH11 (vermelhas) e co coradas com DAPI (azul). iPS, células-tronco pluripotentes induzidas; PSM, mesoderm presomitic; SM, somite; S10, SB431542 10 ΜM; C5, CHIR99021 5 ΜM; I10, IWR1 10 ΜM; Barras de escala = 50 μm. Esta figura foi modificada de Nakajima et al (2018)15. Clique aqui para ver uma versão maior desta figura.
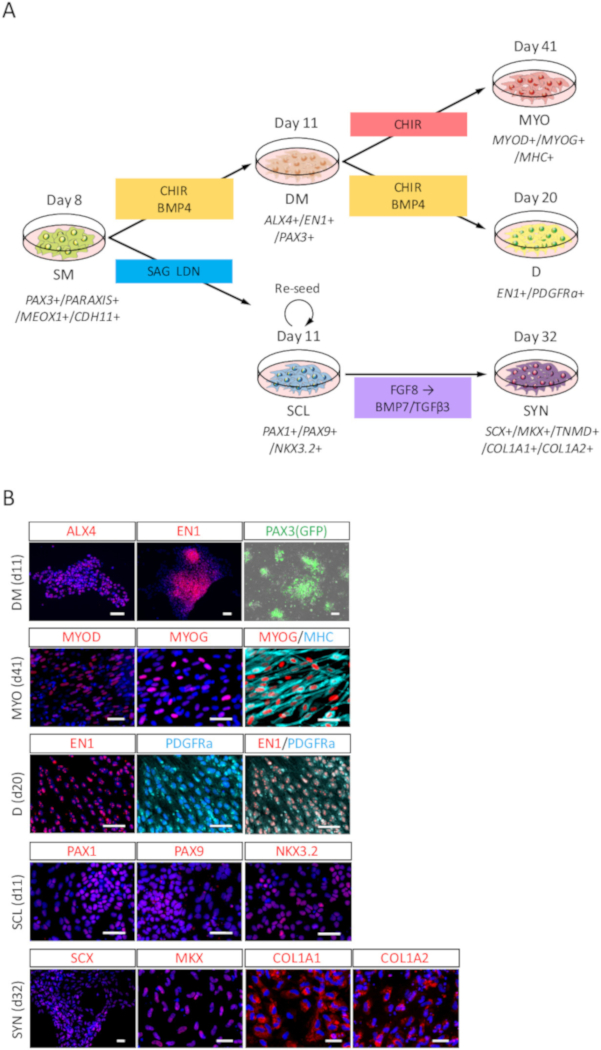
Figura 3: análise de ICC de DM, MYO, D, SCL e SYN diferenciada da humana iPSC-derivado SM (A) visão esquemática dos protocolos para diferenciação de derivados de SM. (B) representante immunocytochemical imagens e PAX3 (GFP)-fluorescência no dia 3 (dia 11 de iPSC) de indução do DM, dia 30 (dia 41 de iPSC) de indução de MYO, dia 9 (dia 20 de iPSC) de indução D, dia 3 (dia 11 de iPSC) de indução de SCL e dia 21 (dia 32 de iPSC) de indução de SYN. DM, células foram coradas com anti-ALX4 e anticorpos EN1 (vermelho) e co manchadas com DAPI (azul) ou detectadas com PAX3 (GFP)-fluorescência (verde); MYO, células estavam manchadas com anti-MYOD, MYOG (vermelho) e anticorpos MHC (ciano), também co manchados com DAPI (azul); D, as células foram coradas com anti-EN1 (vermelho) e anticorpos PDGFRa (ciano) e co coradas com DAPI (azul); SCL, as células foram coradas com anti-PAX1, PAX9, NKX3.2 e anticorpos (vermelhos) e co manchado com DAPI (azul); SYN, as células foram coradas com anti-SCX, MKX, COL1A1 e COL1A2 anticorpos (vermelhos) e co manchado com DAPI (azul). DM, dermomyotome; MYO, Miótomo; D, dermátomo; SCL, sclerotome; SYN, syndetome; Barras de escala = 50 μm. Esta figura foi modificada de Nakajima et al (2018)15. Clique aqui para ver uma versão maior desta figura.
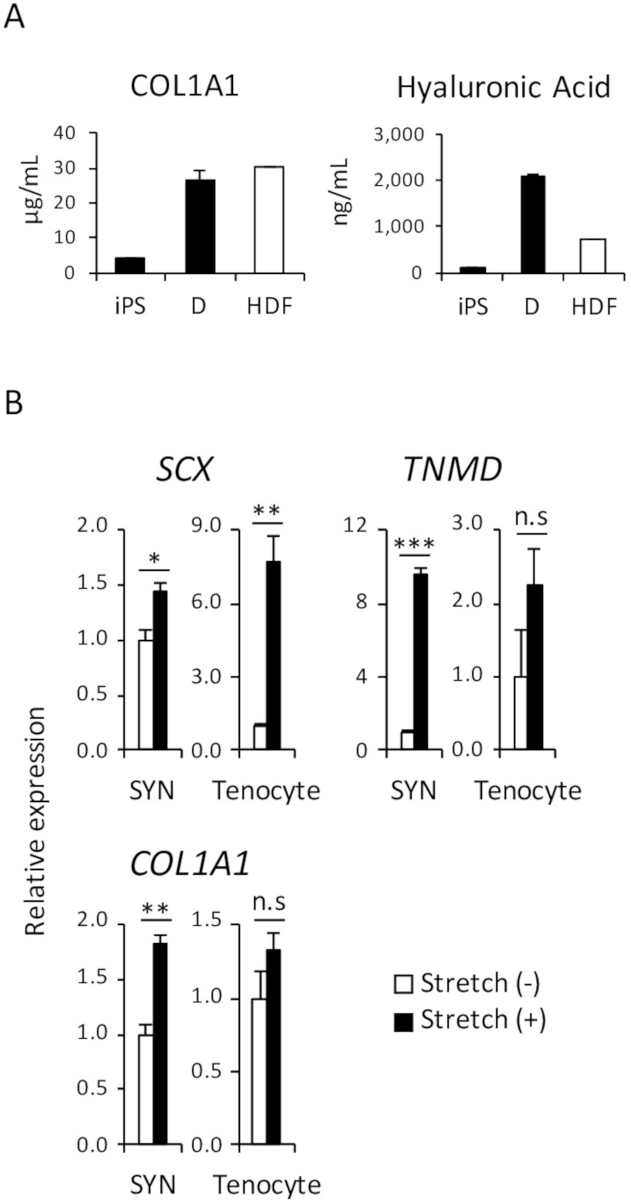
Figura 4: ensaio funcional de induzido D e SYN. (A) a quantidade de colágeno tipo 1 e hialurônico ácido proteínas do meio de cultura foram analisadas por ELISA. (B) o efeito do estiramento mecânico estimulação induzida SYN e tenocytes adulto humano foi avaliada por RT-qPCR. Significa ± erro padrão (S.E.) de três conjuntos de experimentos são mostrados. * p < 0,05; * * p < 0,01; p < 0,001 por múltiplas comparações t-teste Dunnett comparado ao estiramento (-); ratinho63, não significativa, HDF, humano adulto fibroblastos dérmicos. Esta figura foi modificada de Nakajima et al (2018)15. Clique aqui para ver uma versão maior desta figura.
| Médio/solução | Reagant | Concentração |
| Meio basal de MDL | Iscove modificado F12 médio/Ham de Dulbecco | 1:1 |
| Penicilina/estreptomicina | 0,5% | |
| Quimicamente definidos concentrado lipídico | 1% | |
| APO-transferrina | 15 mg/mL | |
| Monothioglycerol | 450 mM | |
| Albumina de soro bovino | 5 mg/mL | |
| Insulina | 7 mg/mL | |
| Solução CTK | Água | - |
| Tripsina | 0,25% | |
| Colagenase IV | 0,1 mg/mL | |
| Cloreto de cálcio | 1 mM | |
| SR nocaute | 20% | |
| Médio de indução D | Meio basal de MDL | - |
| CHIR99021 | 5 ΜM | |
| BMP4 | 10 ng/mL | |
| Médio de indução do DM | Meio basal de MDL | - |
| CHIR99021 | 5 ΜM | |
| BMP4 | 10 ng/mL | |
| Solução de ECM | Artificial da matriz extracelular | 0,3 mg/mL |
| DMEM/F12 | - | |
| Buffer de FACS | PBS | - |
| Albumina de soro bovino | 0,1% | |
| Meio de cultura celular livre de alimentador | mTeSR1 | - |
| Penicilina/estreptomicina | 0,5% | |
| Meio de cultura HDF | DMEM | - |
| Soro fetal bovino | 10% | |
| hESC médio | Meio de primata ES celular | - |
| Penicilina/estreptomicina | 0,5% | |
| FGF2 | 4 ng/mL | |
| Meio de indução de MYO | Meio basal de MDL | - |
| CHIR99021 | 5 ΜM | |
| Meio de indução de PSM | Meio basal de MDL | - |
| SB431542 | 10 ΜM | |
| CHIR99021 | 10 ΜM | |
| DMH1 | 2 ΜM | |
| FGF2 | 20 ng/mL | |
| Meio de indução de SCL | Meio basal de MDL | - |
| SAG | 100 nM | |
| LDN193189 | 0,6 ΜM | |
| Meio de indução de SM | Meio basal de MDL | - |
| SB431542 | 10 ΜM | |
| CHIR99021 | 5 ΜM | |
| Meio de indução de SYN-1 | Meio basal de MDL | - |
| FGF8 | 20 ng/mL | |
| Meio de indução de SYN-2 | Meio basal de MDL | - |
| BMP7 | 10 ng/mL | |
| TGFΒ3 | 10 ng/mL |
Tabela 1: Receitas de mídia e solução.
| NOME | Para a frente | Inverter |
| ACTB | CACCATTGGCAATGAGCGGTTC | AGGTCTTTGCGGATGTCCACGT |
| COL1A1 | GGACACAGAGGTTTCAGTGGT | GCACCATCATTTCCACGAGC |
| MEOX1 | GAGATTGCGGTAAACCTGGA | GAACTTGGAGAGGCTGTGGA |
| MSGN1 | GGAGAAGCTCAGGATGAGGA | GTCTGTGAGTTCCCCGATGT |
| PARAXIS | TCCTGGAGAGCTGTGAGGAT | CACACCCTGTCACCAACAGT |
| PAX3 | AGGAAGGAGGCAGAGGAAAG | CAGCTGTTCTGCTGTGAAGG |
| SCX | CCCAAACAGATCTGCACCTTC | GCGAATCGCTGTCTTTCTGTC |
| TBX6 | AGCCTGTGTCTTTCCATCGT | AGGCTGTCACGGAGATGAAT |
| TNMD | CCCTTCATGCTGAAGCCACTT | CTCACTTTCAGCAGAATTGGGG |
| WNT3A | CAAGATTGGCATCCAGGAGT | ATGAGCGTGTCACTGCAAAG |
Tabela 2: Sequências de Primer para análise de RT-qPCR.
| Concentração | ||
| 1. Anticorpo | ALX4_Goat | 1/50 |
| CDH11_Mouse | 1/1000 | |
| COL1A1_Rabbit | 1/100 | |
| COL2A1_Mouse | 1-2 μg/mL | |
| EN1_Rabbit | 1/50 | |
| MEOX1_Rabbit | 1/50 | |
| MHC_Rabbit | 1/200 | |
| MKX_Rabbit | 1/50 | |
| MYOD_Rabbit | 1/500 | |
| MYOG_Mouse | 1/400 | |
| NKX3.2_Rabbit | 1/50 | |
| PARAXIS_Rabbit | 1/50 | |
| PAX1_Rabbit | 1/50 | |
| PAX9_Rabbit | 1/50 | |
| PDGFRa_Goat | 1/100 | |
| SCX_Rabbit | 1/50 | |
| TBX6_Goat | 1/50 | |
| 2. Anticorpo | Burro anti antibody555 secundário de cabra IgG(H+L) | 1/500 |
| Burro anti antibody647 secundário de cabra IgG(H+L) | 1/500 | |
| Cabra anti IgG(H+L) Mouse antibody555 secundário | 1/500 | |
| Cabra anticoelho IgG(H+L) antibody555 secundário | 1/500 | |
| Cabra anticoelho IgG(H+L) antibody647 secundário | 1/500 |
Tabela 3: Primeira e segunda anticorpos para ICC.
Discussão
Um método conhecido para a indução do PSC-derivado SM através de PSM é a combinação de CHIR99021 + A83-01 (inibidor TGFβ) durante a indução de PSM do PSC, mas não durante o processo de maturação de PSM6. No presente estudo, a sinalização de WNT/beta-catenina foi inibida usando C59 para induzir SM de PSM. No entanto, introduzimos o uso de CHIR99021 para ativar o caminho de WNT durante a diferenciação de SM. Esta decisão foi feita com base na constatação que vários WNTs são expressos nos tecidos circundantes de SM e dados o fato de que os repórteres WNT são ativos em SM20. Como resultado, observamos que a epitelização, uma característica de SM em vivo, apenas sob a condição com CHIR99021, baseado no acúmulo de CDH11 em junções célula-célula (Figura 2E). Esta observação indica o envolvimento crítico de sinalização durante a diferenciação do PSM e SM epitelização, portanto que nosso protocolo melhor pode recapitular o ambiente endógeno de sinalização de WNT. No entanto, implica também uma nova possibilidade de ajuste fino do WNT/beta-catenina via de sinalização durante a diferenciação, como robustez e eficiência de diferenciação podem variar significativamente dependendo os tipos de células, linhas celulares e vários compostos químicos de WNT-indutores usados por cada pesquisador.
Esse método também nos permite gerar todos os quatro SM derivados, MYO, D, SCL e SYN, de iPSCs humana. Nossos protocolos em etapas usando o CDM podem ser usados para identificar os requisitos de sinalização durante o humano somitogenesis/somite padronização e fornecem insights importantes sobre desenvolvimento humano de SM. Por exemplo, nossos métodos poderiam ser útil para estudar os mecanismos de relógio de segmentação, um sistema de oscilação molecular que regula a formação de SM. Ele foi exaustivamente investigado no zebrafish, filhotes e ratos, mas não em seres humanos devido à falta de ferramentas experimentais adequadas.
Além disso, nosso método pode ser aplicável para futuras terapias clínicas baseada em célula. Por exemplo, humano D iPSC-derivado ou SYN pode ser transplantado pele severamente lesionada ou rompido tendões para regeneração e tratamento. No entanto, várias limitações precisam ser resolvidos antes que esse método pode ser aplicado praticamente. Embora no presente estudo, usamos células de alimentador SNL para iPSC manutenção e solução de ECM, que é extraída do sarcoma de rato Engelbreth-Holm-enxame, como uma superfície de revestimento sobre o prato durante a indução, estes reagentes de origem animal não-humano devem ser removido para melhorar a qualidade da clínica. Além disso, célula quantidade e qualidade, que inclui a pureza e a maturação das células desejadas, também devem ser melhorados. Além disso, não só o número de células, mas também a força de célula é uma característica importante para a regeneração do tendão/ligamento. Além disso, o desenvolvimento de marcadores de superfície para a purificação e um método novo para reconstituição 3D são indispensáveis para avançar nossos protocolos clínicos terapias baseadas em células.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Gostaríamos de agradecer Dr. Junya Toguchida (CiRA) por sua ajuda com a administração do projeto e o financiamento de aquisição, Sr. Mitsuaki Shibata (CiRA) e MS. Mei Terashima (CiRA) para sua assistência técnica, Dr. Yayoi Toyooka (CiRA) e Dr. Daisuke Kamiya (CiRA) sua revisão do manuscrito e Sr. Masaya Todani (CiRA) para fornecer uma ilustração (Figura 1). Agradecemos também a todos os membros dos laboratórios Ikeya e Toguchida (CiRA) pelo apoio durante este estudo. Este trabalho foi apoiado pela Grants-in-aid para a investigação científica da sociedade de Japão para a promoção da ciência (JSPS) (26670661), o programa para as células iPS de intratável doenças pesquisa utilizando doenças específicas do Japão de ciência e tecnologia Agência (JST) e a agência de Japão para pesquisa médica e desenvolvimento (AMED), o núcleo centro para pesquisa da pilha de iPS da rede de centro de pesquisa para a realização da medicina regenerativa (JST/AMED) e o fundo de pesquisa de células iPS (em parte para Makoto Ikeya e Junya Toguchida). Makoto Ikeya era também apoiada pelos Grants-in-aid para pesquisa científica (JSPS) (16H 05447) e o programa de aceleração para a investigação de doenças intratáveis utilizando células iPS de doenças específicas (AMED).
Materiais
| Name | Company | Catalog Number | Comments |
| ALX4_Goat antibody | Santacruz | sc-22066 | |
| Apo-transferrin | Sigma | T1147 | |
| BMP4 | R&D | 314-BP-010 | |
| BMP7 | R&D | 354-BP-010 | |
| Bovine serum albumin | Sigma | A8806 | |
| Calcium chloride | Nacalai tesque | 067730-15 | |
| CDH11_Mouse antibody | Cell signaling | 13577 | |
| Cell streching device | Strex | STB-140 | |
| Chemically defined lipid concentrate | Gibco | 11905-031 | |
| CHIR99021 | Axon | 1386 | |
| COL1A1_Rabbit antibody | Abcam | ab34710 | |
| COL2A1_Mouse antibody | Thermo scientific | MS-235 | |
| Collagenase IV | Thermofisher | 17104019 | |
| DLL1 APC-conjugated_Mouse antibody | R&D | FAB1818A | For FACS |
| DMEM | Sigma | D6046 | |
| DMEM/F12 | Gibco | 11320-082 | |
| DMH1 | Tocris | 4126 | |
| EN1_Rabbit antibody | Abcam | ab70993 | |
| Fetal bovine serum | Nichirei | 171012 | |
| FGF2 | Wako | 060-04543 | |
| FGF8 | Peprotech | 100-25 | |
| Human dermal fibroblast | Cell applications | 160-05a | |
| Human tenocyte | Angio proteomie | cAP-0041 | |
| Insulin | Wako | 090-06474 | |
| Iscove’s modified Dulbecco’s medium/Ham’s F12 | Gibco | 21056023 | |
| Knockout SR | Gibco | 10828028 | |
| LDN193189 | Axon | 1509 | |
| Matrigel | BD bioscience | 354230 | Artificial extracellular matrix |
| MEOX1_Rabbit antibody | Abcam | ab75895 | |
| MHC_Rabbit antibody | Santacruz | sc-20641 | |
| MKX_Rabbit antibody | Atlas antibodies | A83377 | |
| Monothioglycerol | Sigma | M6145 | |
| mTeSR1 | Stemcell tech | 85850 | |
| Multi well-type silicon rubber chamber | Strex | STB-CH-4W | |
| MYOD_Rabbit antibody | Abcam | ab133627 | |
| MYOG_Mouse antibody | Santacruz | sc-12732 | |
| NKX3.2_Rabbit antibody | Sigma | HPA027564 | |
| Novex Donkey anti Goat IgG(H+L) secondary antibody555 | Invitrogen | A21432 | |
| Novex Donkey anti Goat IgG(H+L) secondary antibody647 | Invitrogen | A21447 | |
| Novex Goat anti Mouse IgG(H+L) secondary antibody555 | Invitrogen | A21422 | |
| Novex Goat anti Rabbit IgG(H+L) secondary antibody555 | Invitrogen | A21428 | |
| Novex Goat anti Rabbit IgG(H+L) secondary antibody647 | Invitrogen | A21245 | |
| PARAXIS_Rabbit antibody | Santacruz | sc-98796 | |
| PAX1_Rabbit antibody | Abcam | ab95227 | |
| PAX9_Rabbit antibody | Gene tex | GTX104454 | |
| PBS | - | - | |
| PDGFRa_Goat | R&D | AF307 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| Primate ES cell medium | Reprocell | RCHEMD001 | |
| SAG | Calbiochem | 566661 | |
| SB431542 | Selleckchem | SEL-S1067-10 | |
| SCX_Rabbit antibody | Abcam | ab58655 | |
| TBX6_Goat antibody | R&D | AF4744 | |
| Tendon cell growth medium | Angio-proteomie | cAP-40 | Tenocytes growth medium |
| TGFβ3 | R&D | 243-B3-200 | |
| Trypsin | Gibco | 15090046 |
Referências
- Tanaka, A., et al. Efficient and reproducible myogenic differentiation from human iPS cells: prospects for modeling Miyoshi Myopathy in vitro. PLoS One. 8 (4), e61540 (2013).
- Sakurai, H., et al. In vitro modeling of paraxial mesodermal progenitors derived from induced pluripotent stem cells. PLoS One. 7 (10), e47078 (2012).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocl. 11 (10), 1833-1850 (2016).
- Chal, J., et al. Differentiation of pluripotent stem cells to muscle fiber to model Duchenne muscular dystrophy. Nature Biotechnology. 33 (9), 962-969 (2015).
- Umeda, K., et al. Human chondrogenic paraxial mesoderm, directed specification and prospective isolation from pluripotent stem cells. Scientific Reports. 2, 455 (2012).
- Loh, K. M., et al. Mapping the Pairwise Choices Leading from Pluripotency to Human Bone, Heart, and Other Mesoderm Cell Types. Cell. 166 (2), 451-467 (2016).
- Xi, H., et al. In Vivo Human Somitogenesis Guides Somite Development from hPSCs. Cell Reports. 18 (6), 1573-1585 (2017).
- Chal, J., Pourquie, O. Making muscle: skeletal myogenesis in vivo and in vitro. Development. 144 (12), 2104-2122 (2017).
- Tam, P. P., Beddington, R. S. The formation of mesodermal tissues in the mouse embryo during gastrulation and early organogenesis. Development. 99 (1), 109-126 (1987).
- Aulehla, A., Pourquie, O. Signaling gradients during paraxial mesoderm development. Cold Spring Harbor Perspectives in Biology. 2 (2), a000869 (2010).
- Christ, B., Scaal, M. Formation and differentiation of avian somite derivatives. Advances in Experimental Medicine and Biology. 638, 1-41 (2008).
- Brent, A. E., Schweitzer, R., Tabin, C. J. A somitic compartment of tendon progenitors. Cell. 113 (2), 235-248 (2003).
- Sakurai, H., et al. Bidirectional induction toward paraxial mesodermal derivatives from mouse ES cells in chemically defined medium. Stem Cell Research. 3 (2-3), 157-169 (2009).
- Zhao, J., et al. Small molecule-directed specification of sclerotome-like chondroprogenitors and induction of a somitic chondrogenesis program from embryonic stem cells. Development. 141 (20), 3848-3858 (2014).
- Nakajima, T., et al. Modeling human somite development and fibrodysplasia ossificans progressiva with induced pluripotent stem cells. Development. 145 (16), (2018).
- McMahon, A. P., Bradley, A. The Wnt-1 (int-1) proto-oncogene is required for development of a large region of the mouse brain. Cell. 62 (6), 1073-1085 (1990).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Suzuki, H., et al. targeting of the transcription factor Mohawk in rats causes heterotopic ossification of Achilles tendon via failed tenogenesis. Proceedings of the National Academy of Sciences of the United States of America. 113 (28), 7840-7845 (2016).
- Marturano, J. E., Arena, J. D., Schiller, Z. A., Georgakoudi, I., Kuo, C. K. Characterization of mechanical and biochemical properties of developing embryonic tendon. Proceedings of the National Academy of Sciences of the United States of America. 110 (16), 6370-6375 (2013).
- Maretto, S., et al. Mapping Wnt/beta-catenin signaling during mouse development and in colorectal tumors. Proceedings of the National Academy of Sciences of the United States of America. 100 (6), 3299-3304 (2003).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados