Method Article
인간 유도에서 Somite 파생 상품의 체 외 발생에서 만능 줄기 세포
요약
선물이 여기 각 somite 파생 (myotome, sclerotome, dermatome, 및 syndetome)에 인간 유도 만능 줄기 세포의 분화에 대 한 프로토콜 정의 화학적 조건에서 미래의 질병 모델링에 응용 프로그램에는 고 정형 외과에서 세포 기반 요법입니다.
초록
WNTs 같은 신호에 대응, 뼈 morphogenetic 단백질 (BMPs), 그리고 소닉 고슴도치 (쉬)를 둘러싼 조직에서 분 비, somites (SMs)을 일으키 myotome (묘), sclerotome (SCL), dermatome (D), 및 syndetome (SYN)을 포함 한 여러 세포 유형, 차례로 개발 하 골격 근육, 축 골격, 등 피, 그리고 축 힘 줄 또는 인 대, 각각. 따라서, SMs 및 인간 유도 만능 줄기 세포 (Ipsc)에서 그들의 유도체의 생성은 만능 줄기 세포 (PSCs) 재생 의학에 응용 프로그램 및 정형 외과 수술의 분야에서 질병 연구를 중요 합니다. 묘와 Psc에서 SCL에 대 한 유도 프로토콜 이전 여러 연구자에 의해 보고 되었습니다, 비록 아무 연구 Ipsc에서 SYN와 D의 유도 아직 시연 하고있다. 따라서, 완전히 유능한 SMs의 효율적인 유도 주요 도전 남아 있습니다. 여기, 우리는 화학적 병아리/마우스 SM 개발 및 SM 파생 상품 (묘, SCL, D, 및 SYN)에서 인간의 Ipsc에서의 체계적인 유도의 방법에 대 한 보고서 중 신호 환경을 흉내 낸에 의해 인간의 Ipsc 생체 외와 인간의 SM 패턴 정리 presomitic mesoderm (PSM) 및 SM 상태를 통해 정의 된 조건입니다. 병아리/마우스 SM 개발에 관한 지식은 인간의 Ipsc와 SMs의 유도에 성공적으로 적용 되었습니다. 이 방법은 인간의 somitogenesis를 공부 하 고 사용 배아의 세포 기반 치료 및 질병 모델링 없이 패턴화 하는 소설 도구 수 있습니다.
서문
Psc에서 원하는 셀 형식에 대 한 감독된 차별화 방법을 개발 하는 것은 임상 응용 프로그램으로 변환 하는 PSC 파생 셀의 연구 필요한 단계입니다. 주요 유전자의 강제 식 Psc에서 장기 세포 분화를 위한 유망한 전략 이며 세포 운명 결정, 기관 morphogenesis 및 조직 embryogenesis1의 유전 규칙의 우리의 이해를 개선 했다. 또한, 로드맵로 마우스와 병아리 태아의 발달을 사용 하 여 내 생 신호 환경 업과 Psc의 감독된 분화에 필수적인 간주 됩니다. 그러나, PSC 파생 셀 세포 기반 치료 등 임상 연구에의 응용을 감안할 때, 후자의 전략은 더 적합 한 유전자 조작 필요 하지 않습니다.
여러 연구에서 인간의 mesoderm 유도 보고 및 마우스 Psc에서 화학적 조건을 정의. 일반적으로 이러한 방법을 activin/결핵/변형 성장 인자 β (TGFβ) 신호에 의존 해야 하 고 뼈 morphogenetic 단백질 (BMP) 신호, meso endoderm 및 mesoderm 분화, 낮은 유도 효율성의 결과 수행으로 paraxial mesoderm (약 20%)2. 즉, 이러한 신호 통로 의해 유도 된 PSC 파생 mesoderm 되었고 주로 옆 격판덮개 mesoderm paraxial mesoderm 하지. 최근에, 몇 가지 연구의 PSC 파생 paraxial mesoderm 다른 전략3,,45,6,7,8에 따라 효율적인 생산 증명 . 이러한 연구에서 Psc 글 리 코겐 synthase 키 니 아 제 3 (GSK3)의 상대적으로 높은 농도로 배양 했다 억제제 (WNT 신호 활성 제), 따라서 paraxial mesoderm의 유도 효율에 도달 70%-956,7 .
Somitogenesis, paraxial mesoderm 먼저 뒤로, presomitic mesoderm (PSM)를 형성 하 고 mesenchyme-상피 전환9,10앞쪽 부분에 somites (SMs)를 형성 한다. 노치 ligand 델타 같은 1 (DLL1) DLL1 식, mRNA와 단백질 수준에 둘 다의 진동 제어 조절 SM 세분화로 somitogenesis, 동안 중추적인 역할을 알려져 있습니다. SMs 결국 세분화 두 부분, dermomyotome (DM)을 dorsally 기한 및 sclerotome (SCL)으로 ventrally11. 그 후, DM dermatome (D), 진 피, 그리고 myotome (묘), 골격 근육;의 선구자의 선구자로 차별화 또한, SCL의 복 부 부분 syndetome (SYN), 힘 줄과 인 대12 (그림 1)의 전조를 형성 한다. 일부 연구 자들은 보고 묘4,13 등 SCL14; SM PSC 파생 된 파생 상품의 유도 그러나, 이러한 연구에서 몇 가지 제한이 있습니다. 특히, D 및 SYN 신호 환경의 우리의 지식을 단편적 이기 때문에, D 및 SYN 유도 프로토콜 하지 아직 체계적으로 설립 되었습니다. Psc에서 유도 된 SMs의 전체 능력을 보여 다 차별화를 보여 필수적 이다 용량 (D, 묘, SCL, 및 SYN), 모든 4 개의 유도체로 유도 SMs의 이전 연구는 특정 SM 파생 상품에만 집중 하는 동안. 여기, 우리 인간의 Ipsc15에서 PSM 및 SM 운명을 통해 D 및 SYN를 포함 하 여 모든 4 개의 SM 유도체를 생성 하는 방법에 보고 합니다. 우리는 생체 외에서 stepwise 방법 SM 개발 프로세스는 어떻게 인간의 SM의 연구에 기여할 수 있는 그 모델 수립 동안에 발전 한다 embryogenesis, 배아를 사용 하지 않고 믿습니다.
프로토콜
모든 실험 프로토콜 관련 된 인간의 Ipsc 의학과와 대학원의 대학, 교토대학 윤리 위원회에 의해 승인 되었다.
1. 인간의 Ipsc 준비 하기 전에 유도
참고: SNL 급지대 문화 인간의 Ipsc (201B7-PAX3-GFP) 영장류 ES 세포 매체 4 ng/mL 재조합 인간 기본적인 섬유 아 세포 성장 인자 (FGF2) 및 0.5% 페니실린과 스 보충16 세포 (hESC 매체로 볼이 하 추천 표 1)입니다. 때 합류 비율에 도달 70%-80%, 통행 셀 앞에서 설명한17로 합니다.
-
SNL 피더 세포17 에 인간의 Ipsc의 뿌리고
- 뿌리고에 대 한 셀 자란 그릇에 PBS를 추가 하 고 셀 린스. 그런 다음, PBS를 제거 (,이 과정은 수 라 함 PBS로 세척).
- CTK 솔루션의 1 mL를 추가 (하십시오 표 1참조)에서 실 온 (RT)와 SNL 피더 세포 시작 접시의 바닥에서 분리 될 때까지 대기.
- CTK 솔루션을 제거 하 고 그 후 PBS로 두번 세척.
- HESC 매체의 1 mL을 추가 접시에 다음은 스 크레이 퍼를 사용 하 여 셀을 긁 고 15 mL 원뿔 튜브에 수집 ( 표 1참조).
- 부드럽게 내용을 5 번 사용 하 여 1000 µ L 팁, 플라스틱 그리고 hESC 매체 가득한 새로운 접시에 전송. 1:4 1:10, 뿌리고 전에 합류 비율에 따라 분할 비율을 사용 합니다. 또한, 요리 (요리를 6 cm, 10 cm 접시 8 mL에 대 한 예를 들어, 3 mL)의 규모에 따라 hESC 매체의 볼륨을 변화 한다.
- 37 ° C, 5% CO2인간의 Ipsc를 품 어.
- (제외 뿌리고 다음날) 중간 매일 변경 하 고 passaging 프로시저까지 셀 문화.
-
PSM 유도 하기 전에 인간의 Ipsc의 경작 지류-무료
참고: SNL 피더 세포에서 분 비 되는 성장 인자의 효과 최소화 하기 위해 문화 급지대 무료 세포 배양 매체와 피더 무료 조건 하에서 인간의 Ipsc ( 표 1참조)에 세포 외 기질 (ECM) 솔루션 ( 표 1참조) 3 일전 PSM 유도 대 한 코팅된 접시.- -PSM 유도 시작 하기 전에 (4 일) 4 일
- ECM 솔루션 코팅 접시를 준비 하려면 추가 10 cm 접시에 ECM 솔루션의 4 mL 4 ° C에서 하룻밤.
참고: 준비 하는 동안 얼음에 ECM 솔루션을 배치 합니다.
- ECM 솔루션 코팅 접시를 준비 하려면 추가 10 cm 접시에 ECM 솔루션의 4 mL 4 ° C에서 하룻밤.
- 하루-3
- 첫째, 접시에서 ECM 솔루션을 제거 하 고 셀 피더-무료 문화 매체의 8 mL을 추가.
- 시작 하려면 경작 지류-무료, 린스 배양된 세포를 PBS와 한번 세척.
- SNL 피더 세포 시작 접시의 바닥에서 분리 될 때까지 RT에서 CTK 솔루션의 1 mL를 추가 합니다.
참고: 현미경을 사용 하 여 모든 피더 세포는 바닥에서 분리 확인. - CTK 솔루션을 제거 하 고 모든 SNL 피더 세포 완전히 제거 되도록 두 번, PBS로 세척.
- 접시에 셀 피더-무료 문화 매체의 1 mL을 추가 다음 긁는 긁는 도구를 사용 하 여 셀 고 15 mL 원뿔 튜브로 그들을 수집 합니다.
- 부드럽게 플라스틱 세 번 사용 하 여 1000 µ L 팁 내용 다음 새로운 ECM 솔루션 코팅 10 cm 접시 (1.2.1 단계 준비)에 전송 합니다. 약 1:2 1:4, 경작 지류 무료 전에 합류 비율에 따라 분할 비율을 사용 합니다.
- 하루-1에 매체를 변경 하는 3 일 동안 37 ° C, 5% CO2 인간의 Ipsc를 품 어.
- -PSM 유도 시작 하기 전에 (4 일) 4 일
2. PSM 차별화 및 형광 활성화 셀 정렬 (FACS) 격리
-
PSM 차별화 (0-하루 4)
- 급지대 무료 세포 배양 매체를 발음 하 고 PSM 유도 매체의 8 mL을 추가 (CDM 기저 매체 10 µ M와 보충 SB431542, 10 µ M CHIR99021, 2 µ M DMH1, 및 20 ng/mL FGF2, 표 1참조).
참고: PSM 차별화의 개시에 셀 합류 유도 효율에 대 한 중요 하다. 현미경을 사용 하 여 확인 confluent 비율은 약 30%. - 4 일, 3 일에 매체를 변경에 대 한 37 ° C, 5% CO2에서 세포를 품 어.
- FACS (2.2, 아래 섹션) 4 일에 대 한 베스트 셀.
- 급지대 무료 세포 배양 매체를 발음 하 고 PSM 유도 매체의 8 mL을 추가 (CDM 기저 매체 10 µ M와 보충 SB431542, 10 µ M CHIR99021, 2 µ M DMH1, 및 20 ng/mL FGF2, 표 1참조).
-
절연 DLL1 긍정적인 PSM 셀 형광 활성화 (FACS) 정렬
참고: 아래 FACS DLL1 긍정적인 셀의 정렬 하기 전에 셀 준비를 위한 절차입니다. 제조 업체의 프로토콜에 따라 FACS 교류 cytometer를 사용 하 여 분류를 수행 합니다.- 매체, 발음 후 PBS로 세척. 그 후, 셀 분리 시 약의 1 mL을 추가 하 고 실시간에 3 분 동안 떠나
- CDM 기저 매체의 4 개 mL를 추가 하 고는 스 크레이 퍼를 사용 하 여 셀을 긁어 15 mL 원뿔 튜브로 그들을 수집 합니다.
- 자동된 셀 카운터를 사용 하 여 셀 수를 계산 후 3 분 동안 280 x g 에서 원심.
- 조심 스럽게는 상쾌한 열망을 FACS 버퍼에 셀 resuspend ( 표 1참조) 1.0 x 107 셀/mL의 농도에서. 부정적인 컨트롤 샘플 (isotype 제어, 또는 항 체 없이 대회에), 15 mL 원뿔 튜브로 50 µ L를 전송 하 고 다음 FACS 버퍼의 450 µ L로 일시 중단.
- 추가 DLL1 항 체 ( 재료의 표참조) 1/200의 비율로. 빛에서 튜브를 보호 하 고 30 분 동안 얼음에 계속.
- 3 분 280 x g 에서 원심 분리기.
- 신중 하 게는 상쾌한 발음 하 고 FACS 버퍼 (107 셀/mL x 1.0) 1 mg/mL DAPI 보충에 resuspend.
- 35 µ m 나일론 메쉬 필터링, 모자에 통합 컬렉션 튜브로 이동 다음 장소는 관 얼음에 정렬 완료 될 때까지. 부정적인 컨트롤 샘플 (2.2.4 단계)와 동일한 절차를 수행 합니다.
- 제조 업체의 프로토콜에 따라 교류 cytometer를 사용 하 여 정렬을 수행 합니다.
- 10 µ M Y27632의 보충 CDM 기저 매체의 4 mL를 포함 하는 15 mL 원뿔 튜브로 정렬된 DLL1 긍정적인 세포를 수집 합니다. 총 RNA 추출에 대 일 분 280 x g 에서 원심 RNA 세포의 용 해 버퍼에서 resuspend 그리고-30 ° c.에 저장 RNA 추출, 반전 녹음 방송, 그리고 실시간 정량 Pcr 절차 (섹션 5.1) 자세한 내용은 참조 하십시오.
- SM 차별화에 따라 정렬된 셀을 사용 하 여 수행 하는 프로토콜 (제 3) 아래.
3. SM PSM에서 차별화
-
정렬 된 DLL1 긍정적인 PSM 세포 (주 4 일 8)에서 SM 차별화
참고: FACS 정렬 전날 ECM 솔루션 코팅 12-잘 접시를 준비. ECM 솔루션 코팅 12-잘 접시를 준비 하려면 4 ° C에서 각 음에 ECM 솔루션의 1 mL을 추가 하 고 하룻밤 둡니다. 준비 하는 동안 얼음에 ECM 솔루션을 유지.- 다음 단계 2.2.10, 280 x g 에서 원심 분리기 3 분.
- 신중 하 고 상쾌한 발음 하 고 SM 유도 매체의 1 mL에 resuspend (10 µ M으로 보충 하는 CDM 기저 매체 SB431542 5 µ m CHIR99021, 표 1참조).
- 자동된 셀 카운터를 사용 하 여 셀 수를 계산 합니다.
- ECM 솔루션 코팅 12 잘 플레이트의 SM 유도 매체 10 µ M Y27632의 보충의 1 mL를 포함 하는 각 우물에 시드 1.0 x 105 셀.
- 8 일까지 4 일 동안 5% CO2 와 37 ° C에서 품 어. Y27632 주 5 (FACS 정렬 후 일)에 7 일을 포함 하지 않는 매체를 변경 합니다.
- SM 파생 상품 차별화 아래 프로토콜에 따라 유도 SM 셀을 사용 하 여 수행 합니다. 유도 SM 셀에서 총 RNA 추출, 15 mL 원뿔 튜브와 3 분, 280 x g 에서 원심 분리기는 세포를 수집 다음 RNA 세포의 용 해 버퍼에서 resuspend와-30 ° c.에 저장
4. SM에서 SM (DM, 묘, D, SCL, SYN) 파생 상품 차별화
참고: SM 셀의 전체 능력을 보여 먼저 DM (dermomyotome)와 SCL (sclerotome) 유도 따라 iPSC 파생 SM 셀을 사용 하 여 수행 합니다. 그 후, 묘 (myotome)와 D (dermatome) 유도 DM 셀을 사용 하 여 수행 하 고 SCL 셀을 사용 하 여 SYN (syndetome) 유도 실시. 아래는 생체 외에서 유도 SM 셀에서 각 파생 (DM, 묘, D, SCL, 및 SYN)의 유도 대 한 프로토콜입니다.
-
SM 셀 (하루 하루 8-11)에서 DM 차별화
- 매체, 발음 다음 DM 유도 매체의 1 mL을 추가 (CDM 기저 매체 5 µ M와 보충 CHIR99021 그리고 10 ng/mL BMP4, 표 1참조).
- 하루 11까지 3 일 동안 37 ° C, 5% CO2에서 세포를 품 어. 10 일 (하루 2 DM 유도)에 매체를 변경 합니다.
- 묘와 DM 셀 아래의 프로토콜에 따라 유도 D 차별화를 사용 하 여.
-
디 엠 세포 (일 11-주 41)에서 묘 차별화
- 매체, 발음 다음 묘 유도 매체의 1 mL을 추가 (5 µ M로 보충 하는 CDM 기저 매체 CHIR99021, 표 1참조).
- 하루 41까지 30 일 동안 37 ° C, 5% CO2에서 세포를 품 어. 매체 마다 3 일 변경 합니다.
-
디 엠 세포 (11-주 20 주)에서 D 차별화
- 매체, 발음 다음 D 유도 매체의 1 mL을 추가 (CDM 기저 매체 5 µ M와 보충 CHIR99021 그리고 10 ng/mL BMP4, 표 1참조).
- 하루 20까지 9 일 동안 37 ° C, 5% CO2에서 세포를 품 어. 매체 마다 3 일 변경 합니다.
-
SM 셀 (하루 하루 8-11)에서 SCL 차별화
- 매체, 발음 다음 SCL 유도 매체의 1 mL을 추가 (CDM 기저 매체 보충 100 nM SAG 및 0.6 µ M LDN193189, 표 1참조)14.
- 3 일 동안 37 ° C, 5% CO2에서 세포를 품 어. 10 일 (하루 2 SCL 유도)에 매체를 변경 합니다.
- SYN 차별화 아래 프로토콜에 따라 유도 SCL 셀을 사용 하 여 수행 합니다.
-
SCL 셀 (일 11-주 32)에서 SYN 차별화
참고: ECM 솔루션 코팅 24-잘 접시 SYN 유도 시작 하기 전에 날 준비. ECM 솔루션 코팅 24-잘 접시를 준비 하려면 4 ° C에서 각 음에 ECM 솔루션의 0.5 mL을 추가 하 고 하룻밤 둡니다. 준비 하는 동안 얼음에 ECM 솔루션을 유지.- 매체를 발음 그리고 PBS, 씻어 다음 각 잘 하 셀 분리 시 약의 0.2 mL를 추가 실시간에 3 분 동안 떠나
- 각 잘에 CDM 기저 매체의 0.8 mL을 추가 다음 긁 고 15 mL 원뿔 튜브로 모든 셀을 수집 합니다.
- 3 분 280 x g 에서 원심 분리기.
- 신중 하 게는 상쾌한 발음 하 고 SYN 유도 매체-1의 1 mL에 resuspend (CDM 기저 매체 20 ng/mL FGF8, 보충 표 1참조), 자동화 된 셀 카운터를 사용 하 여 셀의 수를 계산 하는 다음.
- ECM 솔루션 코팅 24 잘 플레이트의 SYN 유도 매체-1의 1 mL를 포함 하는 각 우물에 씨 5.0 x 104 셀.
- 3 일 동안 37 ° C, 5% CO2에서 품 어.
- 하루 14 (하루 3 SYN 유도), 대체 매체 SYN 유도 매체-2 (CDM 기저 매체 10 ng/mL BMP7와 10 ng/mL TGFβ3, 보충 표 1참조).
- 하루 32까지 18 일 동안 37 ° C, 5% CO2에서 품 어. 매체 마다 3 일 변경 합니다.
5입니다. iPSC 파생 제품의 특성
참고: 차별화에 따라 양적 실시간 PCR (RT-정량), immunocytochemistry (ICC), 효소 연결 된 immunosorbent 분석 실험 (ELISA), 및 기계 스트레치 자극 분석를 사용 하 여 인간의 Ipsc 파생 상품 특징.
-
셀 수확, 총 RNA 추출, 반전 녹음 방송, 그리고 실시간 정량 PCR (RT-정량) 분석
- 1.5 mL 튜브에 세포 샘플 (절차 2.2.10, 3.1.6, 5.4.3)를 수집 다음 3 분 280 x g 에서 원심.
- 상쾌한, 다음 적절 한 총 RNA 추출 키트에서 제공 하는 RNA 세포의 용 해 버퍼의 350 µ L에서 resuspend.
- 제조 업체의 프로토콜에 따라 키트를 사용 하 여 전체 RNA를 추출 합니다.
- 역은 제조업체의 프로토콜에 따라 총 RNA, cDNA의 고립 된 1 µ g을 녹음.
- 실시간 정량 Pcr 적당 한 효소, 시 약, 그리고 제조 업체의 프로토콜에 따라 프라이 머를 사용 하 여 수행 합니다. 이 연구에 사용 된 뇌관 시퀀스는 표 2에 나열 됩니다.
-
Immunocytochemistry (ICC)
- 항 체와 immunocytochemistry를 수행 하기 전에 10 분, 4 ° C에서 2 %paraformaldehyde 셀을 수정 하 고 PBS로 두번 세척.
- Permeabilization를 위한 15 분 동안 4 ° C에 0.2% 메탄올 또는 0.2% 법무부 20/PBS (PBS T 칭함) 품 어.
- Permeabilization 시 약을 제거 하 고 치료는 적절 한 차단 버퍼 또는 1% 소 혈 청 알 부 민/PBS 60 분 동안 4 ° C에서 셀.
- 첫 번째 항 체 10% 블로킹 버퍼 PBS-T와 4 ° C에서 떨고 기계에 장소에서 하룻밤 희석을 추가 합니다.
- PBS-T로 세 번 세척 (PBS-T를 추가 하 고 10 분에 대 한 실시간에 떨고 기계에).
- 두 번째 항 체, PBS-T와 60 분에 대 한 실시간에 떨고 기계에 10% 블로킹 버퍼 희석을 추가 합니다. 이 연구에 사용 된 ICC에 대 한 첫 번째 및 두 번째 항 체는 표 3에 나열 됩니다.
참고: 이 단계 이후부터 호 일에 감싸서 빛에서 접시/접시를 보호 합니다. - PBS-t.로 두 번 씻어
- 카운터 얼룩, 추가 1/5000 DAPI PBS와 5 분 RT에 떨고 기계에 희석 합니다.
- DAPI 솔루션을 제거 하 고 각 우물에 PBS를 추가.
- 형광 현미경을 사용 하 여 셀 얼룩이 관찰 합니다. 또는, 1 개월 최대 4 ° C에서 접시/접시를 저장 합니다.
-
효소 연결 된 Immunosorbent 분석 결과 (ELISA) iPSC 파생 D의 기능 분석에 대 한
참고: 인간 피부 섬유 아 세포 세포 (HDF) 상업적으로 사용할 수 있습니다. HDF DMEM 보충 10% 태아 둔감 한 혈 청에서에서 문화 ( 표 1참조).- 각 문화 매체의 1 mL를 포함 하는 24-잘 접시에 iPSC 파생 D 및 HDF의 씨앗 1.0 x 105 셀 (d: D 유도 매체, HDF: DMEM 10% 태아 둔감 한 혈 청으로 보충).
- 세포 배양의 3 일 수집 후 각 매체의 100 µ L 1.5 mL 튜브에 놓고 4 ° c.에 저장
- 제조업체의 지시에 따라 절차, 탐지 항 체 및 이차 항 체의 추가 등의 시리즈를 수행 하 고 컨트롤의 농도 대 한 표준 곡선을 생성 하 여 대상의 수를 계량 분석 샘플입니다.
-
IPSC 파생 SYN의 기능 분석을 위한 기계 스트레치 자극 시험
참고: 성인 인간 tenocytes는 상용 ( 재료의 표참조). 문화 인간의 iPSC 파생 SYN 및18,19아래 설명 된 대로 기계 스트레치 자극 분석 결과 대 한 장치를 기지개 하는 셀에 성인 인간 tenocytes. 사용 하 여 SYN 유도 매체-2와 tenocytes 성장 매체 ( 재료의 표참조) 각 iPSC 파생 SYN 및 성인 인간 tenocytes에 대 한 자란 매체로 각각.- 스트레칭 하기 전에 24 h, iPSC 파생 SYN 및 ECM 솔루션 코팅 멀티 잘 형 실리콘 고무에 인간 tenocytes의 판 1.0 x 105 세포 챔버, 각각 1.5 cm x 1.5 cm의 문화 표면 ( 재료의 표참조).
- 셀 스트레칭, 장치에는 챔버를 설정 하 고 monoaxial 주기적 스트레인 (0.5 Hz, 5%)을 강제로 12 h에 대 한.
- 총 RNA 추출에 대 한 RNA 세포의 용 해 버퍼의 350 µ L을 추가 하 고 긁어 한 총 RNA 추출 및 후속 실시간 정량 분석 (절차 5.1 참조)에 대 한 1.5 mL 튜브에 세포를 수집.
결과
이 보고서에 있는 모든 숫자는 201B7-PAX3-GFP Ipsc, EGFP exon 1에 있는 PAX3 코딩 순서의 1 개의 대립 유전자를 대체와 함께 얻은 했다. 201B7-PAX3-GFP Ipsc의 설립 될 것 이다 (H. 사쿠라이, 개인 통신) 설명 되어. 통계적 의미는 통계 소프트웨어를 사용 하 여 평가 되었습니다. P-값 낮은 보다 0.05 중요 하 게 고려 했다.
인간의 iPSC 파생 PSM 및 SM 셀의 특성
PSM 상태 (그림 2A), FACS 분석 통해 SM으로 인간의 Ipsc의 차별화를 평가 하기 위해 ICC 분석, 그리고 실시간 정량 분석 수행 했다. 그림 2B에서 같이, 이상 세포의 85% 있었다 DLL1, 하지만 PAX3, SM의 표식에 대 한 부정적인 PSM의 표식에 대 한 긍정적인 인간의 Ipsc와 PSM 유도의 4 일 후. 그 후,이 인구 SM 유도의 4 일 후 PAX3 긍정적인 SM 셀이 되었다. PSM-SM 전환 또한 ICC (그림 2C) 및 실시간 정량 (그림 2D)에 의해 확인 되었다. TBX6, MSGN1, 및 WNT3A, PSM 마커 PSM 상태 (4 일)에서 표현 했지만 SM 상태 (주 8)에서 표현 되지. PARAXIS, MEOX1, 및 PAX3, SM 마커, SM에 표현 했지만 PSM에 표현 되지. 또한,에 셀 셀, CHIR99021와 SB431542의 추가 따라 축적만의 CDH11, epithelialized SM의 마커 얼룩 (그림 2E).
인간의 iPSC 파생 SM 셀에서 SM 파생 상품의 특성화 유도
인간의 iPSC 파생 된 SM의 차별화 효능 평가, DM, 묘, D, SCL, 및 SYN (그림 3A) 차별화 ICC 분석과 PAX3 (GFP)에 의해 평가 되었다-형광. 그림 3B에서 같이, DM 차별화 EN1 및 ALX4에 의해 확인 되었다, 얼룩이 지 고 PAX3 (GFP)-형광; 묘 차별화 MYOD, MYOG, 및 Myosin 무거운 체인 (MHC) 얼룩;에 의해 확인 되었다 D 차별화 EN1 및 PDGFRa 얼룩;에 의해 확인 되었다 SCL 차별화 PAX1, PAX9, 그리고 얼룩; NKX3.2에 의해 확인 되었다 SYN 차별화 SCX, MKX, COL1A1, 및 COL1A2에 의해 확인 되었다 그리고 얼룩이 지기.
유도 및 SYN의 특성
1. 효소 연결 된 immunosorbent 분석 결과 (ELISA) iPSC 파생 D의 기능 분석에 대 한
인간의 신체에서 피부 섬유 아 세포의 기본 기능 중 하나는 피부를 수 화와 피부 구조를 유지할 수 있도록 하는 콜라겐과 히 알루 론 산 등의 세포 외 기질 (ECM) 단백질을 분 비 하입니다. 그림 4A와 같이 콜라겐 타입 1과 히 알루 론 산 단백질의 유사한 금액 iPSC 파생 D와 HDF의 문화 매체에 은닉 했다 입증, ELISA 수행 되었다.
2. 기계 스트레칭 자극 iPSC 파생 SYN의 기능 분석에 대 한 분석 결과
여러 연구 결과 이미 보고, 기계적 자극 힘 줄 개발 출생 전후에 영향을 미치는 고 전조 세포18,19에서 tenocytes의 분화를 촉진. 따라서, 그것은 잘 알려진 기계적 스트레스에 반응 tenocytes의 특성 중 하나입니다. 입증 하기 위해 인간의 iPSC 파생 SYN 및 인간 성인 tenocytes의 비교 반응성, 기계적 스트레칭 자극 분석 결과 그림 4B와 같이 수행 되었다.
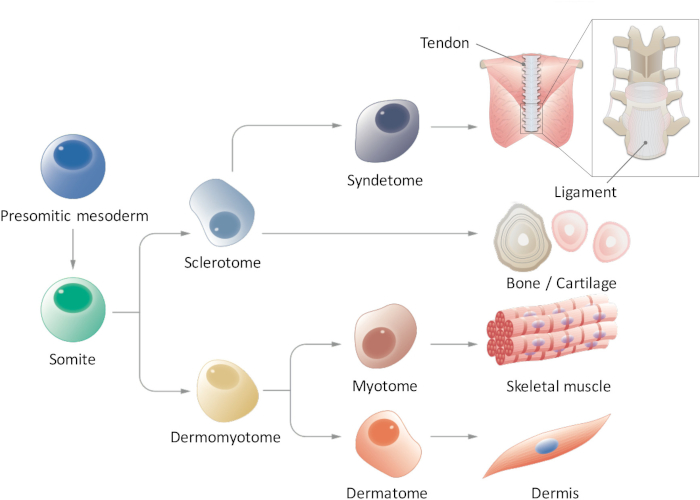
그림 1: paraxial mesoderm의 계층적 분화의 회로도 보기. Presomitic mesoderm는 세포 인구를 뚜렷이 초기 embryogenesis 동안 나온다 양식 somites 세분화를 겪 습. Somites는 여러 세포 유형, sclerotome, dermomyotome, syndetome, dermatome, 및 myotome 셀, 결국 힘 줄 또는 인 대, 뼈/연골, 골격 근육 및 피부에 차별화 등을 생겨나게 하는 일시적인 줄기 세포 인구 셀입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
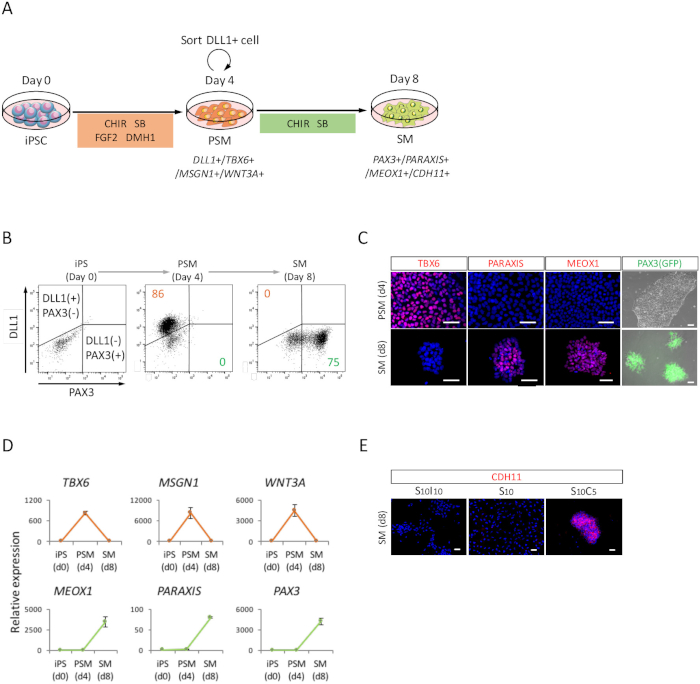
그림 2: 인간의 iPSC 파생 PSM 및 SM. FACS, RT-정량, 및 ICC 분석 (A) PSM 통해 SM 차별화에 대 한 프로토콜의 구조도 볼 수 있습니다. (B) DLL1 얼룩 및 PAX3 (GFP)의 대표 점 줄거리-PSM 유도의 4 일에 하루 4 (iPSC에서 하루 8) SM 유도 형광. (C) 대표 immunocytochemical 이미지와 PAX3 (GFP)-PSM 유도의 4 일에 하루 4 (iPSC에서 하루 8) SM 유도 형광. 셀은 스테인드 안티-TBX6, PARAXIS, 및 MEOX1 항 체 (레드)와 공동 DAPI (파란색)으로 물 또는 PAX3 (GFP)을 발견-형광 (녹색). (D) 마커 PSM 및 SM iPSC에서 PSM 및 SM의 실시간 정량 분석. 실험의 3 세트에서 수단 ± 표준 오차 (남동) 표시 됩니다. (E) 대표 immunocytochemical S10I10에서 경작 하루에 4 (iPSC에서 하루 8) SM의 이미지 (SB431542 및 IWR1, WNT 신호의 억제제의 조합), S10 (SB431542), 및 S10C5 (SB431542와 CHIR99021의 조합) 조건. 셀 (빨간색) 안티-CDH11 항 체로 얼룩진 고 공동 DAPI (파란색)으로 물. iPS, 유도 만능 줄기 세포; PSM, presomitic mesoderm; SM, somite; S10, SB431542 10 Μ M; C5, CHIR99021 5 Μ M; I10, IWR1 10 Μ M; 스케일 바 = 50 μ m. 이 그림은 나카지마 외. (2018)15에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
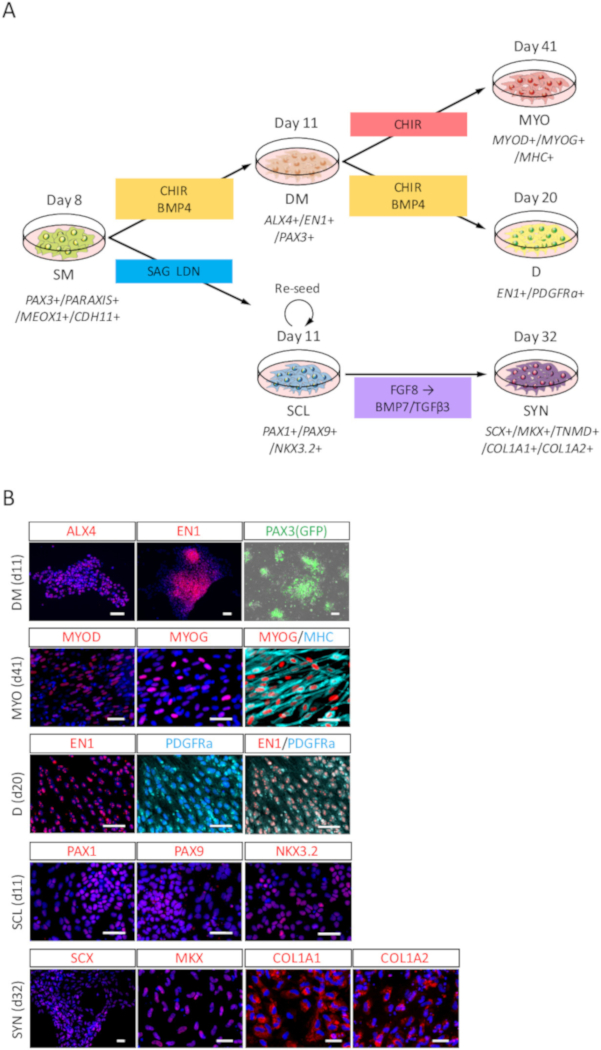
그림 3: 인간의 iPSC 파생 된 SM.에서 차별화 된 DM, 묘, D, SCL, SYN의 ICC 분석 (A) SM 파생 상품 차별화에 대 한 프로토콜의 구조도 볼 수 있습니다. (B) 대표 immunocytochemical 이미지와 PAX3 (GFP)-DM 유도의 일 3 (iPSC에서 11 일), 묘 유도의 일 30 (iPSC에서 41 일), 9 (iPSC에서 하루 20) D 유도의 SCL 유도, 3 (iPSC에서 11 일) 하루 일과 하루 21 (주 32에 형광 iPSC)에서 SYN 유도의. DM, 셀 안티-ALX4와 EN1 항 체 (레드) 스테인드과 공동 DAPI (파란색)으로 물 또는 PAX3 (GFP)을 발견-형광 (녹색); 묘, 셀 안티 MYOD, MYOG (빨강)와 MHC (녹청) 항 체, 또한 공동 DAPI (파랑); 물 묻은 했다 D, 셀 안티-EN1 (빨강) 및 PDGFRa (녹청) 항 체로 얼룩진 되었고 DAPI (파랑); 공동 물 SCL, 셀은 (빨간색) 항 체, 안티 PAX1, PAX9와 NKX3.2 얼룩이 지 고 공동 물 DAPI (파랑); SYN, 셀은 (빨간) 항 체, 안티 SCX, MKX, COL1A1와 COL1A2 얼룩이 지 고 공동 DAPI (파란색)으로 물. DM, dermomyotome; 묘, myotome; D, dermatome; SCL, sclerotome; SYN, syndetome; 스케일 바 = 50 μ m. 이 그림은 나카지마 외. (2018)15에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
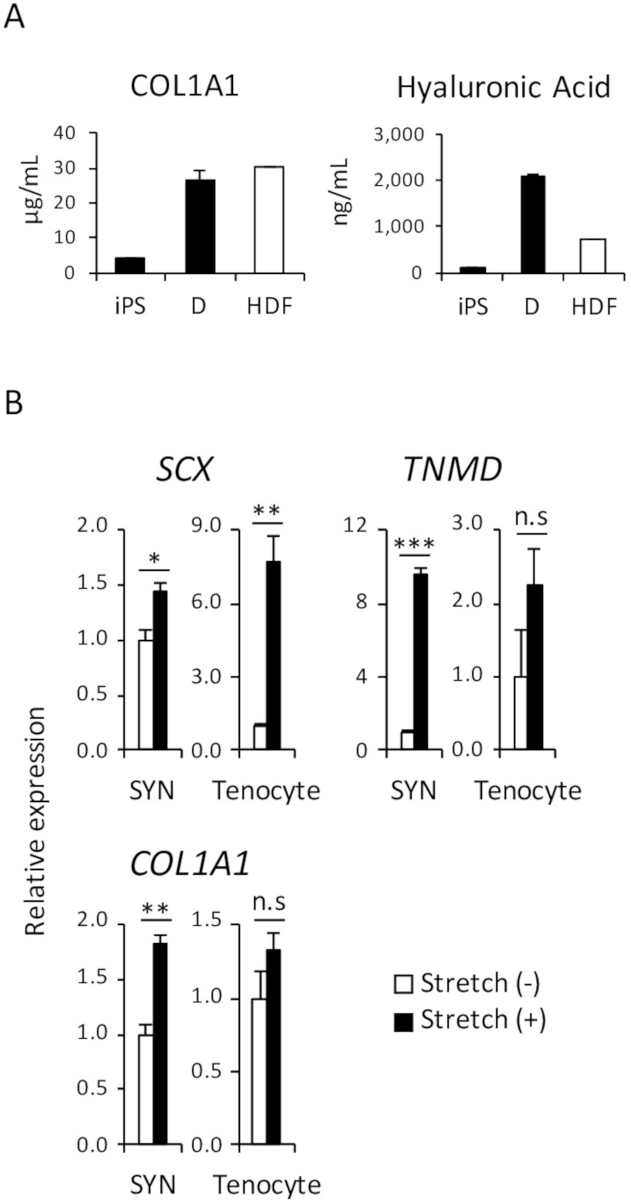
그림 4: 유도 D와 합성의 기능 분석 결과 (A) 양의 콜라겐 타입 1과 히 알루 론 산 문화 매체에서 단백질 ELISA 분석 했다. (B) 기계 스트레치 효과 자극 유발된 SYN에 인간 성인 tenocytes 실시간 정량 Pcr에 의해 평가 되었다. 실험의 3 세트에서 수단 ± 표준 오차 (남동) 표시 됩니다. * p < 0.05; * * p < 0.01; p < 0.001 Dunnett의 여러 비교 t-검정 스트레치 (--);에 비해 여 n.s, 중요 하지, HDF, 인간 성인 피부 섬유 아 세포. 이 그림은 나카지마 외. (2018)15에서 수정 되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
| 매체/솔루션 | Reagant | 농도 |
| CDM 기저 매체 | Iscove의 Dulbecco의 매체/햄의 F12 수정 | 1:1 |
| 페니실린/스 | 0.5% | |
| 화학적으로 지질 집중을 정의 | 1% | |
| Apo 처리가 | 15 mg/mL | |
| Monothioglycerol | 450 m m | |
| 소 혈 청 알 부 민 | 5 mg/mL | |
| 인슐린 | 7 mg/mL | |
| CTK 솔루션 | 물 | - |
| 트립 신 | 0.25% | |
| 콜라 4 | 0.1 mg/mL | |
| 염화 칼슘 | 1mm | |
| 녹아웃 SR | 20% | |
| D 유도 매체 | CDM 기저 매체 | - |
| CHIR99021 | 5 Μ M | |
| BMP4 | 10 ng/mL | |
| DM 유도 매체 | CDM 기저 매체 | - |
| CHIR99021 | 5 Μ M | |
| BMP4 | 10 ng/mL | |
| ECM 솔루션 | 인공 세포 외 매트릭스 | 0.3 m g/mL |
| DMEM/F12 | - | |
| FACS 버퍼 | PBS | - |
| 소 혈 청 알 부 민 | 0.1% | |
| 급지대 무료 세포 배양 매체 | mTeSR1 | - |
| 페니실린/스 | 0.5% | |
| HDF 문화 매체 | DMEM | - |
| 소 태아 혈 청 | 10% | |
| hESC 매체 | 영장류 ES 세포 매체 | - |
| 페니실린/스 | 0.5% | |
| FGF2 | 4 ng/mL | |
| 묘 유도 매체 | CDM 기저 매체 | - |
| CHIR99021 | 5 Μ M | |
| PSM 유도 매체 | CDM 기저 매체 | - |
| SB431542 | 10 Μ M | |
| CHIR99021 | 10 Μ M | |
| DMH1 | 2 Μ M | |
| FGF2 | 20 ng/mL | |
| SCL 유도 매체 | CDM 기저 매체 | - |
| SAG | 100 nM | |
| LDN193189 | 0.6 Μ M | |
| SM 유도 매체 | CDM 기저 매체 | - |
| SB431542 | 10 Μ M | |
| CHIR99021 | 5 Μ M | |
| SYN 유도 매체-1 | CDM 기저 매체 | - |
| FGF8 | 20 ng/mL | |
| SYN 유도 매체-2 | CDM 기저 매체 | - |
| BMP7 | 10 ng/mL | |
| TGFΒ3 | 10 ng/mL |
표 1: 미디어와 솔루션 조리법입니다.
| 이름 | 앞으로 | 역 |
| ACTB | CACCATTGGCAATGAGCGGTTC | AGGTCTTTGCGGATGTCCACGT |
| COL1A1 | GGACACAGAGGTTTCAGTGGT | GCACCATCATTTCCACGAGC |
| MEOX1 | GAGATTGCGGTAAACCTGGA | GAACTTGGAGAGGCTGTGGA |
| MSGN1 | GGAGAAGCTCAGGATGAGGA | GTCTGTGAGTTCCCCGATGT |
| PARAXIS | TCCTGGAGAGCTGTGAGGAT | CACACCCTGTCACCAACAGT |
| PAX3 | AGGAAGGAGGCAGAGGAAAG | CAGCTGTTCTGCTGTGAAGG |
| SCX | CCCAAACAGATCTGCACCTTC | GCGAATCGCTGTCTTTCTGTC |
| TBX6 | AGCCTGTGTCTTTCCATCGT | AGGCTGTCACGGAGATGAAT |
| TNMD | CCCTTCATGCTGAAGCCACTT | CTCACTTTCAGCAGAATTGGGG |
| WNT3A | CAAGATTGGCATCCAGGAGT | ATGAGCGTGTCACTGCAAAG |
표 2: 뇌관 시퀀스 RT-정량 분석에 대 한.
| 농도 | ||
| 1 항 체 | ALX4_Goat | 1/50 |
| CDH11_Mouse | 1/1000 | |
| COL1A1_Rabbit | 1/100 | |
| COL2A1_Mouse | 1-2 μ g/mL | |
| EN1_Rabbit | 1/50 | |
| MEOX1_Rabbit | 1/50 | |
| MHC_Rabbit | 1/200 | |
| MKX_Rabbit | 1/50 | |
| MYOD_Rabbit | 1/500 | |
| MYOG_Mouse | 1/400 | |
| NKX3.2_Rabbit | 1/50 | |
| PARAXIS_Rabbit | 1/50 | |
| PAX1_Rabbit | 1/50 | |
| PAX9_Rabbit | 1/50 | |
| PDGFRa_Goat | 1/100 | |
| SCX_Rabbit | 1/50 | |
| TBX6_Goat | 1/50 | |
| 2 항 체 | 염소 IgG(H+L) 보조 antibody555 안티 당나귀 | 1/500 |
| 염소 IgG(H+L) 보조 antibody647 안티 당나귀 | 1/500 | |
| 마우스 IgG(H+L) 보조 antibody555 안티 염소 | 1/500 | |
| 염소 토끼 IgG(H+L) 보조 antibody555 안티 | 1/500 | |
| 염소 토끼 IgG(H+L) 보조 antibody647 안티 | 1/500 |
표 3: 첫 번째 ICC에 대 한 항 체를 두 번째.
토론
PSM 통해 PSC 파생 된 SM의 유도 대 한 잘 알려진 방법에서 PSC, PSM 유도 동안 하지만6PSM 성숙 과정 동안 CHIR99021 + A83-01 (TGFβ 억제제)의 조합입니다. 현재 연구에서 WNT/베타-catenin 신호는 저해 C59 PSM에서 SM 유도를 사용 하 여. 그러나, 우리 SM 차별화 중 WNT 통로 활성화 하는 CHIR99021의 사용을 소개 했다. 이 결정 찾는 여러 WNTs는 SM의 주변 조직에 표현 하 고 주어진 사실 WNT 기자 SM20에서 활동에 따라 되었다. 결과적으로, 우리는 epithelialization, vivo에서, CHIR99021와 조건만 SM의 특징-셀 연결 (그림 2E)에 CDH11의 축적에 따라 관찰 했다. 이 관측 WNT PSM 차별화 및 SM epithelialization, 신호 따라서 우리의 프로토콜 생 신호 환경 정리 더 수의 중요 한 참여를 나타냅니다. 그러나, 그것은 또한 견고성과 차별화의 효율성 세포 유형, 셀 라인, 그리고 다양 한에 따라 크게 달라질 수 있으므로 WNT/베타-catenin 신호 전달 경로 차별화, 동안 조정의 더 가능성을 의미 WNT inducers 각 연구원에 의해 사용의 화학 화합물.
이 메서드는 또한 모든 4 개의 SM 파생 상품, 묘, D, SCL, 및 생성 SYN, 인간의 Ipsc에서 우리 수 있습니다. CDM을 사용 하 여 우리의 stepwise 프로토콜 인간 somitogenesis/somite 패턴화, 동안 신호 요구 사항을 식별 하는 데 수 고 인간의 SM 개발에 중요 한 통찰력을 제공 합니다. 예를 들어 우리의 방법을 세분화 시계 메커니즘, SM의 형성을 조절 하는 분자 진동 시스템을 공부 하는 데 유용 수 있습니다. 그것은 철저 하 게 조사 쥐, 병아리, 그리고 zebrafish, 인간의 적절 한 실험 도구의 부족 때문에.
또한, 우리의 방법은 미래 임상 세포 기반 치료에 적용할 수 있습니다. 예를 들어 인간의 iPSC 파생 D 또는 SYN 심하게 다친된 피부에 이식 될 수 있습니다 또는 재생 및 치료 힘 줄 파열. 그러나, 몇 가지 제한이이 방법은 실질적으로 적용 될 수 있습니다 전에 해결 될 필요가 있다. 현재 연구에서 우리는 iPSC 유지 보수 및 유도, 중 접시에 표면 코트로 Engelbreth-Holm-떼 마우스 육 종에서 추출 되는 ECM 솔루션에 대 한 SNL 피더 세포를 사용 하지만 이러한 비 인간 동물 파생 된 시 약 해야 임상 품질을 향상 시키기 위해 제거. 또한, 셀 수량 및 품질, 순도 및 원하는 셀의 성숙, 포함 해야 합니다 또한 향상 될. 또한, 휴대폰 번호 뿐만 아니라 셀 힘 힘 줄 또는 인 대 재생에 대 한 중요 한 특성입니다. 또한, 정화에 대 한 표면 마커 및 3D 재구성 하는 새로운 방법의 개발은 임상 세포 기반 요법을 우리의 프로토콜을 전진 하기 위하여 불가결.
공개
저자는 공개 없다.
감사의 말
우리에 대 한 프로젝트 관리 및 자금 수집, 미스터 Mitsuaki 시바타 (CiRA)와 양 메이 테라 (CiRA) 그들의 기술 지원, 박사 야요이 토 유카 (CiRA) 및 박사 카 미 야 다이스케 (CiRA)로 그의 도움에 대 한 박사 준 Toguchida (CiRA)를 감사 하 고 싶습니다. 그들의 교정 원고, 및 씨 마사 야 Todani (CiRA)의 그림 (그림 1)를 제공 하. 우리는 또한이 연구 기간 동안 그들의 지원을 위해 이케야 및 Toguchida 실험실 (CiRA)의 모든 회원을 감사합니다. 이 작품에 의해 지원 되었다 보조금 일본 사회에서 과학적인 연구를 위한 대는 승진의 과학 (JSP) (26670661), 일본 과학 및 기술에서 다루기 힘든 질병 연구 활용 질병 특정 iPS 세포를 위한 프로그램 기구 (JST)와 의료 연구 및 개발 (아메드) 일본 기관, 연구 센터 네트워크 실현 재생 의학 (JST/아메드)의 iPS 세포 연구와 iPS 세포 연구 기금에 대 한 핵심 센터 (마코토 이케야 하는 부분에 고 준 Toguchida)입니다. 마코토 이케야 했다 또한 질병 특정 iPS 세포 (아메드)를 활용 하 여 다루기 힘든 질병 연구를 위한 과학 연구 (JSP) (16 H 05447) 및 가속 프로그램에 대 한 보조금에 의해 지원.
자료
| Name | Company | Catalog Number | Comments |
| ALX4_Goat antibody | Santacruz | sc-22066 | |
| Apo-transferrin | Sigma | T1147 | |
| BMP4 | R&D | 314-BP-010 | |
| BMP7 | R&D | 354-BP-010 | |
| Bovine serum albumin | Sigma | A8806 | |
| Calcium chloride | Nacalai tesque | 067730-15 | |
| CDH11_Mouse antibody | Cell signaling | 13577 | |
| Cell streching device | Strex | STB-140 | |
| Chemically defined lipid concentrate | Gibco | 11905-031 | |
| CHIR99021 | Axon | 1386 | |
| COL1A1_Rabbit antibody | Abcam | ab34710 | |
| COL2A1_Mouse antibody | Thermo scientific | MS-235 | |
| Collagenase IV | Thermofisher | 17104019 | |
| DLL1 APC-conjugated_Mouse antibody | R&D | FAB1818A | For FACS |
| DMEM | Sigma | D6046 | |
| DMEM/F12 | Gibco | 11320-082 | |
| DMH1 | Tocris | 4126 | |
| EN1_Rabbit antibody | Abcam | ab70993 | |
| Fetal bovine serum | Nichirei | 171012 | |
| FGF2 | Wako | 060-04543 | |
| FGF8 | Peprotech | 100-25 | |
| Human dermal fibroblast | Cell applications | 160-05a | |
| Human tenocyte | Angio proteomie | cAP-0041 | |
| Insulin | Wako | 090-06474 | |
| Iscove’s modified Dulbecco’s medium/Ham’s F12 | Gibco | 21056023 | |
| Knockout SR | Gibco | 10828028 | |
| LDN193189 | Axon | 1509 | |
| Matrigel | BD bioscience | 354230 | Artificial extracellular matrix |
| MEOX1_Rabbit antibody | Abcam | ab75895 | |
| MHC_Rabbit antibody | Santacruz | sc-20641 | |
| MKX_Rabbit antibody | Atlas antibodies | A83377 | |
| Monothioglycerol | Sigma | M6145 | |
| mTeSR1 | Stemcell tech | 85850 | |
| Multi well-type silicon rubber chamber | Strex | STB-CH-4W | |
| MYOD_Rabbit antibody | Abcam | ab133627 | |
| MYOG_Mouse antibody | Santacruz | sc-12732 | |
| NKX3.2_Rabbit antibody | Sigma | HPA027564 | |
| Novex Donkey anti Goat IgG(H+L) secondary antibody555 | Invitrogen | A21432 | |
| Novex Donkey anti Goat IgG(H+L) secondary antibody647 | Invitrogen | A21447 | |
| Novex Goat anti Mouse IgG(H+L) secondary antibody555 | Invitrogen | A21422 | |
| Novex Goat anti Rabbit IgG(H+L) secondary antibody555 | Invitrogen | A21428 | |
| Novex Goat anti Rabbit IgG(H+L) secondary antibody647 | Invitrogen | A21245 | |
| PARAXIS_Rabbit antibody | Santacruz | sc-98796 | |
| PAX1_Rabbit antibody | Abcam | ab95227 | |
| PAX9_Rabbit antibody | Gene tex | GTX104454 | |
| PBS | - | - | |
| PDGFRa_Goat | R&D | AF307 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| Primate ES cell medium | Reprocell | RCHEMD001 | |
| SAG | Calbiochem | 566661 | |
| SB431542 | Selleckchem | SEL-S1067-10 | |
| SCX_Rabbit antibody | Abcam | ab58655 | |
| TBX6_Goat antibody | R&D | AF4744 | |
| Tendon cell growth medium | Angio-proteomie | cAP-40 | Tenocytes growth medium |
| TGFβ3 | R&D | 243-B3-200 | |
| Trypsin | Gibco | 15090046 |
참고문헌
- Tanaka, A., et al. Efficient and reproducible myogenic differentiation from human iPS cells: prospects for modeling Miyoshi Myopathy in vitro. PLoS One. 8 (4), e61540 (2013).
- Sakurai, H., et al. In vitro modeling of paraxial mesodermal progenitors derived from induced pluripotent stem cells. PLoS One. 7 (10), e47078 (2012).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocl. 11 (10), 1833-1850 (2016).
- Chal, J., et al. Differentiation of pluripotent stem cells to muscle fiber to model Duchenne muscular dystrophy. Nature Biotechnology. 33 (9), 962-969 (2015).
- Umeda, K., et al. Human chondrogenic paraxial mesoderm, directed specification and prospective isolation from pluripotent stem cells. Scientific Reports. 2, 455 (2012).
- Loh, K. M., et al. Mapping the Pairwise Choices Leading from Pluripotency to Human Bone, Heart, and Other Mesoderm Cell Types. Cell. 166 (2), 451-467 (2016).
- Xi, H., et al. In Vivo Human Somitogenesis Guides Somite Development from hPSCs. Cell Reports. 18 (6), 1573-1585 (2017).
- Chal, J., Pourquie, O. Making muscle: skeletal myogenesis in vivo and in vitro. Development. 144 (12), 2104-2122 (2017).
- Tam, P. P., Beddington, R. S. The formation of mesodermal tissues in the mouse embryo during gastrulation and early organogenesis. Development. 99 (1), 109-126 (1987).
- Aulehla, A., Pourquie, O. Signaling gradients during paraxial mesoderm development. Cold Spring Harbor Perspectives in Biology. 2 (2), a000869 (2010).
- Christ, B., Scaal, M. Formation and differentiation of avian somite derivatives. Advances in Experimental Medicine and Biology. 638, 1-41 (2008).
- Brent, A. E., Schweitzer, R., Tabin, C. J. A somitic compartment of tendon progenitors. Cell. 113 (2), 235-248 (2003).
- Sakurai, H., et al. Bidirectional induction toward paraxial mesodermal derivatives from mouse ES cells in chemically defined medium. Stem Cell Research. 3 (2-3), 157-169 (2009).
- Zhao, J., et al. Small molecule-directed specification of sclerotome-like chondroprogenitors and induction of a somitic chondrogenesis program from embryonic stem cells. Development. 141 (20), 3848-3858 (2014).
- Nakajima, T., et al. Modeling human somite development and fibrodysplasia ossificans progressiva with induced pluripotent stem cells. Development. 145 (16), (2018).
- McMahon, A. P., Bradley, A. The Wnt-1 (int-1) proto-oncogene is required for development of a large region of the mouse brain. Cell. 62 (6), 1073-1085 (1990).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Suzuki, H., et al. targeting of the transcription factor Mohawk in rats causes heterotopic ossification of Achilles tendon via failed tenogenesis. Proceedings of the National Academy of Sciences of the United States of America. 113 (28), 7840-7845 (2016).
- Marturano, J. E., Arena, J. D., Schiller, Z. A., Georgakoudi, I., Kuo, C. K. Characterization of mechanical and biochemical properties of developing embryonic tendon. Proceedings of the National Academy of Sciences of the United States of America. 110 (16), 6370-6375 (2013).
- Maretto, S., et al. Mapping Wnt/beta-catenin signaling during mouse development and in colorectal tumors. Proceedings of the National Academy of Sciences of the United States of America. 100 (6), 3299-3304 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유