Method Article
Dans Vitro génération du Somite dérivés de Human induit Pluripotent Stem cellules
Dans cet article
Résumé
Nous présentons ici un protocole pour la différenciation des cellules souches humaines pluripotentes induites dans chaque dérivé du somite (myotome, sclérotome, dermatome et syndetome) dans des conditions définies chimiquement, qui trouve des applications dans la modélisation de maladies éventuelles et thérapies basées sur les cellules en chirurgie orthopédique.
Résumé
En réponse à des signaux tels que WNTs, OS protéines morphogénétiques (PGB) et sonic hedgehog (SHH) sécrétée par les tissus environnants, somites (SMs) donnent lieu à plusieurs types de cellules, y compris le myotome (MYO), sclérotome (SCL), dermatome (D) et syndetome (SYN) , qui à leur tour développent dans le muscle squelettique, squelette axial, derme dorsale et axial tendon/ligament, respectivement. Par conséquent, la génération de SMs et de leurs dérivés à partir des cellules souches humaines pluripotentes induites (CISP) est essentielle pour obtenir des cellules souches pluripotentes (PSC) pour application en médecine régénératrice et recherche sur les maladies dans le domaine de la chirurgie orthopédique. Bien que les protocoles d’induction pour MYO et SCL du PSC ont été rapportées par plusieurs chercheurs, aucune étude n’a encore démontré l’induction de SYN et D de CISP. Par conséquent, l’induction efficace de SMs tout à fait compétent demeure un défi majeur. Ici, nous récapituler humaine structuration SM avec le CISP humaine in vitro en imitant l’environnement signalisation pendant développement SM poussin/souris et rapport sur les méthodes d’induction systématique des dérivés de la SM (MYO, SCL, D et SYN) de CISP humaine sous chimiquement conditions définies par le biais de la somitiques mésoderme (PSM) et les États de SM. Connaissances en matière de développement de SM poussin/chez la souris a été appliquée avec succès à l’induction de SMs avec le CISP humaine. Cette méthode pourrait être un nouvel outil pour l’étude de somitogenèse humain et structuration sans l’utilisation d’embryons et pour la modélisation de la maladie et de la thérapie cellulaire.
Introduction
Élaboration d’une méthode de différenciation dirigée pour un type de cellule souhaitée du PSC est une étape nécessaire pour traduire l’étude des cellules dérivées de la CFP en applications cliniques. Forcé d’expression des gènes principaux est une stratégie prometteuse pour la différenciation des cellules orgue du PSC et a amélioré notre compréhension de la régulation génétique de détermination destin cellulaire, morphogenèse de l’orgue et l’organisation au cours de l’embryogenèse1. En outre, récapitulant les environnements signalisation endogènes, à l’aide au développement des embryons de souris et poussin comme une feuille de route, est considérée comme essentielle pour la différenciation dirigée de PSC. Toutefois, cette dernière stratégie compte tenu de l’application des cellules dérivées de la CFP dans les études cliniques tels que les thérapies à base de cellules, est plus appropriée car il ne nécessite pas de manipulation génétique.
Plusieurs études ont rapporté l’induction du mésoderme d’être humain et de souris PSC dans les conditions définies chimiquement. En général, ces méthodes sont sont appuyés sur la signalisation activin/nodal/transformant β (TGFβ) facteur de croissance et d’OS protéine morphogénétique (BMP) de signalisation, censé effectuer une différenciation méso-endoderme et mésoderme, ayant pour résultat une efficacité faible induction de la paraxial mésoderme (environ 20 %)2. En d’autres termes, le mésoderme dérivés CFP induit par ces voies de signalisation a été principalement mésoderme plaque latérale et non les mésoderme paraxial. Récemment, quelques études ont démontré la production efficace du mésoderme paraxial dérivés CFP basé sur différentes stratégies3,4,5,6,7,8 . Dans ces études, les CSP ont été cultivées avec des concentrations relativement élevées de glycogène synthase kinase 3 (GSK3) inhibiteurs (activateurs de signalisation WNT), par conséquent l’efficacité de l’induction du mésoderme paraxial atteint 70 % – 95 %6,7 .
Somitogenèse, le mésoderme paraxial tout d’abord forme le mésoderme somitiques (PSM) vers l’arrière, en forme alors des somites (SMs) sur la partie antérieure par le biais du mésenchyme-à-épithéliales transition9,10. Ligand encoche 1 Delta-like (DLL1) est connu pour avoir un rôle essentiel au cours de la somitogenèse, comme contrôle oscillatoire de l’expression DLL1, tant au niveau de l’ARNm et de protéines, réglemente la segmentation SM. SMs a finalement subdivisent en deux parties, donnant naissance à la dermomyotome (DM) sur le dos et sclérotome (SCL) sur le ventre11. Par la suite, le DM différencie dans le dermatome (D), un précurseur du derme et myotome (MYO), un précurseur du muscle squelettique ; en outre, une partie ventrale du SCL forme le syndetome (SYN), un précurseur des tendons et des ligaments12 (Figure 1). Certains chercheurs ont signalé l’induction des dérivés de dérivés CFP SM comme MYO4,13 et14de SCL ; Cependant, il y a plusieurs limites dans ces études. Notamment, étant donné que notre connaissance des signalisation des environnements de D et SYN est fragmentaire, protocoles d’induction pour D et SYN n'ont pas encore été systématiquement établis. Afin de démontrer la compétence-plein de SMs induite du PSC, il est essentiel de montrer la multi-différenciation capacité de SMs induites dans tous les quatre dérivés (D, MYO, SCL et SYN), tandis que des études antérieures ont seulement porté sur spécifiques dérivés de SM. Nous rapportons ici, sur la façon de générer tous les quatre dérivés de SM, notamment D et SYN, fates PSM et SM du CISP humain15. Nous pensons qu’établir une méthode in vitro par étapes que le processus de développement de SM pourrait contribuer à l’étude de la façon dont l’homme SM les modèles se développe durant l’embryogenèse, sans utiliser d’embryons.
Protocole
Tous les protocoles expérimentaux impliquant CISP humaine ont été approuvées par le Comité d’éthique de la faculté de médecine et la Graduate School of Medicine, Université de Kyoto.
1. humain CISP préparation avant Induction
Remarque : La culture humaine CISP (201B7-PAX3-GFP) sur artère SNL cellules16 avec primate ES cellules additionné à 4 ng/mL facteur de croissance fibroblastique base humaine recombinante (FGF2) et 0,5 % la pénicilline et la streptomycine (ci-après désignée comme moyen de CSEh, voir Le tableau 1). Lorsque le rapport de confluence atteint 70 à 80 %, le passage des cellules comme décrit précédemment17.
-
Passage des humains CISP sur SNL alimentation cellules17
- Pour passage, ajouter PBS dans le récipient de culture cellulaire et rincer les cellules. Puis, retirez le PBS (, ce processus va être dénommé lavage avec du PBS).
- Ajouter 1 mL de solution CTK (voir tableau 1) à température ambiante (RT) et attendez jusqu'à ce que les cellules nourricières SNL commencent à détacher le fond du plat.
- Enlever la solution CTK et puis laver deux fois avec du PBS.
- Ajouter 1 mL de milieu de CSEh (voir tableau 1) dans le plat, puis gratter les cellules à l’aide d’un racloir et recueillir dans un tube conique de 15 mL.
- Pipetez doucement le contenu cinq fois en utilisant un embout µL 1 000 et puis les transférer vers une autre boite remplie de CSEh moyen. Utiliser un rapport de 1:4 à 01:10, selon le rapport de confluence avant passage de split. En outre, varier le volume de milieu de CSEh selon l’importance du plat (par exemple, 3 mL pour un plat de 6 cm, 8 mL pour un plat de 10 cm).
- Incuber le CISP humain à 37 ° C et 5 % de CO2.
- Changer le quotidien moyen (sauf pour le lendemain de passage) et la culture des cellules jusqu'à la prochaine procédure de passaging.
-
Feeder-free culture de CISP humain avant l’induction de la PSM
Remarque : pour minimiser l’effet de facteurs de croissance sécrétés par des cellules nourricières SNL, de la culture le CISP humaine dans des conditions sans chargeur avec un milieu de culture cellulaire exempt d’alimentation (voir tableau 1) sur les solutions de la matrice extracellulaire (mec) (voir tableau 1) plat couché pendant 3 jours avant l’induction de la PSM.- Jour -4 (4 jours avant de commencer l’induction PSM)
- Pour préparer le plat de revêtement solution ECM, ajouter 4 mL de solution d’ECM sur un plat de 10 cm à 4 ° C durant la nuit.
Remarque : Placer la solution ECM sur la glace lors de la préparation.
- Pour préparer le plat de revêtement solution ECM, ajouter 4 mL de solution d’ECM sur un plat de 10 cm à 4 ° C durant la nuit.
- Jour -3
- Tout d’abord, retirer le plat de la solution ECM et ajoutez 8 mL de milieu de culture cellulaire exempt d’engraissement.
- Pour démarrer l’engraissement-free culture, laver une fois avec du PBS pour rincer les cellules cultivées.
- Ajouter 1 mL de solution CTK à ta jusqu'à ce que les cellules nourricières SNL commencent à détacher le fond du plat.
Remarque : La microscopie permet de confirmer que toutes les cellules nourricières sont détachent du fond. - Enlever la solution CTK et laver avec du PBS, deux fois, afin que toutes les cellules nourricières SNL sont entièrement enlevés.
- Ajouter 1 mL de milieu de culture cellulaire exempt d’engraissement dans le plat, puis gratter les cellules à l’aide d’un racloir et à leur rassemblement dans un tube conique de 15 mL.
- Doucement la pipette le contenu trois fois, avec une pointe de 1 000 µL, puis transférer dans un plat de solution-enduit 10 cm nouveau ECM (préparé au cours de l’étape 1.2.1). Utiliser un coefficient de fractionnement d’environ 1,2 à 1,4, selon le rapport de confluence avant chargeur-free culture.
- Incuber le CISP humain à 37 ° C et 5 % de CO2 pendant 3 jours, changeant le milieu jour -1.
- Jour -4 (4 jours avant de commencer l’induction PSM)
2. PSM différenciation et l’isolement par cellule activée par Fluorescence triant (FACS)
-
Différenciation de PSM (0 – jour 4)
- Aspirer le milieu de culture cellulaire exempt d’engraissement et ajoutez 8 mL de milieu d’induction de PSM (milieu de base au titre du MDP additionné de 10 µM SB431542, 10 µM CHIR99021, 2 µM DMH1 et 20 ng/mL FGF2, voient tableau 1).
Remarque : Confluence de la cellule lors de l’ouverture de la différenciation de la PSM est critique pour l’efficacité de l’induction. La microscopie permet de confirmer que le rapport confluent est environ 30 %. - Incuber les cellules à 37 ° C, avec 5 % de CO2, pour 4 jours, changeant la moyenne sur 3 jours.
- Récolte des cellules pour les FACS au jour 4 (section 2.2, ci-dessous).
- Aspirer le milieu de culture cellulaire exempt d’engraissement et ajoutez 8 mL de milieu d’induction de PSM (milieu de base au titre du MDP additionné de 10 µM SB431542, 10 µM CHIR99021, 2 µM DMH1 et 20 ng/mL FGF2, voient tableau 1).
-
Isolement des cellules PSM positives DLL1 par cellule activée par fluorescence triant (FACS)
Remarque : Voici une procédure pour la préparation de cellules avant FACS trier des cellules positives DLL1. Effectuer des FACS tri à l’aide d’un cytomètre en flux, selon le protocole du fabricant.- Aspirez le milieu, puis laver avec du PBS. Par la suite, ajouter 1 mL de réactif de dissociation cellulaire et laisser pendant 3 min à température ambiante.
- Ajouter 4 mL de milieu de base au titre du MDP, gratter les cellules à l’aide d’un racloir et à leur rassemblement dans un tube conique de 15 mL.
- Compter le nombre de cellules à l’aide d’un compteur de cellules automatisées, puis centrifuger à 280 g pendant 3 min.
- Soigneusement retirer le surnageant par aspiration et remettre en suspension les cellules dans le tampon de FACS (voir tableau 1) à une concentration de 1,0 x 107 cellules/mL. Pour un échantillon de contrôle négatif (contrôle de l’isotype, soit par convention sans anticorps), transférer 50 µL dans un tube conique de 15 mL et ensuite suspendre avec 450 µL de tampon de FACS.
- Ajoutez l’anticorps DLL1 (voir Table des matières) dans une proportion de 1/200. Protéger le tube de lumière et de garder sur la glace pendant 30 min.
- Centrifuger à 280 x g pendant 3 min.
- Avec précaution, aspirer le surnageant et remettre en suspension dans un tampon de FACS (1,0 x 107 cellules/mL) additionné de 1 mg/mL DAPI.
- Transvaser dans un tube de prélèvement, incorporé avec une maille en nylon de 35 µm dans le capuchon pour le filtrage, puis placez le tube sur la glace jusqu'à ce que le tri est terminé. Effectuez la même procédure avec l’échantillon de contrôle négatif (étape 2.2.4).
- Effectuer le tri à l’aide d’un cytomètre en flux selon le protocole du fabricant.
- Recueillir les cellules positives de DLL1 triées dans un tube conique de 15 mL, contenant 4 mL de milieu de base au titre du MDP additionné de 10 µM de Y27632. Pour l’extraction de l’ARN totale, centrifuger à 280 g pendant 3 min puis remettre en suspension dans le tampon de lyse RNA et conserver à-30 ° C. Voir l’extraction de l’ARN, transcription inverse, RT-qPCR procédures (article 5.1) pour plus d’informations.
- Effectuer la différenciation SM en utilisant les cellules triées selon le dessous protocole (article 3).
3. SM différenciation de PSM
-
Différenciation de cellules positives PSM triés DLL1 (jour 4 – jour 8) SM
Remarque : préparer les plaques de 12 puits recouvert solution ECM le jour avant le tri des FACS. Pour préparer une plaque de 12 puits recouvert solution ECM, ajouter 1 mL de solution d’ECM dans chaque puits à 4 ° C et laisser une nuit. Conserver la solution ECM sur la glace lors de la préparation.- Après l’étape 2.2.10, centrifuger à 280 x g pendant 3 min.
- Soigneusement aspirer le surnageant et remettre en suspension dans 1 mL de milieu d’induction SM (milieu de base au titre du MDP additionné de 10 µM SB431542 et 5 µM CHIR99021, voir tableau 1).
- Compter le nombre de cellules à l’aide d’un compteur de cellules automatisées.
- Semences 1,0 x 105 cellules sur chaque puits des ECM solution-enduit 12 plaques à puits contenant 1 mL de milieu d’induction SM additionné de 10 µM de Y27632.
- Incuber à 37 ° C, avec 5 % de CO2 pendant 4 jours jusqu’au jour 8. Changer le milieu ne contenant ne pas de Y27632 sur 5 jours (le jour après le tri des FACS) et 7 jours.
- Effectuer la différenciation des dérivés SM en utilisant des cellules de SM induits selon les protocoles ci-dessous. Pour l’extraction d’ARN totale de cellules SM induites, recueillir les cellules dans un tube conique de 15 mL et centrifuger à 280 x g pendant 3 min, puis remettre en suspension dans le tampon de lyse RNA et conserver à-30 ° C.
4. SM dérivés (DM, MYO, D, SCL, SYN) différenciation de SM
Remarque : Afin de démontrer la compétence-plein de cellules SM, exécutez d’abord DM (dermomyotome) et l’induction de SCL (sclérotome) en conséquence à l’aide de cellules iPSC-SM. Par la suite, effectuent MYO (myotome) et l’induction de D (dermatome) en utilisant les cellules DM et conduite induction SYN (syndetome) en utilisant les cellules SCL. Voici les protocoles pour l’induction de chaque dérivé (DM, MYO, D, SCL et SYN) de cellules SM induites in vitro.
-
DM la différenciation des cellules SM (jour 8 – jour 11)
- Aspirez le milieu, puis ajouter 1 mL de milieu d’induction DM (milieu basal de MDP additionné de 5 µM CHIR99021 et 10 ng/mL BMP4, voir tableau 1).
- Incuber les cellules à 37 ° C, avec 5 % de CO2, pendant 3 jours jusqu'à 11 jours. Changer la moyenne sur 10 jours (jour 2 de DM induction).
- Effectuent MYO et D à l’aide de la différenciation induite par DM cellules selon les protocoles ci-dessous.
-
Différenciation des cellules DM (jour 11 – journée 41) MYO
- Aspirez le milieu, puis ajouter 1 mL de milieu d’induction MYO (milieu de base au titre du MDP additionné de 5 µM CHIR99021, voir le tableau 1).
- Incuber les cellules à 37 ° C, avec 5 % de CO2, pour 30 jours jusqu'à 41 jours. Changer le support tous les 3 jours.
-
Différenciation des cellules (jour 11 – journée 20) de la DM D
- Aspirer le milieu, puis ajouter 1 mL de milieu d’induction D (milieu de base au titre du MDP additionné de 5 µM CHIR99021 et 10 ng/mL BMP4, voir tableau 1).
- Incuber les cellules à 37 ° C, avec 5 % de CO2, 9 jours jusqu'à 20 jours. Changer le support tous les 3 jours.
-
Différenciation des cellules SM (jour 8 – jour 11) SCL
- Aspirez le milieu, puis ajouter 1 mL de milieu d’induction SCL (milieu de base au titre du MDP additionné de 100 nM SAG et 0,6 µM LDN193189, voir le tableau 1)14.
- Incuber les cellules à 37 ° C, avec 5 % de CO2, pendant 3 jours. Changer la moyenne sur 10 jours (induction 2 jour de SCL).
- Effectuer la différenciation SYN à l’aide de cellules SCL induites selon le protocole ci-dessous.
-
Différenciation des cellules SCL (jour 11 – journée 32) SYN
Remarque : préparer les plaques de 24 puits recouvert solution ECM la journée avant d’amorcer l’induction SYN. Pour préparer une plaque de 24 puits recouvert solution ECM, ajouter 0,5 mL de solution d’ECM dans chaque puits à 4 ° C et laisser une nuit. Conserver la solution ECM sur la glace lors de la préparation.- Aspirez le milieu puis laver avec du PBS, puis ajouter 0,2 mL de réactif de dissociation cellulaire dans chaque puits et laisser pendant 3 min à température ambiante.
- Ajouter 0,8 mL de milieu de base au titre du MDP dans chaque puits puis raclez et recueillir toutes les cellules dans un tube conique de 15 mL.
- Centrifuger à 280 x g pendant 3 min.
- Soigneusement aspirer le surnageant et remettre en suspension dans 1 mL de SYN induction moyen-1 (milieu de base au titre du MDP additionné de 20 ng/mL FGF8, voir tableau 1), puis comptez le nombre de cellules à l’aide d’un compteur de cellules automatisées.
- Semences 5.0 x 104 cellules dans chaque puits des ECM solution-enduit 24 plaques à puits contenant 1 mL de SYN induction moyen-1.
- Incuber à 37 ° C, avec 5 % de CO2, pendant 3 jours.
- Le jour 14 (induction de la journée 3 de SYN), remplacez le support par SYN induction moyen-2 (milieu de base au titre du MDP additionné de 10 ng/mL BMP7 et 10 ng/mL TGFβ3, voir tableau 1).
- Incuber à 37 ° C, avec 5 % de CO2, pendant 18 jours jusqu'à 32 jours. Changer le support tous les 3 jours.
5. caractérisation des produits dérivés de la CISP
Remarque : Lors de la différenciation, caractériser CISP humains dérivés utilisant quantitative PCR en temps réel (RT-qPCR), immunocytochimie (ICC), dosages immuno-enzymatiques (ELISA) et essais de stimulation étirement mécanique, en conséquence.
-
Cellulaire, extraction d’ARN totale, transcription inverse et analyse quantitative de PCR (RT-qPCR) en temps réel
- Prélever des échantillons cellulaires (procédures 2.2.10, 3.1.6, 5.4.3) dans un tube de 1,5 mL, puis centrifuger à 280 g pendant 3 min.
- Retirez le surnageant, puis resuspendre dans 350 µL de tampon de lyse RNA, fourni par un kit d’extraction d’ARN total approprié.
- Extraire l’ARN total utilisant le kit selon le protocole du fabricant.
- Marche arrière transcrire l’isolé 1 µg d’ARN total au cDNA, selon le protocole du fabricant.
- Effectuer la RT-qPCR utilisant les enzymes appropriés, aux réactifs et amorces selon le protocole du fabricant. Les séquences d’amorces utilisées dans cette étude sont répertoriés dans le tableau 2.
-
Immunocytochimie (ICC)
- Avant d’effectuer l’immunocytochimie avec des anticorps, fixer les cellules avec du paraformaldéhyde de 2 % à 4 ° C pendant 10 min et laver deux fois avec du PBS.
- Pour perméabilisation, incuber avec 0,2 % de méthanol ou 0,2 % polysorbate 20/PBS (ci-après dénommé PBS-T) à 4 ° C pendant 15 minutes.
- Retirez les réactifs perméabilisation et traiter les cellules avec un approprié blocage tampon ou 1 % bovine sérum albumine/PBS à 4 ° C pendant 60 min.
- Ajouter le premier anticorps dilué avec 10 % de tampon bloquant dans PBS-T et le déposer sur une machine vibrante à 4 ° C durant la nuit.
- Laver trois fois avec PBS-T (ajouter PBS-T et le placer sur la machine vibrante RT pendant 10 min).
- Ajouter le deuxième anticorps, dilué dans un tampon bloquant 10 % dans PBS-T et le déposer sur la machine vibrante RT pendant 60 min. Les premiers et deuxième anticorps pour ICC utilisé dans cette étude sont répertoriés dans le tableau 3.
Remarque : A partir de cette étape, protéger le plat/plat de la lumière en l’enveloppant dans du papier. - Laver deux fois avec du PBS-T.
- Pour compteur de coloration, ajouter 1/5000 DAPI dilué avec PBS et les placer sur la machine vibrante RT pendant 5 min.
- Enlever la solution DAPI et ajouter PBS dans chaque puits.
- Observer la coloration de cellules à l’aide d’un microscope à fluorescence. Vous pouvez également stocker le plat/plat à 4 ° C pendant environ 1 mois.
-
Enzyme-linked Immunosorbent assay (ELISA) pour une analyse fonctionnelle de l’iPSC dérivé D
Remarque : fibroblastes dermiques humains (HDF) sont disponibles dans le commerce. La culture de HDF en DMEM additionné de sérum de veau fœtal 10 % (voir tableau 1).- Semences 1,0 x 105 cellules dérivées iPSC D et HDF sur plaques 24 puits contenant 1 mL de chaque milieu de culture (milieu d’induction D: D, HDF : DMEM additionné de sérum de veau fœtal 10 %).
- Après 3 jours de culture de cellules, collecter 100 µL de chaque support, placer dans un tube de 1,5 mL et conserver à 4 ° C.
- Effectuer la série de procédures, telles que l’ajout d’anticorps de détection et des anticorps secondaires, selon les instructions du fabricant et de quantifier le nombre de cibles en générant une courbe standard contre la concentration du contrôle échantillons de l’analyte.
-
Test de stimulation étirement mécanique pour l’analyse fonctionnelle des dérivés iPSC SYN
Remarque : tenocytes humains adultes sont disponibles dans le commerce (voir Table des matières). La culture humaine iPSC dérivés SYN et adulte tenocytes humaine sur une cellule qui s’étend de dispositif pour l’essai de stimulation étirement mécanique tel que décrit ci-dessous18,19. Utilisation SYN induction moyen-2 et tenocytes milieu de culture (voir Table des matières) comme milieu de culture pour chaque SYN dérivés iPSC et tenocytes humain adulte, respectivement.- Après 24 h avant l’étirement, plaque 1,0 x 105 cellules dérivées iPSC SYN et humaine tenocytes sur caoutchouc de silicium évidement multi enduits solution ECM chambres, chacune avec une surface de culture de 1,5 x 1,5 cm (voir Table des matières).
- Positionnez les chambres de l’appareil pour la cellule qui s’étend et forcer monoaxial souche cyclique (0,5 Hz, 5 %) pendant 12 h.
- Pour l’extraction de l’ARN totale, ajouter 350 µL de tampon de lyse RNA, puis gratter et prélever les cellules dans un tube de 1,5 mL pour extraction de l’ARN totale et l’analyse ultérieure de RT-qPCR (voir procédure 5.1).
Résultats
Tous les chiffres dans ce rapport ont été obtenues avec le CISP PAX3-201B7-GFP, dans laquelle EGFP remplace un allèle de la séquence codante PAX3 dans l’exon 1. Mise en place de 201B7-PAX3-GFP CISP seront décrits ailleurs (H. Sakurai, communication personnelle). La signification statistique a été évaluée à l’aide d’un logiciel de statistique. P-valeurs inférieures à 0,05 était considérée comme significative.
Caractérisation des dérivés iPSC PSM et SM des cellules humaines
Afin d’évaluer la différenciation du CISP humaine vers SM par l’intermédiaire de l’état PSM (Figure 2 a), analyse de FACS, l’analyse ICC et RT-qPCR ont été effectuées. Comme le montre la Figure 2 b, plus 85 % des cellules étaient positifs pour DLL1, un marqueur du PSM, mais négatif pour PAX3, un marqueur de SM, après 4 jours d’induction de PSM avec CISP humaine. Par la suite, cette population devint PAX3 positives cellules SM après 4 jours d’induction de SM. La transition de PSM-SM a également été confirmée par la CCI (Figure 2) et la RT-qPCR (Figure 2D). Marqueurs PSM TBX6, MSGN1 et WNT3A, ont été exprimées à l’état PSM (jour 4), mais pas exprimés à l’état de SM (jour 8). Marqueurs PARAXIS, MEOX1 et PAX3, SM, ont été exprimées à la SM, mais pas à PSM. En outre, la coloration des CDH11, un marqueur d’epithelialized SM, seulement accumulé à la jonction des cellules, suite à l’ajout de SB431542 avec CHIR99021 (Figure 2E).
Caractérisation de dérivés SM induits à partir des cellules humaines dérivées iPSC SM
Pour évaluer la puissance de la différenciation des humain dérivés iPSC SM, différenciation vers DM, MYO, D, SCL et le SYN (Figure 3 a) a été évaluée par analyse de l’ICC et PAX3 (GFP)-fluorescence. Comme illustré à la Figure 3 b, différenciation de DM a été confirmée par ALX4 et EN1 coloration et PAX3 (GFP)-fluorescence ; La différenciation MYO a été confirmée par MYOD, MYOG et la myosine chaîne lourde (MHC) coloration ; Différenciation de D a été confirmée par EN1 et PDGFRa coloration ; Différenciation de SCL a été confirmée par PAX1 et PAX9 NKX3.2 coloration ; différenciation de SYN a été confirmé par SCX, MKX, COL1A1 et COL1A2 coloration.
Caractérisation des induits D et SYN
1. enzyme-linked immunosorbent assay (ELISA) analyse fonctionnelle de l’iPSC dérivé D
Dans le corps humain, une des principales fonctions des fibroblastes dermiques est de sécréter des protéines de la matrice extracellulaire (mec), tels que le collagène et l’acide hyaluronique qui hydrate la peau et aident à maintenir la structure de la peau. Afin de démontrer qu’une quantité comparable de protéines de collagène de type 1 et de l’acide hyaluronique sont sécrétées dans le milieu de culture des dérivés iPSC D et HDF, ELISA a été réalisée, comme illustré à la Figure 4 a.
2. mechanical stretch test de stimulation pour l’analyse fonctionnelle des dérivés iPSC SYN
Comme plusieurs études l’ont déjà signalé, une stimulation mécanique affecte le développement du tendon avant et après la naissance et favorise la différenciation des tenocytes du précurseur des cellules18,19. Par conséquent, il est bien connu que la réactivité au stress mécanique est l’une des caractéristiques de tenocytes. Pour illustrer la réactivité comparable des humain dérivés iPSC SYN et tenocytes adulte humain, un test de stimulation étirement mécanique a été effectué comme indiqué dans la Figure 4 b.
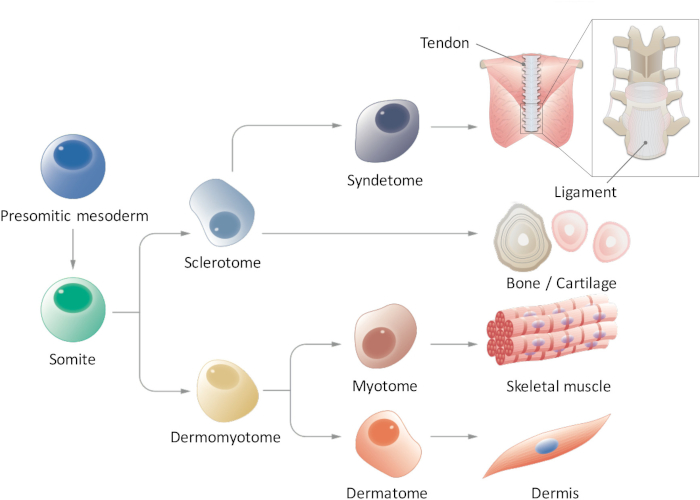
Figure 1 : vue schématique de la différenciation hiérarchique du mésoderme paraxial. Somitiques mésoderme est une population de cellules que transitoirement apparaît au cours de l’embryogenèse précoce et subit une segmentation de somites de forme. Somites sont une population transitoire des cellules souches qui donne lieu à plusieurs types de cellules, telles que les cellules sclérotome, dermomyotome, syndetome, dermatome et myotome, qui finit par se différencient en tendon/Ligament, cartilage de l’os, muscle squelettique et le derme cellules. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
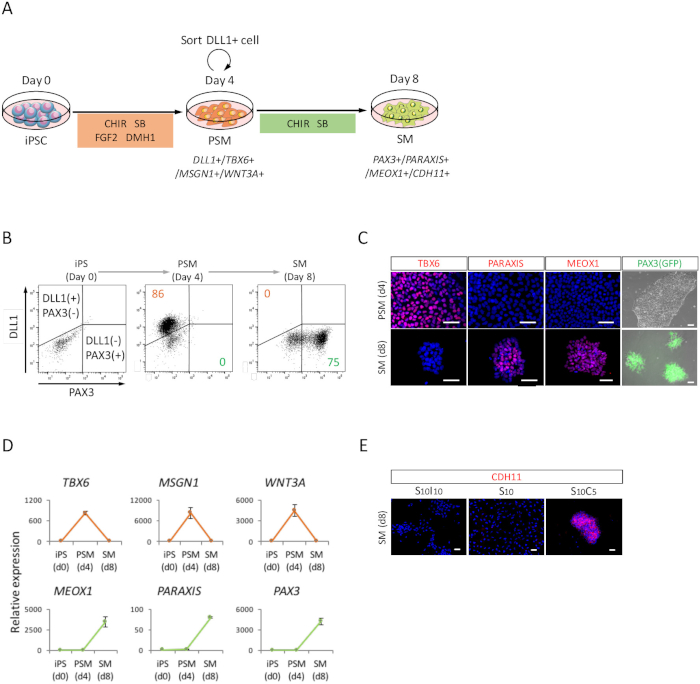
Figure 2 : analyse de FACS, RT-qPCR et ICC des humain dérivés iPSC PSM et SM. (A) vue schématique d’un protocole pour la différenciation par le biais de PSM SM. (B) parcelle de point représentatif de coloration DLL1 et PAX3 (GFP)-fluorescence sur 4 d’induction de PSM et jour 4 (jour 8 d’iPSC) de l’induction de la SM. (C) des images représentant immunocytochimiques et PAX3 (GFP)-fluorescence sur 4 d’induction de PSM et jour 4 (jour 8 d’iPSC) de l’induction de la SM. Les cellules ont été colorées avec anti-TBX6, PARAXIS et MEOX1 anticorps (rouge) et co colorées au DAPI (bleu) ou détecté avec PAX3 (GFP)-fluorescence (vert). (D) RT-qPCR analyse de marqueurs PSM et SM au CPSI, PSM et SM. L’erreur-type moyen ± (S.E.) de trois séries d’expériences sont indiqués. Immunocytochimique de représentant (E) des images jour 4 (jour 8 d’iPSC) du SM, cultivées en S10I10 (combinaison de SB431542 et IWR1, un inhibiteur de la signalisation WNT), S10 (SB431542) et S10C5 des conditions (combinaison de SB431542 et CHIR99021). Les cellules ont été colorées avec les anticorps anti-CDH11 (rouges) et co colorées au DAPI (bleu). iPS, les cellules souches pluripotentes induites ; PSM, somitiques mésoderme ; SM, somite ; S10, SB431542 10 ΜM ; C5, CHIR99021 5 ΜM ; I10, IWR1 10 ΜM ; Barreaux de l’échelle = 50 μm. Ce chiffre a été modifié par Nakajima et coll. (2018)15. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
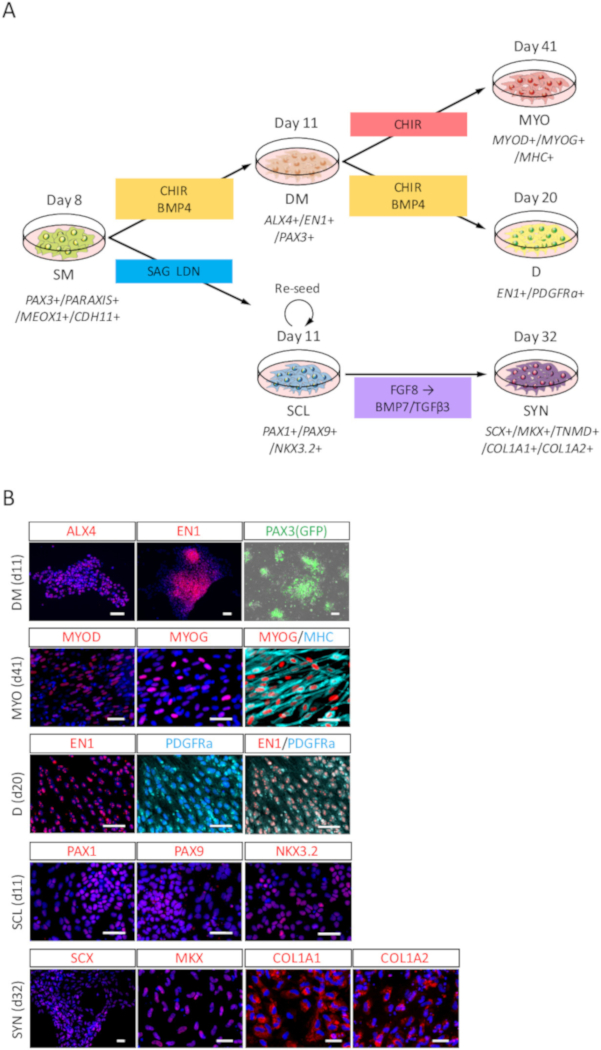
Figure 3 : analyse d’ICC de DM, MYO, D, SCL et SYN différenciées humaines dérivées iPSC SM. (A) vue schématique des protocoles pour la différenciation des dérivés SM. (B) des images représentant immunocytochimiques et PAX3 (GFP)-fluorescence sur jour 3 (jour 11 d’iPSC) de DM induction, journée 30 (jour 41 de l’iPSC) d’induction MYO, jour 9 (20e jour de l’iPSC) d’induction D, jour 3 (jour 11 d’iPSC) d’induction de SCL et 21 (jour 32 jours de l’iPSC) d’induction SYN. DM, les cellules ont été colorées avec des anticorps de EN1 (rouge) et anti-ALX4 et co colorées au DAPI (bleu) ou détectés avec PAX3 (GFP)-fluorescence (vert) ; MYO, les cellules ont été colorées avec anti-MYOD, MYOG (rouge) et les anticorps de MHC (cyan), également co colorées au DAPI (bleu) ; D, les cellules sont colorées avec des anticorps de PDGFRa (cyan) et anti-EN1 (rouge) et co colorées au DAPI (bleu) ; SCL, les cellules sont colorées avec anti-PAX1 et PAX9 NKX3.2 anticorps (rouges) et co colorées au DAPI (bleu) ; SYN, les cellules sont colorées avec anti-SCX, MKX, COL1A1 et COL1A2 anticorps (rouges) et co colorées au DAPI (bleu). DM, dermomyotome ; MYO, myotome ; D, dermatome ; SCL, sclérotome ; SYN, syndetome ; Barreaux de l’échelle = 50 μm. Ce chiffre a été modifié par Nakajima et coll. (2018)15. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
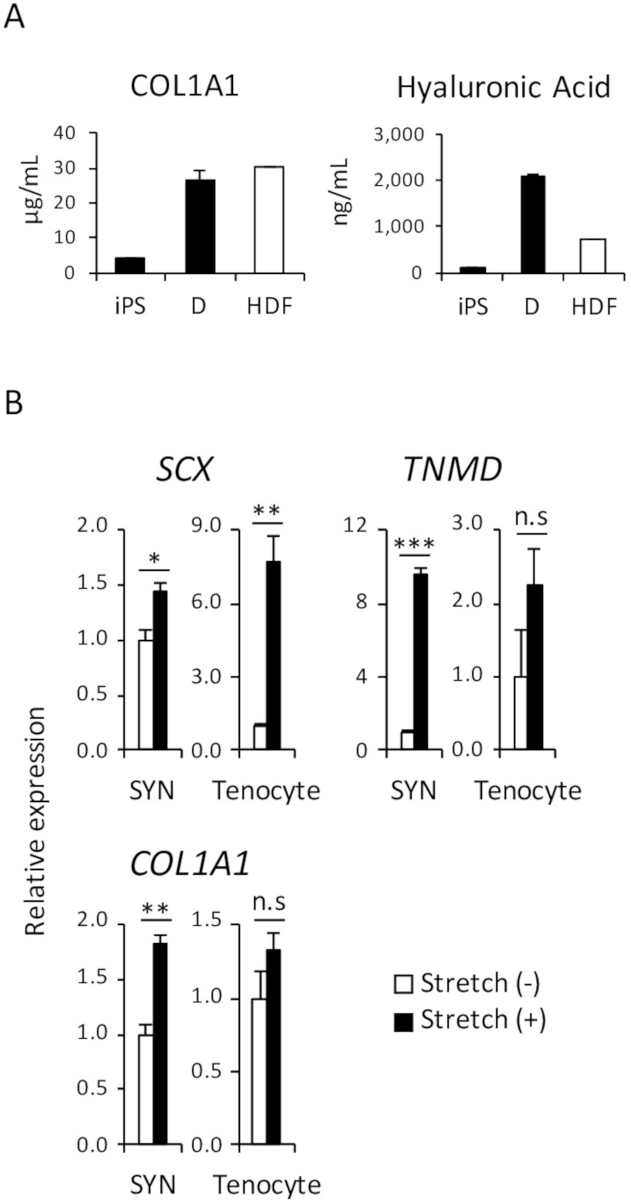
Figure 4 : analyse fonctionnelle induit D et SYN. (A) la quantité de collagène de type 1 et hyaluronique acide protéines dans le milieu de culture ont été analysés par ELISA. (B) l’effet de l’étirement mécanique stimulation induit SYN et tenocytes adulte humain a été évaluée par RT-qPCR. L’erreur-type moyen ± (S.E.) de trois séries d’expériences sont indiqués. * p < 0,05 ; ** p < 0,01 ; p < 0,001 par test de Dunnett multiples comparaisons t-par rapport à l’étirement (-) ; n.s, non significatif, HDF, humain adulte fibroblastes dermiques. Ce chiffre a été modifié par Nakajima et coll. (2018)15. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Moyen/solution | Reagant | Concentration de |
| Milieu de base au titre du MDP | Iscove modifié F12 moyen/Ham de Dulbecco | 1:1 |
| La pénicilline/streptomycine | 0,5 % | |
| Concentré de lipides de constitution chimique définie | 1 % | |
| APO-transferrine | 15 mg/mL | |
| Monothioglycerol | 450 mM | |
| Albumine sérique bovine | 5 mg/mL | |
| Insuline | 7 mg/mL | |
| Solution CTK | Eau | - |
| Trypsine | 0,25 % | |
| Collagénase IV | 0,1 mg/mL | |
| Chlorure de calcium | 1 mM | |
| Knockout SR | 20 % | |
| Milieu d’induction D | Milieu de base au titre du MDP | - |
| CHIR99021 | 5 ΜM | |
| BMP4 | 10 ng/mL | |
| Milieu d’induction DM | Milieu de base au titre du MDP | - |
| CHIR99021 | 5 ΜM | |
| BMP4 | 10 ng/mL | |
| Solution d’ECM | Matrice extracellulaire artificielle | 0,3 mg/mL |
| DMEM/F12 | - | |
| Tampon de FACS | PBS | - |
| Albumine sérique bovine | 0,1 % | |
| Milieu de culture cellulaire exempt d’engraissement | mTeSR1 | - |
| La pénicilline/streptomycine | 0,5 % | |
| Milieu de culture HDF | DMEM | - |
| Sérum de veau fœtal | 10 % | |
| moyen de CSEh | Primate ES un milieu cellulaire | - |
| La pénicilline/streptomycine | 0,5 % | |
| FGF2 | 4 ng/mL | |
| Milieu d’induction MYO | Milieu de base au titre du MDP | - |
| CHIR99021 | 5 ΜM | |
| Milieu d’induction de PSM | Milieu de base au titre du MDP | - |
| SB431542 | 10 ΜM | |
| CHIR99021 | 10 ΜM | |
| DMH1 | 2 ΜM | |
| FGF2 | 20 ng/mL | |
| Milieu d’induction SCL | Milieu de base au titre du MDP | - |
| SAG | 100 nM | |
| LDN193189 | 0,6 ΜM | |
| Milieu d’induction SM | Milieu de base au titre du MDP | - |
| SB431542 | 10 ΜM | |
| CHIR99021 | 5 ΜM | |
| SYN induction moyen-1 | Milieu de base au titre du MDP | - |
| FGF8 | 20 ng/mL | |
| SYN induction moyen-2 | Milieu de base au titre du MDP | - |
| BMP7 | 10 ng/mL | |
| TGFΒ3 | 10 ng/mL |
Tableau 1 : Recettes de médias et de la solution.
| NOM | Vers l’avant | Marche arrière |
| ACTB | CACCATTGGCAATGAGCGGTTC | AGGTCTTTGCGGATGTCCACGT |
| COL1A1 | GGACACAGAGGTTTCAGTGGT | GCACCATCATTTCCACGAGC |
| MEOX1 | GAGATTGCGGTAAACCTGGA | GAACTTGGAGAGGCTGTGGA |
| MSGN1 | GGAGAAGCTCAGGATGAGGA | GTCTGTGAGTTCCCCGATGT |
| PARAXIS | TCCTGGAGAGCTGTGAGGAT | CACACCCTGTCACCAACAGT |
| PAX3 | AGGAAGGAGGCAGAGGAAAG | CAGCTGTTCTGCTGTGAAGG |
| SCX | CCCAAACAGATCTGCACCTTC | GCGAATCGCTGTCTTTCTGTC |
| TBX6 | AGCCTGTGTCTTTCCATCGT | AGGCTGTCACGGAGATGAAT |
| TNMD | CCCTTCATGCTGAAGCCACTT | CTCACTTTCAGCAGAATTGGGG |
| WNT3A | CAAGATTGGCATCCAGGAGT | ATGAGCGTGTCACTGCAAAG |
Tableau 2 : Séquences d’amorces pour l’analyse de la RT-qPCR.
| Concentration de | ||
| 1er Anticorps | ALX4_Goat | 1/50 |
| CDH11_Mouse | 1/1000 | |
| COL1A1_Rabbit | 1/100 | |
| COL2A1_Mouse | 1 à 2 μg/mL | |
| EN1_Rabbit | 1/50 | |
| MEOX1_Rabbit | 1/50 | |
| MHC_Rabbit | 1/200 | |
| MKX_Rabbit | 1/50 | |
| MYOD_Rabbit | 1/500 | |
| MYOG_Mouse | 1/400 | |
| NKX3.2_Rabbit | 1/50 | |
| PARAXIS_Rabbit | 1/50 | |
| PAX1_Rabbit | 1/50 | |
| PAX9_Rabbit | 1/50 | |
| PDGFRa_Goat | 1/100 | |
| SCX_Rabbit | 1/50 | |
| TBX6_Goat | 1/50 | |
| 2ème Anticorps | Âne anti chèvre IgG(H+L) antibody555 secondaire | 1/500 |
| Âne anti chèvre IgG(H+L) antibody647 secondaire | 1/500 | |
| Chèvre anti souris IgG(H+L) antibody555 secondaire | 1/500 | |
| Chèvre anti lapin IgG(H+L) antibody555 secondaire | 1/500 | |
| Chèvre anti lapin IgG(H+L) antibody647 secondaire | 1/500 |
Tableau 3 : Première et deuxième anticorps pour ICC.
Discussion
Une méthode bien connue pour l’induction de SM CFP dérivé par le biais de PSM est la combinaison de CHIR99021 + A83-01 (inhibiteur de TGFβ) durant l’induction PSM de CFP, mais pas pendant le traitement de maturation du PSM6. Dans la présente étude, la signalisation WNT/bêta-caténine est inhibée utilisant C59 pour induire la SM de PSM. Cependant, nous avons introduit l’utilisation de CHIR99021 pour activer la signalisation WNT durant la différenciation SM. Cette décision a été faite à la base sur la constatation que plusieurs WNTs sont exprimés dans les tissus environnants de SM et compte tenus du fait que les journalistes WNT sont actifs dans SM20. En conséquence, nous avons observé épithélialisation, une caractéristique des SM in vivo, que sous la condition avec CHIR99021, basé sur l’accumulation de CDH11 dans les jonctions cellule-cellule (Figure 2E). Cette observation montre la participation critique de WNT signaling au cours de la différenciation de PSM et épithélialisation SM, donc que notre protocole peut mieux récapituler l’environnement signalisation endogène. Cependant, elle implique également une autre possibilité d’affiner la durant la différenciation, voie de signalisation WNT/bêta-caténine, parce que la robustesse et l’efficacité de la différenciation peuvent varier significativement selon les types de cellules, les lignées cellulaires et divers composés chimiques de WNT-inducteurs utilisés par chaque chercheur.
Cette méthode permet également de générer tous les quatre SM dérivés, MYO, D, SCL et SYN, de CISP humaine. Nos protocoles par étapes à l’aide de MDP peuvent être utilisés pour identifier les exigences de signalisation au cours de l’humaine somitogenèse/somite patterning et fournissent des renseignements importants sur le développement humain de SM. Par exemple, nos méthodes pourraient être utiles pour l’étude des mécanismes d’horlogerie de segmentation, un système d’oscillation moléculaire qui régule la formation de SM. Il a étudié à fond dans la souris, poussins et le poisson-zèbre, mais pas chez les humains en raison du manque d’outils expérimentaux appropriés.
En outre, notre méthode peut s’appliquer aux futures thérapies cliniques de base de cellules. Par exemple, humain D dérivé iPSC ou SYN peut être transplanté dans la peau gravement blessée ou rupture des tendons de régénération et de traitement. Toutefois, plusieurs limitations doivent être résolus avant que cette méthode peut s’appliquer pratiquement. Bien que dans la présente étude, nous avons utilisé des cellules nourricières SNL pour l’entretien de l’iPSC et solution ECM, qui est extraite du sarcome de souris Engelbreth-Holm-Swarm, comme une couche de surface sur le plat durant l’induction, ces réactifs d’origine animale non humaine devraient être enlevé pour améliorer la qualité de la clinique. En outre, cellule quantitatif et qualitatif, qui comprend la pureté et la maturation des cellules désirées, doivent également être améliorées. En outre, non seulement le nombre de cellules, mais aussi la résistance de la cellule est une caractéristique importante pour la régénération du tendon/ligament. En outre, le développement de marqueurs de surface pour la purification et une nouvelle méthode pour la reconstitution 3D sont indispensables afin de faire progresser nos protocoles cliniques thérapies basées sur les cellules.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier Dr. Junya Toguchida (ACEI) pour son aide avec l’administration des projets et de financement d’acquisition, M. Mitsuaki Shibata (ACEI) et Mme Mei Terashima (ACEI) pour leur assistance technique, Dr Yayoi Toyooka (ACEI) et Dr Daisuke Kamiya (ACEI) pour leur relecture de manuscrit et M. Masaya Todani (ACEI) pour fournir une illustration (Figure 1). Nous remercions également tous les membres des laboratoires Ikeya et Toguchida (ACEI) pour leur soutien au cours de cette étude. Ce travail a été soutenu par subventions pour la recherche scientifique de la société japonaise pour la Promotion of Science (JSPS) (26670661), le programme pour les cellules iPS insolubles maladies recherche utilisant la maladie spécifique de la Japan Science and Technology Agency (JST) et l’Agence japonaise pour la recherche médicale et le développement (AMED), le centre de noyau pour iPS recherche sur les cellules du réseau de centre de recherche pour la réalisation de la médecine régénératrice (JST/AMED) et les adresses IP Cell Research Fund (en partie à Makoto Ikeya et Junya Toguchida). Makoto Ikeya reposait également de subventions pour la recherche scientifique (SJPS) (16H 05447) et le programme d’accélération d’insolubles maladies recherche utilisant des cellules iPS de maladies particulières (AMED).
matériels
| Name | Company | Catalog Number | Comments |
| ALX4_Goat antibody | Santacruz | sc-22066 | |
| Apo-transferrin | Sigma | T1147 | |
| BMP4 | R&D | 314-BP-010 | |
| BMP7 | R&D | 354-BP-010 | |
| Bovine serum albumin | Sigma | A8806 | |
| Calcium chloride | Nacalai tesque | 067730-15 | |
| CDH11_Mouse antibody | Cell signaling | 13577 | |
| Cell streching device | Strex | STB-140 | |
| Chemically defined lipid concentrate | Gibco | 11905-031 | |
| CHIR99021 | Axon | 1386 | |
| COL1A1_Rabbit antibody | Abcam | ab34710 | |
| COL2A1_Mouse antibody | Thermo scientific | MS-235 | |
| Collagenase IV | Thermofisher | 17104019 | |
| DLL1 APC-conjugated_Mouse antibody | R&D | FAB1818A | For FACS |
| DMEM | Sigma | D6046 | |
| DMEM/F12 | Gibco | 11320-082 | |
| DMH1 | Tocris | 4126 | |
| EN1_Rabbit antibody | Abcam | ab70993 | |
| Fetal bovine serum | Nichirei | 171012 | |
| FGF2 | Wako | 060-04543 | |
| FGF8 | Peprotech | 100-25 | |
| Human dermal fibroblast | Cell applications | 160-05a | |
| Human tenocyte | Angio proteomie | cAP-0041 | |
| Insulin | Wako | 090-06474 | |
| Iscove’s modified Dulbecco’s medium/Ham’s F12 | Gibco | 21056023 | |
| Knockout SR | Gibco | 10828028 | |
| LDN193189 | Axon | 1509 | |
| Matrigel | BD bioscience | 354230 | Artificial extracellular matrix |
| MEOX1_Rabbit antibody | Abcam | ab75895 | |
| MHC_Rabbit antibody | Santacruz | sc-20641 | |
| MKX_Rabbit antibody | Atlas antibodies | A83377 | |
| Monothioglycerol | Sigma | M6145 | |
| mTeSR1 | Stemcell tech | 85850 | |
| Multi well-type silicon rubber chamber | Strex | STB-CH-4W | |
| MYOD_Rabbit antibody | Abcam | ab133627 | |
| MYOG_Mouse antibody | Santacruz | sc-12732 | |
| NKX3.2_Rabbit antibody | Sigma | HPA027564 | |
| Novex Donkey anti Goat IgG(H+L) secondary antibody555 | Invitrogen | A21432 | |
| Novex Donkey anti Goat IgG(H+L) secondary antibody647 | Invitrogen | A21447 | |
| Novex Goat anti Mouse IgG(H+L) secondary antibody555 | Invitrogen | A21422 | |
| Novex Goat anti Rabbit IgG(H+L) secondary antibody555 | Invitrogen | A21428 | |
| Novex Goat anti Rabbit IgG(H+L) secondary antibody647 | Invitrogen | A21245 | |
| PARAXIS_Rabbit antibody | Santacruz | sc-98796 | |
| PAX1_Rabbit antibody | Abcam | ab95227 | |
| PAX9_Rabbit antibody | Gene tex | GTX104454 | |
| PBS | - | - | |
| PDGFRa_Goat | R&D | AF307 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| Primate ES cell medium | Reprocell | RCHEMD001 | |
| SAG | Calbiochem | 566661 | |
| SB431542 | Selleckchem | SEL-S1067-10 | |
| SCX_Rabbit antibody | Abcam | ab58655 | |
| TBX6_Goat antibody | R&D | AF4744 | |
| Tendon cell growth medium | Angio-proteomie | cAP-40 | Tenocytes growth medium |
| TGFβ3 | R&D | 243-B3-200 | |
| Trypsin | Gibco | 15090046 |
Références
- Tanaka, A., et al. Efficient and reproducible myogenic differentiation from human iPS cells: prospects for modeling Miyoshi Myopathy in vitro. PLoS One. 8 (4), e61540 (2013).
- Sakurai, H., et al. In vitro modeling of paraxial mesodermal progenitors derived from induced pluripotent stem cells. PLoS One. 7 (10), e47078 (2012).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocl. 11 (10), 1833-1850 (2016).
- Chal, J., et al. Differentiation of pluripotent stem cells to muscle fiber to model Duchenne muscular dystrophy. Nature Biotechnology. 33 (9), 962-969 (2015).
- Umeda, K., et al. Human chondrogenic paraxial mesoderm, directed specification and prospective isolation from pluripotent stem cells. Scientific Reports. 2, 455 (2012).
- Loh, K. M., et al. Mapping the Pairwise Choices Leading from Pluripotency to Human Bone, Heart, and Other Mesoderm Cell Types. Cell. 166 (2), 451-467 (2016).
- Xi, H., et al. In Vivo Human Somitogenesis Guides Somite Development from hPSCs. Cell Reports. 18 (6), 1573-1585 (2017).
- Chal, J., Pourquie, O. Making muscle: skeletal myogenesis in vivo and in vitro. Development. 144 (12), 2104-2122 (2017).
- Tam, P. P., Beddington, R. S. The formation of mesodermal tissues in the mouse embryo during gastrulation and early organogenesis. Development. 99 (1), 109-126 (1987).
- Aulehla, A., Pourquie, O. Signaling gradients during paraxial mesoderm development. Cold Spring Harbor Perspectives in Biology. 2 (2), a000869 (2010).
- Christ, B., Scaal, M. Formation and differentiation of avian somite derivatives. Advances in Experimental Medicine and Biology. 638, 1-41 (2008).
- Brent, A. E., Schweitzer, R., Tabin, C. J. A somitic compartment of tendon progenitors. Cell. 113 (2), 235-248 (2003).
- Sakurai, H., et al. Bidirectional induction toward paraxial mesodermal derivatives from mouse ES cells in chemically defined medium. Stem Cell Research. 3 (2-3), 157-169 (2009).
- Zhao, J., et al. Small molecule-directed specification of sclerotome-like chondroprogenitors and induction of a somitic chondrogenesis program from embryonic stem cells. Development. 141 (20), 3848-3858 (2014).
- Nakajima, T., et al. Modeling human somite development and fibrodysplasia ossificans progressiva with induced pluripotent stem cells. Development. 145 (16), (2018).
- McMahon, A. P., Bradley, A. The Wnt-1 (int-1) proto-oncogene is required for development of a large region of the mouse brain. Cell. 62 (6), 1073-1085 (1990).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Suzuki, H., et al. targeting of the transcription factor Mohawk in rats causes heterotopic ossification of Achilles tendon via failed tenogenesis. Proceedings of the National Academy of Sciences of the United States of America. 113 (28), 7840-7845 (2016).
- Marturano, J. E., Arena, J. D., Schiller, Z. A., Georgakoudi, I., Kuo, C. K. Characterization of mechanical and biochemical properties of developing embryonic tendon. Proceedings of the National Academy of Sciences of the United States of America. 110 (16), 6370-6375 (2013).
- Maretto, S., et al. Mapping Wnt/beta-catenin signaling during mouse development and in colorectal tumors. Proceedings of the National Academy of Sciences of the United States of America. 100 (6), 3299-3304 (2003).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon