Method Article
In vitro-Generation der Somiten Derivate aus menschlichen induzierten Zellen pluripotenten Stammzellen
In diesem Artikel
Zusammenfassung
Wir stellen Ihnen hier ein Protokoll für die Differenzierung der menschlichen induzierten pluripotenten Stammzellen in jeder Somiten Derivat (Myotom, Sklerotom Dermatome und Syndetome) in chemisch definierten Bedingungen, die hat Anwendungen in zukünftigen Krankheit Modellierung und zellbasierte Therapien in der orthopädischen Chirurgie.
Zusammenfassung
In Reaktion auf Signale wie WNTs Knochen morphogenetische Proteine (BMPs) und sonic Hedgehog (SHH) abgesondert vom umgebenden Gewebe, Somiten (SMs) geben Anlass zu mehreren Zelltypen, einschließlich der Myotome (MYO), Sklerotom (SCL), Dermatom (D) und Syndetome (SYN) , die wiederum in Skelettmuskel, Achsenskeletts, dorsal Dermis und axiale Sehnen/Bänder, bzw. entwickeln. Daher ist die Erzeugung von SMs und deren Derivate aus menschlichen induzierten pluripotenten Stammzellen (iPSCs) kritisch zu pluripotenten Stammzellen (EAP) für die Anwendung in der regenerativen Medizin und zur Erforschung von Krankheiten im Bereich der orthopädischen Chirurgie. Obwohl die Induktion-Protokolle für MYO und SCL von EAP zuvor von einigen Forschern gemeldet worden sind, hat keine Studie noch die Induktion von SYN und D aus iPSCs bewiesen. Effiziente Induktion voll geschäftsfähig SMS bleibt daher eine große Herausforderung. Rekapitulieren wir hier menschliche SM Musterung mit in-vitro-menschlichen iPSCs durch die Nachahmung der Signalisierung Umwelt während Küken/Maus SM Entwicklungs- und Bericht über die Methoden der systematischen Induktion von SM-Derivate (MYO, SCL, D und SYN) aus menschlichen iPSCs unter chemisch definierten Bedingungen durch die presomitic Mesoderm (PSM) und SM Staaten. Wissen in Bezug auf Küken/Maus SM Entwicklung wurde erfolgreich zur Induktion von SMs mit menschlichen iPSCs eingesetzt. Diese Methode könnte eine neuartige Werkzeug zur Erforschung menschlichen Somitogenesis und ohne den Einsatz von Embryonen und für zellbasierte Therapien und Krankheit Modellierung Musterung.
Einleitung
Entwicklung einer gezielten Differenzierung-Methode für einen gewünschten Zelltyp von EAP ist ein notwendiger Schritt für die Studie der PSC-abgeleitete Zellen in klinische Anwendungen umzusetzen. Erzwungene Ausdruck Schlüsselgene ist eine vielversprechende Strategie für Orgel-Zell-Differenzierung von einheitlichen Ansprechpartner und unser Verständnis der genetischen Regulierung der Zelle Schicksal Entschlossenheit, Orgel Morphogenese und Organisation während der Embryogenese1verbessert. Darüber hinaus Rekapitulation der endogenen Signalisierung Umgebungen, mit der Entwicklung von Maus und Küken Embryonen als eine Roadmap für die gezielte Differenzierung der einheitlichen Ansprechpartner gilt. Jedoch ist angesichts der Anwendung der PSC-abgeleitete Zellen in klinischen Studien wie zellbasierte Therapien, die letzte Strategie besser geeignet da es keine Genmanipulation erfordert.
Mehrere Studien haben berichtet, die Induktion von Mesoderm von Mensch und Maus EAP in chemisch definierten Bedingungen. In der Regel diese Methoden haben sich verlassen auf Activin/Knoten/Umwandlung Wachstumsfaktor β (TGFβ) Signalisierung und Knochen morphogenetische Protein (BMP) Signalisierung, geglaubt, um führen Sie Meso-Entoderm und Mesoderm Differenzierung, was zu einem niedrigen Induktion-Wirkungsgrad von die achsnahen Mesoderm (ca. 20 %)2. Das heißt, war das PSC abgeleitet Mesoderm induziert durch diese Signalwege hauptsächlich seitliches Platte Mesoderm und nicht achsparallel Mesoderm. Vor kurzem, haben einige Studien die effiziente Produktion von PSC abgeleitet achsparallel Mesoderm basierend auf unterschiedliche Strategien3,4,5,6,7,8 gezeigt. . In diesen Studien wurden mit relativ hohen Konzentrationen von Glykogen-Synthase Kinase 3 (GSK3) EAP kultiviert-Inhibitoren (WNT signalisieren Aktivatoren), folglich die Induktion Effizienz der achsnahen Mesoderm erreicht 70 – 95 %6,7 .
In Somitogenesis das achsparallel Mesoderm zuerst bildet das presomitic Mesoderm (PSM) nach hinten, und dann bildet Somiten (SMs) im vorderen Teil durch Mesenchym-epithelialen Übergang9,10. Notch-Liganden Delta-Like 1 (DLL1) ist bekannt, eine zentrale Rolle während der Somitogenesis, haben als oszillierende Kontrolle der DLL1 Ausdruck, beide in mRNA und Protein-Ebene, SM Segmentierung regelt. SMs schließlich unterteilen in zwei Teile, wodurch sich die Dermomyotome (DM) dorsal und Sklerotom (SCL) ventral11. Danach unterscheidet die DM in das Dermatom (D), ein Vorläufer der Dermis und Myotome (MYO), ein Vorläufer des skelettartigen Muskels; Darüber hinaus bildet ein ventraler Teil des SCL Syndetome (SYN), ein Vorläufer der Sehnen und Bänder12 (Abbildung 1). Einige Forscher haben die Induktion von PSC abgeleitet SM-Derivaten wie MYO4,13 und SCL-14berichtet; Es gibt jedoch einige Einschränkungen in diesen Studien. Vor allem, da unser Wissen über die Signalisierung Umgebungen von D und SYN fragmentarisch ist, Induktion Protokolle für D und SYN nicht noch systematisch entstanden. Um die volle Kompetenz der SMs induziert von EAP zu demonstrieren, es ist wichtig, die Multi-Differenzierung zu zeigen Kapazität der induzierten SMs in alle vier Derivate (D, MYO, SCL und SYN), während frühere Studien nur auf bestimmte SM Derivate konzentriert haben. Hier berichten wir über alle vier SM-Derivate, einschließlich D und SYN, durch PSM und SM Schicksale von menschlichen iPSCs15Generierung. Wir glauben, dass zur Gründung einer in-vitro-schrittweisen Methode, dass Modelle, die zur Erforschung der menschlichen SM SM-Entwicklungsprozess beitragen könnten in der Embryogenese, ohne Verwendung von Embryonen entwickelt.
Protokoll
Alle experimentelle Protokolle mit menschlichen iPSCs stimmten die Ethik-Kommission von der Department of Medicine and Graduate School of Medicine, Universität Kyoto.
1. menschliche iPSCs Vorbereitung vor der Induktion
Hinweis: Kultur menschlichen iPSCs (201B7-PAX3-GFP) auf SNL Feeder-Zellen16 mit Primaten ES Zelle Medium ergänzt mit 4 ng/mL-rekombinanten menschlichen grundlegende Fibroblasten-Wachstumsfaktor (FGF2) und 0,5 % Penicillin und Streptomycin (nachfolgend als hESC Medium sehen ( Tabelle 1). Wenn das Verhältnis der Zusammenfluss 70 – 80 %, Durchgang der Zellen wie zuvor beschrieben17erreicht.
-
Passagierung der menschlichen iPSCs auf SNL Feeder Zellen17
- Fügen Sie für Passagierung PBS in die Zelle Kultivierung Schüssel hinzu und spülen Sie Zellen. Dann entfernen Sie die PBS (, dieser Prozess wird werden nachstehend mit PBS waschen).
- Fügen Sie 1 mL CTK-Lösung (siehe Tabelle 1) bei Raumtemperatur (RT) und warten Sie, bis die SNL-Feeder-Zellen beginnen von der Unterseite der Schale lösen.
- Die CTK-Lösung entfernen und dann zweimal mit PBS waschen.
- Fügen Sie 1 mL hESC Medium in die Schüssel, dann kratzen die Zellen mit einem Schaber und sammeln Sie in einem 15 mL konische Rohr (siehe Tabelle 1).
- Pipette vorsichtig den Inhalt fünfmal mit einer 1.000 µL-Spitze, und übertragen Sie dann auf ein neues Gericht mit hESC Medium gefüllt. Verwenden Sie ein Split-Verhältnis von 1:4 bis 01:10, je nach Zusammenfluss Verhältnis vor Passagierung. Außerdem variieren Sie die Lautstärke des hESC Medium je nach Umfang der Schale (z. B. 3 mL für eine 6 cm Schüssel, 8 mL für eine 10 cm Teller).
- Inkubieren Sie die menschliche iPSCs bei 37 ° C und 5 % CO2.
- Ändern Sie die mittlere jeden Tag (außer am Tag nach Passagierung) und Kulturzellen Sie bis zum nächsten passaging Verfahren.
-
Feeder-freie Kultivierung der menschlichen iPSCs vor PSM Induktion
Hinweis: um die Wirkung von Wachstumsfaktoren aus SNL-Feeder-Zellen abgesondert zu minimieren, Kultur der menschlichen iPSCs Feeder-freien Bedingungen mit einem Feeder-freie Zellkulturmedium (siehe Tabelle 1) auf die extrazelluläre Matrix (ECM) Lösungen (siehe Tabelle 1) beschichtete Platte für 3 Tage vor der PSM-Induktion.- Tag-4 (4 Tage vor dem Beginn der PSM-Induktion)
- Um das ECM Lösung beschichtet Gericht vorzubereiten, fügen Sie 4 mL ECM-Lösung auf einem 10 cm Teller über Nacht bei 4 ° C.
Hinweis: Legen Sie ECM-Lösung auf Eis, während der Vorbereitung.
- Um das ECM Lösung beschichtet Gericht vorzubereiten, fügen Sie 4 mL ECM-Lösung auf einem 10 cm Teller über Nacht bei 4 ° C.
- Tag-3
- Zuerst entfernen Sie die ECM-Lösung aus der Schale und 8 mL Feeder-freie Zellkulturmedium.
- Pour commencer Feeder-freie Kultivierung, einmal waschen Sie mit PBS, kultivierten Zellen zu spülen.
- Fügen Sie 1 mL CTK-Lösung bei RT, bis die SNL-Feeder-Zellen beginnen von der Unterseite der Schale lösen.
Hinweis: Verwenden Sie Mikroskopie um zu bestätigen, dass alle Feeder-Zellen aus dem Boden gelöst werden. - Die CTK-Lösung entfernen und waschen mit PBS zweimal, damit alle SNL-Feeder-Zellen vollständig entfernt werden.
- Fügen Sie 1 mL der Feeder-freie Zellkulturmedium in die Schüssel, dann Kratzen Sie die Zellen mit einem Schaber und sammeln sie in einem 15 mL konische Röhrchen.
- Sanft den Inhalt dreimal mit einer 1.000 µL Spitze pipette, dann übertragen auf einen neuen ECM-Lösung beschichtet 10 cm Teller (während Schritt 1.2.1 vorbereitet). Verwenden Sie ein Split-Verhältnis von etwa 1:2 bis 1:4, je nach Zusammenfluss Verhältnis vor Feeder-freie Kultivierung.
- 3 Tage, ändern des Mediums am Tag-1 inkubieren Sie der menschlichen iPSCs bei 37 ° C und 5 % CO2 .
- Tag-4 (4 Tage vor dem Beginn der PSM-Induktion)
(2) PSM Differenzierung und Isolation von Fluoreszenz-aktivierte Zelle sortieren (FACS)
-
PSM Differenzierung (Tag 0 – Tag 4)
- Der Feeder-freie Zellkulturmedium Aspirieren und 8 mL PSM Induktion Medium (CDM basal Medium ergänzt mit 10 µM SB431542, 10 µM CHIR99021, 2 µM DMH1 und 20 ng/mL FGF2, siehe Tabelle 1).
Hinweis: Zelle Zusammenfluss bei Einleitung der PSM Differenzierung ist für Induktion Effizienz entscheidend. Verwendung-Mikroskopie, konfluierende Verhältnis zu bestätigen ist ca. 30 %. - 4 Tage, ändern des Mediums an Tag3 inkubieren Sie Zellen bei 37 ° C, mit 5 % CO2.
- Ernten Sie Zellen für FACS, an Tag 4 (siehe Abschnitt 2.2, unten).
- Der Feeder-freie Zellkulturmedium Aspirieren und 8 mL PSM Induktion Medium (CDM basal Medium ergänzt mit 10 µM SB431542, 10 µM CHIR99021, 2 µM DMH1 und 20 ng/mL FGF2, siehe Tabelle 1).
-
Isolierung von DLL1 positive PSM Zellen durch Fluoreszenz-aktivierte Zelle sortieren (FACS)
Hinweis: unten ist ein Verfahren zur Vorbereitung der Zelle vor FACS Sortierung der DLL1 positive Zellen. Laut Protokoll des Herstellers durchführen Sie FACS Sortierung mit einem Durchflusszytometer.- Aspirieren Sie das Medium, dann mit PBS waschen. Anschließend fügen Sie 1 mL der Zelle Dissoziation Reagenz und lassen für 3 min bei RT
- Fügen Sie 4 mL CDM basal Medium hinzu, kratzen Sie die Zellen mit einem Schaber und sammeln sie in einem 15 mL konische Röhrchen.
- Die Anzahl der Zellen mit Hilfe eines automatisierten Zelle Zählers, dann bei 280 X g für 3 min zentrifugieren.
- Sorgfältig entfernen den Überstand durch Absaugen und Aufschwemmen der Zellen in FACS-Puffer (siehe Tabelle 1) in einer Konzentration von 1,0 x 107 Zellen/mL. Für eine Negativkontrolle Probe (Isotype Kontrolle oder im Konvent ohne Antikörper), 50 µL in einem 15 mL konische Rohr übertragen und dann mit 450 µL FACS Puffer aussetzen.
- Fügen Sie DLL1 Antikörper (siehe Tabelle der Materialien) in einem Verhältnis von 1/200. Schützen Sie das Rohr vor Licht und halten Sie für 30 min auf Eis.
- Zentrifuge bei 280 X g 3 Minuten lang.
- Vorsichtig Aspirieren überstand und Aufschwemmen im FACS Puffer (1,0 x 107 Zellen/mL) mit 1 mg/mL DAPI ergänzt.
- Transfer in ein Sammelrohr, aufgenommen mit einer 35 µm-Nylon-Netzgewebe in der Kappe für die Filterung, legen Sie dann die Röhre auf Eis, bis Sortierung abgeschlossen ist. Führen Sie die gleiche Prozedur mit der Negativkontrolle Probe (Schritt 2.2.4).
- Durchführen Sie Sortierung mit einem Durchflusszytometer laut Protokoll des Herstellers.
- Sammeln Sie die sortierten DLL1 positive Zellen in eine 15 mL konische Röhrchen, mit 4 mL CDM basal Medium mit 10 µM Y27632 ergänzt. Für total RNA-Extraktion 280 X g für 3 min Zentrifugieren dann in RNA Lyse Puffer Aufschwemmen und speichern bei-30 ° C. Die RNA-Extraktion, reverse Transkription und RT-qPCR Verfahren (Abschnitt 5.1) für weitere detaillierte Informationen zu sehen.
- SM-Differenzierung, die Verwendung der sortierten Zellen nach Ausführen der unter Protokoll (Abschnitt 3).
3. SM Differenzierung von PSM
-
SM-Differenzierung von sortierten DLL1 positive PSM Zellen (Tag 4 – Tag 8)
Hinweis: bereiten die ECM Lösung beschichtet 12-Well-Platten am Vortag FACS sortieren. Zur Vorbereitung einer ECM-Lösung beschichtet 12-Well-Platte, fügen Sie 1 mL der ECM-Lösung in jede Vertiefung bei 4 ° C und lassen Sie über Nacht. Halten Sie die ECM-Lösung auf dem Eis während der Vorbereitung.- Folgenden Schritt 2.2.10, Zentrifuge bei 280 X g 3 Minuten lang.
- Sorgfältig den Überstand abgesaugt und in 1 mL SM Induktion Medium Aufschwemmen (CDM basal Medium ergänzt mit 10 µM SB431542 und 5 µM CHIR99021, siehe Tabelle 1).
- Die Anzahl der Zellen mit Hilfe eines automatisierten Zelle Zählers.
- 1.0 x 105 Samenzellen auf jede Vertiefung der ECM-Lösung beschichtet 12-Well-Platten mit 1 mL SM Induktion Medium mit 10 µM Y27632 ergänzt.
- Inkubation bei 37 ° C mit 5 % CO2 für 4 Tage bis zum 8. Tag. Verändern Sie das Medium nicht mit Y27632 am 5. Tag (der Tag nach dem FACS sortieren) und 7. Tag.
- Führen Sie SM-Derivate-Differenzierung mit induzierten SM-Zellen nach unten Protokolle. Für total RNA-Extraktion aus induzierten SM Zellen sammeln die Zellen in einem 15 mL konische Rohr und Zentrifuge bei 280 X g für 3 min, dann in RNA Lyse Puffer Aufschwemmen und speichern bei-30 ° C.
4. SM-Derivate (DM, MYO, D, SCL, SYN) Differenzierung von SM
Hinweis: Um die volle Kompetenz der SM Zellen zu demonstrieren, zuerst führen Sie DM (Dermomyotome) und SCL (Sklerotom) Induktion entsprechend mit iPSC-abgeleitete SM Zellen aus. Anschließend führen Sie MYO (Myotom) und D (Dermatom) Induktion mit der DM-Zellen, und führen Sie SYN (Syndetome) Induktion mit der SCL-Zellen. Unten sind die Protokolle für die Induktion von jeder Ableitung (DM, MYO, D, SCL und SYN) von induzierten SM-Zellen in vitro.
-
DM-Differenzierung von SM Zellen (Tag 8 – Tag 11)
- Aspirieren Sie das Medium, dann fügen Sie 1 mL DM Induktion Medium (CDM basal Medium ergänzt mit 5 µM CHIR99021 und 10 ng/mL BMP4, siehe Tabelle 1).
- 3 Tage bis Tag 11 der Zellen bei 37 ° C, mit 5 % CO2, inkubieren. Das Medium am 10. Tag (Tag 2 der DM-Induktion) verändern.
- Führen Sie MYO und D Differenzierung mit DM Zellen nach unten Protokolle induziert.
-
MYO-Differenzierung von DM Zellen (Tag 11-Tag 41)
- Aspirieren Sie das Medium, dann fügen Sie 1 mL MYO Induktion Medium (CDM basal Medium ergänzt mit 5 µM CHIR99021, siehe Tabelle 1).
- 30 Tage bis Tag 41 die Zellen bei 37 ° C, mit 5 % CO2, inkubieren. Verändern Sie alle 3 Tage das Medium.
-
D Differenzierung von DM Zellen (Tag 11-Tag 20)
- Aspirieren Sie das Medium, dann fügen Sie 1 mL D Induktion Medium (CDM basal Medium ergänzt mit 5 µM CHIR99021 und 10 ng/mL BMP4, siehe Tabelle 1).
- 9 Tage bis Tag 20 Zellen bei 37 ° C, mit 5 % CO2, inkubieren. Verändern Sie alle 3 Tage das Medium.
-
SCL-Differenzierung von SM Zellen (Tag 8 – Tag 11)
- Aspirieren Sie das Medium, dann fügen Sie 1 mL der SCL Induktion Medium (CDM basal Medium ergänzt mit 100 nM SAG und 0,6 µM LDN193189, siehe Tabelle 1)14.
- 3 Tage die Zellen bei 37 ° C, mit 5 % CO2, inkubieren. Das Medium am 10. Tag (Tag 2 der SCL Induktion) verändern.
- Durchführen Sie SYN-Differenzierung mit induzierten SCL Zellen gemäß dem Protokoll unten.
-
SYN-Differenzierung von SCL Zellen (Tag 11-Tag 32)
Hinweis: bereiten die ECM Lösung beschichtet 24-Well-Platten am Vortag Initiierung SYN Induktion. Zur Vorbereitung einer ECM-Lösung beschichtet 24-Well-Platte, fügen Sie 0,5 mL der ECM-Lösung in jede Vertiefung bei 4 ° C und lassen Sie über Nacht. Halten Sie die ECM-Lösung auf dem Eis während der Vorbereitung.- Aspirieren Sie das Medium dann waschen mit PBS, dann jedes gut 0,2 mL der Zelle Dissoziation Reagenz hinzu und lassen Sie für 3 min bei RT
- Jedes gut fügen Sie 0,8 mL CDM basal Medium hinzu dann Kratzen Sie und sammeln Sie alle Zellen in einem 15 mL konische Röhrchen.
- Zentrifuge bei 280 X g 3 Minuten lang.
- Sorgfältig den Überstand abgesaugt und in 1 mL SYN Induktion Medium-1 Aufschwemmen (CDM basal Medium ergänzt mit 20 ng/mL FGF8, siehe Tabelle 1), dann die Anzahl der Zellen mit Hilfe eines automatisierten Zelle Zählers.
- 5.0 x 104 Samenzellen in jede Vertiefung der ECM-Lösung beschichtet 24-Well-Platten mit 1 mL SYN Induktion Medium-1.
- 3 Tage bei 37 ° C, mit 5 % CO2, inkubieren.
- Am 14. Tag (Tag 3 der SYN-Induktion), ersetzen Sie das Medium mit SYN Induktion Medium-2 (CDM basal Medium ergänzt um 10 ng/mL BMP7 und 10 ng/mL TGFβ3, siehe Tabelle 1).
- Inkubation bei 37 ° C, mit 5 % CO2, 18 Tage bis zum Tag 32. Verändern Sie alle 3 Tage das Medium.
5. Charakterisierung der iPSC-abgeleitete Produkte
Hinweis: Charakterisieren Sie bei der Differenzierung menschliches iPSCs Derivate mit quantitative Echtzeit-PCR (RT-qPCR), Immunocytochemistry (ICC), Enzym-linked Immunosorbentprobe Assays (ELISA) und mechanischen Stretch Stimulation Assays, entsprechend.
-
Zellernte, total RNA-Extraktion, reverse Transkription und quantitative Echtzeit-PCR (RT-qPCR) Analyse
- Die Zellproben (Verfahren 2.2.10, 3.1.6, 5.4.3) in ein 1,5 mL Röhrchen sammeln, dann bei 280 X g für 3 min zentrifugieren.
- Den Überstand zu entfernen, dann in 350 µL RNA Lyse Puffer, eine geeignete Gesamt RNA Extraktion Kit Aufschwemmen.
- Gesamt-RNS mit dem Kit laut Protokoll des Herstellers zu extrahieren.
- Umgekehrter Reihenfolge transkribieren isoliert 1 µg Gesamt RNA in cDNA, laut Protokoll des Herstellers.
- Durchführen Sie RT-qPCR mit geeigneten Enzymen, Reagenzien und Primer nach Protokoll des Herstellers. In dieser Studie verwendeten Primer-Sequenzen sind in Tabelle 2aufgeführt.
-
Immunocytochemistry (ICC)
- Befestigen Sie vor der Durchführung von Immunocytochemistry mit Antikörpern die Zellen mit 2 % Paraformaldehyd bei 4 ° C für 10 min, und zweimal mit PBS waschen.
- Inkubieren Sie für Permeabilisierung mit 0,2 % Methanol oder 0,2 % Polysorbat 20/PBS (nachfolgend PBS-T) bei 4 ° C für 15 Minuten.
- Permeabilisierung Reagenzien zu entfernen und die Zellen mit eine entsprechende blockierende Puffer oder 1 % bovine Serum Albumin/PBS bei 4 ° C für 60 min. zu behandeln.
- Fügen Sie den ersten Antikörper, verdünnt mit 10 % blockierende Puffer in PBS-T und Platz auf einer schütteln Maschine bei 4 ° C über Nacht.
- Waschen dreimal mit PBS-T (PBS-T hinzufügen und legen Sie auf die schütteln Maschine bei RT für 10 min).
- Fügen Sie den zweiten Antikörper, verdünnt mit 10 % blockierende Puffer in PBS-T und Platz auf dem Schütteln Computer bei RT für 60 min. Die ersten und zweiten Antikörper für ICC verwendet in dieser Studie sind in Tabelle 3aufgeführt.
Hinweis: Von diesem Schritt ab die Platte/Schale vor Licht geschützt in Folie einwickeln. - Waschen Sie zweimal mit PBS-T.
- Fügen Sie für Zähler Färbung 1/5000 DAPI mit PBS und auf das Schütteln Maschine bei RT 5 min verdünnt hinzu.
- Die DAPI Lösung entfernen und Hinzufügen von PBS in jede Vertiefung.
- Die Zelle Färbung mit einem Fluoreszenzmikroskop zu beobachten. Alternativ speichern Sie die Platte/Schale bei 4 ° C für bis zu 1 Monat.
-
Enzym-linked Immunosorbentprobe Assay (ELISA) für Funktionsanalyse des iPSC abgeleitet D
Hinweis: menschlichen dermalen Fibroblastenzellen (HDF) sind im Handel erhältlich. Kultur HDF in DMEM mit 10 % fötalen Rinderserum ergänzt (siehe Tabelle 1).- 1.0 x 105 Samenzellen iPSC abgeleitet D und HDF auf 24-Well-Platten mit 1 mL je Nährmedium (D: D Induktion Medium, HDF: DMEM mit 10 % fötalen Rinderserum ergänzt).
- Nach 3 Tagen der Zelle Kultivierung, sammeln 100 µL eines jeden Mediums in einen 1,5 mL-Tube, und bei 4 ° c lagern
- Führen Sie die Reihe von Verfahren, wie beispielsweise die Erkennung Antikörper und sekundäre Antikörper nach Anweisungen des Herstellers, und quantifizieren die Anzahl der Ziele durch die Erzeugung einer Standardkurve gegen die Konzentration des Steuerelements zu Analyten Proben.
-
Mechanischen Stretch Stimulation Assay für Funktionsanalyse des iPSC-abgeleitete SYN
Hinweis: Erwachsenen menschlichen Tenocytes sind im Handel erhältlich (siehe Tabelle der Materialien). Kultur menschlichen iPSC-abgeleitete SYN und Erwachsenen menschlichen Tenocytes auf eine Zelle, die Streckvorrichtung für die mechanischen Stretch Stimulation Assay wie unter18,19beschrieben. Nutzung SYN Induktion Medium-2 und Tenocytes Wachstumsmedium (siehe Tabelle der Materialien) als Kultivierung Medium für jede iPSC-abgeleitete SYN und Erwachsenen menschlichen Tenocytes, beziehungsweise.- 24 h vor der Ausdehnung, chambers Platte 1,0 x 105 Zellen des iPSC-abgeleitete SYN und menschliche Tenocytes auf ECM-Lösung beschichtet Multi-Brunnen-Typ Silikon-Kautschuk, jeweils mit einer Kultur-Fläche von 1,5 x 1,5 cm (siehe Tabelle der Materialien).
- Die Kammern für Zelle erstreckt sich auf dem Gerät festgelegt, und zwingen monoaxiale zyklische Belastung (0,5 Hz, 5 %) für 12 h.
- Fügen Sie für total RNA-Extraktion 350 µL RNA Lyse Puffer, dann Kratzen Sie und sammeln Sie die Zellen in einer 1,5 mL-Tube für insgesamt RNA-Extraktion und anschließende RT-qPCR-Analyse (siehe Verfahren 5.1).
Ergebnisse
Alle Zahlen in diesem Bericht wurden mit 201B7-PAX3-GFP iPSCs erzielt in denen EGFP ein Allel von der PAX3 kodierende Sequenz im Exon 1 ersetzt. Gründung der 201B7-PAX3-GFP iPSCs werden an anderer Stelle beschrieben (H. Sakurai, persönliche Kommunikation). Die statistische Signifikanz wurde mit Statistiksoftware ausgewertet. P-Werte geringer als 0,05 als signifikant angesehen wurden.
Charakterisierung von menschlichen iPSC-abgeleitete PSM und SM-Zellen
Um die Differenzierung der menschlichen iPSCs in Richtung SM durch den PSM-Staat (Abbildung 2A), FACS Analyse beurteilen wurden ICC, und RT-qPCR-Analyse durchgeführt. Wie in Abbildung 2 bgezeigt, waren mehr als 85 % der Zellen positiv für DLL1, ein Marker für PSM, aber negativ für PAX3, ein Marker für SM, nach 4 Tagen der PSM-Induktion mit menschlichen iPSCs. Anschließend wurde dieser Population PAX3 positive SM Zellen nach 4 Tagen der SM Induktion. Die PSM-SM-Übergang bestätigte auch ICC (Abbildung 2) und RT-qPCR (Abb. 2D). TBX6, MSGN1 und WNT3A, PSM Markierungen waren auf den PSM-Stand (Tag 4) angegeben, jedoch nicht auf dem SM-Stand (Tag 8) angegeben. PARAXIS, MEOX1 und PAX3, SM-Marker wurden bei SM angegeben, jedoch nicht bei PSM angegeben. Darüber hinaus angesammelt Färbung des CDH11, ein Marker für epithelialized SM, nur an der Zell-Zell-Kreuzung, nach Zugabe von SB431542 mit CHIR99021 (Abb. 2E).
Charakterisierung von SM-Derivaten aus menschlichen iPSC-abgeleitete SM Zellen induziert
Um die Differenzierung Potenz des menschlichen iPSC-abgeleitete SM zu bewerten, wurde durch ICC Analyse und PAX3 (GFP) Differenzierung gegenüber DM, MYO, D, SCL und SYN (Abbildung 3A) beurteilt-Fluoreszenz. Wie in Abbildung 3 bgezeigt, bestätigte DM Differenzierung von ALX4 und EN1 Färbung und PAX3 (GFP)-Fluoreszenz; MYO Differenzierung wurde durch MYOD, MYOG und Myosin heavy Chain (MHC) Färbung bestätigt; D Differenzierung wurde durch EN1 und PDGFRa Färbung bestätigt; SCL Differenzierung wurde durch PAX1, PAX9 und NKX3.2 Färbung bestätigt; und SYN Differenzierung wurde bestätigt durch SCX, MKX, COL1A1 und COL1A2 Färbung.
Charakterisierung der induzierten D und SYN
1. Enzym-linked Immunosorbentprobe Assay (ELISA) für Funktionsanalyse des iPSC abgeleitet D
Im menschlichen Körper ist eine der Hauptfunktionen der dermalen Fibroblasten absondern extrazelluläre Matrix (ECM) Proteine wie Kollagen und Hyaluronsäure, die Feuchtigkeit der Haut und helfen, die Struktur der Haut aufrecht zu erhalten. Um zu demonstrieren, dass eine vergleichbare Menge an Kollagen-Typ 1 und Hyaluronsäure Proteine in das Kulturmedium iPSC abgeleitet D und HDF abgesondert wurden, war ELISA durchgeführt, wie in Abbildung 4Adargestellt.
(2) mechanische dehnen Stimulation Assay für Funktionsanalyse des iPSC-abgeleitete SYN
Wie mehrere Studien bereits berichtet haben, mechanische Stimulation Sehne Entwicklung vor und nach der Geburt beeinflusst und fördert die Differenzierung von Tenocytes vom Vorläufer Zellen18,19. Daher ist es bekannt, dass die Reaktivität gegen mechanische Beanspruchung ist eines der Merkmale des Tenocytes. Um die vergleichbare Reaktivität des menschlichen iPSC-abgeleitete SYN und menschlichen Erwachsenen Tenocytes zu demonstrieren, wurde ein mechanischen Stretch Stimulation Assay durchgeführt, wie in Abbildung 4 bdargestellt.
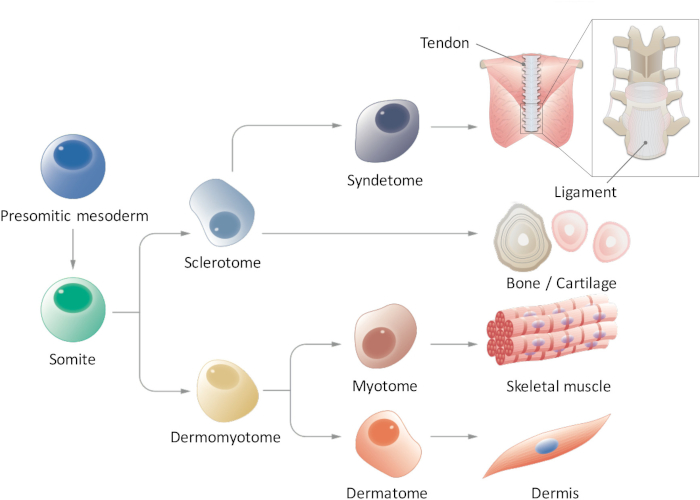
Abbildung 1: Schematische Darstellung der hierarchische Differenzierung der achsnahen Mesoderm. Presomitic Mesoderm ist einer Zellpopulation, die vorübergehend in der frühen Embryogenese entsteht und Segmentierung Form Somiten erfährt. Sag sind eine vorübergehende Stammzell-Bevölkerung, die Anlass zu mehreren Zelltypen, wie Sklerotom, Dermomyotome, Syndetome, Dermatome und Myotome Zellen, die schließlich in Sehnen/Bänder, Knochen/Knorpel, Skelettmuskel und Dermis zu differenzieren Zellen. Bitte klicken Sie hier für eine größere Version dieser Figur.
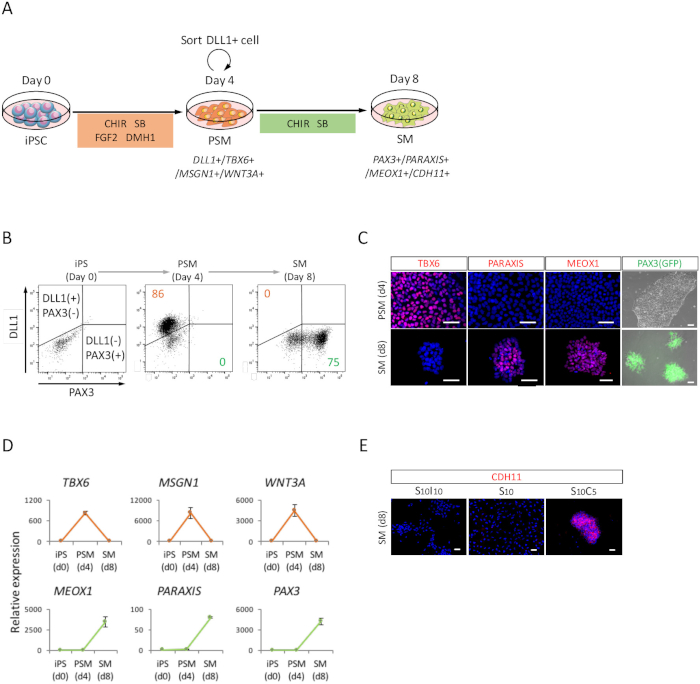
Abbildung 2: FACS, RT-qPCR und ICC Analyse der menschlichen iPSC-abgeleitete PSM und infrarotem (A) schematische Darstellung eines Protokolls für SM Differenzierung durch PSM. (B) repräsentative Dot Plot DLL1 Färbung und PAX3 (GFP)-Fluoreszenz am Tag 4 der PSM-Induktion und Tag 4 (Tag 8 von iPSC) von SM-Induktion. (C) Vertreter Immunocytochemical Bilder und PAX3 (GFP)-Fluoreszenz am Tag 4 der PSM-Induktion und Tag 4 (Tag 8 von iPSC) von SM-Induktion. Zellen waren voller Flecken mit Anti-TBX6, PARAXIS und MEOX1 Antikörper (rot) und Co gebeizt mit DAPI (blau) oder mit PAX3 (GFP) erkannt-Fluoreszenz (grün). (D) RT-qPCR Analyse Marker für PSM und SM zu iPSC, PSM und SM. Die Mittel ± Standardfehler (S.E) aus drei Experimente werden angezeigt. (E) Vertreter Immunocytochemical Bilder an Tag 4 (Tag 8 von iPSC) cm, kultiviert in S10I10 (Kombination von SB431542 und IWR1, ein Inhibitor der WNT-Signal), S10 (SB431542) und S10C5 (Kombination von SB431542 und CHIR99021) Bedingungen. Zellen waren fleckig mit Anti-CDH11 Antikörper (rot) und Co mit DAPI (blau) gefärbt. iPS, induzierte pluripotente Stammzellen; PSM, presomitic Mesoderm; SM, Somiten; S10, SB431542 10 ΜM; C5, CHIR99021 5 ΜM; I10, IWR1 10 ΜM; Skalieren von Balken = 50 μm. Diese Zahl wurde von Nakajima Et Al. (2018)15geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
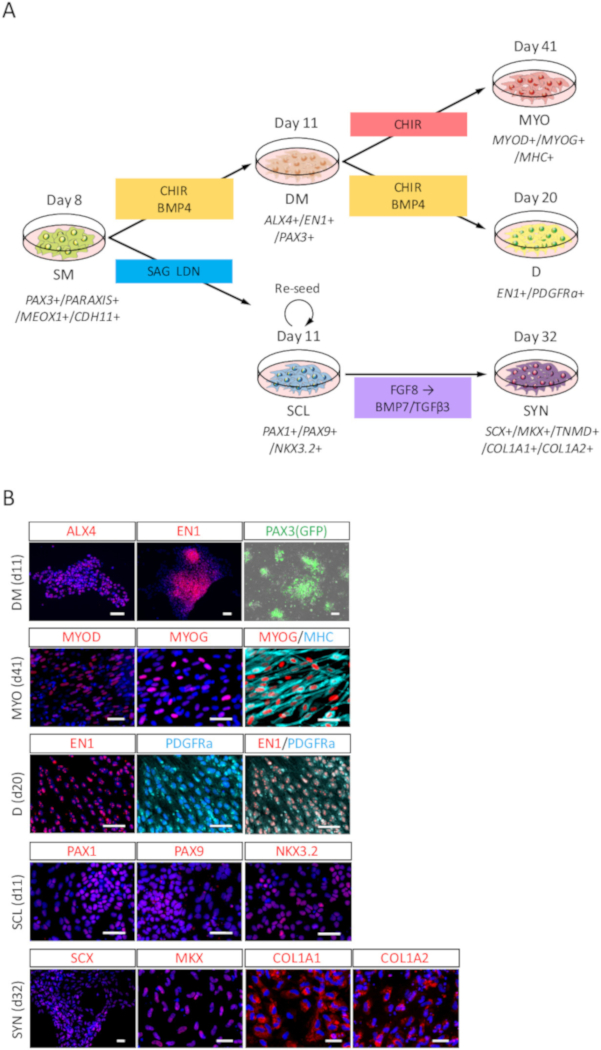
Abbildung 3: ICC-Analyse von DM, MYO, D, SCL und SYN unterschieden von menschlichen iPSC-abgeleitete Körperlänge (A) schematische Darstellung der Protokolle für SM Derivate Differenzierung. (B) Vertreter Immunocytochemical Bilder und PAX3 (GFP)-Fluoreszenz auf Tag 3 (Tag 11 von iPSC) von DM Induktion, Tag 30 (41. Tag aus iPSC) der MYO Induktion, Tag 9 (Tag 20 von iPSC) der D-Induktion, Tag 3 (Tag 11 von iPSC) des SCL-Induktion und Tag 21 (32. Tag von iPSC) der SYN-Induktion. DM, Zellen waren befleckt mit Anti-ALX4 und EN1 Antikörper (rot) und Co gebeizt mit DAPI (blau) oder mit PAX3 (GFP) erkannt-Fluoreszenz (grün); MYO, Zellen waren voller Flecken, mit Anti-MYOD, MYOG (rot) und MHC (Cyan) Antikörper, auch Co gebeizt mit DAPI (blau); D, Zellen waren fleckig mit Anti-EN1 (rot) und PDGFRa (Cyan) Antikörper und Co gebeizt mit DAPI (blau); SCL, Zellen waren befleckt mit Anti-PAX1, PAX9 und NKX3.2 (rot) Antikörper, und Co befleckt mit DAPI (blau); SYN, Zellen waren befleckt mit Anti-SCX, MKX, COL1A1 und COL1A2 (rot) Antikörper, und gemeinsam mit DAPI (blau) befleckt. DM, Dermomyotome; MYO, Myotom; D, Dermatome; SCL, Sklerotom; SYN, Syndetome; Skalieren von Balken = 50 μm. Diese Zahl wurde von Nakajima Et Al. (2018)15geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
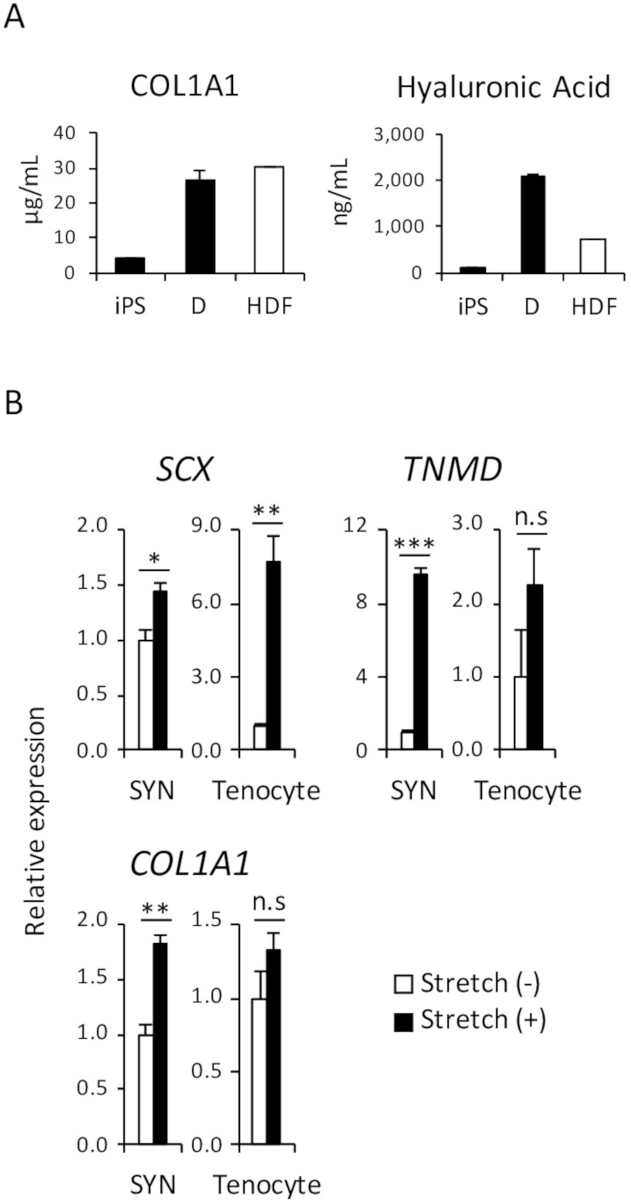
Abbildung 4: funktionelle Assay induzierte D und Sy (A) die Menge an Kollagen-Typ 1 und Hyaluronic Säure, die Proteine in das Kulturmedium von ELISA analysiert wurden. (B) die Wirkung der mechanische Dehnung Stimulation induzierte SYN und menschlichen Erwachsenen Tenocytes wurde von RT-qPCR bewertet. Die Mittel ± Standardfehler (S.E) aus drei Experimente werden angezeigt. * p < 0,05; ** p < 0,01; p < 0,001 Dunnett mehrere Vergleiche t-Test im Vergleich zur Strecke (-); n.s, nicht signifikant, HDF, menschlichen Erwachsenen dermalen Fibroblasten. Diese Zahl wurde von Nakajima Et Al. (2018)15geändert. Bitte klicken Sie hier für eine größere Version dieser Figur.
| Medium/Lösung | Reagant | Konzentration |
| CDM basal medium | Die Iscove geändert Dulbecco Medium/Ham F12 | 1:1 |
| Penicillin/Streptomycin | 0,5 % | |
| Chemisch definiert Lipid-Konzentrat | 1 % | |
| APO-transferrin | 15 mg/mL | |
| Monothioglycerol | 450 mM | |
| Rinderserumalbumin | 5 mg/mL | |
| Insulin | 7 mg/mL | |
| CTK-Lösung | Wasser | - |
| Trypsin | 0,25 % | |
| Kollagenase IV | 0,1 mg/mL | |
| Kalzium-Chlorid | 1 mM | |
| Ko-SR | 20 % | |
| D-Induktion-medium | CDM basal medium | - |
| CHIR99021 | 5 ΜM | |
| BMP4 | 10 ng/mL | |
| DM-Induktion-medium | CDM basal medium | - |
| CHIR99021 | 5 ΜM | |
| BMP4 | 10 ng/mL | |
| ECM-Lösung | Künstliche extrazelluläre matrix | 0,3 mg/mL |
| DMEM/F12 | - | |
| FACS-Puffer | PBS | - |
| Rinderserumalbumin | 0,1 % | |
| Feeder-freie Zellkulturmedium | mTeSR1 | - |
| Penicillin/Streptomycin | 0,5 % | |
| HDF Kulturmedium | DMEM | - |
| Fetale Rinderserum | 10 % | |
| hESC medium | Primate ES Zelle medium | - |
| Penicillin/Streptomycin | 0,5 % | |
| FGF2 | 4 ng/mL | |
| MYO-Induktion-medium | CDM basal medium | - |
| CHIR99021 | 5 ΜM | |
| PSM Induktion medium | CDM basal medium | - |
| SB431542 | 10 ΜM | |
| CHIR99021 | 10 ΜM | |
| DMH1 | 2 ΜM | |
| FGF2 | 20 ng/mL | |
| SCL-Induktion-medium | CDM basal medium | - |
| SAG | 100 nM | |
| LDN193189 | 0,6 ΜM | |
| SM-Induktion-medium | CDM basal medium | - |
| SB431542 | 10 ΜM | |
| CHIR99021 | 5 ΜM | |
| SYN Induktion Medium-1 | CDM basal medium | - |
| FGF8 | 20 ng/mL | |
| SYN Induktion Medium-2 | CDM basal medium | - |
| BMP7 | 10 ng/mL | |
| TGFΒ3 | 10 ng/mL |
Tabelle 1: Medien und Lösung Rezepte.
| NAME | vorwärts | Rückwärts |
| ACTB | CACCATTGGCAATGAGCGGTTC | AGGTCTTTGCGGATGTCCACGT |
| COL1A1 | GGACACAGAGGTTTCAGTGGT | GCACCATCATTTCCACGAGC |
| MEOX1 | GAGATTGCGGTAAACCTGGA | GAACTTGGAGAGGCTGTGGA |
| MSGN1 | GGAGAAGCTCAGGATGAGGA | GTCTGTGAGTTCCCCGATGT |
| PARAXIS | TCCTGGAGAGCTGTGAGGAT | CACACCCTGTCACCAACAGT |
| PAX3 | AGGAAGGAGGCAGAGGAAAG | CAGCTGTTCTGCTGTGAAGG |
| SCX | CCCAAACAGATCTGCACCTTC | GCGAATCGCTGTCTTTCTGTC |
| TBX6 | AGCCTGTGTCTTTCCATCGT | AGGCTGTCACGGAGATGAAT |
| TNMD | CCCTTCATGCTGAAGCCACTT | CTCACTTTCAGCAGAATTGGGG |
| WNT3A | CAAGATTGGCATCCAGGAGT | ATGAGCGTGTCACTGCAAAG |
Tabelle 2: Primer-Sequenzen für RT-qPCR-Analyse.
| Konzentration | ||
| 1. Antikörper | ALX4_Goat | 1/50 |
| CDH11_Mouse | 1/1000 | |
| COL1A1_Rabbit | 1/100 | |
| COL2A1_Mouse | 1-2 μg/mL | |
| EN1_Rabbit | 1/50 | |
| MEOX1_Rabbit | 1/50 | |
| MHC_Rabbit | 1/200 | |
| MKX_Rabbit | 1/50 | |
| MYOD_Rabbit | 1/500 | |
| MYOG_Mouse | 1/400 | |
| NKX3.2_Rabbit | 1/50 | |
| PARAXIS_Rabbit | 1/50 | |
| PAX1_Rabbit | 1/50 | |
| PAX9_Rabbit | 1/50 | |
| PDGFRa_Goat | 1/100 | |
| SCX_Rabbit | 1/50 | |
| TBX6_Goat | 1/50 | |
| 2. Antikörper | Esel anti-Ziege IgG(H+L) sekundäre antibody555 | 1/500 |
| Esel anti-Ziege IgG(H+L) sekundäre antibody647 | 1/500 | |
| Ziege anti-Maus IgG(H+L) sekundäre antibody555 | 1/500 | |
| Ziege anti-Kaninchen-IgG(H+L) sekundäre antibody555 | 1/500 | |
| Ziege anti-Kaninchen-IgG(H+L) sekundäre antibody647 | 1/500 |
Tabelle 3: Erster und zweiter Antikörper für ICC.
Diskussion
Eine bekannte Methode zur Einarbeitung von PSC abgeleitet SM durch PSM ist die Kombination von CHIR99021 + A83-01 (TGFβ-Hemmer) bei PSM Induktion von PSC, aber nicht während der PSM Reifung Prozess6. In der vorliegenden Studie war WNT/Beta-Catenin-Signalisierung gehemmt mit C59 induzieren SM von PSM. Allerdings haben wir den Einsatz von CHIR99021, der WNT-Signalweg bei SM Differenzierung zu aktivieren. Diese Entscheidung wurde auf der Erkenntnis basiert, dass mehrere WNTs in das umliegende Gewebe von SM ausgedrückt und angesichts der Tatsache, dass WNT Reporter im SM20aktiv sind. Infolgedessen haben wir beobachtet Epithelisierung, ein Merkmal der SM in vivo nur unter der Bedingung mit CHIR99021, basierend auf die Ansammlung von CDH11 in Zell-Zell Verbindungen (Abb. 2E). Diese Beobachtung zeigt die kritische Auseinandersetzung der WNT signalisieren während PSM Differenzierung und SM Epithelisierung, daher, dass unser Protokoll die endogene Signalisierung Umwelt besser rekapitulieren kann. Es bedeutet jedoch auch eine weitere Möglichkeit der Feinabstimmung der WNT/Beta-Catenin Signalweg während der Differenzierung, weil Robustheit und Effizienz der Differenzierung je nach die Zelltypen, Zell-Linien und verschiedene erheblich variieren kann chemische Verbindungen des WNT-Induktoren von jedem Forscher verwendet.
Diese Methode ermöglicht auch alle vier SM Derivate, MYO, D, SCL und SYN, aus menschlichen iPSCs zu generieren. Unsere schrittweise Protokolle mit CDM können verwendet werden, um die Signalisierung Anforderungen während der menschlichen Somitogenesis/Somiten Musterung zu identifizieren und liefern wichtige Erkenntnisse der Bildungsforschung SM. Beispielsweise könnte unsere Methoden für das Studium Segmentierung Uhr Mechanismen, eine molekulare Schwingung-System, das regelt die Bildung von SM nützlich sein. Es wurde bei Mäusen, Küken und Zebrafisch, aber nicht beim Menschen aufgrund des Fehlens entsprechender experimentellen Tools gründlich untersucht.
Darüber hinaus kann unsere Methode auf künftige klinische zellbasierte Therapien anwendbar. Zum Beispiel menschlichen iPSC abgeleitet D SYN in schwer verletzter Haut transplantiert werden kann oder geplatzten Sehnen für Regeneration und Behandlung. Einige Einschränkungen müssen jedoch gelöst werden, bevor diese Methode praktisch angewendet werden kann. Obwohl in der vorliegenden Studie verwendet wir SNL-Feeder-Zellen für iPSC Wartung und ECM-Lösung, die aus der Engelbreth-Holm-Schwarm Maus Sarkom, als Oberfläche Mantel auf dem Teller während der Induktion, extrahiert wird sollte diese nichtmenschlichen tierische Reagenzien entfernt, um klinische Qualität zu verbessern. Darüber hinaus müssen die Zelle Quantität und Qualität, die die Reinheit und die Reifung der gewünschten Zellen umfasst, auch verbessert werden. Darüber hinaus ist nicht nur die Anzahl von Zellen, sondern auch die Stärke der Zelle ein wichtiges Merkmal für die Regeneration von Sehnen/Bänder. Darüber hinaus die Entwicklung der Oberflächenmarker für Reinigung und eine neuartige Methode zur 3D Rekonstruktion sind unerlässlich, um unsere Protokolle, zellbasierte Therapien voraus.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Wir möchten Dr. Junya Toguchida (CiRA) danken für seine Hilfe mit Projektverwaltung und Finanzierung der Akquisition, Herr Mitsuaki Shibata (CiRA) und Frau Mei Terashima (CiRA) für ihre technische Unterstützung, Dr. Yayoi Toyooka (CiRA) und Dr. Daisuke Kamiya (CiRA) Ihre Korrektur des Manuskripts und Herr Masaya Todani (CiRA) für die Bereitstellung einer Illustration (Abbildung 1). Wir danken auch allen Mitgliedern des Ikeya und Toguchida Labors (CiRA) für ihre Unterstützung während der Studie. Diese Arbeit wurde von Grants-in-aid für die wissenschaftliche Forschung der Japan Society für die Förderung von Science (JSPS) (26670661), das Programm für die hartnäckigen Krankheiten Forschung unter Verwendung krankheitsspezifische iPS-Zellen aus der Japan Science and Technology unterstützt Agentur (JST) und die Japan-Agentur für medizinische Forschung und Entwicklung (AMED), dem Kern-Zentrum für iPS Cell Research Center Forschungsnetzwerk für die Realisierung der regenerativen Medizin (JST/AMED) und die iPS Cell Research Fund (teilweise zu Makoto Ikeya und Junya Toguchida). Makoto Ikeya wurde auch von Grants-in-aid für wissenschaftliche Forschung (JSPS) (16 H 05447) und das Acceleration Programm für hartnäckigen Krankheit-Forschung unter Verwendung krankheitsspezifische iPS-Zellen (AMED) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| ALX4_Goat antibody | Santacruz | sc-22066 | |
| Apo-transferrin | Sigma | T1147 | |
| BMP4 | R&D | 314-BP-010 | |
| BMP7 | R&D | 354-BP-010 | |
| Bovine serum albumin | Sigma | A8806 | |
| Calcium chloride | Nacalai tesque | 067730-15 | |
| CDH11_Mouse antibody | Cell signaling | 13577 | |
| Cell streching device | Strex | STB-140 | |
| Chemically defined lipid concentrate | Gibco | 11905-031 | |
| CHIR99021 | Axon | 1386 | |
| COL1A1_Rabbit antibody | Abcam | ab34710 | |
| COL2A1_Mouse antibody | Thermo scientific | MS-235 | |
| Collagenase IV | Thermofisher | 17104019 | |
| DLL1 APC-conjugated_Mouse antibody | R&D | FAB1818A | For FACS |
| DMEM | Sigma | D6046 | |
| DMEM/F12 | Gibco | 11320-082 | |
| DMH1 | Tocris | 4126 | |
| EN1_Rabbit antibody | Abcam | ab70993 | |
| Fetal bovine serum | Nichirei | 171012 | |
| FGF2 | Wako | 060-04543 | |
| FGF8 | Peprotech | 100-25 | |
| Human dermal fibroblast | Cell applications | 160-05a | |
| Human tenocyte | Angio proteomie | cAP-0041 | |
| Insulin | Wako | 090-06474 | |
| Iscove’s modified Dulbecco’s medium/Ham’s F12 | Gibco | 21056023 | |
| Knockout SR | Gibco | 10828028 | |
| LDN193189 | Axon | 1509 | |
| Matrigel | BD bioscience | 354230 | Artificial extracellular matrix |
| MEOX1_Rabbit antibody | Abcam | ab75895 | |
| MHC_Rabbit antibody | Santacruz | sc-20641 | |
| MKX_Rabbit antibody | Atlas antibodies | A83377 | |
| Monothioglycerol | Sigma | M6145 | |
| mTeSR1 | Stemcell tech | 85850 | |
| Multi well-type silicon rubber chamber | Strex | STB-CH-4W | |
| MYOD_Rabbit antibody | Abcam | ab133627 | |
| MYOG_Mouse antibody | Santacruz | sc-12732 | |
| NKX3.2_Rabbit antibody | Sigma | HPA027564 | |
| Novex Donkey anti Goat IgG(H+L) secondary antibody555 | Invitrogen | A21432 | |
| Novex Donkey anti Goat IgG(H+L) secondary antibody647 | Invitrogen | A21447 | |
| Novex Goat anti Mouse IgG(H+L) secondary antibody555 | Invitrogen | A21422 | |
| Novex Goat anti Rabbit IgG(H+L) secondary antibody555 | Invitrogen | A21428 | |
| Novex Goat anti Rabbit IgG(H+L) secondary antibody647 | Invitrogen | A21245 | |
| PARAXIS_Rabbit antibody | Santacruz | sc-98796 | |
| PAX1_Rabbit antibody | Abcam | ab95227 | |
| PAX9_Rabbit antibody | Gene tex | GTX104454 | |
| PBS | - | - | |
| PDGFRa_Goat | R&D | AF307 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| Primate ES cell medium | Reprocell | RCHEMD001 | |
| SAG | Calbiochem | 566661 | |
| SB431542 | Selleckchem | SEL-S1067-10 | |
| SCX_Rabbit antibody | Abcam | ab58655 | |
| TBX6_Goat antibody | R&D | AF4744 | |
| Tendon cell growth medium | Angio-proteomie | cAP-40 | Tenocytes growth medium |
| TGFβ3 | R&D | 243-B3-200 | |
| Trypsin | Gibco | 15090046 |
Referenzen
- Tanaka, A., et al. Efficient and reproducible myogenic differentiation from human iPS cells: prospects for modeling Miyoshi Myopathy in vitro. PLoS One. 8 (4), e61540 (2013).
- Sakurai, H., et al. In vitro modeling of paraxial mesodermal progenitors derived from induced pluripotent stem cells. PLoS One. 7 (10), e47078 (2012).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocl. 11 (10), 1833-1850 (2016).
- Chal, J., et al. Differentiation of pluripotent stem cells to muscle fiber to model Duchenne muscular dystrophy. Nature Biotechnology. 33 (9), 962-969 (2015).
- Umeda, K., et al. Human chondrogenic paraxial mesoderm, directed specification and prospective isolation from pluripotent stem cells. Scientific Reports. 2, 455 (2012).
- Loh, K. M., et al. Mapping the Pairwise Choices Leading from Pluripotency to Human Bone, Heart, and Other Mesoderm Cell Types. Cell. 166 (2), 451-467 (2016).
- Xi, H., et al. In Vivo Human Somitogenesis Guides Somite Development from hPSCs. Cell Reports. 18 (6), 1573-1585 (2017).
- Chal, J., Pourquie, O. Making muscle: skeletal myogenesis in vivo and in vitro. Development. 144 (12), 2104-2122 (2017).
- Tam, P. P., Beddington, R. S. The formation of mesodermal tissues in the mouse embryo during gastrulation and early organogenesis. Development. 99 (1), 109-126 (1987).
- Aulehla, A., Pourquie, O. Signaling gradients during paraxial mesoderm development. Cold Spring Harbor Perspectives in Biology. 2 (2), a000869 (2010).
- Christ, B., Scaal, M. Formation and differentiation of avian somite derivatives. Advances in Experimental Medicine and Biology. 638, 1-41 (2008).
- Brent, A. E., Schweitzer, R., Tabin, C. J. A somitic compartment of tendon progenitors. Cell. 113 (2), 235-248 (2003).
- Sakurai, H., et al. Bidirectional induction toward paraxial mesodermal derivatives from mouse ES cells in chemically defined medium. Stem Cell Research. 3 (2-3), 157-169 (2009).
- Zhao, J., et al. Small molecule-directed specification of sclerotome-like chondroprogenitors and induction of a somitic chondrogenesis program from embryonic stem cells. Development. 141 (20), 3848-3858 (2014).
- Nakajima, T., et al. Modeling human somite development and fibrodysplasia ossificans progressiva with induced pluripotent stem cells. Development. 145 (16), (2018).
- McMahon, A. P., Bradley, A. The Wnt-1 (int-1) proto-oncogene is required for development of a large region of the mouse brain. Cell. 62 (6), 1073-1085 (1990).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Suzuki, H., et al. targeting of the transcription factor Mohawk in rats causes heterotopic ossification of Achilles tendon via failed tenogenesis. Proceedings of the National Academy of Sciences of the United States of America. 113 (28), 7840-7845 (2016).
- Marturano, J. E., Arena, J. D., Schiller, Z. A., Georgakoudi, I., Kuo, C. K. Characterization of mechanical and biochemical properties of developing embryonic tendon. Proceedings of the National Academy of Sciences of the United States of America. 110 (16), 6370-6375 (2013).
- Maretto, S., et al. Mapping Wnt/beta-catenin signaling during mouse development and in colorectal tumors. Proceedings of the National Academy of Sciences of the United States of America. 100 (6), 3299-3304 (2003).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten