Method Article
בדור חוץ גופית של Somite נגזרים מן האדם המושרה בתאי גזע Pluripotent
In This Article
Summary
אנו מציגים כאן עבור הבידול בתאי גזע pluripotent המושרה אנושי לתוך כל נגזרת somite (myotome, sclerotome, פלסטיים ו syndetome) פרוטוקול בתנאים מוגדרים כימי, אשר יש יישומים בדוגמנות מחלות בעתיד, טיפולים מבוססי תא לכירורגיה אורטופדית.
Abstract
בתגובה אותות כגון WNTs, עצם morphogenetic חלבונים (BMPs) ו סוניק הקיפוד (ששש) מופרש מן הרקמות הסובבות, somites (SMs) להצמיח סוגי תאים מרובים, כולל את myotome (MYO), sclerotome (SCL), פלסטיים (D) ו syndetome (SYN) , אשר בתורו להתפתח שרירי השלד, axial שלד, הדרמיס הגבי ו צירית גיד/רצועה, בהתאמה. לכן, הדור של SMs ונגזרותיהם מתאי גזע pluripotent המושרה אנושי (iPSCs) הוא קריטי כדי לקבל גזע pluripotent (מגירסה) עבור יישום של רפואה רגנרטיבית, מחלות מחקר בתחום של כירורגיה אורתופדית. למרות שהפרוטוקולים אינדוקציה MYO, SCL החל מגירסה דווחו בעבר על ידי מספר חוקרים, אף מחקר עדיין הוכיחה את תנאי הגיוס של SYN D מ iPSCs. לכן, אינדוקציה יעיל של SMs המוסמכת באופן מלא נשאר אתגר גדול. כאן, אנו לסכם האנושי SM המתבנת עם iPSCs אנושיים במבחנה על ידי מחקה את הסביבה איתות במהלך חומוס/עכבר SM ופיתוח דוח על שיטות האינדוקציה שיטתית של נגזרות SM (MYO, SCL, D ו- SYN) מ- iPSCs האנושי תחת כימית תנאים מוגדרים באמצעות presomitic והמזודרם (PSM) ו- SM הברית. הידע לגבי בחורה/עכבר SM פיתוח הוחל בהצלחה על אינדוקציה של SMs עם iPSCs האנושית. שיטה זו יכולה להיות כלי הרומן לומד האדם somitogenesis תכנים ללא השימוש של העוברים טיפול מבוססת תא, מידול המחלה.
Introduction
פיתוח שיטה התמיינות מכוונת לסוג התא הרצוי החל מגירסה היא צעד הכרחי לתרגום המחקר הנגזרות PSC תאים לתוך יישומים קליניים. ביטוי מאולץ של גנים מפתח אסטרטגיה מבטיח איברים תאית התמיינות החל מגירסה, השתפרה ההבנה שלנו של התקנון גנטי של גורל תא בנחישות, מורפוגנזה איברים, וארגון במהלך מופרה1. בנוסף, recapitulating את סביבות איתות אנדוגני, באמצעות הפיתוח של העוברים של עכבר חומוס כמו מפת דרכים, הוא נחשב חיוני הבידול בבימויו של מגירסה. בהתחשב היישום של תאים נגזר PSC במחקרים קליניים כגון טיפולים מבוססי תאים, האסטרטגיה השנייה זאת, מתאים יותר כי הוא אינו דורש מניפולציה ג'ין.
מספר מחקרים דיווחו על אינדוקציה של והמזודרם מן האדם, העכבר מגירסה כימית שהוגדרו בתנאי. בדרך כלל, שיטות אלה צריכים לסמוך על activin/קטרי/הפיכת איתות β (TGFβ) גורם גדילה ועצמות חלבון morphogenetic (BMP) איתות, האמין לבצע בידול meso-האנדודרם, והמזודרם, וכתוצאה מכך יעילות נמוכה אינדוקציה והמזודרם (כ-20%) paraxial2. במילים אחרות, והמזודרם, נגזר PSC המושרה על ידי איתות המסלולים האלה היה בעיקר לרוחב הלוח והמזודרם, לא paraxial והמזודרם. לאחרונה, מחקרים אחדים הדגימו ייצור יעיל של והמזודרם paraxial, נגזר PSC בהתבסס על אסטרטגיות שונות3,4,5,6,7,8 . במחקרים אלה, היו מגירסה תרבותי עם ריכוזים גבוהים יחסית של גליקוגן סינתאז קינאז 3 (GSK3) מעכבי (ונ ט מפעילים איתות), כתוצאה מכך היעילות אינדוקציה של paraxial והמזודרם הגיעו 70%-95%6,7 .
ב somitogenesis, והמזודרם paraxial קודם טפסים posteriorly את והמזודרם presomitic (PSM) וטפסים ואז somites (SMs) בחלק הקדמי עד מזנכימה-כדי-אפיתל המעבר9,10. חריץ ליגנד כמו דלתא 1 (DLL1) ידוע יש תפקיד מרכזי במהלך somitogenesis, כמו שליטה מתנדנדות על הביטוי DLL1, הן ברמת mRNA, חלבון, מווסת את פילוח SM. SMs בסופו של דבר לסעף לתוך שני חלקים, והוליד dermomyotome (DM) dorsally, sclerotome (SCL) ventrally11. לאחר מכן, DM מבדילה לתוך פלסטיים (D), הקדמה של הדרמיס, וכן myotome (MYO), הקדמה של שריר השלד; בנוסף, בחלק הגחוני SCL יוצרת את syndetome (SYN), סימן מקדים של הגידים והרצועות12 (איור 1). יש חוקרים דיווחו על אינדוקציה של SM נגזר PSC נגזרים כגון MYO4,13 ו- SCL14; עם זאת, ישנן מספר מגבלות במחקרים אלה. ראוי לציין, מאחר הידע שלנו סביבות איתות של D ו- SYN מקוטעים, אינדוקציה פרוטוקולים עבור D ו- SYN לא עדיין באופן שיטתי הוקמו. להפגין המלא-סמכות של SMs המושרה החל מגירסה, זה חיוני כדי להראות את הבידול מרובי קיבולת SMs המושרה לתוך כל ארבע הנגזרים (D MYO, SCL, SYN), ואילו מחקרים קודמים התמקדו רק ספציפיים נגזרים SM. כאן, אנו מדווחים על איך ליצור כל נגזרים SM ארבע, לרבות D ו- SYN, באמצעות PSM ו- SM הגורל האנושי iPSCs15. אנו מאמינים כי הקמת שיטה stepwise במבחנה כי מודלים תהליך הפיתוח SM יכול לתרום המחקר של SM אנוש מפתחת במהלך מופרה, ללא שימוש עוברי.
Protocol
כל הפרוטוקולים ניסיוני מעורבים iPSCs האנושי אושרו על ידי ועדת האתיקה של החוג לרפואה, בוגר ביה ס לרפואה, אוניברסיטת קיוטו.
1. האדם iPSCs הכנה לפני הגיוס
הערה: התרבות האנושית iPSCs (201B7-PAX3-GFP) על באן מזין תאים16 הפרימטים ES תא בינונית בתוספת 4 ננוגרם למ"ל רקומביננטי אנושי בסיסי פיברובלסט גורם גידול (FGF2) ו- 0.5% פניצילין, סטרפטומיצין (ולחוד: כל hESC בינוני, רואה טבלה 1). כאשר היחס בין הנהרות מגיע ל- 70%-80%, מעבר התאים כפי שתואר לעיל17.
-
Passaging של האדם iPSCs על באן מזין תאים17
- עבור passaging, להוסיף PBS לתוך המנה culturing תא ולשטוף תאים. לאחר מכן, הסר את PBS (, תהליך זה להיות ןלהל לשטוף עם PBS).
- להוסיף 1 מ"ל של פתרון CTK (ראה טבלה 1) בטמפרטורת החדר (RT), לחכות עד באן מזין התאים להתחיל מתנתקת מהחלק התחתון של המנה.
- הסר את הפתרון CTK ולאחר מכן לשטוף פעמיים עם PBS.
- להוסיף 1 מ"ל של מדיום hESC (ראה טבלה 1) לתוך קערה, ואז לגרד את התאים באמצעות מגרד ולאסוף לתוך צינור חרוטי 15 מ"ל.
- Pipette בעדינות את התוכן חמש פעמים באמצעות טיפ µL 1,000, ולאחר מכן להעביר את תבשיל חדש מלא hESC בינונית. השתמש פיצול יחס של 1:4 על 1:10, בהתאם היחס הנהרות לפני passaging. כמו כן, משתנים נפח בינוני hESC בהתאם קנה המידה של המנה (למשל, 3 מ"ל עבור מנה 6 ס מ, 8 מ"ל על צלחת 10 ס מ).
- דגירה את iPSCs האנושית-CO 37 ° C ו-5%2.
- לשנות את כל יום בינוני (למעט יום אחרי passaging) ואת התרבות התאים עד passaging ההליך הבא.
-
מזין נטול culturing של האדם iPSCs לקראת הגיוס PSM
הערה: כדי למזער את ההשפעה של גורמי גדילה מופרש מתאי מזין באן, תרבות את iPSCs האנושית בתנאים ללא מזין עם תא מזין ללא תרבות בינוני (ראה טבלה 1) על פתרונות מטריצה חוץ-תאית (ECM) (ראה טבלה 1) מאכל מצופה במשך 3 ימים לפני הגיוס PSM.- יום-4 (4 ימים לפני הפעלת PSM אינדוקציה)
- כדי להכין את המנה מצופים פתרון ה-ECM, להוסיף 4 מ של פתרון ה-ECM על גבי צלחת 10 ס מ ב 4 מעלות צלזיוס למשך הלילה.
הערה: במקום פתרון ה-ECM על קרח בעת הכנת.
- כדי להכין את המנה מצופים פתרון ה-ECM, להוסיף 4 מ של פתרון ה-ECM על גבי צלחת 10 ס מ ב 4 מעלות צלזיוס למשך הלילה.
- יום-3
- ראשית, להסיר את פתרון ה-ECM מתוך קערה ומוסיפים 8 מ של תא מזין ללא תרבות בינוני.
- כדי להתחיל ללא מזין culturing, לשטוף פעם עם PBS לשטוף את התאים בתרבית.
- להוסיף 1 מ"ל של פתרון CTK-RT עד התאים מזין באן יתחילו מתנתקת מהחלק התחתון של המנה.
הערה: השתמש במיקרוסקופ כדי לאשר שכל התאים מזין מנותקים מלמטה. - הסר את הפתרון CTK, לשטוף עם PBS פעמיים, כך כל התאים מזין באן יוסרו לחלוטין.
- להוסיף 1 מ"ל של תא מזין ללא תרבות בינוני לתוך קערה, ואז לגרד את התאים באמצעות מגרד ולאסוף אותם לתוך צינור חרוטי 15 מ"ל.
- בעדינות את התוכן שלוש פעמים באמצעות טיפ 1,000 µL pipette, ולאחר מכן להעביר את תבשיל חדש ECM מצופים פתרון 10 ס מ (להכין במהלך שלב 1.2.1). השתמש יחס פיצול של בערך 1:2 ל- 1:4, בהתאם היחס הנהרות לפני נטולת מזין culturing.
- דגירה את iPSCs האנושית-CO של 37 ° C ו- 5%-2 למשך 3 ימים, שינוי המדיום ביום-1.
- יום-4 (4 ימים לפני הפעלת PSM אינדוקציה)
2. PSM בידול ובידוד על ידי תא לפעיל על-ידי קרינה פלואורסצנטית מיון (FACS)
-
בידול PSM (יום 0 – יום 4)
- האחות המדיום תרבות תא מזין ללא ולהוסיף 8 מ של PSM אינדוקציה בינוני (CDM בינוני הבזליים בתוספת 10 מיקרומטר SB431542, 10 מיקרומטר CHIR99021, 2 מיקרומטר DMH1, ו- 20 ng/mL FGF2, ראה טבלה 1).
הערה: תא הנהרות ביוזמתו של בידול PSM הוא קריטי ליעילות אינדוקציה. השתמש במיקרוסקופ כדי לאשר את שהיחס confluent הוא כ- 30%. - דגירה תאים ב- 37 מעלות צלזיוס, עם 5% CO2, במשך ארבעה ימים, שינוי המדיום על יום 3.
- קציר תאים עבור FACS ביום 4 (סעיף 2.2, להלן).
- האחות המדיום תרבות תא מזין ללא ולהוסיף 8 מ של PSM אינדוקציה בינוני (CDM בינוני הבזליים בתוספת 10 מיקרומטר SB431542, 10 מיקרומטר CHIR99021, 2 מיקרומטר DMH1, ו- 20 ng/mL FGF2, ראה טבלה 1).
-
בידוד תאי PSM חיובית DLL1, על ידי תא לפעיל על-ידי קרינה פלואורסצנטית מיון (FACS)
הערה: להלן הוא תהליך הכנה תא לפני FACS מיון של תאים חיובי DLL1. לבצע FACS מיון באמצעות cytometer של זרימה, על-פי הפרוטוקול של היצרן.- האחות של המדיום, ולאחר מכן לשטוף עם PBS. לאחר מכן, להוסיף 1 מ"ל של ריאגנט דיסוציאציה תא ולהשאיר למשך 3 דקות ב- RT.
- להוסיף 4 מיליליטר בינוני הבזליים CDM, לגרד את התאים באמצעות מגרד, לאסוף אותם לתוך צינור חרוטי 15 מ"ל.
- לספור את מספר תאים באמצעות מונה הניתן תא אוטומטיות ולאחר מכן צנטריפוגה ב x 280 גר' למשך 3 דקות.
- הסר את תגובת שיקוע על ידי השאיפה ובזהירות resuspend התאים במאגר FACS (ראה טבלה 1)-ריכוז של 1.0 x 107 תאים למ"ל. עבור מדגם שליטה שלילי (שליטה isotype, או בכנס ללא נוגדנים), להעביר 50 µL לתוך צינור חרוטי 15-mL, ואז להשעות עם 450 µL מאגר FACS.
- הוספת נוגדן DLL1 (ראה טבלה של חומרים) על יחס של 1/200. להגן על הצינור מפני אור ולשמור בקירור למשך 30 דקות.
- צנטריפוגה ב x 280 גר' למשך 3 דקות.
- בזהירות וארוקן את תגובת שיקוע, resuspend FACS מאגר (1.0 x 107 תאים למ"ל) בתוספת 1 מ"ג/מ"ל דאפי.
- העברת לתוך צינור אוסף, משולבים עם רשת ניילון מיקרומטר 35 בהכיפה לסינון, ואז למקם את הצינור על הקרח, עד מיון תושלם. בצע את ההליך אותו עם הדגימה שליטה שלילי (שלב 2.2.4).
- לבצע מיון באמצעות cytometer של זרימה לפי הפרוטוקול של היצרן.
- איסוף התאים חיובי ממוינים DLL1 לתוך צינור 15 מ"ל חרוט, המכיל 4 מ של CDM בינוני הבזליים בתוספת 10 מיקרומטר של Y27632. לחילוץ RNA הכולל, צנטריפוגה ב x 280 גר' למשך 3 דקות ואז resuspend במאגר פירוק RNA ולאחסן ב-30 º C. ראה את החילוץ-RNA, שעתוק במהופך ושגרות RT-qPCR (סעיף 5.1) לקבלת מידע מפורט יותר.
- לבצע SM בידול באמצעות התאים ממוינים על פי להלן פרוטוקול (סעיף 3).
3. SM בידול של PSM
-
בידול של SM מתאי ממוינים DLL1 חיובי PSM (יום 4 – יום 8)
הערה: הכינו את הצלחות 12-ובכן מצופים פתרון ה-ECM יום לפני מיון FACS. להכין צלחת 12-ובכן מצופים פתרון ה-ECM, להוסיף 1 מ"ל של פתרון ה-ECM לבאר כל ב 4 ° C, להשאיר למשך הלילה. לשמור את פתרון ה-ECM על הקרח תוך הכנת.- בעקבות צעד 2.2.10, צנטריפוגה ב x 280 גר' למשך 3 דקות.
- וארוקן את תגובת שיקוע ובזהירות resuspend ב 1 מ"ל של SM אינדוקציה בינוני (CDM בינוני הבזליים בתוספת 10 מיקרומטר SB431542 ו 5 מיקרומטר CHIR99021, ראה טבלה 1).
- לספור את מספר תאים באמצעות מונה הניתן תא אוטומטית.
- זרע 1.0 x 105 תאים על גבי כל טוב של ECM מצופים פתרון טוב 12 הלוחות המכיל 1 מ"ל של מדיום אינדוקציה SM בתוספת 10 מיקרומטר של Y27632.
- תקופת דגירה ב 37 ° C עם 5% CO2 של 4 ימים עד יום 8. לשנות את המדיום אשר אינו מכיל Y27632 על יום 5 (יום לאחר מיון FACS) ו- 7 יום.
- לבצע SM נגזרים בידול באמצעות תאים SM המושרה על-פי הפרוטוקולים להלן. לחילוץ הכולל RNA מתאי SM המושרה, לאסוף את התאים לתוך צינור חרוטי 15-mL צנטריפוגה ב 280 x גר' למשך 3 דקות, ואז resuspend במאגר פירוק RNA ולאחסן ב-30 º C.
4. SM נגזרים (DM, MYO, D, SCL, SYN) בידול של SM
הערה: להפגין את היכולות המלא של תאי SM, תחילה לבצע DM (dermomyotome) ומעגל SCL (sclerotome) בהתאם באמצעות נגזר iPSC תאי SM. לאחר מכן, לבצע MYO (myotome) ומעגל D (פלסטיים) באמצעות התאים DM, לנהל באמצעות התאים SCL אינדוקציה סינטטיים (syndetome). להלן הפרוטוקולים עבור אינדוקציה של כל נגזרת (DM, MYO, D, SCL ו SYN) מתאי SM המושרה במבחנה.
-
מיט בידול מתאי SM (יום 8 – יום 11)
- האחות של המדיום, ולאחר מכן להוסיף 1 מ"ל של מיט אינדוקציה בינוני (CDM בינוני הבזליים בתוספת 5 מיקרומטר CHIR99021 10 ננוגרם למ"ל BMP4, ראה טבלה 1).
- דגירה התאים ב 37 מעלות צלזיוס, עם 5% CO2, 3 ימים עד יום 11. לשנות את המדיום על יום 10 (יום 2 של מיט אינדוקציה).
- לבצע MYO, D בידול באמצעות המושרה מיט תאים לפי הפרוטוקולים להלן.
-
MYO בידול מתאי DM (יום 11 – יום 41)
- האחות של המדיום, ולאחר מכן להוסיף 1 מ"ל MYO אינדוקציה בינוני (CDM בינוני הבזליים בתוספת 5 מיקרומטר CHIR99021, ראה טבלה 1).
- דגירה התאים ב 37 מעלות צלזיוס, עם 5% CO2, 30 ימים עד 41 יום. לשנות את המדיום כל 3 ימים.
-
בידול D מתאי DM (יום 11 – יום 20)
- האחות של המדיום, ולאחר מכן להוסיף 1 מ"ל D אינדוקציה בינוני (CDM בינוני הבזליים בתוספת 5 מיקרומטר CHIR99021 10 ננוגרם למ"ל BMP4, ראה טבלה 1).
- תקופת דגירה התאים ב 37 מעלות צלזיוס, עם 5% CO2, של 9 ימים עד 20 יום. לשנות את המדיום כל 3 ימים.
-
בידול SCL מתאי SM (יום 8 – יום 11)
- האחות של המדיום, ולאחר מכן להוסיף 1 מ"ל SCL אינדוקציה בינוני (CDM בינוני הבזליים בתוספת 100 ננומטר סאג ו- 0.6 מיקרומטר LDN193189, ראה טבלה 1)14.
- דגירה התאים ב 37 מעלות צלזיוס, עם 5% CO2, 3 ימים. לשנות את המדיום על יום 10 (יום 2 של SCL אינדוקציה).
- לבצע SYN בידול באמצעות תאים SCL המושרה לפי הפרוטוקול להלן.
-
בידול SYN מתאי SCL (יום 11 – יום 32)
הערה: הכינו את הצלחות 24-ובכן מצופים פתרון ה-ECM יום לפני ייזום SYN אינדוקציה. להכין צלחת 24-ובכן מצופים פתרון ה-ECM, להוסיף 0.5 מ של פתרון ה-ECM לבאר כל ב 4 ° C, להשאיר למשך הלילה. לשמור את פתרון ה-ECM על הקרח תוך הכנת.- תשאף המדיום ולאחר מכן לשטוף עם PBS, ולאחר מכן להוסיף 0.2 מ של ריאגנט דיסוציאציה תא מכל קידוח ולהשאיר למשך 3 דקות ב- RT.
- להוסיף 0.8 מ של CDM בינוני הבזליים מכל קידוח ואז לגרד ולאסוף כל התאים לתוך צינור חרוטי 15 מ"ל.
- צנטריפוגה ב x 280 גר' למשך 3 דקות.
- וארוקן את תגובת שיקוע ובזהירות resuspend ב 1 מ"ל של SYN אינדוקציה בינוני-1 (CDM בינוני הבזליים בתוספת 20 ng/mL FGF8, ראה טבלה 1), ואז לספור את מספר תאים באמצעות מונה הניתן תא אוטומטית.
- זרע 5.0 x 104 תאים לבאר כל ECM מצופים פתרון 24-ובכן הלוחיות המכיל 1 מ"ל של SYN אינדוקציה בינוני-1....
- דגירה ב 37 מעלות צלזיוס, עם 5% CO2, 3 ימים.
- על 14 יום (יום 3 של SYN אינדוקציה), להחליף את המדיום SYN אינדוקציה בינוני-2 (CDM בינוני הבזליים בתוספת 10 ננוגרם למ"ל BMP7 ו 10 ננוגרם למ"ל TGFβ3, ראה טבלה 1).
- דגירה ב 37 מעלות צלזיוס, עם 5% CO2, במשך 18 ימים עד 32 יום. לשנות את המדיום כל 3 ימים.
5. אפיון המוצרים נגזר iPSC
הערה: על בידול, לאפיין נגזרים iPSCs האנושי באמצעות PCR כמותי בזמן אמת (RT-qPCR), immunocytochemistry (ICC), מבחני מקושרים-אנזים immunosorbent (אליסה) מבחני גירוי מכני מתיחה, בהתאם.
-
תא הקציר, הכולל החילוץ-RNA, שעתוק במהופך, וניתוח כמותי בזמן אמת PCR (RT-qPCR)
- לאסוף דגימות תאים (נהלים 2.2.10, 3.1.6, 5.4.3) לתוך צינור 1.5 mL ולאחר מכן צנטריפוגה ב x 280 גר' למשך 3 דקות.
- הסר את תגובת שיקוע ולאחר מכן resuspend ב µL 350 מאגר פירוק RNA, שסופקו על-ידי ערכת חילוץ RNA הכולל המתאים.
- תמצית הכולל RNA באמצעות הערכה על פי הפרוטוקול של היצרן.
- הפוך לתמלל את µg 1 מבודדת של RNA הכולל כדי cDNA, על-פי הפרוטוקול של היצרן.
- לבצע RT-qPCR באמצעות אנזימים מתאימים, ריאגנטים, תחל לפי הפרוטוקול של היצרן. רצפי פריימר השתמשו במחקר זה מפורטים בטבלה 2.
-
Immunocytochemistry (ICC)
- לפני ביצוע immunocytochemistry עם נוגדנים, לתקן את התאים עם 2% paraformaldehyde ב 4 מעלות צלזיוס למשך 10 דקות, לשטוף פעמיים עם PBS.
- עבור permeabilization, דגירה 0.2% מתנול או 0.2% polysorbate 20/PBS (המכונים להלן PBS-T) ב 4 מעלות צלזיוס למשך 15 דקות.
- הסר את ריאגנטים permeabilization ולפנק את התאים עם הולם חסימה מאגר או 1% שור אלבומין/PBS ב 4 מעלות צלזיוס למשך 60 דקות.
- הוסף את הנוגדן הראשון. מדולל עם 10% מאגר חסימה ב- PBS-T ומקום במחשב חזק ב 4 מעלות צלזיוס למשך הלילה.
- תשטוף שלוש פעמים עם PBS-T (להוסיף PBS-T ומקום במחשב חזק ב RT עבור 10 דקות).
- הוסף הנוגדן השני, מדולל עם 10% מאגר חסימה ב- PBS-T ומקום במחשב חזק ב RT עבור 60 דקות. הנוגדנים הראשון והשני עבור ICC השתמשו במחקר זה מפורטים בטבלה3.
הערה: משלב זה ואילך, להגן על המנה/הצלחת מאור על ידי ליפוף זה בנייר. - לשטוף פעמיים עם PBS-טי
- מונה מכתים, הוסיפו 1/5000 דאפי מדולל עם PBS ומקום במחשב חזק ב RT עבור 5 דקות.
- להסיר את הפתרון דאפי ולהוסיף PBS כל טוב.
- להתבונן ההכתמה התא באמצעות מיקרוסקופ זריחה. לחלופין, לאחסן את המנה/הצלחת ב 4 ° C עד כחודש.
-
מקושרים-אנזים Immunosorbent assay (אליסה) עבור אנליזה פונקציונלית של נגזר iPSC D
הערה: תאי פיברובלסט עורי אנושי (HDF) זמינים מסחרית. תרבות HDF ב DMEM בתוספת 10% סרום שור עוברית (ראה טבלה 1).- זרע 1.0 x 105 תאים של D ו HDF iPSC נגזר על גבי לוחות 24-ובכן המכיל 1 מ"ל של כל מדיום תרבות (D d: אינדוקציה בינוני, HDF: DMEM בתוספת 10% סרום שור עוברית).
- אחרי 3 ימים של התא culturing, לאסוף 100 µL של כל מדיום, למקם את צינור 1.5 mL, ולאחסן ב 4 º C.
- לבצע הסדרה של הליכים, כגון התוספת של זיהוי נוגדנים, נוגדנים משניים, על פי הוראות היצרן, ולכמת את מספר מטרות על-ידי יצירת עיקול רגיל נגד הריכוז של הפקד דוגמאות analyte.
-
גירוי מכני מתיחה assay לניתוח פונקציונלי של נגזר iPSC SYN
הערה: tenocytes האנושית הבוגרת הינם זמינים מסחרית (ראו טבלה של חומרים). התרבות האנושית נגזר iPSC SYN, למבוגרים tenocytes האנושי על תא מתיחה התקן עבור וזמינותו גירוי מכני מתיחה כפי שמתואר להלן18,19. שימוש SYN אינדוקציה בינוני-2 ו- tenocytes מדיום הגידול (ראה טבלה של חומרים) כמדיום culturing לכל נגזר iPSC SYN או tenocytes אדם מבוגר, בהתאמה.- ב- 24 שעות לפני מתיחה, צלחת 1.0 x 105 תאים של נגזר iPSC SYN, tenocytes אדם על גבי גומי סיליקון מסוג טוב רב מצופי פתרון ECM צ'יימברס, כל אחד עם משטח תרבות של 1.5 ס מ x 1.5 ס מ (ראה טבלה של חומרים).
- הגדרת התאים על המכשיר למתיחת תא, ולאלץ monoaxial זן מחזורית (0.5 Hz, 5%) במשך 12 שעות.
- לחילוץ RNA הכולל, להוסיף 350 µL מאגר פירוק RNA, ואז לגרד ולאסוף את התאים לתוך צינור 1.5 mL הכולל החילוץ-RNA, חשפה RT-qPCR (ראה נוהל 5.1).
תוצאות
כל הדמויות בדו"ח זה התקבלו עם iPSCs 201B7-PAX3-GFP, שבו EGFP מחליף אלל אחד של רצף קידוד PAX3 ב אקסון 1. הקמת iPSCs 201B7-PAX3-GFP יהיה תיאר במקום אחר (ח' סקוראי, תקשורת אישית). מובהקות סטטיסטית הוערך באמצעות תוכנה סטטיסטית. P-ערכים נמוכים מ- 0.05 נחשבו משמעותית.
אפיון נגזר iPSC PSM ו- SM תאים אנושיים
כדי להעריך את הבידול של iPSCs אנושית כלפי SM דרך המדינה PSM (איור 2 א), ניתוח FACS, בוצעו ניתוח ICC, וניתוח RT-qPCR. כפי שמוצג באיור 2B, מעל 85% של התאים היו חיוביות עבור DLL1, סמן של PSM, אבל שלילי עבור PAX3, סמן של SM, אחרי ארבעה ימים של PSM אינדוקציה עם iPSCs האנושית. לאחר מכן, אוכלוסייה זו הפכה PAX3 תאים SM חיובי לאחר 4 ימים האינדוקציה SM. המעבר PSM-SM אושר גם ע י ICC (איור 2C) ו- RT-qPCR (איור דו-ממדי). סמני PSM TBX6, MSGN1 ו- WNT3A, היו באים לביטוי עם המדינה PSM (יום ד'), אך אינו מתבטא באיזה מצב SM (יום 8). PARAXIS, MEOX1, PAX3, סמני SM, באה לידי ביטוי ב- SM, אך אינו מתבטא ב- PSM. יתר על כן, כתמים של CDH11, סמן של epithelialized SM, רק שהצטברו באזור צומת תאים תאים, בעקבות התוספת של SB431542 עם CHIR99021 (2E איור).
אפיון SM נגזרים המושרה מתאי האדם הנגזרות iPSC SM
כדי להעריך את העוצמה בידול של SM נגזר iPSC אנושי, בידול כלפי DM, MYO, D, SCL, סינטטיים (איור 3 א) הוערך על ידי ניתוח ICC ו PAX3 (GFP)-קרינה פלואורסצנטית. כפי שמוצג באיור 3B, מיט בידול אושר ע י ALX4 ו- EN1 מכתים, ו- PAX3 (GFP)-קרינה פלואורסצנטית; MYO בידול אושר ע י אלוהים, MYOG ו צולבות הקישור חוטים שרירן שרשרת כבדה (MHC) מכתימה; בידול D אושר ע י EN1 ו- PDGFRa מכתימה; בידול SCL אושר ע י PAX1, PAX9 ו- NKX3.2 מכתימה; בידול SYN אושרה על ידי SCX, MKX, COL1A1, COL1A2 מכתים.
אפיון המושרה D ו- SYN
1. אנזים-מקושרים immunosorbent assay (אליסה) עבור אנליזה פונקציונלית של נגזר iPSC D
בגוף האדם, אחת הפונקציות העיקריות של עורי fibroblasts היא להפריש חלבונים מטריצה חוץ-תאית (ECM), כגון קולגן או חומצה היאלורונית העור מימה, לעזור לשמר את מרקם העור. כדי להדגים כי כמות דומה של קולגן מסוג 1 ו חומצה היאלורונית חלבונים היו מופרש במדיום תרבות של נגזר iPSC D ו HDF, בוצעה אליסה, כפי שמוצג באיור 4A.
2. מכונות למתוח גירוי assay לניתוח פונקציונלי של נגזר iPSC SYN
כפי שכבר דיווחו על מספר מחקרים, גירוי מכני משפיעה על התפתחות גיד לפני ואחרי לידה, ומקדם את הבידול של tenocytes קודמן תאים18,19. לכן, זה ידוע כי תגובתיות ללחץ מכני הוא אחד המאפיינים של tenocytes. כדי להדגים את תגובתיות דומות של SYN נגזר iPSC אנושי ולא אנושי tenocytes למבוגרים, וזמינותו גירוי מכני מתיחה בוצעה כפי שמוצג באיור 4B.
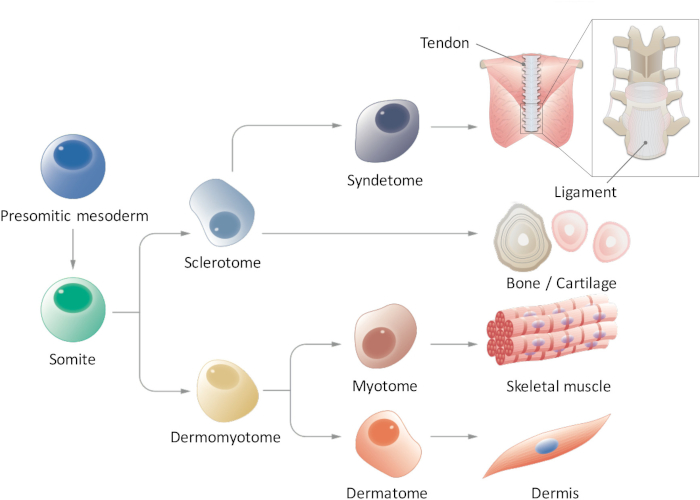
איור 1: הצג סכימתי של הבידול הירארכי של paraxial והמזודרם. והמזודרם presomitic היא אוכלוסיה תא transiently מתגלה במהלך המוקדמות מופרה, עובר פילוח על טופס somites. Somites הם אוכלוסיית תאי גזע ארעי הולידה סוגי תאים מרובים, כגון תאים sclerotome ', ' dermomyotome ', ' syndetome ', פלסטיים, myotome, אשר בסופו של דבר להבדיל לתוך הגיד/רצועה, עצם/סחוס, שרירי השלד, הדרמיס תאים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
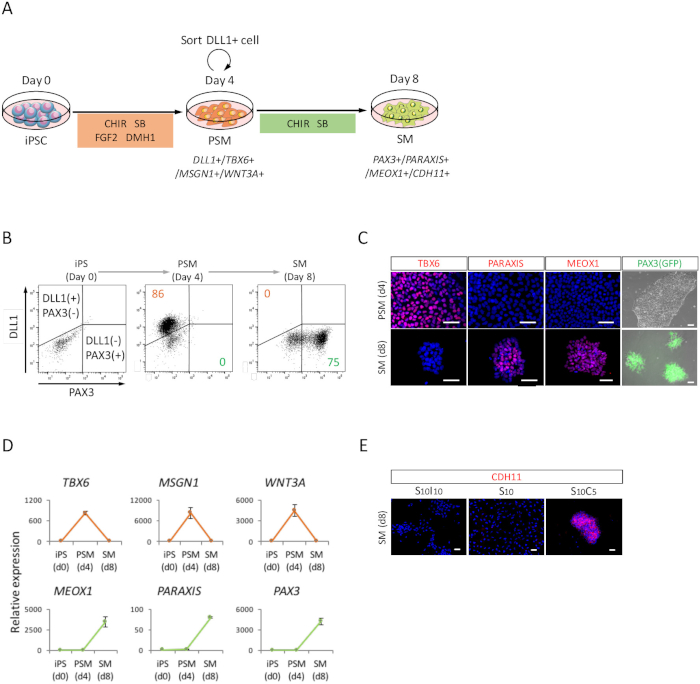
איור 2: ניתוח FACS, RT-qPCR ו- ICC של האדם נגזר iPSC PSM, SM. (א) הצג סכימתי של פרוטוקול עבור SM בידול באמצעות PSM. (B) נקודה נציג חלקת מכתים DLL1 ו- PAX3 (GFP)-קרינה פלואורסצנטית ביום 4 האינדוקציה PSM וביום 4 (יום 8 מ iPSC) SM האינדוקציה. תמונות נציג immunocytochemical (ג) ו- PAX3 (GFP)-קרינה פלואורסצנטית ביום 4 האינדוקציה PSM וביום 4 (יום 8 מ iPSC) SM האינדוקציה. התאים היו מוכתמים anti-TBX6, PARAXIS ו- MEOX1 נוגדנים (אדום) ו מוכתם שיתוף דאפי (כחול) או מזוהה עם PAX3 (GFP)-קרינה פלואורסצנטית (ירוק). (ד) ניתוח RT-qPCR של סמנים עבור PSM ו- SM iPSC, PSM ו- SM. האמצעים ± השגיאה הסטנדרטית (S.E.) של שלושה סטים של ניסויים מוצגים. (E) נציג immunocytochemical תמונות ביום 4 (יום 8 מ iPSC) SM, תרבותי ב- S10I10 (שילוב של SB431542 ו- IWR1, מעכב של חגיגת איתות), S10 (SB431542), ו- S10C5 (שילוב של SB431542 ו- CHIR99021) תנאים. התאים היו מוכתמים נוגדן anti-CDH11 (אדום), מוכתם שיתוף דאפי (כחול). iPS, תאי גזע pluripotent המושרה; PSM, והמזודרם presomitic; SM, somite; S10, SB431542 10 ΜM; C5, CHIR99021 5 ΜM; I10, IWR1 10 ΜM; גודל ברים = 50 μm. איור זה השתנה בין נקאג'ימה et al. (2018)15. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
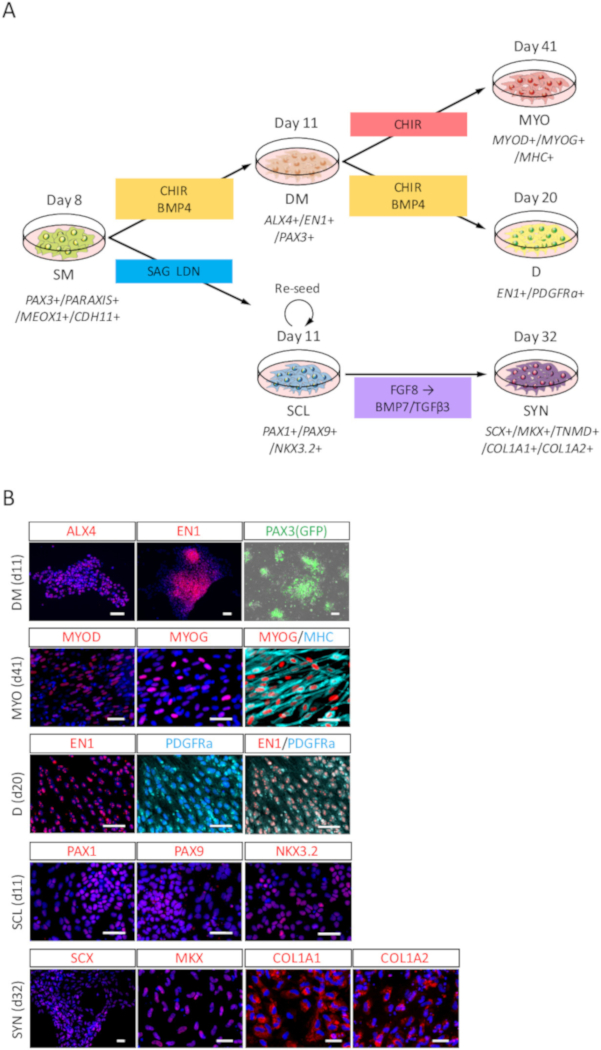
איור 3: ניתוח ICC של מיט, MYO, D, SCL SYN תריז האדם הנגזרות iPSC SM. (א) הצג סכימתי של פרוטוקולים עבור SM נגזרים בידול. PAX3 (GFP) ותמונות של נציג immunocytochemical (B)-קרינה פלואורסצנטית יום 3 (יום 11 מ iPSC) האינדוקציה DM, ביום 30 (יום 41 מ iPSC) האינדוקציה MYO, יום 9 (יום 20 מ iPSC) האינדוקציה D, יום 3 (יום 11 מ iPSC) האינדוקציה SCL, וביום 21 (יום 32 מ iPSC) האינדוקציה SYN. מיט, התאים היו מוכתמים anti-ALX4 ו- EN1 נוגדנים (אדום) ו מוכתם שיתוף דאפי (כחול) או זוהה עם PAX3 (GFP)-קרינה פלואורסצנטית (ירוק); MYO, התאים היו מוכתמים אנטי-אלוהים, MYOG (אדום) ו- MHC (ציאן) נוגדנים, גם שיתוף מוכתם דאפי (כחול); D, התאים היו מוכתמים אנטי-EN1 (אדום) ו- PDGFRa (ציאן) נוגדנים, מוכתם שיתוף דאפי (כחול); SCL, התאים היו מוכתמים anti-PAX1, PAX9 ו- NKX3.2 (אדום) נוגדנים, מוכתם שיתוף דאפי (כחול); SYN, התאים היו מוכתמים אנטי-SCX, MKX, COL1A1 ו- COL1A2 (אדום) נוגדנים, מוכתם שיתוף דאפי (כחול). מיט, dermomyotome; MYO, myotome; D, פלסטיים; SCL, sclerotome; SYN, syndetome; גודל ברים = 50 μm. איור זה השתנה בין נקאג'ימה et al. (2018)15. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
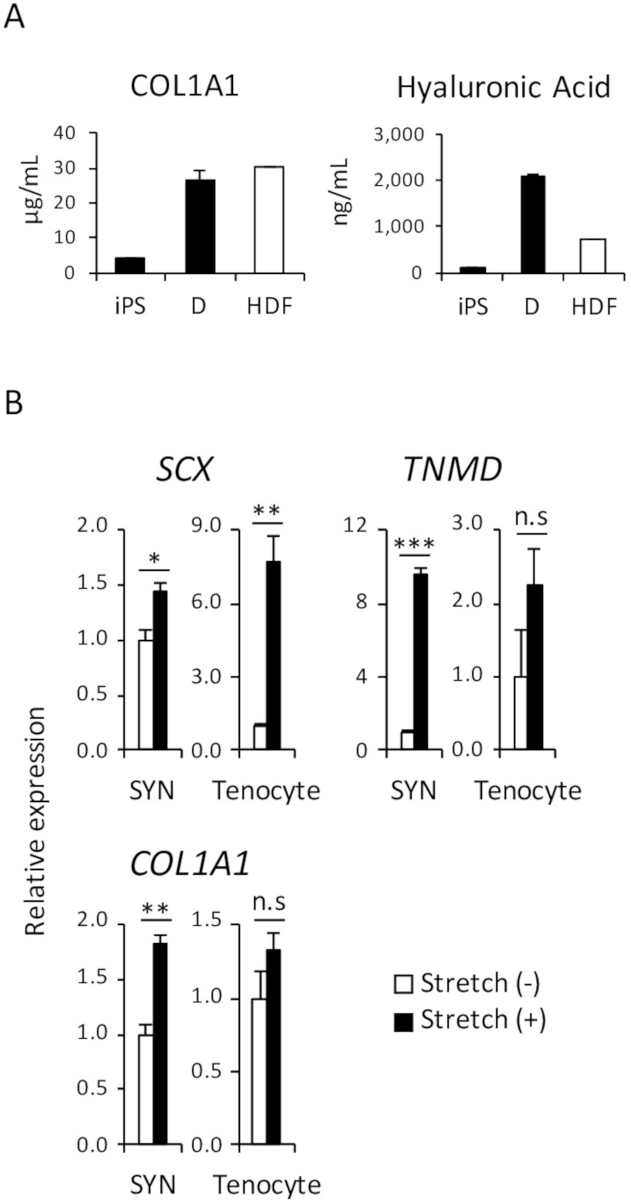
איור 4: assay פונקציונלי של המושרה D ו- SYN. (א) כמות 1 קולגן מסוג חומצה היאלורונית חלבונים במדיום תרבות נותחו על ידי אליסה. (B) ההשפעה של מתיחה מכנית גירוי SYN המושרה ואת האדם tenocytes למבוגרים הוערכה על ידי RT-qPCR. האמצעים ± השגיאה הסטנדרטית (S.E.) של שלושה סטים של ניסויים מוצגים. * p < 0.05; * * p < 0.01; p < 0.001 מאת של Dunnett מספר השוואות מבחן t לעומת מתיחה (-); n.s, לא משמעותי, HDF,. פיברובלסט עורי למבוגרים אנושי. איור זה השתנה בין נקאג'ימה et al. (2018)15. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.
| בינוני/פתרון | Reagant | ריכוז |
| CDM הבזליים בינוני | של Iscove שונה F12 בינוני/ירך חזיר של Dulbecco | 1:1 |
| פניצילין/סטרפטומיצין | 0.5% | |
| מבחינה כימית שהוגדרו השומנים להתרכז | 1% | |
| Apo-transferrin | 15 מ"ג/מ"ל | |
| Monothioglycerol | 450 מ מ | |
| אלבומין שור | 5 מ"ג/מ"ל | |
| אינסולין | 7 מ"ג/מ"ל | |
| פתרון CTK | מים | - |
| טריפסין | 0.25% | |
| Collagenase הרביעי | 0.1 מ"ג/מ"ל | |
| סידן כלורי | 1 מ מ | |
| נוקאאוט SR | 20% | |
| D אינדוקציה בינוני | CDM הבזליים בינוני | - |
| CHIR99021 | 5 מיקרומטר | |
| BMP4 | 10 ng/mL | |
| מיט אינדוקציה בינוני | CDM הבזליים בינוני | - |
| CHIR99021 | 5 מיקרומטר | |
| BMP4 | 10 ng/mL | |
| פתרון ה-ECM | מטריצה חוץ-תאית מלאכותי | 0.3 מ"ג/מ"ל |
| DMEM/F12 | - | |
| מאגר FACS | PBS | - |
| אלבומין שור | 0.1% | |
| תא מזין ללא תרבות בינוני | mTeSR1 | - |
| פניצילין/סטרפטומיצין | 0.5% | |
| HDF תרבות בינוני | DMEM | - |
| סרום שור עוברית | 10% | |
| hESC בינוני | פרימטים ES תא בינוני | - |
| פניצילין/סטרפטומיצין | 0.5% | |
| FGF2 | 4 ng/mL | |
| MYO אינדוקציה בינוני | CDM הבזליים בינוני | - |
| CHIR99021 | 5 מיקרומטר | |
| PSM אינדוקציה בינוני | CDM הבזליים בינוני | - |
| SB431542 | 10 מיקרומטר | |
| CHIR99021 | 10 מיקרומטר | |
| DMH1 | 2 מיקרומטר | |
| FGF2 | 20 ng/mL | |
| SCL אינדוקציה בינוני | CDM הבזליים בינוני | - |
| סאג | 100 ננומטר | |
| LDN193189 | מיקרומטר 0.6 | |
| SM אינדוקציה בינוני | CDM הבזליים בינוני | - |
| SB431542 | 10 מיקרומטר | |
| CHIR99021 | 5 מיקרומטר | |
| SYN אינדוקציה בינוני-1... | CDM הבזליים בינוני | - |
| FGF8 | 20 ng/mL | |
| SYN אינדוקציה בינוני-2... | CDM הבזליים בינוני | - |
| BMP7 | 10 ng/mL | |
| TGFΒ3 | 10 ng/mL |
טבלה 1: תקשורת, פתרון מתכונים.
| שם | קדימה | הפוך |
| ACTB | CACCATTGGCAATGAGCGGTTC | AGGTCTTTGCGGATGTCCACGT |
| COL1A1 | GGACACAGAGGTTTCAGTGGT | GCACCATCATTTCCACGAGC |
| MEOX1 | GAGATTGCGGTAAACCTGGA | GAACTTGGAGAGGCTGTGGA |
| MSGN1 | GGAGAAGCTCAGGATGAGGA | GTCTGTGAGTTCCCCGATGT |
| PARAXIS | TCCTGGAGAGCTGTGAGGAT | CACACCCTGTCACCAACAGT |
| PAX3 | AGGAAGGAGGCAGAGGAAAG | CAGCTGTTCTGCTGTGAAGG |
| SCX | CCCAAACAGATCTGCACCTTC | GCGAATCGCTGTCTTTCTGTC |
| TBX6 | AGCCTGTGTCTTTCCATCGT | AGGCTGTCACGGAGATGAAT |
| TNMD | CCCTTCATGCTGAAGCCACTT | CTCACTTTCAGCAGAATTGGGG |
| WNT3A | CAAGATTGGCATCCAGGAGT | ATGAGCGTGTCACTGCAAAG |
טבלה 2: פריימר רצפים לניתוח RT-qPCR.
| ריכוז | ||
| 1 נוגדן | ALX4_Goat | 1/50 |
| CDH11_Mouse | 1/1000 | |
| COL1A1_Rabbit | 1/100 | |
| COL2A1_Mouse | 1-2 μg/mL | |
| EN1_Rabbit | 1/50 | |
| MEOX1_Rabbit | 1/50 | |
| MHC_Rabbit | 1/200 | |
| MKX_Rabbit | 1/50 | |
| MYOD_Rabbit | 1/500 | |
| MYOG_Mouse | 1/400 | |
| NKX3.2_Rabbit | 1/50 | |
| PARAXIS_Rabbit | 1/50 | |
| PAX1_Rabbit | 1/50 | |
| PAX9_Rabbit | 1/50 | |
| PDGFRa_Goat | 1/100 | |
| SCX_Rabbit | 1/50 | |
| TBX6_Goat | 1/50 | |
| 2 נוגדן | החמור אנטי antibody555 משני IgG(H+L) עז | 1/500 |
| החמור אנטי antibody647 משני IgG(H+L) עז | 1/500 | |
| עז אנטי IgG(H+L) העכבר המשני antibody555 | 1/500 | |
| עז אנטי antibody555 המשנית IgG(H+L) ארנב | 1/500 | |
| עז אנטי antibody647 המשנית IgG(H+L) ארנב | 1/500 |
טבלה 3: ראשון ושני נוגדנים עבור ICC.
Discussion
שיטה ידועה אינדוקציה של נגזר PSC SM דרך PSM הוא השילוב של CHIR99021 + A83-01 (TGFβ מעכב) במהלך PSM אינדוקציה של PSC, אך לא את תהליך ההבשלה PSM6. במחקר הנוכחי, ונ ט/בטא-catenin איתות היה עכבות באמצעות C59 לזירוז SM מ PSM. עם זאת, הצגנו את השימוש CHIR99021 כדי להפעיל את השביל ונ ט במהלך בידול של SM. החלטה זו התקבלה בהתבסס על הממצאים כי מספר WNTs הם הביעו ברקמות שמסביב של SM, בהתחשב בעובדה כי ונ ט כתבים פעילים SM20. כתוצאה מכך, הבחנו epithelialization, מאפיין של SM ויוו, רק תחת התנאי עם CHIR99021, בהתבסס על ההצטברות של CDH11 ב צמתי תא-תא (2E איור). התבוננות זו מצביע על מעורבות ביקורתית של חגיגת איתות במהלך PSM בידול של SM epithelialization, לכן שפרוטוקול שלנו אולי כדאי לסכם הסביבה איתות אנדוגני. עם זאת, הוא גם מרמז על אפשרות נוספת של כוונון של חגיגת/הבטא-catenin איתות במהלך התמיינות, כי החוסן ואת היעילות של בידול עשוי להשתנות באופן משמעותי בהתאם את סוגי תאים, שורות תאים שונים תרכובות כימיות של חגיגת-inducers בשימוש על ידי כל אחד.
שיטה זו גם מאפשרת לנו ליצור כל ארבע SM נגזרים MYO, D, SCL, SYN, מתוך iPSCs האנושית. את כל מנגנוני stepwise באמצעות CDM יכול לשמש כדי לזהות את הדרישות איתות במהלך האנושי somitogenesis/somite תכנים, ומספקים תובנות חשובות בהתפתחות SM. לדוגמה, השיטות שלנו יכול להיות שימושי עבור לימוד מנגנוני שעון פילוח, מערכת תנודה מולקולרית המווסת את היווצרות SM. זה ביסודיות נחקר עכברים, אפרוחים, דג זברה, אך לא בבני אדם בשל היעדר ניסוי כלים מתאימים.
יתר על כן, שיטת שלנו יכולה להיות ישימה לטיפולים עתידיות הקלינית מבוססת-תא. לדוגמה, האדם הנגזרות iPSC D או SYN יכול להיות מושתלים לתוך העור נפגע קשות או קרע גידים עבור התחדשות וטיפול. עם זאת, מספר מגבלות צריך להיפתר לפני שיטה זו יכול להיות מיושם באופן מעשי. למרות במחקר הנוכחי, השתמשנו באן מזין תאים עבור iPSC תחזוקה, פתרון ה-ECM, אשר מופק סרקומה העכבר Engelbreth-הולם-נחיל, כמו מעיל משטח על מדיח הכלים במהלך אינדוקציה, ריאגנטים מהחי אלה שאינם בני אדם צריכים להיות הסיר לשיפור איכות קליניים. בנוסף, תאים בכמות ובאיכות, הכוללת את הטוהר ואת ההבשלה של תאי הרצוי, חייב להיות גם שיפור. יתר על כן, לא רק את מספר התאים, אלא גם את הכוח תא הוא מאפיין חשוב עבור התחדשות גיד/רצועה. בנוסף, הפיתוח של סמני פני לטיהור ושל שיטה עבור תלת-ממד שיחזור הן תנאי הכרחי על מנת לקדם את כל מנגנוני טיפולים קליניים מבוססי תאים.
Disclosures
המחברים אין לחשוף.
Acknowledgements
ברצוננו להודות ד ר Junya Toguchida (CiRA) לעזרתו עם מינהלת הפרויקט, מימון הרכישה, מר. מיצואקי (CiRA) ו גב' מיי Terashima (CiRA) לסיוע טכני שלהם, טויוקה יאיואי ד ר (CiRA), ד ר Daisuke Kamiya (CiRA) עבור שלהם הגהה של כתב היד, מר Masaya Todani (CiRA) לספק המחשה (איור 1). ברצוננו להודות לכל חברי Ikeya ו- Toguchida המעבדות (CiRA) על תמיכתם במהלך מחקר זה. עבודה זו נתמך על ידי Grants-in-aid למחקר מדעי מן האגודה יפן עבור הקידום של המדע (JSPS) (26670661), התוכנית עבור תאי iPS סורר מחלות מחקר ניצול מחלות ספציפיות של יפן המדע והטכנולוגיה סוכנות (JST), הסוכנות יפן למחקר רפואי, פיתוח (AMED), המרכז הליבה iPS מחקר תאי של רשת מרכז מחקר עבור מימוש של רפואה רגנרטיבית (JST/AMED), שב"ס קרן מחקרים תא (ל מקוטו Ikeya ו Junya Toguchida). מקוטו Ikeya נתמכה גם על ידי Grants-in-aid מחקר מדעי (JSPS) (16H 05447), את תוכנית ההאצה לחקר מחלות סורר ניצול תאי iPS מחלות ספציפיות (AMED).
Materials
| Name | Company | Catalog Number | Comments |
| ALX4_Goat antibody | Santacruz | sc-22066 | |
| Apo-transferrin | Sigma | T1147 | |
| BMP4 | R&D | 314-BP-010 | |
| BMP7 | R&D | 354-BP-010 | |
| Bovine serum albumin | Sigma | A8806 | |
| Calcium chloride | Nacalai tesque | 067730-15 | |
| CDH11_Mouse antibody | Cell signaling | 13577 | |
| Cell streching device | Strex | STB-140 | |
| Chemically defined lipid concentrate | Gibco | 11905-031 | |
| CHIR99021 | Axon | 1386 | |
| COL1A1_Rabbit antibody | Abcam | ab34710 | |
| COL2A1_Mouse antibody | Thermo scientific | MS-235 | |
| Collagenase IV | Thermofisher | 17104019 | |
| DLL1 APC-conjugated_Mouse antibody | R&D | FAB1818A | For FACS |
| DMEM | Sigma | D6046 | |
| DMEM/F12 | Gibco | 11320-082 | |
| DMH1 | Tocris | 4126 | |
| EN1_Rabbit antibody | Abcam | ab70993 | |
| Fetal bovine serum | Nichirei | 171012 | |
| FGF2 | Wako | 060-04543 | |
| FGF8 | Peprotech | 100-25 | |
| Human dermal fibroblast | Cell applications | 160-05a | |
| Human tenocyte | Angio proteomie | cAP-0041 | |
| Insulin | Wako | 090-06474 | |
| Iscove’s modified Dulbecco’s medium/Ham’s F12 | Gibco | 21056023 | |
| Knockout SR | Gibco | 10828028 | |
| LDN193189 | Axon | 1509 | |
| Matrigel | BD bioscience | 354230 | Artificial extracellular matrix |
| MEOX1_Rabbit antibody | Abcam | ab75895 | |
| MHC_Rabbit antibody | Santacruz | sc-20641 | |
| MKX_Rabbit antibody | Atlas antibodies | A83377 | |
| Monothioglycerol | Sigma | M6145 | |
| mTeSR1 | Stemcell tech | 85850 | |
| Multi well-type silicon rubber chamber | Strex | STB-CH-4W | |
| MYOD_Rabbit antibody | Abcam | ab133627 | |
| MYOG_Mouse antibody | Santacruz | sc-12732 | |
| NKX3.2_Rabbit antibody | Sigma | HPA027564 | |
| Novex Donkey anti Goat IgG(H+L) secondary antibody555 | Invitrogen | A21432 | |
| Novex Donkey anti Goat IgG(H+L) secondary antibody647 | Invitrogen | A21447 | |
| Novex Goat anti Mouse IgG(H+L) secondary antibody555 | Invitrogen | A21422 | |
| Novex Goat anti Rabbit IgG(H+L) secondary antibody555 | Invitrogen | A21428 | |
| Novex Goat anti Rabbit IgG(H+L) secondary antibody647 | Invitrogen | A21245 | |
| PARAXIS_Rabbit antibody | Santacruz | sc-98796 | |
| PAX1_Rabbit antibody | Abcam | ab95227 | |
| PAX9_Rabbit antibody | Gene tex | GTX104454 | |
| PBS | - | - | |
| PDGFRa_Goat | R&D | AF307 | |
| Penicillin/Streptomycin | Invitrogen | 15140-122 | |
| Primate ES cell medium | Reprocell | RCHEMD001 | |
| SAG | Calbiochem | 566661 | |
| SB431542 | Selleckchem | SEL-S1067-10 | |
| SCX_Rabbit antibody | Abcam | ab58655 | |
| TBX6_Goat antibody | R&D | AF4744 | |
| Tendon cell growth medium | Angio-proteomie | cAP-40 | Tenocytes growth medium |
| TGFβ3 | R&D | 243-B3-200 | |
| Trypsin | Gibco | 15090046 |
References
- Tanaka, A., et al. Efficient and reproducible myogenic differentiation from human iPS cells: prospects for modeling Miyoshi Myopathy in vitro. PLoS One. 8 (4), e61540 (2013).
- Sakurai, H., et al. In vitro modeling of paraxial mesodermal progenitors derived from induced pluripotent stem cells. PLoS One. 7 (10), e47078 (2012).
- Chal, J., et al. Generation of human muscle fibers and satellite-like cells from human pluripotent stem cells in vitro. Nature Protocl. 11 (10), 1833-1850 (2016).
- Chal, J., et al. Differentiation of pluripotent stem cells to muscle fiber to model Duchenne muscular dystrophy. Nature Biotechnology. 33 (9), 962-969 (2015).
- Umeda, K., et al. Human chondrogenic paraxial mesoderm, directed specification and prospective isolation from pluripotent stem cells. Scientific Reports. 2, 455 (2012).
- Loh, K. M., et al. Mapping the Pairwise Choices Leading from Pluripotency to Human Bone, Heart, and Other Mesoderm Cell Types. Cell. 166 (2), 451-467 (2016).
- Xi, H., et al. In Vivo Human Somitogenesis Guides Somite Development from hPSCs. Cell Reports. 18 (6), 1573-1585 (2017).
- Chal, J., Pourquie, O. Making muscle: skeletal myogenesis in vivo and in vitro. Development. 144 (12), 2104-2122 (2017).
- Tam, P. P., Beddington, R. S. The formation of mesodermal tissues in the mouse embryo during gastrulation and early organogenesis. Development. 99 (1), 109-126 (1987).
- Aulehla, A., Pourquie, O. Signaling gradients during paraxial mesoderm development. Cold Spring Harbor Perspectives in Biology. 2 (2), a000869 (2010).
- Christ, B., Scaal, M. Formation and differentiation of avian somite derivatives. Advances in Experimental Medicine and Biology. 638, 1-41 (2008).
- Brent, A. E., Schweitzer, R., Tabin, C. J. A somitic compartment of tendon progenitors. Cell. 113 (2), 235-248 (2003).
- Sakurai, H., et al. Bidirectional induction toward paraxial mesodermal derivatives from mouse ES cells in chemically defined medium. Stem Cell Research. 3 (2-3), 157-169 (2009).
- Zhao, J., et al. Small molecule-directed specification of sclerotome-like chondroprogenitors and induction of a somitic chondrogenesis program from embryonic stem cells. Development. 141 (20), 3848-3858 (2014).
- Nakajima, T., et al. Modeling human somite development and fibrodysplasia ossificans progressiva with induced pluripotent stem cells. Development. 145 (16), (2018).
- McMahon, A. P., Bradley, A. The Wnt-1 (int-1) proto-oncogene is required for development of a large region of the mouse brain. Cell. 62 (6), 1073-1085 (1990).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Suzuki, H., et al. targeting of the transcription factor Mohawk in rats causes heterotopic ossification of Achilles tendon via failed tenogenesis. Proceedings of the National Academy of Sciences of the United States of America. 113 (28), 7840-7845 (2016).
- Marturano, J. E., Arena, J. D., Schiller, Z. A., Georgakoudi, I., Kuo, C. K. Characterization of mechanical and biochemical properties of developing embryonic tendon. Proceedings of the National Academy of Sciences of the United States of America. 110 (16), 6370-6375 (2013).
- Maretto, S., et al. Mapping Wnt/beta-catenin signaling during mouse development and in colorectal tumors. Proceedings of the National Academy of Sciences of the United States of America. 100 (6), 3299-3304 (2003).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved