Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Modelo Quirúrgico Murino de Aneurisma aórtico torácico descendente fortuito tópico
En este artículo
Resumen
Describimos un protocolo quirúrgico para inducir consistentemente aneurismas de la aorta torácica descendentes robustos en ratones. El procedimiento consiste en la toracotomía izquierda, la exposición a la aorta torácica y la colocación de una esponja empapada en elastasa pancreática porcina en la pared aórtica.
Resumen
Según el Centro para el Control de Enfermedades, los aneurismas aórticos (AA) fueron considerados una de las principales causas de muerte en todas las razas y ambos sexos de 1999 a 2016. Se forma un aneurisma como resultado del debilitamiento progresivo y la dilatación eventual de la aorta, que puede romperse o desgarrarse una vez que alcanza un diámetro crítico. Los aneurismas de la aorta descendente en el pecho, llamados aneurismas de la aorta torácica descendente (dTAA), conforman una gran proporción de casos de aneurisma en los Estados Unidos. La ruptura dTAA no contenida es casi universalmente letal, y la reparación electiva tiene una alta tasa de morbilidad y mortalidad. El propósito de nuestro modelo es estudiar dTAA específicamente, dilucidar la fisiopatología de dTAA y buscar dianas moleculares para detener el crecimiento o reducir el tamaño de dTAA. Al tener un modelo murino para estudiar la patología torácica con precisión, se pueden desarrollar terapias dirigidas para probar específicamente la dTAA. El método se basa en la colocación de la elastasa pancreática porcina (EPP) directamente en la pared aórtica murinosexterna después de la exposición quirúrgica. Esto crea una reacción destructiva e inflamatoria, que debilita la pared aórtica y permite la formación de aneurisma durante semanas o meses. Aunque los modelos murinos poseen limitaciones, nuestro modelo dTAA produce aneurismas robustos de tamaño predecible. Además, este modelo se puede utilizar para probar objetivos genéticos y farmacéuticos que pueden detener el crecimiento de dTAA o prevenir la ruptura. En pacientes humanos, intervenciones como estas podrían ayudar a evitar la ruptura del aneurisma y la difícil intervención quirúrgica.
Introducción
El propósito de este método es estudiar el desarrollo, la fisiopatología y los cambios estructurales en la aorta torácica descendente murina durante la formación del aneurisma aórtico. Nuestro modelo ofrece un método reproducible y consistente para inducir aneurismas de la aorta torácica (dTAA) en ratones permitiendo así la prueba de diversos inhibidores genéticos y farmacológicos. Este trabajo puede ayudar a identificar fármacos y terapias génicas que podrían traducirse en una estrategia de tratamiento viable para los seres humanos con enfermedad de dTAA.
los dTAa se forman cuando la pared de la aorta torácica se debilita y se dilata con el tiempo hasta alcanzar un diámetro crítico al rasgarse o romperse. Clínicamente, dTAA puede progresar en silencio, aumentando de tamaño hasta que la estructura de la pared aórtica está tan distorsionada que finalmente falla, con consecuencias catastróficas. En cuanto a todo, los síntomas generalmente se desarrollan sólo cuando el aneurisma ha alcanzado un tamaño peligroso (100-150% dilatación) y está en alto riesgo de disección o ruptura1,2. la ruptura dTAA escasi universalmente letal 3, y la reparación quirúrgica electiva conlleva una morbilidad significativa4,5. Además, la mayoría de los pacientes llevan el diagnóstico de un aneurisma aórtico durante aproximadamente 5 años antes de la reparación quirúrgica6,7. Esta ventana representa un momento oportuno para intervenir no quirúrgicamente. Por lo tanto, se necesitan terapias médicas para tratar o la progresión lenta de la dTAA y representarían un avance significativo en el campo de la investigación del aneurisma. Actualmente no hay tratamientos médicos para dTAA disponibles, principalmente debido a una comprensión incompleta de la patogénesis dTAA.
En los últimos 20 años, se han desarrollado varios modelos animales dTAA, pero cada uno de estos modelos fueron distintos de los nuestros y no produjeron aneurismas robustos. Un modelo dTAA murino más similar al nuestro fue desarrollado por Ikonomidis et al.8, que incluye la aplicación directa de CaCl2 a la adventitia de la aorta. Aunque nuestro modelo fue adaptado de muchas de las técnicas establecidas por Ikonomidis, nuestro modelo es único en tres maneras separadas. En primer lugar, en nuestro modelo la aorta se expone a la elastasa tópica durante 3-5 minutos, en comparación con 15 minutos de exposición a CaCl 2. En segundo lugar, la dilatación aórtica ocurre en 2 semanas, en comparación con 16 semanas en el modelo CaCl 2. Por último, nuestro modelo produce consistentemente aneurismas de aproximadamente 100% de dilatación, en comparación con las dilataciones aórticas de 20-30% producidas por la aplicación CaCl2 (que no pueden considerarse verdaderamente aneurismas como se definen como un aumento de la aórtica diámetro >50%). Existen otros modelos murinos no quirúrgicos de formación de aneurisma, como el ratón noqueador Apo E, que forman aneurismas robustos con infusión de angiotensina II. Sin embargo, estos ratones desarrollan aneurismas de la aorta torácica suprarrenal o ascendenteen lugar de aneurismas específicamente en la aorta torácica descendente 9,10.
La razón de este protocolo es tener una manera simple, económica y adecuada para estudiar dTAA en un modelo murino. El modelo de ratón proporciona una oportunidad única para utilizar muchos knockouts genéticos y celulares específicos que se han encontrado para ser impactantes en otras enfermedades vasculares. El uso de nuestro modelo TAA específico ha sido bien recibido y los experimentos que lo utilizan se han publicado en revistas de alto impacto11,12. Hasta este punto, el modelo se ha utilizado para investigar posibles tratamientos genéticos y farmacológicos que tuvieron un efecto significativo en los modelos de aneurisma de la aorta abdominal (AAA); sin embargo, a medida que nuestro laboratorio ha ampliado el uso del modelo dTAA, estamos encontrando objetivos únicos para la formación de dTAA que podrían ser utilizados como terapias dirigidas en seres humanos.
Este modelo es más adecuado para laboratorios que tienen capacidades microquirúrgicas murinas. Aunque es técnicamente difícil, puede ser ejecutado consistentemente incluso por investigadores sin experiencia quirúrgica previa. Para un investigador sin experiencia quirúrgica murina, el modelo se puede dominar en aproximadamente 20 sesiones operativas (o aproximadamente 50 ratones). Para el investigador con experiencia quirúrgica previa, el modelo se puede dominar en 5 sesiones operativas (aproximadamente 20 ratones). Creemos que con un vídeo de alta calidad, el tiempo de dominio se puede reducir aún más. Después de la competencia, el procedimiento se puede completar en 35 minutos para la cirugía, y 20 minutos para la cosecha terminal. Los cirujanos de nuestro laboratorio pueden completar entre 10 y 12 cirugías completas por día, con una tasa de mortalidad operativa del 5-10%. La causa más común de mortalidad es la lesión pulmonar al entrar en el pecho, toxicidad anestésica o desgarro de la aorta durante la disección. Además de la investigación dTAA, este modelo también sirve como una guía para un acceso seguro y fácil a la aorta torácica y al hilum pulmonar para los investigadores que estudian otras intervenciones en el pecho.
Protocolo
Los protocolos animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales de la Universidad de Virginia (núm. 3634).
1. Inducción de anestesia e intubación
- Coloque un ratón C57BL/6 macho de 8-10 semanas de edad en una cámara cerrada con flujo continuo de 5% de isoflurano y mezcla de oxígeno durante 5 minutos, hasta que las respiraciones se desaceleren visiblemente.
NOTA: Se pueden utilizar diferentes cepas, géneros y edades de los ratones dependiendo del protocolo experimental. Los ratones hembras pueden ser más difíciles de intubar debido a un tamaño más pequeño y, por lo tanto, a las vías respiratorias más pequeñas. - Intubar el ratón como lo describen Vandivort et al.13.
NOTA: El paso de intubación es la parte más difícil de este modelo para aprender y realizar. Los autores mencionados anteriormente hacen un excelente trabajo explicando los pasos en su video.
2. Asegurar el ratón a la placa quirúrgica
- Conecte el tubo endotraqueal (ET), confirme el aumento del pecho y coloque el ratón en la posición del decúmito lateral derecho. Gire el isoflurano a aproximadamente el 3% y aplique la lubricación en ambos ojos. El ventilador debe ajustarse para proporcionar aproximadamente 200 respiraciones por minuto y 225 ml de volumen de marea.
NOTA: La toxicidad es rápida si el isoflurano se deja en el 5%. Sin embargo, la respuesta al isoflurano es variable, por lo que el caudal anestésico debe valorarse de tal manera que se produzcan contracciones diafragmáticas espontáneas aproximadamente cada 10-20 s y la oxigenación parezca adecuada en la inspección de las membranas mucosas y el tejido expuesto. - Fije el tubo ET a la placa con cinta adhesiva. Extiende el brazo derecho rostrally para que la pata delantera esté en línea con la nariz y fíjala con cinta adhesiva.
- Tire de la cola caudalmente para crear una línea de tensión entre el brazo derecho y la cola, produciendo la extensión de la columna vertebral.
NOTA: Asegurar tanto la cola como la pata derecha en línea evita la inserción excesiva o desconexión del tubo ET. - Tape la pierna izquierda en su posición natural. Dibuje el brazo izquierdo ventralmente sobre la gasa enrollada y la cinta hacia abajo.
3. Preparación para la cirugía
- Afiva el flanco izquierdo del ratón con pinzas eléctricas desde el hombro izquierdo hasta el abdomen izquierdo.
- Utilice un aplicador de punta de algodón para cepillar la solución de betadina sobre el sitio quirúrgico. Utilice un nuevo aplicador de punta de algodón para cepillar 70% solución de etanol sobre el sitio quirúrgico. Dejar secar. Coloque una cortina estéril.
- ADVERTENCIA: Asegúrese de que todo el etanol esté completamente seco antes de proceder ya que se utiliza la electrocauterización y puede encender el etanol.
4. Entrada en el tórax
- Haga una incisión lateral de 1 cm en el punto medio del hemitrastóx con tijeras quirúrgicas. Utilice la electrocauterización de mano para dividir las capas musculares hasta que las costillas sean visibles.
- Cauterizar directamente una porción de 2 mm de la costilla.
NOTA: Cuando utilice electrocauterización en la costilla, observe la frecuencia respiratoria espontánea. Si el ratón tiene una contracción diafragmática durante la cautela, la punta puede entrar en el tórax y perforar el pulmón, que suele ser mortal en este modelo. - Usando un aplicador húmedo con punta de algodón fino en el espacio de las costillas superior a la porción cauterizada, gire la punta sobre el tejido para romper en el espacio pleural. Coloque la esponja humedecida de 3 mm x 2 mm en el tórax para ayudar a colapsar el pulmón.
NOTA: Deje que las esponjas suaves, húmedas y entren en contacto con el pulmón, ya que es extremadamente delicado. - Utilice tijeras para cortar a lo largo del aspecto superior de la costilla cauterizada, hasta que el diafragma sea visible.
5. Exposición aórtica
- Coloque los retractores de costillas y utilícelos para abrir la incisión de toracotomía. Retire cuidadosamente la esponja de la superficie del pulmón.
- Coloque la esponja humedecida de 6 mm x 4 mm de modo que quede cubriendo el pulmón, con extremos apuntando de forma rostrally y caudal. Coloque el retractor pulmonar (plano ancho) sobre la esponja y deslice suavemente el retractor ventralmente hasta que la aorta torácica descendente quede expuesta.
- Utilice #7 fórceps para diseccionar el tejido conectivo y la grasa de la aorta durante una sección de aproximadamente 5 mm.
NOTA: Las venas pequeñas pueden estar corriendo transversalmente a través de la aorta; evitar rasgarlos durante la disección (usar al menos 14x aumento puede ayudar a evitar esta complicación).
6. Exposición a elastasa
- Saturar la esponja de 0,5 mm x 1 mm con 12 ml de elastasa pancreática porcina y colocarla sobre la superficie expuesta de la aorta.
NOTA: No deje que la esponja toque el pulmón contralateral. - Después del tiempo predeterminado (generalmente 3-5 min), retire la esponja de elastasa con #7 fórceps. Retire el retractor pulmonar. Irrigar la cavidad torácica con 1 ml de solución salina estéril.
NOTA: Retire el retractor pulmonar antes de irrigación con solución salina, ya que permitirá que la esponja pulmonar se sature y se descante, lo que facilita su eliminación de la superficie del pulmón. - Utilice una gasa enrollada de 2" x 2" para absorber el riego salino restante. Gire el isoflurano al 2%.
7. Cierre del pecho
- Retire la esponja pulmonar. Retire el retractor pulmonar caudal. Retire el retractor de pulmón rostral.
- Coloque 3 suturas no absorbibles de 6-0 interrumpidas para oponerse a las costillas, ate un nudo suelto en cada una, pero no ate. Tenga mucho cuidado de no tocar el pulmón con la aguja de sutura.
- Vuelva a inflar el pulmón mediante la oclusión del tubo de salida en el ventilador o soplando rápidamente 0,5-1,0 ml de aire a través del tubo ET mediante la utilización de la polla de parada de 3 vías.
NOTA: Para evitar el barotraumatismo, evite el uso excesivo de la jeringa llena de aire y no utilice más de 1,0 ml de aire. - Ate suturas no absorbibles. Reaproxima las capas musculares con una sutura multifilamento absorbible 5-0. Gire el isoflurano al 1%.
- Cierre la piel con 7-10 suturas no absorbibles interrumpidas 5-0. Gire el isoflurano a 0%.
8. Recuperación
- Administrar 6 g (0,02 ml de una suspensión de 0,3 mg/ml) de buprenorfina por vía subcutánea. Retire la cinta del pie derecho, la cola y el brazo izquierdo seguido de la cinta del brazo derecho.
- Cuando el ratón mueve las extremidades, extubere tirando de ella por su cola para deslizarse fuera del tubo ET. Colocar en la cámara más cálida de alto contenido de oxígeno en la posición supina.
NOTA: Es seguro mover el ratón de la cámara de oxígeno a la jaula cuando puede girarse a sí mismo a la posición normal de pie. Además, los ratones deben ser monitoreados en busca de signos de dolor, angustia o falta de desarrollo con frecuencia durante las primeras 24-48 horas después de la cirugía y proporcionar analgesia adicional o alimentos blandos como se indica.
9. Exposición del aneurisma aórtico (procedimiento de cosecha terminal)
NOTA: En general, la cosecha de tejido se lleva a cabo a los 14 días, ya que esto representa el período de dilatación máxima. Sin embargo, dependiendo del experimento, el tiempo del procedimiento de cosecha se puede llevar a cabo en cualquier momento entre 3 días y 4+ semanas, dependiendo del experimento.
- Intubar y asegurar el ratón al campo operativo como se describió anteriormente (secciones 1-3). Use tijeras para inciser la piel medialmente desde el flanco izquierdo hasta el abdomen central teniendo cuidado de no entrar en el peritoneo.
- Incise la piel desde el flanco izquierdo dorsal rostrally hasta el nivel del hombro izquierdo. A continuación, incise en un ángulo de 90o a través de la axila al esternón.
NOTA: Esta incisión debe rodear completamente la incisión cutánea original. - Usando cauterio, disecciona la solapa de la piel hacia el aspecto ventral del ratón, exponiendo el hemitórax izquierdo. Usa tijeras para entrar en el abdomen e inciso a lo largo del margen costalista izquierdo de ventral a dorsal para exponer la parte inferior del diafragma izquierdo. El borde lateral más lateral del diafragma puede abrirse y se desea.
- Si no se crea con el paso anterior, incise el diafragma en su borde más lateral. Coloque la punta de la cauterización en este agujero y cauterice el diafragma fuera del margen costal al proceso de la ciifoidea. Usando un aplicador húmedo con punta fina de algodón, libere suavemente el pulmón de las adherencias a la pared torácica y empuje el pulmón medialmente.
NOTA: Si las adherencias no salen fácilmente de la pared torácica, utilice cautery para eliminarlas; hacerlo ayuda a evitar el desgarro del pulmón que puede causar sangrado abundante. - Cauterizar el interior de la pared torácica desde la costilla uno hasta el margen costal, dorsal a la línea axilar media pero al menos 2 mm de la aorta. Corte la pared torácica a lo largo de la línea cauterizada.
NOTA: Esta técnica evita el sangrado de las arterias intercostales. - Corte a lo largo del margen superior de la costilla uno y luego caudalmente a lo largo del borde lateral del esternón, retirando la caja torácica izquierda. Coloque los retractores en el pulmón y tire de la media. Coloque el retractor en el diafragma y dibuje caudalmente para exponer la mayor cantidad de aorta posible.
- Utilice un aplicador seco con punta de algodón para eliminar las adherencias del aneurisma aórtico y un segmento distal no afectado. Mida el diámetro del segmento de control no afectado y la porción más ancha del aneurisma tratado por elastasa utilizando micrometría de vídeo.
NOTA: Las mediciones de micrometría de vídeo se utilizan para calcular el porcentaje de dilatación del segmento aneurisma en comparación con un segmento de control con la ecuación 1. Se selecciona un segmento de control de 0,5 mm distal al segmento aneurisma 1.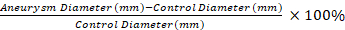 Ecuación 1
Ecuación 1
- Agarre la aorta con fórceps de daño, simplemente distal al segmento tratado. Usa tijeras para cortar el distal a los fórceps, luego disecciona la aorta de la columna vertebral. Cortar la aorta proximal al segmento tratado y eliminar la aorta aneurisma.
- Con una jeringa y una aguja de tuberculina, lave el lumen aórtico con salina y procese el tejido como desee.
Resultados
La aplicación de nuestro protocolo da como resultado un dTAA robusto en ratones en comparación con los controles salinos. Los TAA desarrollados tienen forma fusiforme y se producen únicamente en la parte tratada de la aorta (Figura1 y Figura 2)11. La Figura 2 muestra un ejemplo de una medición de micrometría de vídeo en la cosecha de tejidos. Usando la Ecuación 1, la dilatación aórtica es 130% en est...
Discusión
La aorta torácica y abdominal son celular y embrionariamente distintas, lo que es relevante para la enfermedad aneurisma14,15,16. Por lo tanto, se necesita un modelo animal específico para estudiar TAA. Aunque otros modelos de dTAA murinos se han publicado8, el nuestro es el único modelo para crear dilatación aórtica torácica descendente que puede considerarse verdaderamente aneurisma (más del 50% ...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por las subvenciones de la Subvención de Desarrollo Científico de la AHA 14SDG18730000 (M.S.), NIH K08 HL098560 (G.A.) y RO1 HL081629 (G.R.U.). Este proyecto fue apoyado por la Beca de Investigación de la Fundación de Cirugía Torácica para la Investigación y la Educación (TSFRE) (PI: G. Ailawadi). El contenido es responsabilidad exclusiva de los autores y no representa necesariamente las opiniones de la NHLBI o del TSFRE. Agradecemos a Anthony Herring y Cindy Dodson por su conocimiento y experiencia técnica.
Materiales
| Name | Company | Catalog Number | Comments |
| Angiocatheter (22G) | Used for ET Tube | ||
| Dumont Tweezers; Pattern #7 x2 | Roboz | RS-4982 | |
| Graefe Tissue Forceps | Roboz | RS-5158 | |
| Harms Forceps x2 | Roboz | RS-5097 | |
| Intracardiac Needle Holder; Extra Delicate; Carbide Jaws; 7" Length | Roboz | RS-7800 | |
| KL 1500 LED Light Source | Leica | 150-400 | |
| M205A Dissction Microscope | Leica | CH 94-35 | |
| Iris Scissors, 11cm, Tungsten Carbide | World Precision Instruments | 500216-G | |
| Metal Clip board | Use with the Mouse Retractor Set | ||
| Mouse Retractor Set | Kent | SURGI-5001 | Need 2 short and 1 tall fixators |
| Mouse Ventilator MiniVent Type 845, 115 V, Power Supply with US Connector | Harvard Apparatus | 73-0043 | MiniVent Ventilator for Mice (Model 845), Single Animal, Volume Controlled |
| Sigma Aldrich | Elastase from porcine pancreas | E0258-50MG | Can be purchased in various size bottles |
| Small Vessel Cauterizer Kit | Fine Science Tools | 18000-00 | Recommend using rechargable AA batteries |
| Spring Scissors, 10.5cm | World Precision Instruments | 14127 | |
| Steril Swabs (Sponges) | Sugi | 31603 | Can be cut to size |
| Surgi Suite Surgical Platform | Kent | Attach to clip board | |
| Tech IV Isoflurane Vap | Jorgensen Laboratories | J0561A | Anesthesia vaporizer |
Referencias
- Coady, M. A., et al. What is the appropriate size criterion for resection of thoracic aortic aneurysms. Journal of Thoracic and Cardiovascular Surgery. 113 (3), 489-491 (1997).
- Aggarwal, S., Qamar, A., Sharma, V., Sharma, A. Abdominal aortic aneurysm: A comprehensive review. Experimental and Clinical Cardiology. 16 (1), 11-15 (2011).
- Bickerstaff, L. K., et al. Thoracic aortic aneurysms: a population-based study. Surgery. 92 (6), 1103-1108 (1982).
- Cheng, D., et al. Endovascular aortic repair versus open surgical repair for descending thoracic aortic disease a systematic review and meta-analysis of comparative studies. Journal of the American College of Cardiology. 55 (10), 986-1001 (2010).
- Walsh, S. R., et al. Endovascular stenting versus open surgery for thoracic aortic disease: systematic review and meta-analysis of perioperative results. Journal of Vascular Surgery. 47 (5), 1094-1098 (2008).
- Absi, T. S., et al. Altered patterns of gene expression distinguishing ascending aortic aneurysms from abdominal aortic aneurysms: complementary DNA expression profiling in the molecular characterization of aortic disease. The Journal of Thoracic and Cardiovascular Surgery. 126 (2), 344-357 (2003).
- Ailawadi, G., Eliason, J. L., Upchurch, G. R. Current concepts in the pathogenesis of abdominal aortic aneurysm. Journal of Vascular Surgery. 38 (3), 584-588 (2003).
- Ikonomidis, J. S., et al. A murine model of thoracic aortic aneurysms. Journal of Surgical Research. 115 (1), 157-163 (2003).
- Daugherty, A., Manning, M. W., Cassis, L. A. Angiotensin II promotes atherosclerotic lesions and aneurysms in apolipoprotein E-deficient mice. Journal of Clinical Investigation. 105 (11), 1605-1612 (2000).
- Trachet, B., et al. Ascending Aortic Aneurysm in Angiotensin II-Infused Mice: Formation, Progression, and the Role of Focal Dissections. Arteriosclerosis, Thrombosis, and Vascular Biology. 36 (4), 673-681 (2016).
- Johnston, W. F., et al. Inhibition of interleukin-1beta decreases aneurysm formation and progression in a novel model of thoracic aortic aneurysms. Circulation. 130 (11), 51-59 (2014).
- Pope, N. H., et al. Interleukin-6 Receptor Inhibition Prevents Descending Thoracic Aortic Aneurysm Formation. Annals of Thoracic Surgery. 100 (5), 1620-1626 (2015).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771 (2016).
- Ailawadi, G., et al. A nonintrinsic regional basis for increased infrarenal aortic MMP-9 expression and activity. Journal of Vascular Surgery. 37 (5), 1059-1066 (2003).
- Ruddy, J. M., Jones, J. A., Spinale, F. G., Ikonomidis, J. S. Regional heterogeneity within the aorta: relevance to aneurysm disease. Journal of Thoracic and Cardiovascular Surgery. 136 (5), 1123-1130 (2008).
- Trigueros-Motos, L., et al. Embryological-origin-dependent differences in homeobox expression in adult aorta: role in regional phenotypic variability and regulation of NF-kappaB activity. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (6), 1248-1256 (2013).
- Lu, G. S. G., Davis, J. P., Schaheen, B., Downs, E., Roy, R. J., Ailawadi, G., Upchurch, G. R. A novel chronic advanced staged abdominal aortic aneurysm murine model. Journal of Vascular Surgery. 66 (1), 232-242 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados