Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Modèle chirurgical murine de l'élastase topique induit descendant l'aneurysm aortique thoracique
Dans cet article
Résumé
Nous décrivons un protocole chirurgical pour induire uniformément les aneurysms aortiques thoraciques descendants robustes chez les souris. La procédure implique la thoracotomie gauche, l'exposition à l'aorte thoracique, et le placement d'une éponge imbibée d'élastase pancréatique porcine sur la paroi aortique.
Résumé
Selon le Center for Disease Control, les anévrismes aortiques (AA) ont été considérés comme l'une des principales causes de décès dans toutes les races et les deux sexes de 1999 à 2016. Un anévrisme se forme à la suite de l'affaiblissement progressif et de la dilatation éventuelle de l'aorte, qui peut se rompre ou se déchirer une fois qu'elle atteint un diamètre critique. Les anévrismes de l'aorte descendante dans la poitrine, appelés anévrismes aortiques thoraciques descendants (dTAA), constituent une grande proportion des cas d'anévrisme aux États-Unis. La rupture non confinée de dTAA est presque universellement mortelle, et la réparation élective a un taux élevé de morbidité et de mortalité. Le but de notre modèle est d'étudier dTAA spécifiquement, d'élucider la pathophysiologie de dTAA et de rechercher des cibles moléculaires pour arrêter la croissance ou réduire la taille de dTAA. En ayant un modèle murine pour étudier la pathologie thoracique avec précision, des thérapies ciblées peuvent être développées pour tester spécifiquement dTAA. La méthode est basée sur le placement de l'élastase pancréatique porcine (PPE) directement sur la paroi aortique murine externe après exposition chirurgicale. Cela crée une réaction destructrice et inflammatoire, qui affaiblit la paroi aortique et permet la formation d'anévrisme sur des semaines à des mois. Bien que les modèles murins possèdent des limitations, notre modèle dTAA produit des anévrismes robustes de taille prévisible. En outre, ce modèle peut être utilisé pour tester des cibles génétiques et pharmaceutiques qui peuvent arrêter la croissance dTAA ou prévenir la rupture. Chez les patients humains, des interventions comme celles-ci pourraient aider à éviter la rupture de l'anévrisme, et l'intervention chirurgicale difficile.
Introduction
Le but de cette méthode est d'étudier le développement, la pathophysiologie, et les changements structurels dans l'aorte thoracique descendante murine pendant la formation aortique d'anévrisme. Notre modèle offre une méthode reproductible et cohérente pour induire des anévrismes aortiques thoraciques (dTAA) chez la souris permettant ainsi l'essai de divers inhibiteurs génétiques et pharmacologiques. Ces travaux peuvent aider à identifier les médicaments et les thérapies géniques qui pourraient se traduire par une stratégie de traitement viable pour les humains atteints de la maladie d'ATD.
dTAAs se forment lorsque la paroi de l'aorte thoracique s'affaiblit et se dilate au fil du temps jusqu'à atteindre un diamètre critique lors de la déchirure ou la rupture peut alors se produire. Cliniquement, dTAA peut progresser en silence, augmentant en taille jusqu'à ce que la structure de la paroi aortique soit si déformée qu'elle échoue finalement, avec des conséquences catastrophiques. En ce qui concerne, les symptômes ne se développent généralement que lorsque l'anévrisme a atteint une taille périlleuse (100-150% de dilatation) et est à haut risque de dissection ou de rupture1,2. la rupture de dTAAest presque universellement mortelle 3, et la réparation chirurgicale élective porte la morbidité significative4,5. En outre, la plupart des patients portent le diagnostic d'un anévrisme aortique pendant approximativement 5 ans avant la réparation chirurgicale6,7. Cette fenêtre représente un moment opportun pour intervenir non-chirurgicalement. Ainsi, des thérapies médicales pour traiter ou ralentir la progression de dTAA sont nécessaires et représenteraient un avancement significatif au domaine de la recherche d'aneurysm. Il n'existe actuellement aucun traitement médical pour le dTAA disponible, principalement en raison d'une compréhension incomplète de la pathogénie dTAA.
Au cours des 20 dernières années, plusieurs modèles animaux d'ATD ont été développés, mais chacun de ces modèles était distinct des nôtres et ne produisait pas d'anévrismes robustes. Un modèle dTAA murine le plus semblable au nôtre a été développé par Ikonomidis et autres8, qui inclut l'application directe de CaCl2 à l'aventitia de l'aorte. Bien que notre modèle ait été adapté à partir de nombreuses techniques énoncées par Ikonomidis, notre modèle est unique à trois égards distincts. Tout d'abord, dans notre modèle, l'aorte est exposée à l'élastase topique pendant 3-5 minutes, comparativement à 15 minutes d'exposition CaCl 2. Deuxièmement, la dilatation aortique se produit en 2 semaines, comparativement à 16 semaines dans le modèle CaCl 2. Enfin, notre modèle produit systématiquement des anévrismes d'environ 100% de dilatation, par rapport aux dilatations aortiques de 20-30% produites par l'application CaCl2 (qui ne peuvent pas être vraiment considérées comme des anévrismes car elles sont définies comme une augmentation de l'aortique diamètre 'gt;50%). Il y a d'autres modèles murinenons non chirurgicaux de formation d'aneurysm, tels que la souris knock-out d'Apo E, qui forment des aneurysms robustes avec l'infusion de l'angiotensine II. Cependant, ces souris développent des anévrismes aortiques thoraciques supra-rénaux ou ascendants plutôt que des anévrismes spécifiquement dans l'aorte thoracique descendante9,10.
Le rationnel pour ce protocole est d'avoir un moyen simple, peu coûteux, et le temps approprié pour étudier dTAA dans un modèle de murine. Le modèle de souris offre une occasion unique d'utiliser de nombreux KO génétiques et cellulaires spécifiques qui se sont avérés être percutants dans d'autres maladies vasculaires. L'utilisation de notre modèle TAA spécifique a été bien reçue et des expériences l'utilisant ont été publiées dans des revues à fort impact11,12. Jusqu'à ce point, le modèle a été employé pour étudier les traitements génétiques et pharmacologiques possibles qui ont eu un effet significatif dans les modèles auriculaires aortiques abdominaux (AAA) de murine ; cependant, comme notre laboratoire a élargi l'utilisation du modèle dTAA, nous trouvons des cibles uniques à la formation dTAA qui pourraient être utilisés comme thérapies ciblées chez l'homme.
Ce modèle est plus approprié pour les laboratoires qui ont des capacités micro-chirurgicales murines. Bien qu'il soit techniquement difficile, il peut être exécuté uniformément même par des chercheurs sans expérience chirurgicale préalable. Pour un chercheur sans expérience chirurgicale murine, le modèle peut être maîtrisé en une vingtaine de séances opératoires (soit environ 50 souris). Pour le chercheur ayant une expérience chirurgicale antérieure, le modèle peut être maîtrisé en 5 séances opératoires (environ 20 souris). Nous croyons qu'avec une vidéo de haute qualité, le temps de maîtrise peut être encore réduit. Une fois la compétence atteinte, la procédure peut être complétée en 35 minutes pour la chirurgie, et 20 minutes pour la récolte terminale. Les chirurgiens de notre laboratoire peuvent effectuer 10 à 12 chirurgies complètes par jour, avec un taux de mortalité opératoire de 5 à 10 %. La cause la plus fréquente de mortalité est une lésion pulmonaire à l'entrée de la poitrine, une toxicité anesthésique ou une déchirure de l'aorte pendant la dissection. En plus de la recherche dTAA, ce modèle sert également de guide pour un accès sûr et facile à l'aorte thoracique et le hilum pulmonaire pour les chercheurs qui étudient d'autres interventions dans la poitrine.
Protocole
Les protocoles sur les animaux ont été approuvés par le Comité institutionnel de soins et d'utilisation des animaux de l'Université de Virginie (no 3634).
1. Induction de l'anesthésie et de l'intubation
- Placez une souris C57BL/6 mâle de 8-10 semaines dans une chambre fermée avec un flux continu de 5% d'isoflurane et de mélange d'oxygène pendant 5 min, jusqu'à ce que les respirations soient visiblement ralenties.
REMARQUE : Différentes souches, sexes et âges de souris peuvent être utilisés selon le protocole expérimental. Les souris femelles peuvent être plus difficiles à intuber en raison de la plus petite taille et donc des voies respiratoires plus petites. - Intubate la souris telle que décrite par Vandivort et al.13.
REMARQUE : L'étape d'intubation est la partie la plus difficile de ce modèle à apprendre et à effectuer. Les auteurs mentionnés ci-dessus font un excellent travail en expliquant les étapes de leur vidéo.
2. Sécurisant la souris à la carte chirurgicale
- Connectez le tube endotrachéal (ET), confirmez l'élévation de la poitrine et placez la souris en position dedécubitus latérale droite. Tourner l'isoflurane à environ 3% et appliquer la lubrification sur les deux yeux. Le ventilateur doit être réglé pour fournir environ 200 respirations par minute et 225 l de volume de marée.
REMARQUE: La toxicité est rapide si l'isoflurane est laissé à 5%. Cependant, la réponse à l'isoflurane est variable ainsi le taux anesthésique de flux devrait être titré de telle sorte que les contractions diaphragmatiques spontanées se produisent approximativement tous les 10-20 s et l'oxygénation semble proportionnée sur l'inspection des muqueuses et des tissus exposés. - Fixer le tube ET sur la planche avec du ruban adhésif. Étendre le bras droit vers le rosée afin que la patte avant soit en ligne avec le nez et le fixer avec du ruban adhésif.
- Tirez la queue caudally afin de créer une ligne de tension entre le bras droit et la queue, produisant l'extension de la colonne vertébrale.
REMARQUE : La fixation de la queue et de la patte droite en ligne empêche l'insertion ou le délogement du tube ET. - Tapez la jambe gauche dans sa position naturelle. Dessiner le bras gauche ventralement sur la gaze roulée et ruban adhésif vers le bas.
3. Préparation pour la chirurgie
- Raser le flanc gauche de la souris avec des tondeuses électriques de l'épaule gauche à l'abdomen gauche.
- Utilisez un applicateur à pointe de coton pour brosser la solution de bêtadine sur le site chirurgical. Utilisez un nouvel applicateur à pointe de coton pour brosser la solution d'éthanol à 70 % sur le site chirurgical. Laisser sécher. Placer un drapé stérile.
- CAUTION : Assurez-vous que tout l'éthanol est complètement séché avant de procéder à l'utilisation de l'électrocautérisation et peut enflammer l'éthanol.
4. Entrée dans le thorax
- Faire une incision latérale de 1 cm au milieu de l'hémithorax à l'aide de ciseaux chirurgicaux. Utilisez l'électrocautérie portatif pour diviser les couches musculaires jusqu'à ce que les côtes soient visibles.
- Cautérisez directement une portion de 2 mm de la côte.
REMARQUE : Lorsque vous utilisez l'électrocautérisation sur la côte, observez la fréquence respiratoire spontanée. Si la souris a une contraction diaphragmatique pendant la cautérisation, la pointe peut entrer dans le thorax et perforer le poumon, qui est habituellement mortel dans ce modèle. - À l'aide d'un applicateur à bout de coton fin et humide dans l'espace des côtes supérieur à la partie cautérisée, faites pivoter la pointe sur le tissu pour pénétrer dans l'espace pleural. Placer l'éponge humide de 3 mm x 2 mm dans le thorax pour aider à effondrer le poumon.
REMARQUE : Laissez seulement les éponges molles et humides entrer en contact avec le poumon, car il est extrêmement délicat. - Utilisez des ciseaux pour couper le long de l'aspect supérieur de la côte cautérisée, jusqu'à ce que le diaphragme soit visible.
5. Exposition aortique
- Placez les rétracteurs de côtes et utilisez-les pour ouvrir l'incision thoracotomy. Retirez soigneusement l'éponge de la surface du poumon.
- Placer l'éponge humide de 6 mm x 4 mm de sorte qu'elle recouvre le poumon, avec des extrémités pointant vers le rostalement et caudally. Placez le rétracteur pulmonaire (large plat) sur l'éponge et faites glisser doucement le rétracteur ventralement jusqu'à ce que l'aorte thoracique descendante soit exposée.
- Utilisez #7 forceps pour disséquer le tissu conjonctif et la graisse de l'aorte pendant une section d'environ 5 mm.
REMARQUE : De petites veines peuvent courir transversalement à travers l'aorte ; éviter de les déchirer pendant la dissection (en utilisant au moins 14x grossissement peut aider à éviter cette complication).
6. Exposition à l'élastase
- Saturate 0.5 mm x 1 mm éponge avec 12 'L d'élastase pancréatique porcine et placez-le sur la surface exposée de l'aorte.
REMARQUE : Ne laissez pas l'éponge toucher le poumon contralatéral. - Après le temps prédéterminé (généralement 3-5 min), retirer l'éponge d'élastase avec #7 forceps. Retirez le rétracteur pulmonaire. Irriguer la cavité thoracique avec 1 ml de salin stérile.
REMARQUE : Retirez le rétracteur pulmonaire avant l'irrigation avec saline car il permettra à l'éponge pulmonaire de devenir saturée et molle, ce qui facilitera l'enlèvement de la surface du poumon. - Utilisez de la gaze roulée de 2 po x 2 po pour absorber l'irrigation saline restante. Tournez isoflurane à 2%.
7. Fermeture de la poitrine
- Retirer l'éponge pulmonaire. Retirez le rétracteur caudal du poumon. Retirez le rétracteur rostral de poumon.
- Placez 3 sutures interrompues 6-0 non absorbables pour s'opposer aux côtes, attacher un noeud lâche dans chacun, mais ne pas attacher. Prenez grand soin de ne pas toucher le poumon avec l'aiguille de suture.
- Regonfler le poumon en occlolouant le tube de sortie sur ventilateur ou en soufflant rapidement 0,5-1,0 ml d'air à travers le tube ET en utilisant le coq d'arrêt à 3 voies.
REMARQUE : Pour éviter le barotraumatisme, évitez l'utilisation excessive de la seringue remplie d'air et n'utilisez pas plus de 1,0 ml d'air. - Attachez les sutures non absorbables. Réappréorquer les couches musculaires avec une suture multifilament absorbable 5-0 en cours d'exécution. Tournez isoflurane à 1%.
- Fermer la peau avec 7-10 interrompu 5-0 sutures non absorbables. Tourner isoflurane à 0%.
8. Récupération
- Administrer 6 g (0,02 ml d'une suspension de 0,3 mg/mL) de buprénorphine sous-cutanée. Retirez le ruban du pied droit, de la queue et du bras gauche, suivi du ruban adhésif du bras droit.
- Lorsque la souris se déplace extrémités, extubate en tirant par sa queue pour glisser hors du tube ET. Placer dans la chambre plus chaude à haute teneur en oxygène en position de supine.
REMARQUE : Il est sûr de déplacer la souris de la chambre d'oxygène dans la cage quand elle peut se retourner à la position debout normale. En outre, les souris devraient être surveillées pour détecter les signes de douleur, de détresse ou d'incapacité à se développer fréquemment pendant les 24 à 48 premières heures après la chirurgie et fournir des analgésiques supplémentaires ou des aliments mous comme indiqué.
9. Exposition de l'anévrisme aortique (procédure de récolte terminale)
REMARQUE : En général, la récolte de tissus est effectuée à 14 jours, car cela représente la période de dilatation maximale. Toutefois, selon l'expérience, le calendrier de la procédure de récolte peut être effectué à tout moment entre 3 jours et 4 semaines, selon l'expérience.
- Intuber et sécuriser la souris au champ opératoire tel que décrit ci-dessus (sections 1-3). Utilisez des ciseaux pour inciser la peau médialement du flanc gauche à l'abdomen central en prenant soin de ne pas entrer dans le péritoine.
- Inciser la peau du flanc gauche dorsal rostalement au niveau de l'épaule gauche. Puis incise à un angle de 90 degrés à travers l'axilla au sternum.
REMARQUE : Cette incision devrait encercler complètement l'incision originale de peau. - À l'aide de la cautérisation, disséquer le rabat cutané vers l'aspect ventral de la souris, exposant l'hémithorax gauche. Utilisez des ciseaux pour entrer dans l'abdomen et inciser le long de la marge costale gauche de ventrale à dorsal pour exposer le dessous du diaphragme gauche. Le bord latéral le plus du diaphragme peut s'ouvrir ce qui est désiré.
- S'il n'est pas créé avec l'étape précédente, inciser le diaphragme à son bord le plus latéral. Placer la pointe de la cautérisation dans ce trou et cautériser le diaphragme hors de la marge costale au processus xyphoïde. À l'aide d'un applicateur à pointe de coton à pointe fine humide, libérer délicatement le poumon des adhérences à la paroi thoracique et pousser les poumons médially.
REMARQUE : Si les adhérences ne se détachent pas facilement de la paroi thoracique, utilisez la cautérisation pour les enlever; ce faisant aide à éviter de déchirer le poumon qui peut causer des saignements lourds. - Cauteriser l'intérieur de la paroi thoracique de la nervure une à la marge costale, dorsale à la ligne axillaire moyenne, mais au moins 2 mm de l'aorte. Couper la paroi thoracique le long de la ligne cautérisée.
REMARQUE : Cette technique évite les saignements des artères intercostales. - Couper le long de la marge supérieure de la nervure un, puis caudally le long du bord latéral du sternum, en enlevant la cage thoracique gauche. Placez les rétracteurs sur le poumon et tirez médially. Placez le rétracteur sur le diaphragme et dessinez caudally pour exposer autant d'aorte que possible.
- Utilisez un applicateur à pointe de coton sèche pour enlever les adhérences de l'anévrisme aortique et d'un segment distal inchangé. Mesurez le diamètre du segment témoin non affecté et la partie la plus large de l'anévrisme traité par élastase à l'aide de la micrométrie vidéo.
REMARQUE : Les mesures de micrométrie vidéo sont utilisées pour calculer la dilatation en pourcentage du segment anévrisme par rapport à un segment de contrôle avec l'équation 1. Un segment de contrôle qui est distal de 0,5 mm au segment aneurysmal 1 est sélectionné.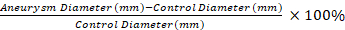 Équation 1
Équation 1
- Saisissez l'aorte avec des forceps harms, juste distal au segment traité. Utilisez des ciseaux pour couper le distal aux forceps, puis disséquez l'aorte de la colonne vertébrale. Couper l'aorte proximal au segment traité et enlever l'aorte anévrismale.
- À l'aide d'une seringue et d'une aiguille de tuberculine, laver le lumen aortique avec du tissu salin et traiter le tissu comme désiré.
Résultats
L'application de notre protocole se traduit par un dTAA robuste chez la souris par rapport aux contrôles salins. Les AAT développés sont de forme fusiforme et ne se produisent que dans la partie traitée de l'aorte (Figure 1 et Figure 2)11. La figure 2 montre un exemple de mesure vidéo de micrométrie à la récolte des tissus. En utilisant l'équation 1, la dilatation aortique est de 130% dans cet exempl...
Discussion
L'aorte thoracique et abdominale sont cellulairement et embryologiquement distinctes, ce qui est pertinent pour la maladie anévrismale14,15,16. Par conséquent, un modèle animal spécifique pour étudier tAA est nécessaire. Bien que d'autres modèles dTAA murine ont été publiés8, le nôtre est le seul modèle à créer la dilatation aortique thoracique descendante qui peut être considéré comme vr...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Ces travaux ont été appuyés par la subvention de développement scientifique 14SDG18730000 (M.S.), les subventions NIH K08 HL098560 (G.A.) et RO1 HL081629 (G.R.U.). Ce projet a été soutenu par la Subvention de recherche de la Fondation de chirurgie thoracique pour la recherche et l'éducation (TSFRE) (PI : G. Ailawadi). Le contenu est uniquement de la responsabilité des auteurs et ne représente pas nécessairement les points de vue de l'NHLBI ou du TSFRE. Nous remercions Anthony Herring et Cindy Dodson pour leurs connaissances et leur expertise technique.
matériels
| Name | Company | Catalog Number | Comments |
| Angiocatheter (22G) | Used for ET Tube | ||
| Dumont Tweezers; Pattern #7 x2 | Roboz | RS-4982 | |
| Graefe Tissue Forceps | Roboz | RS-5158 | |
| Harms Forceps x2 | Roboz | RS-5097 | |
| Intracardiac Needle Holder; Extra Delicate; Carbide Jaws; 7" Length | Roboz | RS-7800 | |
| KL 1500 LED Light Source | Leica | 150-400 | |
| M205A Dissction Microscope | Leica | CH 94-35 | |
| Iris Scissors, 11cm, Tungsten Carbide | World Precision Instruments | 500216-G | |
| Metal Clip board | Use with the Mouse Retractor Set | ||
| Mouse Retractor Set | Kent | SURGI-5001 | Need 2 short and 1 tall fixators |
| Mouse Ventilator MiniVent Type 845, 115 V, Power Supply with US Connector | Harvard Apparatus | 73-0043 | MiniVent Ventilator for Mice (Model 845), Single Animal, Volume Controlled |
| Sigma Aldrich | Elastase from porcine pancreas | E0258-50MG | Can be purchased in various size bottles |
| Small Vessel Cauterizer Kit | Fine Science Tools | 18000-00 | Recommend using rechargable AA batteries |
| Spring Scissors, 10.5cm | World Precision Instruments | 14127 | |
| Steril Swabs (Sponges) | Sugi | 31603 | Can be cut to size |
| Surgi Suite Surgical Platform | Kent | Attach to clip board | |
| Tech IV Isoflurane Vap | Jorgensen Laboratories | J0561A | Anesthesia vaporizer |
Références
- Coady, M. A., et al. What is the appropriate size criterion for resection of thoracic aortic aneurysms. Journal of Thoracic and Cardiovascular Surgery. 113 (3), 489-491 (1997).
- Aggarwal, S., Qamar, A., Sharma, V., Sharma, A. Abdominal aortic aneurysm: A comprehensive review. Experimental and Clinical Cardiology. 16 (1), 11-15 (2011).
- Bickerstaff, L. K., et al. Thoracic aortic aneurysms: a population-based study. Surgery. 92 (6), 1103-1108 (1982).
- Cheng, D., et al. Endovascular aortic repair versus open surgical repair for descending thoracic aortic disease a systematic review and meta-analysis of comparative studies. Journal of the American College of Cardiology. 55 (10), 986-1001 (2010).
- Walsh, S. R., et al. Endovascular stenting versus open surgery for thoracic aortic disease: systematic review and meta-analysis of perioperative results. Journal of Vascular Surgery. 47 (5), 1094-1098 (2008).
- Absi, T. S., et al. Altered patterns of gene expression distinguishing ascending aortic aneurysms from abdominal aortic aneurysms: complementary DNA expression profiling in the molecular characterization of aortic disease. The Journal of Thoracic and Cardiovascular Surgery. 126 (2), 344-357 (2003).
- Ailawadi, G., Eliason, J. L., Upchurch, G. R. Current concepts in the pathogenesis of abdominal aortic aneurysm. Journal of Vascular Surgery. 38 (3), 584-588 (2003).
- Ikonomidis, J. S., et al. A murine model of thoracic aortic aneurysms. Journal of Surgical Research. 115 (1), 157-163 (2003).
- Daugherty, A., Manning, M. W., Cassis, L. A. Angiotensin II promotes atherosclerotic lesions and aneurysms in apolipoprotein E-deficient mice. Journal of Clinical Investigation. 105 (11), 1605-1612 (2000).
- Trachet, B., et al. Ascending Aortic Aneurysm in Angiotensin II-Infused Mice: Formation, Progression, and the Role of Focal Dissections. Arteriosclerosis, Thrombosis, and Vascular Biology. 36 (4), 673-681 (2016).
- Johnston, W. F., et al. Inhibition of interleukin-1beta decreases aneurysm formation and progression in a novel model of thoracic aortic aneurysms. Circulation. 130 (11), 51-59 (2014).
- Pope, N. H., et al. Interleukin-6 Receptor Inhibition Prevents Descending Thoracic Aortic Aneurysm Formation. Annals of Thoracic Surgery. 100 (5), 1620-1626 (2015).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771 (2016).
- Ailawadi, G., et al. A nonintrinsic regional basis for increased infrarenal aortic MMP-9 expression and activity. Journal of Vascular Surgery. 37 (5), 1059-1066 (2003).
- Ruddy, J. M., Jones, J. A., Spinale, F. G., Ikonomidis, J. S. Regional heterogeneity within the aorta: relevance to aneurysm disease. Journal of Thoracic and Cardiovascular Surgery. 136 (5), 1123-1130 (2008).
- Trigueros-Motos, L., et al. Embryological-origin-dependent differences in homeobox expression in adult aorta: role in regional phenotypic variability and regulation of NF-kappaB activity. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (6), 1248-1256 (2013).
- Lu, G. S. G., Davis, J. P., Schaheen, B., Downs, E., Roy, R. J., Ailawadi, G., Upchurch, G. R. A novel chronic advanced staged abdominal aortic aneurysm murine model. Journal of Vascular Surgery. 66 (1), 232-242 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon