A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
המודל הכירורגי של מורנה של Elastase אקטואלי המושרה מפרצת אבי העורקים החזי
In This Article
Summary
אנו מתארים פרוטוקול כירורגי כדי לגרום בעקביות בירידה חזקה בבית החזה של אבי העורקים בעכברים. ההליך כולל כריתת האונה השמאלית, החשיפה של אבי העורקים החזה, ומיקום של ספוג ספוגה הלבלב לבלב חזירי על הקיר של אבי העורקים.
Abstract
על פי המרכז לבקרת מחלות, מחלת אבי העורקים (AAs) נחשבו לגורם מוביל של מוות בכל הגזעים ובשני המינים מ-1999-2016. צורות מפרצת כתוצאה של היחלשות מתקדמת ובסופו של דבר התרחבות של העורקים, אשר יכול קרע או דמעה ברגע שהוא מגיע לקוטר קריטי. מפרצות של אבי העורקים היורדים בחזה, שנקרא בירידה בdTAA של אבי העורקים הבית החזה (ב), לפצות על חלק גדול של מקרים מפרצת בארצות הברית. הקרע dTAA uncontained הוא קטלני כמעט אוניברסלית, ותיקון בחירה יש שיעור גבוה של תחלואה ותמותה. מטרת המודל שלנו היא ללמוד dTAA באופן ספציפי, כדי להבהיר את הפתופסיולוגיה של dTAA ולחפש מטרות מולקולריות כדי לעצור את הצמיחה או להקטין את הגודל של dTAA. על ידי בעל מודל murine ללמוד מחלות בבית החזה בדיוק, טיפולים ייעודיים ניתן לפתח כדי לבדוק במיוחד dTAA. השיטה מבוססת על המיקום של חזירי הלבלב elastase (PPE) ישירות על קיר אבי העורקים החיצוני murine לאחר חשיפה כירורגית. זה יוצר תגובה הרסנית דלקתית, אשר מחליש את חומת אבי העורקים ומאפשר היווצרות מפרצת במשך שבועות עד חודשים. למרות מודלים murine בעלי מגבלות, מודל dTAA שלנו מייצרת מפרצות חזקות של גודל צפוי. יתר על כן, מודל זה יכול לשמש כדי לבדוק מטרות גנטיות ותרופות אשר עלול לעצור את הצמיחה dTAA או למנוע קרע. בחולים אנושיים, התערבויות כגון אלה יכולים למנוע קרע מפרצת, והתערבות כירורגית קשה.
Introduction
המטרה של שיטה זו היא ללמוד את ההתפתחות, פתופסולוגיה, ושינויים מבניים מורטין יורד העורקים החזי במהלך היווצרות מפרצת אבי העורקים. המודל שלנו מציע שיטה מיותרת ועקבית כדי לגרום לטרשת העורקים הבית החזה (dTAA) בעכברים ובכך מאפשר בדיקות של מעכבי גנטיים ופרמקוקולוגי שונים. העבודה הזאת יכולה לעזור לזהות תרופות גן-טיפולים אשר יכול להיות מתורגם לאסטרטגיה הטיפול קיימא עבור בני אדם עם מחלת dTAA.
dTAAs טופס כאשר הקיר של העורקים של בית החזה הופך נחלש ומדיטים לאורך זמן עד להגיע לקוטר קריטי כאשר קרע או קרע יכול להתרחש לאחר מכן. קלינית, dTAA יכול להתקדם בשתיקה, הגדלת גודל עד מבנה של קיר אבי העורקים הוא כל כך מעוות, כי בסופו של דבר נכשל, עם השלכות קטסטרופיות. בדרך כלל, התסמינים מתפתחים רק כאשר המפרצת הגיעה לגודל מסוכן (100-150% התרחבות) והוא נמצא בסיכון גבוה לניתוח או קרע1,2. dTAA הקרע הוא כמעט ואוניברסלי קטלני3, ותיקון כירורגי בחירה נושאת תחלואה משמעותית4,5. יתר על כן, רוב המטופלים לשאת את האבחנה של מפרצת אבי העורקים במשך כ 5 שנים לפני תיקון כירורגי6,7. חלון זה מייצג זמן המתאים להתערבות לא-בניתוח. לכן, טיפולים רפואיים לטיפול או התקדמות איטית של dTAA נחוצים ומייצגים התקדמות משמעותית לתחום מחקר מפרצת. אין כרגע טיפולים רפואיים עבור dTAA זמין, בעיקר בגלל הבנה לא מלאה של dTAA פתוגנזה.
במהלך 20 השנים האחרונות פותחו מספר דגמים של בעלי חיים dTAA, אך כל אחד מהמודלים האלה היה ברור משלנו ולא הפיק מפרצות חזקות. מודל dTAA murine דומה ביותר לשלנו פותחה על ידי Ikonomidis ואח '8, הכולל יישום ישיר של cacl2 אל האדוידטיה של העורקים. למרות שהמודל שלנו הותאם רבים של טכניקות שנקבעו על ידי Ikonomidis, המודל שלנו הוא ייחודי בשלוש דרכים נפרדות. ראשית, במודל שלנו את העורקים נחשפת elastase אקטואלי עבור 3-5 דקות, לעומת 15 דקות של החשיפה CaCl2 . שנית, התרחבות אבי העורקים מתרחשת בתוך 2 שבועות, לעומת 16 שבועות במודל CaCl2 . אחרון, המודל שלנו בעקביות מייצרת באופן עקבי של כ 100% dilatation, לעומת הדיזות אבי העורקים של 20-30% המיוצר על ידי היישום CaCl2 (אשר לא יכול להיחשב באמת מוגדר כפי שהם מוגדרים כגידול באבי העורקים קוטר > 50%). ישנם מודלים אחרים של מורטין שאינם כירורגיים של היווצרות מפרצת, כגון עכבר הנוק-אאוט של Apo, אשר יוצרים מפרצות חזקות עם עירוי של אנגיוטנסין II. עם זאת, עכברים אלה לפתח את-הכליות או לסדר את מערך העורקים החזי במקום באופן ספציפי במיוחד בתוך האבי העורקים היורדים9,10.
הרציונלי עבור פרוטוקול זה הוא להיות פשוט, זול, הדרך המתאימה הזמן ללמוד dTAA במודל murine. מודל העכבר מספק הזדמנות ייחודית לנצל מספר רב של הסתרה גנטית ותא ספציפיים כי נמצאו להיות מאריכות במחלות כלי דם אחרים. השימוש במודל TAA הספציפי שלנו התקבל היטב וניסיונות ניצול זה פורסמו בכתבי עת השפעה גבוהה11,12. לנקודה זו, המודל נעשה שימוש כדי לחקור טיפולים גנטיים ופרמקוקולוגי אפשרי כי היה השפעה משמעותית במפרצת הבטן הבטני (AAA) מורטין מודלים; עם זאת, כמו המעבדה שלנו הרחיבה את השימוש במודל dTAA, אנחנו מוצאים מטרות ייחודיות dTAA היווצרות אשר יכול לשמש כטיפולים ייעודיים בבני אדם.
מודל זה מתאים ביותר עבור מעבדות בעלות יכולות מיקרו-כירורגיות של מורטין. למרות שזה מאתגר טכנית, זה יכול להתבצע בעקביות גם על ידי חוקרים ללא ניסיון כירורגי קודם. עבור חוקר ללא ניסיון כירורגי murine המודל יכול להיות שולט כ 20 הפעלות אופרטיבית (או כ 50 עכברים). עבור החוקר עם ניסיון כירורגי קודם, המודל יכול להיות שולט 5 הפעלות אופרטיבית (כ 20 עכברים). אנו מאמינים בווידאו באיכות גבוהה, הזמן לשליטה יכול להיות מופחת עוד יותר. לאחר השגת מיומנות, ההליך ניתן להשלים ב 35 דקות לניתוח, ו 20 דקות למסיק הטרמינל. המנתחים במעבדה שלנו יכולים להשלים 10-12 ניתוחים מלאים ליום, עם שיעור תמותה פעיל של 5-10%. הגורם השכיח ביותר לתמותה הוא פציעה בריאה עם כניסה לחזה, רעילות הרדמה, או קרע של העורקים במהלך הניתוח. בנוסף למחקר dTAA, מודל זה משמש גם מדריך לגישה בטוחה וקלה העורקים הבית החזה וריאות hilum עבור החוקרים ללמוד התערבויות אחרות בחזה.
Access restricted. Please log in or start a trial to view this content.
Protocol
פרוטוקולי בעלי חיים אושרו על ידי הוועדה לטיפול בבעלי חיים מוסדיים באוניברסיטת וירג (No. 3634).
1. אינדוקציה של הרדמה וצנרור
- מ8-10 ניחים עכבר C57BL/6 גבר בן שבוע בחדר סגור עם זרימה רציפה של 5% isof ane ותערובת חמצן עבור 5 דקות, עד הנשימות הם בעליל האטה.
הערה: זנים שונים, מינים וגילאים של עכברים ניתן להשתמש בהתאם לפרוטוקול ניסיוני. עכברים נקבה עלול להיות קשה יותר לצנרור בגלל גודל קטן יותר ולכן יותר קל נשימה. - צנרור את העכבר כפי שמתואר על ידי ואנדיבורט ואח '13.
הערה: צעד הצנרור הוא החלק הקשה ביותר של מודל זה כדי ללמוד ולבצע. המחברים הנ ל לעשות עבודה מצוינת להסביר את השלבים בווידאו שלהם.
2. אבטחת העכבר על הלוח הכירורגי
- לחבר את הצינור האנדוקנה (ET), לאשר עליית החזה, ולהטיל את העכבר בתנוחה הימנית לרוחב. הפעל את isof, כדי כ 3% להחיל שימון על שתי העיניים. המאוורר צריך להיות מוגדר כדי לספק כ 200 נשימות לדקה ו 225 μL של נפח הגאות.
הערה: רעילות מהירה אם מדובר בחמישה אחוזים. עם זאת, תגובה isof, משתנה כך שיעור זרימת הרדמה צריך להיות טיטרציה כגון התכווצויות סרמטיות ספונטנית להתרחש בקירוב כל 10-20 s ו חמצן מופיע הולם על בדיקה של קרום רירי ורקמות חשופות. - אבטח את שפופרת ה-ET ללוח באמצעות קלטת. להאריך את הזרוע הימנית rostrally כך כפה הקדמי הוא בקנה אחד עם האף ולאבטח אותו עם קלטת.
- משוך את הזנב במקום כדי ליצור קו של מתח בין הזרוע הימנית והזנב, בהפקת הארכה של עמוד השדרה.
הערה: אבטחת שני הזנב והכפה הימנית בקו מונעות מעל ההכנסה או הdislodgement של צינור ה-ET. - הקלטת את הרגל השמאלית. במיקומה הטבעי משוך את הזרוע השמאלית והוא מעל גזה התגלגל והקלטת למטה.
3. הכנה לניתוח
- לגלח את האגף השמאלי של העכבר עם קוצץ חשמלי מהכתף השמאלית לבטן שמאל.
- השתמש במוליך כותנה כדי לצחצח. את פתרון הבטאדין באתר הכירורגי השתמש המוליך כותנה חדשה משופעת להבריש 70% אתנול פתרון דרך האתר כירורגי. . הרשי לי להתייבש . מניחים את העטוף הסטרילי
- התראה: ודא כי כל אתנול הוא יבש לחלוטין לפני הליך כמו אלקטרוקאולטרי משמש והוא יכול להצית את האתנול.
4. כניסה לתוך החזה
- הפוך חתך רוחב 1 ס מ באמצע החזה באמצעות מספריים כירורגיים. השתמש אלקטרוקאולטרי כף-יד כדי לחלק שכבות שריר עד הצלעות גלויות.
- מצרוב במישרין חלק של 2 מ"מ מהצלע.
הערה: כאשר משתמשים באלקטרוקובלטרי על הצלע, שימו לב לתדר הנשימה הספונטני. אם העכבר יש התכווצות במהלך הכניסה, הקצה יכול להיכנס לבית החזה לנקב את הריאה, אשר בדרך כלל קטלנית במודל זה. - באמצעות מואביק, בסדר משופעת כותנה המוליך בחלל הצלעות מעולה על החלק הצרוב, לסובב את הקצה על הרקמה כדי לפרוץ לתוך החלל הפלסטריאל. מניחים את הספוג 3 מ"מ x 2 מ"מ לתוך בית החזה כדי לעזור לכווץ את הריאה.
הערה: רק תן רך, רטוב, ספוגים לריאות עם הריאה מאוד עדין. - השתמשו במספריים כדי לחתוך לאורך ההיבט העליון של הצלע הקאומיזציה, עד שהסרעפת תהיה גלויה.
5. חשיפת אבי העורקים
- הניחו את הצלעות מחדש והשתמשו בהם כדי לפתוח את חתך האונה. הסירו בזהירות את הספוג מהמשטח של הריאה.
- מניחים את הספוג 6 מ"מ x 4 מ"מ, כך שהוא מניח את כיסוי הריאה, עם מסתיים הצבעה rostrally ומלא. מניחים את (רחב שטוח) הריאות מפסק על הספוג ולהחליק בעדינות את ברית המפטרל עד העורקים היורדים בית החזה נחשף.
- השתמש מלקחיים #7 כדי לנתח את רקמת החיבור ושומן את העורקים עבור סעיף בקירוב 5 מ"מ.
הערה: הורידים הקטנים עשויים לפעול בצורה מועטה לאורך העורקים; להימנע קורע אותם במהלך החיתוך (באמצעות לפחות 14x ההגדלה יכול לעזור למנוע סיבוך זה).
6. חשיפה לזיסטסה
- רוויה 0.5 mm x 1 מ"מ ספוג עם 12 μl של חזירי הלבלב elastase ומניחים אותו על פני השטח החשוף של העורקים.
הערה: אל תתנו לספוג לגעת בריאה הצלעות. - לאחר הזמן הנקבע מראש (בדרך כלל 3-5 דקות), להסיר את הספוג elastase עם מלקחיים #7. . תסיר את מפסק הריאה להשקפה את חלל החזה. עם 1 מ ל של תמיסת מלח סטרילית
הערה: הסר את מפסק הריאה לפני השקיה עם תמיסת מלח כפי שהיא תאפשר ספוג הריאה להיות רווי ורך, מה שהופך את זה קל יותר להסיר מהמשטח של הריאה. - השימוש מתגלגל 2 "x 2" גזה לקלוט את השקיה מלוחים שנותרו. . בסדר.
7. סגירת החזה
- . תסיר את ספוג הריאה . הסר את מפסק הריאה קאודל . תסיר את מפסק הריאות הrostral
- מקום 3 נקטע 6-0 התפרים שאינם נספגים להתנגד לצלעות, לקשור קשר רופף בכל אחד אבל לא לקשור. הטיפול הגדול לא לגעת בריאה עם מחט תפר.
- לנפח את הריאה מחדש על ידי הסגר את צינור האוורור על המאוורר או על ידי פיצוץ במהירות 0.5-1.0 mL של אוויר דרך צינור ה-ET על ידי ניצול התרנגול 3 הדרך לעצור.
הערה: כדי למנוע בארוטראומה, הימנע משימוש מוגזם במזרק שמולא באוויר, והשתמש ביותר מ-1.0 mL של אוויר. - לקשור תפרים לא נספגים. משוער את שכבות השריר עם מפעיל 5-0 תפר מרובה. . בסדר.
- העור הסגור עם 7-10 הפריעו ל-5-0 תפרים שאינם נספגים. . בסדר.
8. שחזור
- מנהל 6 μg (0.02 mL של 0.3 mg/mL השעיה) של buתת-עורי, בוקנורטין. הסר את הקלטת מהרגל הימנית, הזנב והזרוע השמאלית ואחריו את הקלטת הימנית.
- כאשר העכבר נע בגפיים, מחליק על-ידי משיכת אותו בזנבו כדי להחליק מצינור ה-ET. מקום בחדר החמים התוכן חמצן גבוה במצב פרקדן.
הערה: בטוח להזיז את העכבר מחדר החמצן לכלוב כאשר הוא יכול להפוך את עצמו למצב עמידה נורמלי. יתר על כן, עכברים צריכים להיות מנוטרים על סימנים של כאב, מצוקה, או כישלון לשגשג לעתים קרובות על 24-48 שעות הראשון לאחר הניתוח וסיפק כאבים נוספים או מזון רך כפי שצוין.
9. חשיפת מפרצת אבי העורקים (מסוף הליך הקציר)
הערה: באופן כללי, קציר הרקמה מתבצע ב -14 ימים, משום שהוא מייצג את תקופת הדיגנציה המקסימלית. עם זאת, בהתאם לניסוי, התזמון תהליך הקציר יכול להתבצע בכל עת בין 3 ימים ו 4 שבועות, בהתאם לניסוי.
- צנרור ועכבר מאובטח לשדה פעיל כמתואר לעיל (סעיפים 1-3). השימוש במספריים כדי מדיום העור באופן מיידי מהאגף השמאלי לבטן המרכזית מטפלת לא להיכנס צפק.
- . עד לרמת הכתף השמאלית ואז באמצע זווית 90 מעלות דרך האקליה לעצם החזה.
הערה: החתך הזה צריך להקיף לחלוטין את חתך העור המקורי. - באמצעות הקאטרי, מנתח העור הכנף לכיוון ההיבט הגחוני של העכבר, חשיפת האונה השמאלית. השתמש במספריים כדי להזין את הבטן ואת הזמן לאורך השוליים הקוסטל השמאלי מתוך הגעד הראש כדי לחשוף את החלק התחתון של הסרעפת השמאלית. הקצה הרוחבי ביותר של הסרעפת עשוי להיפתח אשר רצוי.
- אם לא נוצר עם הצעד הקודם, לשלב את הסרעפת בקצה הרוחבי ביותר שלה. מקום קצה של בית בחור זה ומצרוב את הסרעפת מחוץ לשולי הקוסטל לתהליך xyphoid. באמצעות כותנה משופעת לח משופעת המוליך, בעדינות לשחרר את הריאה מתוך הידבולים לקיר החזה ולדחוף את הריאה medially.
הערה: אם האדסיות לא בקלות יורד מהקיר בחזה, השתמש בקאטרי כדי להסיר אותם; פעולה זו תסייע להימנע מקריעת הריאה שעלולה לגרום לדימום כבד. - לצרוב את החלק הפנימי של קיר החזה מצלע 1 אל השוליים הקוסטל, מראש לקו הביניים באמצע, אבל לפחות 2 מ"מ מן העורקים. חותכים את קיר החזה לאורך הקו הצרוב.
הערה: טכניקה זו נמנעת מדימום מעורקי האינטרקוסטל. - חותכים לאורך השוליים העליונים של צלע 1 ולאחר מכן מסלק לאורך הקצה לרוחב של עצם החזה, הסרת כלוב הצלעות השמאלית. מניחים את הטרקטורים על הריאה ומשכו מדיום. לשים מפסק על הסרעפת ולצייר כדי לחשוף את העורקים כמה שאפשר.
- כדי להסיר את הידקויות ממפרצת. באבי העורקים ומקטע לא מושפע למדוד את קוטר של מקטע שליטה מושפע ואת החלק הרחב ביותר של מפרצת elastase מטופלים באמצעות מיקרומטר וידאו.
הערה: המדידות מיקרומטר וידאו משמשות כדי לחשב את התארכות האחוזים של הקטע האנאוריאני לעומת מקטע בקרה עם משוואה 1. קטע שליטה שהוא 0.5 מ"מ מילימטר למקטע האנאוריפרי 1 נבחר.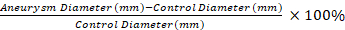 משוואה 1
משוואה 1
- , תפוס את העורקים עם מלקחיים מזיק. רק מדיוק לקטע המטופל ואז לנתח את העורקים. מחוץ לעמוד השדרה לחתוך את העורקים האבומתי לקטע מטופלים ולהסיר העורקים.
- באמצעות טוברקולב מזרק ומחט, לשטוף את לומן אבי העורקים עם מלוחים ורקמות התהליך כרצונך.
Access restricted. Please log in or start a trial to view this content.
תוצאות
היישום של הפרוטוקול שלנו תוצאות dTAA חזק בעכברים לעומת שולטת מלוחים. TAAs פיתח הם כישורי צורה ומתרחשים רק בחלק המטופל של העורקים (איור 1 ואיור 2)11. איור 2 מראה דוגמה של וידאו micrometry מדידה בקציר רקמות. באמצעות משוואה 1, התרחבות אבי העורק?...
Access restricted. Please log in or start a trial to view this content.
Discussion
את החזה ואת העורקים הבטן הם תאית ו embryologically נפרדות, אשר רלוונטי מחלת אנאאולי14,15,16. לכן, יש צורך במודל בעלי חיים ספציפי ללימוד TAA. למרות מודלים murine dTAA אחרים פורסמו8, שלנו היא המודל היחיד כדי ליצור בירידה האבי העורקים רחבה אשר יכול...
Access restricted. Please log in or start a trial to view this content.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
עבודה זו נתמכת על ידי המלגה לפיתוח המדען AHA 14SDG18730000 (טרשת נפוצה), NIH K08 HL098560 (G.A.) ו RO1 HL081629 (G.R.U.) מענקים. פרויקט זה נתמך על ידי קרן כירורגיה של החזה למחקר וחינוך (TSFRE) מענק מחקר (PI: G. Ailawadi). התוכן הוא אך ורק באחריות המחברים ואינו מייצג בהכרח את ההשקפות של NHLBI או את TSFRE. אנו מודים לאנתוני הרינג וסינדי דודסון על הידע שלהם ועל מומחיותם הטכנית.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| Angiocatheter (22G) | Used for ET Tube | ||
| Dumont Tweezers; Pattern #7 x2 | Roboz | RS-4982 | |
| Graefe Tissue Forceps | Roboz | RS-5158 | |
| Harms Forceps x2 | Roboz | RS-5097 | |
| Intracardiac Needle Holder; Extra Delicate; Carbide Jaws; 7" Length | Roboz | RS-7800 | |
| KL 1500 LED Light Source | Leica | 150-400 | |
| M205A Dissction Microscope | Leica | CH 94-35 | |
| Iris Scissors, 11cm, Tungsten Carbide | World Precision Instruments | 500216-G | |
| Metal Clip board | Use with the Mouse Retractor Set | ||
| Mouse Retractor Set | Kent | SURGI-5001 | Need 2 short and 1 tall fixators |
| Mouse Ventilator MiniVent Type 845, 115 V, Power Supply with US Connector | Harvard Apparatus | 73-0043 | MiniVent Ventilator for Mice (Model 845), Single Animal, Volume Controlled |
| Sigma Aldrich | Elastase from porcine pancreas | E0258-50MG | Can be purchased in various size bottles |
| Small Vessel Cauterizer Kit | Fine Science Tools | 18000-00 | Recommend using rechargable AA batteries |
| Spring Scissors, 10.5cm | World Precision Instruments | 14127 | |
| Steril Swabs (Sponges) | Sugi | 31603 | Can be cut to size |
| Surgi Suite Surgical Platform | Kent | Attach to clip board | |
| Tech IV Isoflurane Vap | Jorgensen Laboratories | J0561A | Anesthesia vaporizer |
References
- Coady, M. A., et al. What is the appropriate size criterion for resection of thoracic aortic aneurysms. Journal of Thoracic and Cardiovascular Surgery. 113 (3), 489-491 (1997).
- Aggarwal, S., Qamar, A., Sharma, V., Sharma, A. Abdominal aortic aneurysm: A comprehensive review. Experimental and Clinical Cardiology. 16 (1), 11-15 (2011).
- Bickerstaff, L. K., et al. Thoracic aortic aneurysms: a population-based study. Surgery. 92 (6), 1103-1108 (1982).
- Cheng, D., et al. Endovascular aortic repair versus open surgical repair for descending thoracic aortic disease a systematic review and meta-analysis of comparative studies. Journal of the American College of Cardiology. 55 (10), 986-1001 (2010).
- Walsh, S. R., et al. Endovascular stenting versus open surgery for thoracic aortic disease: systematic review and meta-analysis of perioperative results. Journal of Vascular Surgery. 47 (5), 1094-1098 (2008).
- Absi, T. S., et al. Altered patterns of gene expression distinguishing ascending aortic aneurysms from abdominal aortic aneurysms: complementary DNA expression profiling in the molecular characterization of aortic disease. The Journal of Thoracic and Cardiovascular Surgery. 126 (2), 344-357 (2003).
- Ailawadi, G., Eliason, J. L., Upchurch, G. R. Current concepts in the pathogenesis of abdominal aortic aneurysm. Journal of Vascular Surgery. 38 (3), 584-588 (2003).
- Ikonomidis, J. S., et al. A murine model of thoracic aortic aneurysms. Journal of Surgical Research. 115 (1), 157-163 (2003).
- Daugherty, A., Manning, M. W., Cassis, L. A. Angiotensin II promotes atherosclerotic lesions and aneurysms in apolipoprotein E-deficient mice. Journal of Clinical Investigation. 105 (11), 1605-1612 (2000).
- Trachet, B., et al. Ascending Aortic Aneurysm in Angiotensin II-Infused Mice: Formation, Progression, and the Role of Focal Dissections. Arteriosclerosis, Thrombosis, and Vascular Biology. 36 (4), 673-681 (2016).
- Johnston, W. F., et al. Inhibition of interleukin-1beta decreases aneurysm formation and progression in a novel model of thoracic aortic aneurysms. Circulation. 130 (11), Suppl 1 51-59 (2014).
- Pope, N. H., et al. Interleukin-6 Receptor Inhibition Prevents Descending Thoracic Aortic Aneurysm Formation. Annals of Thoracic Surgery. 100 (5), 1620-1626 (2015).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771(2016).
- Ailawadi, G., et al. A nonintrinsic regional basis for increased infrarenal aortic MMP-9 expression and activity. Journal of Vascular Surgery. 37 (5), 1059-1066 (2003).
- Ruddy, J. M., Jones, J. A., Spinale, F. G., Ikonomidis, J. S. Regional heterogeneity within the aorta: relevance to aneurysm disease. Journal of Thoracic and Cardiovascular Surgery. 136 (5), 1123-1130 (2008).
- Trigueros-Motos, L., et al. Embryological-origin-dependent differences in homeobox expression in adult aorta: role in regional phenotypic variability and regulation of NF-kappaB activity. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (6), 1248-1256 (2013).
- Lu, G. S. G., Davis, J. P., Schaheen, B., Downs, E., Roy, R. J., Ailawadi, G., Upchurch, G. R. A novel chronic advanced staged abdominal aortic aneurysm murine model. Journal of Vascular Surgery. 66 (1), 232-242 (2017).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved