Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Murine chirurgisches Modell der topischen Elastase induzierte absteigende Thorax Aortenaneurysm
In diesem Artikel
Zusammenfassung
Wir beschreiben ein chirurgisches Protokoll, um bei Mäusen konsequent robuste absteigende thorakale Aortenaneurysmen zu induzieren. Das Verfahren beinhaltet linke Thorakotomie, thorakale Aorta-Exposition und Platzierung eines Schwamms, der in schweinepankreasischer Elastase auf der Aortenwand getränkt ist.
Zusammenfassung
Nach Angaben des Center for Disease Control wurden Aortenaneurysmen (AAs) von 1999 bis 2016 in allen Rassen und beibeiden Geschlechtern als eine der Haupttodesursachen angesehen. Ein Aneurysmus bildet sich als Folge der fortschreitenden Schwächung und eventuellen Erweiterung der Aorta, die brechen oder reißen kann, sobald sie einen kritischen Durchmesser erreicht. Aneurysmen der absteigenden Aorta in der Brust, genannt absteigende thorakale Aortenaneurysmen (dTAA), machen einen großen Teil der Aneurysmenfälle in den Vereinigten Staaten aus. Der nicht enthaltene dTAA-Bruch ist fast überall tödlich, und die Wahlreparatur hat eine hohe Morbiditäts- und Sterblichkeitsrate. Der Zweck unseres Modells ist es, dTAA gezielt zu untersuchen, die Pathophysiologie von dTAA aufzuklären und nach molekularen Zielen zu suchen, um das Wachstum zu stoppen oder die Größe von dTAA zu reduzieren. Durch ein murines Modell, um die Thoraxpathologie genau zu untersuchen, können gezielte Therapien entwickelt werden, um dTAA gezielt zu testen. Das Verfahren basiert auf der Platzierung der Schweinepankrease (PPE) direkt auf der äußeren murinen Aortenwand nach chirurgischer Exposition. Dies erzeugt eine destruktive und entzündliche Reaktion, die die Aortenwand schwächt und eine Aneurysmusbildung über Wochen bis Monate ermöglicht. Obwohl murine Modelle Grenzen besitzen, erzeugt unser dTAA-Modell robuste Aneurysmen von vorhersehbarer Größe. Darüber hinaus kann dieses Modell verwendet werden, um genetische und pharmazeutische Ziele zu testen, die das dTAA-Wachstum aufhalten oder einen Bruch verhindern können. Bei menschlichen Patienten könnten Interventionen wie diese dazu beitragen, Aneurysmusbrüche und schwierige chirurgische Eingriffe zu vermeiden.
Einleitung
Der Zweck dieser Methode ist es, die Entwicklung, Pathophysiologie und strukturelle Veränderungen in der murinen absteigenden thorakalen Aorta während der Aortenaneurysmbildung zu untersuchen. Unser Modell bietet eine reproduzierbare und konsistente Methode zur Induzieren von thorakalen Aortenaneurysmen (dTAA) bei Mäusen und ermöglicht so die Prüfung verschiedener genetischer und pharmakologischer Inhibitoren. Diese Arbeit kann helfen, Medikamente und Gen-Therapien zu identifizieren, die in eine praktikable Behandlungsstrategie für Menschen mit dTAA-Krankheit übersetzt werden könnten.
dTAAs bilden sich, wenn die Wand der Thoraxaorta geschwächt wird und sich im Laufe der Zeit ausdimiert, bis ein kritischer Durchmesser erreicht wird, wenn dann reißen oder brechen kann. Klinisch kann dTAA im Stillen voranschreiten und an Größe zunehmen, bis die Struktur der Aortenwand so verzerrt ist, dass sie schließlich versagt, mit katastrophalen Folgen. In der Regel entwickeln sich die Symptome nur, wenn das Aneurysm eine gefährliche Größe erreicht hat (100-150% Dilatation) und ein hohes Risiko für Sezieren oder Brechen1,2ist. dTAA-Ruptur ist fast universell tödlich3, und elektive chirurgische Reparatur trägt erhebliche Morbidität4,5. Darüber hinaus tragen die meisten Patienten die Diagnose eines Aortenaneurysms für ca. 5 Jahre vor der chirurgischen Reparatur6,7. Dieses Fenster ist ein geeigneter Zeitpunkt, um nicht-chirurgisch einzugreifen. Daher sind medizinische Therapien zur Behandlung oder Verlangsamung des Fortschreitens von dTAA erforderlich und würden einen bedeutenden Fortschritt auf dem Gebiet der Aneurysmenforschung darstellen. Derzeit gibt es keine medizinischen Behandlungen für dTAA, vor allem wegen eines unvollständigen Verständnisses der dTAA Pathogenese.
In den letzten 20 Jahren wurden mehrere dTAA-Tiermodelle entwickelt, aber jedes dieser Modelle unterscheidet sich von unseren eigenen und hat keine robusten Aneurysmen produziert. Ein murines dTAA-Modell, das unserem am ähnlichsten ist, wurde von Ikonomidis et al.8entwickelt, das die direkte Anwendung von CaCl2 auf die Adventitia der Aorta beinhaltet. Obwohl unser Modell von vielen der von Ikonomidis festgelegten Techniken angepasst wurde, ist unser Modell auf drei verschiedene Arten einzigartig. Erstens ist die Aorta in unserem Modell 3-5 Minuten lang der topischen Elastase ausgesetzt, verglichen mit 15 Minuten CaCl2 Exposition. Zweitens tritt eine aortenhafte Dilatation in 2 Wochen auf, verglichen mit 16 Wochen im CaCl 2-Modell. Schließlich erzeugt unser Modell konsequent Aneurysmen von ca. 100% Dilatation, im Vergleich zu den aortenförmigen Dilatationen von 20-30% durch CaCl2 Anwendung produziert (die nicht wirklich als Aneurysmen betrachtet werden, da sie als eine Erhöhung der Aorten Durchmesser >50%). Es gibt andere nicht-chirurgische murinische Modelle der Aneurysmenbildung, wie die Apo E Knockout Maus, die robuste Aneurysmen mit Infusion von Angiotensin II bilden. Diese Mäuse entwickeln jedoch suprarenale oder aufsteigende thorakale Aortenaneurysmen anstelle von Aneurysmen speziell in der absteigenden Thoraxaorta9,10.
Der Grund für dieses Protokoll ist, eine einfache, kostengünstige und zeitgerechte Möglichkeit zu haben, dTAA in einem murinen Modell zu studieren. Das Mausmodell bietet eine einzigartige Gelegenheit, viele genetische und zellspezifische Knockouts zu nutzen, die bei anderen Gefäßerkrankungen wirkungsvoll sind. Die Verwendung unseres spezifischen TAA-Modells wurde gut aufgenommen und Experimente, die es verwenden, wurden in den Fachzeitschriften11,12veröffentlicht. Bis zu diesem Punkt wurde das Modell verwendet, um mögliche genetische und pharmakologische Behandlungen zu untersuchen, die eine signifikante Wirkung in der Bauchaortenaneurysm (AAA) murinen Modelle hatten; Da unser Labor jedoch den Einsatz des dTAA-Modells erweitert hat, finden wir Ziele, die für die dTAA-Bildung einzigartig sind und als gezielte Therapien beim Menschen eingesetzt werden könnten.
Dieses Modell eignet sich am besten für Labore mit murinen mikrochirurgischen Fähigkeiten. Obwohl es technisch anspruchsvoll ist, kann es auch von Forschern ohne vorherige chirurgische Erfahrung konsequent ausgeführt werden. Für einen Forscher ohne murine chirurgische Erfahrung kann das Modell in etwa 20 operativen Sitzungen (oder etwa 50 Mäusen) gemeistert werden. Für den Forscher mit vorheriger chirurgischer Erfahrung kann das Modell in 5 operativen Sitzungen (ca. 20 Mäuse) gemeistert werden. Wir glauben, dass mit einem hochwertigen Video die Zeit zur Beherrschung weiter reduziert werden kann. Nach Erreichen der Befähigung kann der Eingriff in 35 Minuten für die Operation und 20 Minuten für die Endernte abgeschlossen werden. Die Chirurgen in unserem Labor können 10-12 volle Operationen pro Tag durchführen, mit einer operativen Sterblichkeitsrate von 5-10%. Die häufigste Todesursache ist Lungenverletzung beim Eintritt in die Brust, Anästhesietoxizität oder Riss der Aorta während der Zerlegung. Neben der dTAA-Forschung dient dieses Modell auch als Leitfaden für einen sicheren und einfachen Zugang zur Thoraxaorta und zum Lungenhilum für Forscher, die andere Eingriffe in die Brust untersuchen.
Protokoll
Tierprotokolle wurden vom Institutional Animal Care and Use Committee der University of Virginia (Nr. 3634) genehmigt.
1. Induktion von Anästhesie und Intubation
- Legen Sie eine 8-10 Wochen alte männliche C57BL/6 Maus in eine geschlossene Kammer mit kontinuierlichem Fluss von 5% Isofluran und Sauerstoffgemisch für 5 min, bis die Atmung enden wird.
HINWEIS: Je nach Experimentellem Protokoll können verschiedene Stämme, Geschlechter und Alter von Mäusen verwendet werden. Weibliche Mäuse können aufgrund ihrer kleineren Größe und damit kleinerer Atemwege schwieriger zu intubieren sein. - Intubieren Sie die Maus, wie von Vandivort et al.13beschrieben.
HINWEIS: Der Intubationsschritt ist der schwierigste Teil dieses Modells, um sowohl zu lernen als auch auszuführen. Die oben genannten Autoren leisten hervorragende Arbeit, um die Schritte in ihrem Video zu erklären.
2. Sicherung der Maus am Operationsbrett
- Verbinden Sie das Endotracheal (ET) Rohr, bestätigen Brustanstieg, und legen Sie die Maus in der rechten seitlichen Dekubitus-Position. Drehen Sie Isofluran auf ca. 3% und schmieren Sie auf beide Augen. Das Beatmungsgerät sollte auf ca. 200 Atemzüge pro Minute und 225 L Gezeitenvolumen eingestellt werden.
HINWEIS: Die Toxizität ist schnell, wenn Isofluran bei 5% bleibt. Die Reaktion auf Isofluran ist jedoch variabel, so dass die Anästhesiedurchflussrate so titriert werden sollte, dass spontane zwerchfhagene Kontraktionen etwa alle 10-20 s auftreten und die Sauerstoffversorgung bei der Inspektion von Schleimhäuten und freiliegendem Gewebe ausreichend erscheint. - Befestizieren Sie das ET-Rohr mit Klebeband an der Platine. Verlängern Sie den rechten Arm rostral, so dass die Vorderpfote in der Linie mit der Nase ist und sichern Sie es mit Klebeband.
- Ziehen Sie den Schwanz kauarisch, um eine Spannungslinie zwischen dem rechten Arm und dem Schwanz zu schaffen, wodurch eine Ausdehnung der Wirbelsäule entsteht.
HINWEIS: Das Sichern sowohl des Schwanzes als auch der rechten Pfote in der Linie verhindert ein Über- oder Abwurf des ET-Rohrs. - Bekleben Sie das linke Bein in seiner natürlichen Position. Ziehen Sie den linken Arm entlüftungswichtig über gerollte Gaze und Band nach unten.
3. Vorbereitung auf die Operation
- Rasieren Sie die linke Flanke der Maus mit elektrischen Clippers von der linken Schulter bis zum linken Bauch.
- Verwenden Sie einen Baumwoll-Applikator, um Betadin-Lösung über die chirurgische Stelle zu bürsten. Verwenden Sie einen neuen Baumwoll-Applikator, um 70% Ethanollösung über die chirurgische Stelle zu bürsten. Trocknen lassen. Legen Sie einen sterilen Vorhang.
- VORSICHT: Stellen Sie sicher, dass das gesamte Ethanol vollständig getrocknet ist, bevor es als Elektrokauterie verwendet wird und das Ethanol entzünden kann.
4. Eintritt in Thorax
- Machen Sie einen 1 cm seitlichen Schnitt in der Mitte des Hemithorax mit chirurgischer Schere. Verwenden Sie Handelektrokautery, um Muskelschichten zu teilen, bis die Rippen sichtbar sind.
- Direkt einen 2 mm Abschnitt der Rippe kauterisieren.
HINWEIS: Beachten Sie bei Verwendung von Elektrokauterie auf der Rippe die spontane Atemfrequenz. Wenn die Maus während der Kautereine eine zwerchfellatische Kontraktion hat, kann die Spitze in den Thorax eindringen und die Lunge punktieren, was in diesem Modell in der Regel tödlich ist. - Drehen Sie die Spitze mit einem benetzten, feinen Baumwoll-Applikator im Rippenraum, der dem kauterisierten Teil überlegen ist, die Spitze auf das Gewebe, um in den Pleuraraum einzubrechen. Legen Sie benetzten 3 mm x 2 mm Schwamm in den Thorax, um die Lunge zu kollabieren.
HINWEIS: Nur weich, nass, Schwämme kontaktieren die Lunge, da es extrem empfindlich ist. - Verwenden Sie eine Schere, um entlang des oberen Aspekts der kauterisierten Rippe zu schneiden, bis Diemembran sichtbar ist.
5. Aortenexposition
- Rippenretraktoren aufstellen und mit ihnen den Thorakotomie-Einschnitt öffnen. Entfernen Sie den Schwamm vorsichtig von der Oberfläche der Lunge.
- 6 mm x 4 mm Schwamm so auflegen, dass er die Lunge bedeckt, mit Enden, die rostral und kauarisch zeigen. Legen Sie den (breiten flachen) Lungenretraktor auf den Schwamm und schieben Sie den Retraktor leicht ventral, bis die absteigende Thoraxaorta freigelegt wird.
- Verwenden Sie #7 Zange, um das Bindegewebe und Fett aus der Aorta für einen etwa 5 mm Abschnitt zu sezieren.
HINWEIS: Kleine Venen können quer über die Aorta verlaufen; vermeiden Sie, sie während der Zerlegung zu reißen (mit mindestens 14-facher Vergrößerung kann helfen, diese Komplikation zu vermeiden).
6. Elastase-Exposition
- 0,5 mm x 1 mm Schwamm mit 12 l Pankrease assig mit 12 l sättigen und auf die freiliegende Oberfläche der Aorta legen.
HINWEIS: Lassen Sie den Schwamm die kontralaterale Lunge nicht berühren. - Nach der vorgegebenen Zeit (in der Regel 3-5 min), entfernen Sie den Elastaseschwamm mit #7 Zangen. Entfernen Sie den Lungenretraktor. Bewässern Sie die Brusthöhle mit 1 ml steriler Saline.
HINWEIS: Entfernen Sie den Lungenretraktor vor der Bewässerung mit Saline, da er es ermöglicht, dass der Lungenschwamm gesättigt und weich wird, was es einfacher macht, von der Oberfläche der Lunge zu entfernen. - Verwenden Sie gewalzte 2 "x 2" Gaze, um die verbleibende Saline-Bewässerung zu absorbieren. Drehen Sie Isoflurane auf 2%.
7. Verschluss der Brust
- Entfernen Sie den Lungenschwamm. Entfernen Sie den kaudalen Lungenretraktor. Entfernen Sie den rostralen Lungenretraktor.
- Platz 3 unterbrochen 6-0 nicht-resorbierbare Nähte, um die Rippen zu widersetzen, binden Sie einen lockeren Knoten in jedem, aber nicht zu binden. Achten Sie sehr darauf, die Lunge nicht mit der Nahtnadel zu berühren.
- Die Lunge wieder aufblasen, indem Sie das Abflussrohr auf dem Beatmungsgerät verschließen oder schnell 0,5-1,0 ml Luft durch das ET-Rohr blasen, indem Sie den 3-Wege-Stopphahn verwenden.
HINWEIS: Um Barotrauma zu vermeiden, vermeiden Sie übermäßigen Einsatz der luftgefüllten Spritze, und verwenden Sie nicht mehr als 1,0 ml Luft. - Binden Sie nicht resorbierbare Nähte. Die Muskelschichten mit einer laufenden 5-0 resorbierbaren Multifilament-Naht neu annähern. Drehen Sie Isoflurane auf 1%.
- Schließen Sie die Haut mit 7-10 unterbrochenen 5-0 nicht resorbierbaren Nähten. Drehen Sie Isoflurane auf 0%.
8. Wiederherstellung
- Subkutane Verabreichung von 6 g (0,02 ml einer 0,3 mg/ml Suspension) Buprenorphin. Entfernen Sie das Band vom rechten Fuß, Schwanz und linken Arm gefolgt vom rechten Armband.
- Wenn die Maus Extremitäten bewegt, extubieren Sie, indem Sie sie am Schwanz ziehen, um aus dem ET-Rohr zu gleiten. In der wärmeren Kammer mit hohem Sauerstoffgehalt in die Supine-Position geben.
HINWEIS: Es ist sicher, die Maus von der Sauerstoffkammer in den Käfig zu bewegen, wenn sie sich selbst in die normale Standposition drehen kann. Darüber hinaus sollten Mäuse in den ersten 24-48 Stunden nach der Operation auf Anzeichen von Schmerzen, Schmerzen oder misserfolgigen Symptomen überwacht werden und zusätzliche Analgesie oder weiche Nahrung zur Verfügung stellen, wie angegeben.
9. Exposition von Aortenaneurysmus (Terminal-Ernteverfahren)
HINWEIS: Im Allgemeinen wird die Gewebeernte nach 14 Tagen durchgeführt, da dies den Zeitraum der maximalen Dilatation darstellt. Je nach Experiment kann jedoch der Zeitpunkt des Ernteablaufs je nach Experiment jederzeit zwischen 3 Tagen und 4+ Wochen durchgeführt werden.
- Intubieren und sichere Maus zu operativem Feld wie oben beschrieben (Abschnitte 1-3). Verwenden Sie eine Schere, um die Haut medial von der linken Flanke bis zum zentralen Bauch zu schneiden, wobei darauf geachtet wird, nicht in das Peritoneum zu gelangen.
- Incise Haut von dorsalen linken Flanke rostral auf das Niveau der linken Schulter. Dann in einem 90°-Winkel durch die Axilla zum Brustbein einknicken.
HINWEIS: Dieser Schnitt sollte den ursprünglichen Hautschnitt vollständig umschließen. - Mit Kauterie, dissektieren Hautklappe in Richtung der ventralen Aspekt der Maus, die linke Hemithorax aussetzen. Verwenden Sie eine Schere, um den Bauch und Dieris entlang der linken Kostenrand von ventral zu dorsal zu betreten, um die Unterseite der linken Membran zu belichten. Die seitliche meiste Kante der Membran kann sich öffnen, was gewünscht wird.
- Wenn nicht mit dem vorherigen Schritt erstellt, schneiden Sie die Membran an seiner seitlichsten Kante. Legen Sie die Spitze der Kautery in dieses Loch und kauterisieren Sie die Membran von der Kostenmarge zum Xyphoidenprozess. Mit einem feuchten, fein gekippten Baumwoll-Applikator, befreien Sie die Lunge sanft von Verklebungen an der Brustwand und drücken Sie die Lunge medial.
HINWEIS: Wenn Adhäsionen nicht leicht von der Brustwand kommen, verwenden Sie Kautery, um sie zu entfernen; dies hilft zu vermeiden, die Lunge zu reißen, die schwere Blutungen verursachen kann. - Kauterisieren Sie die Innenseite der Brustwand von Rippe eins bis zum Costalrand, dorsal bis zur mittleren Achsellinie, aber mindestens 2 mm von der Aorta entfernt. Schneiden Sie die Brustwand entlang der kauterisierten Linie.
HINWEIS: Diese Technik vermeidet Blutungen aus den interkostalen Arterien. - Schneiden Sie entlang der oberen Rand der Rippe ein und dann kauadt entlang der seitlichen Kante des Brustbeins, entfernen Sie den linken Rippenkäfig. Retraktoren auf die Lunge legen und medial ziehen. Retraktor auf Membran legen und kauen, um so viel Aorta wie möglich zu belichten.
- Verwenden Sie einen trockenen Baumwoll-Applikator, um Adhäsionen aus Aortenaneurysm und einem unbeeinflussten distalen Segment zu entfernen. Messen Sie den Durchmesser des nicht betroffenen Kontrollsegments und den breitesten Teil des elastase behandelten Aneurysmus mittels Videomikrometrie.
HINWEIS: Die Messungen der Videomikrometrie werden verwendet, um die prozentuale Dilatation des aneurysmalen Segments im Vergleich zu einem Steuersegment mit Gleichung 1 zu berechnen. Es wird ein Steuersegment ausgewählt, das 0,5 mm distal zum aneurysmalen Segment 1 ist.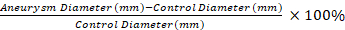 Gleichung 1
Gleichung 1
- Greifen Sie Aorta mit Harms Zange, nur distal zu dem behandelten Segment. Verwenden Sie eine Schere, um distale Zuzangen zu schneiden, und sezieren Sie dann die Aorta von der Wirbelsäule. Aorta proximal schneiden, um das Segment zu behandeln, und aneurysmale Aorta entfernen.
- Mit einer Tuberkulinspritze und -nadel das Aortenlumen mit Saline und Prozessgewebe nach Belieben waschen.
Ergebnisse
Die Anwendung unseres Protokolls führt zu robusten dTAA bei Mäusen im Vergleich zu Saline-Kontrollen. Die entwickelten TAAs sind fusiformförmig und kommen nur im behandelten Teil der Aorta vor (Abbildung 1 und Abbildung 2)11. Abbildung 2 zeigt ein Beispiel für eine Videomikrometriemessung bei der Gewebeernte. Bei Verwendung von Gleichung 1 beträgt die Aortendilatation in diesem Beispiel 130 %.
Diskussion
Die Thorax- und Bauchaorta sind zellulär und embryologisch verschieden, was für die aneurysmale Erkrankung14,15,16relevant ist. Daher ist ein spezifisches Tiermodell zur Untersuchung von TAA erforderlich. Obwohl andere murine dTAA-Modelle veröffentlicht wurden8, ist unser Modell das einzige Modell, um absteigende thorakale aortenhafte Dilatation zu schaffen, die wirklich aneurysmal angesehen werden kan...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde durch AHA Scientist Development Grant 14SDG18730000 (M.S.), NIH K08 HL098560 (G.A.) und RO1 HL081629 (G.R.U.) Stipendien unterstützt. Dieses Projekt wurde von der Thoracic Surgery Foundation for Research and Education (TSFRE) Research Grant (PI: G. Ailawadi) unterstützt. Der Inhalt liegt allein in der Verantwortung der Autoren und stellt nicht unbedingt die Ansichten des NHLBI oder des TSFRE dar. Wir danken Anthony Herring und Cindy Dodson für ihr Wissen und ihr technisches Know-how.
Materialien
| Name | Company | Catalog Number | Comments |
| Angiocatheter (22G) | Used for ET Tube | ||
| Dumont Tweezers; Pattern #7 x2 | Roboz | RS-4982 | |
| Graefe Tissue Forceps | Roboz | RS-5158 | |
| Harms Forceps x2 | Roboz | RS-5097 | |
| Intracardiac Needle Holder; Extra Delicate; Carbide Jaws; 7" Length | Roboz | RS-7800 | |
| KL 1500 LED Light Source | Leica | 150-400 | |
| M205A Dissction Microscope | Leica | CH 94-35 | |
| Iris Scissors, 11cm, Tungsten Carbide | World Precision Instruments | 500216-G | |
| Metal Clip board | Use with the Mouse Retractor Set | ||
| Mouse Retractor Set | Kent | SURGI-5001 | Need 2 short and 1 tall fixators |
| Mouse Ventilator MiniVent Type 845, 115 V, Power Supply with US Connector | Harvard Apparatus | 73-0043 | MiniVent Ventilator for Mice (Model 845), Single Animal, Volume Controlled |
| Sigma Aldrich | Elastase from porcine pancreas | E0258-50MG | Can be purchased in various size bottles |
| Small Vessel Cauterizer Kit | Fine Science Tools | 18000-00 | Recommend using rechargable AA batteries |
| Spring Scissors, 10.5cm | World Precision Instruments | 14127 | |
| Steril Swabs (Sponges) | Sugi | 31603 | Can be cut to size |
| Surgi Suite Surgical Platform | Kent | Attach to clip board | |
| Tech IV Isoflurane Vap | Jorgensen Laboratories | J0561A | Anesthesia vaporizer |
Referenzen
- Coady, M. A., et al. What is the appropriate size criterion for resection of thoracic aortic aneurysms. Journal of Thoracic and Cardiovascular Surgery. 113 (3), 489-491 (1997).
- Aggarwal, S., Qamar, A., Sharma, V., Sharma, A. Abdominal aortic aneurysm: A comprehensive review. Experimental and Clinical Cardiology. 16 (1), 11-15 (2011).
- Bickerstaff, L. K., et al. Thoracic aortic aneurysms: a population-based study. Surgery. 92 (6), 1103-1108 (1982).
- Cheng, D., et al. Endovascular aortic repair versus open surgical repair for descending thoracic aortic disease a systematic review and meta-analysis of comparative studies. Journal of the American College of Cardiology. 55 (10), 986-1001 (2010).
- Walsh, S. R., et al. Endovascular stenting versus open surgery for thoracic aortic disease: systematic review and meta-analysis of perioperative results. Journal of Vascular Surgery. 47 (5), 1094-1098 (2008).
- Absi, T. S., et al. Altered patterns of gene expression distinguishing ascending aortic aneurysms from abdominal aortic aneurysms: complementary DNA expression profiling in the molecular characterization of aortic disease. The Journal of Thoracic and Cardiovascular Surgery. 126 (2), 344-357 (2003).
- Ailawadi, G., Eliason, J. L., Upchurch, G. R. Current concepts in the pathogenesis of abdominal aortic aneurysm. Journal of Vascular Surgery. 38 (3), 584-588 (2003).
- Ikonomidis, J. S., et al. A murine model of thoracic aortic aneurysms. Journal of Surgical Research. 115 (1), 157-163 (2003).
- Daugherty, A., Manning, M. W., Cassis, L. A. Angiotensin II promotes atherosclerotic lesions and aneurysms in apolipoprotein E-deficient mice. Journal of Clinical Investigation. 105 (11), 1605-1612 (2000).
- Trachet, B., et al. Ascending Aortic Aneurysm in Angiotensin II-Infused Mice: Formation, Progression, and the Role of Focal Dissections. Arteriosclerosis, Thrombosis, and Vascular Biology. 36 (4), 673-681 (2016).
- Johnston, W. F., et al. Inhibition of interleukin-1beta decreases aneurysm formation and progression in a novel model of thoracic aortic aneurysms. Circulation. 130 (11), 51-59 (2014).
- Pope, N. H., et al. Interleukin-6 Receptor Inhibition Prevents Descending Thoracic Aortic Aneurysm Formation. Annals of Thoracic Surgery. 100 (5), 1620-1626 (2015).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771 (2016).
- Ailawadi, G., et al. A nonintrinsic regional basis for increased infrarenal aortic MMP-9 expression and activity. Journal of Vascular Surgery. 37 (5), 1059-1066 (2003).
- Ruddy, J. M., Jones, J. A., Spinale, F. G., Ikonomidis, J. S. Regional heterogeneity within the aorta: relevance to aneurysm disease. Journal of Thoracic and Cardiovascular Surgery. 136 (5), 1123-1130 (2008).
- Trigueros-Motos, L., et al. Embryological-origin-dependent differences in homeobox expression in adult aorta: role in regional phenotypic variability and regulation of NF-kappaB activity. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (6), 1248-1256 (2013).
- Lu, G. S. G., Davis, J. P., Schaheen, B., Downs, E., Roy, R. J., Ailawadi, G., Upchurch, G. R. A novel chronic advanced staged abdominal aortic aneurysm murine model. Journal of Vascular Surgery. 66 (1), 232-242 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten