È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Modello chirurgico murine dell'elastasi topica indotta decrescente all'aneurtica toracica
In questo articolo
Riepilogo
Descriviamo un protocollo chirurgico per indurre costantemente robusti aneurismi aortici discendenti nei topi. La procedura prevede la toracotomia sinistra, l'esposizione all'aorta toracica e il posizionamento di una spugna imbevuta di elastasi pancreatica porcina sulla parete aortica.
Abstract
Secondo il Center for Disease Control, gli aneurismi aortici (AA) sono stati considerati una delle principali cause di morte in tutte le razze ed entrambi i sessi dal 1999 al 2016. Un aneurisma si forma a seguito di progressivo indebolimento e didilatazione dell'aorta, che può rompersi o strappare una volta raggiunto un diametro critico. Gli aneurismi dell'aorta discendente nel petto, chiamati aneurismi aortici toracici discendenti (dTAA), costituiscono una grande percentuale di casi di aneurisma negli Stati Uniti. La rottura di dTAA non contenuta è quasi universalmente letale e la riparazione elettiva ha un alto tasso di morbilità e mortalità. Lo scopo del nostro modello è quello di studiare la dTAA in modo specifico, chiarire la fisiopatologia della dTAA e cercare obiettivi molecolari per arrestare la crescita o ridurre le dimensioni della dTAA. Avendo un modello murino per studiare con precisione la patologia toracica, è possibile sviluppare terapie mirate per testare specificamente la dAA. Il metodo si basa sul posizionamento dell'elasasi pancreatica dei porcini (PPE) direttamente sulla parete aortica murina esterna dopo l'esposizione chirurgica. Questo crea una reazione distruttiva e infiammatoria, che indebolisce la parete aortica e permette la formazione di aneurisma per settimane o mesi. Anche se i modelli murine possiedono limitazioni, il nostro modello dTAA produce robusti aneurismi di dimensioni prevedibili. Inoltre, questo modello può essere utilizzato per testare obiettivi genetici e farmaceutici che possono arrestare la crescita della DTAA o prevenire la rottura. Nei pazienti umani, interventi come questi potrebbero aiutare a evitare la rottura dell'aneurisma e un intervento chirurgico difficile.
Introduzione
Lo scopo di questo metodo è quello di studiare lo sviluppo, la fisiofisiologia e i cambiamenti strutturali nell'aorta toracica discendente murina durante la formazione di aneurismi aortici. Il nostro modello offre un metodo riproducibile e coerente per indurre aneurismi aortici toracici (dTAA) nei topi consentendo così la verifica di vari inibitori genetici e farmacologici. Questo lavoro può aiutare a identificare i farmaci e le terapie geniche che potrebbero essere tradotte in una strategia di trattamento praticabile per gli esseri umani affetti da malattia di DTAA.
Le DAA si formano quando la parete dell'aorta toracica si indebolisce e si dilata nel tempo fino a raggiungere un diametro critico quando può verificarsi strappo o rottura. Clinicamente, la dTAA può progredire in silenzio, aumentando di dimensioni fino a quando la struttura della parete aortica è così distorta che alla fine fallisce, con conseguenze catastrofiche. Per quanto riguarda, i sintomi di solito si sviluppano solo quando l'aneurisma ha raggiunto una dimensione perilosa (100-150% dilatazione) ed è ad alto rischio di dissezione o rottura1,2. La rottura della dTAA è quasi universalmente letale3, e la riparazione chirurgica elettiva porta una morbilità significativa4,5. Inoltre, la maggior parte dei pazienti portano la diagnosi di un aneurisma aortico per circa 5 anni prima della riparazione chirurgica6,7. Questa finestra rappresenta un momento opportuno per intervenire in modo non chirurgico. Pertanto, sono necessarie terapie mediche per trattare o rallentare la progressione della dTAA e rappresenterebbero un significativo progresso nel campo della ricerca sull'aneurisma. Attualmente non ci sono trattamenti medici per la dTAA, soprattutto a causa di una comprensione incompleta della patogenesi della dTAA.
Negli ultimi 20 anni sono stati sviluppati diversi modelli animali dTAA, ma ciascuno di questi modelli si è distinto dal nostro e non ha prodotto aneurismi robusti. Un modello di dTAA murine più simile al nostro è stato sviluppato da Ikonomidis et al.8, che include l'applicazione diretta di CaCl2 all'avvento dell'aorta. Anche se il nostro modello è stato adattato da molte delle tecniche stabilite da Ikonomidis, il nostro modello è unico in tre modi separati. In primo luogo, nel nostro modello l'aorta è esposta all'elastasi topica per 3-5 minuti, rispetto ai 15 minuti di esposizione a CaCl 2. In secondo luogo, la dilatazione aortica si verifica in 2 settimane, rispetto alle 16 settimane nel modello CaCl 2. Infine, il nostro modello produce costantemente aneurismi di circa il 100% di dilatazione, rispetto alle dilatazioni aortiche del 20-30% prodotte dall'applicazione CaCl2 (che non possono essere realmente considerate aneurismi in quanto definiti come un aumento diametro >50%). Ci sono altri modelli murini non chirurgici della formazione di aneurisma, come il topo Knockout Apo E, che formano robusti aneurismi con infusione di angiotensina II. Tuttavia, questi topi sviluppano aneurismi aortici tonocici o supracici piuttosto che aneurismi specificamente nell'aorta toracica discendente9,10.
Il razionale per questo protocollo è quello di avere un modo semplice, economico, e il tempo adatto per studiare dTAA in un modello murino. Il modello murino offre un'opportunità unica di utilizzare molti knockout genetici e specifici delle cellule che sono stati trovati per essere di impatto in altre malattie vascolari. L'uso del nostro specifico modello TAA è stato ben accolto e gli esperimenti che lo utilizzano sono stati pubblicati su riviste ad alto impatto11,12. A questo punto, il modello è stato utilizzato per studiare possibili trattamenti genetici e farmacologici che hanno avuto un effetto significativo nei modelli murini addominali anortici (AAA); tuttavia, poiché il nostro laboratorio ha ampliato l'uso del modello dTAA, stiamo trovando obiettivi unici per la formazione di dTAA che potrebbero essere utilizzati come terapie mirate negli esseri umani.
Questo modello è più appropriato per i laboratori che hanno capacità micro-chirurgiche murine. Anche se è tecnicamente impegnativo, può essere eseguito in modo coerente anche dai ricercatori senza alcuna esperienza chirurgica precedente. Per un ricercatore senza alcuna esperienza chirurgica murina il modello può essere masterizzato in circa 20 sessioni operative (o circa 50 topi). Per il ricercatore con esperienza chirurgica precedente, il modello può essere masterizzato in 5 sessioni operative (circa 20 topi). Crediamo che con un video di alta qualità, il tempo di padronanza può essere ulteriormente ridotto. Dopo la conoscenza, la procedura può essere completata in 35 minuti per l'intervento chirurgico e 20 minuti per la raccolta terminale. I chirurghi del nostro laboratorio possono completare 10-12 interventi chirurgici completi al giorno, con un tasso di mortalità operativa del 5-10%. La causa più comune di mortalità è la lesione polmonare all'ingresso al torace, la tossicità anestetica o lo strappo dell'aorta durante la dissezione. Oltre alla ricerca dTAA, questo modello serve anche come guida per un accesso facile e sicuro all'aorta toracico e al barile polmonare per i ricercatori che studiano altri interventi nel torace.
Protocollo
I protocolli sugli animali sono stati approvati dal Comitato per la cura e l'uso degli animali dell'Università della Virginia (n. 3634).
1. Induzione di anestesia e intubazione
- Mettere un topo C57BL/6 maschio di 8-10 settimane in una camera chiusa con flusso continuo del 5% di isoflurane e miscela di ossigeno per 5 min, fino a quando le respirazioni non sono visibilmente rallentate.
NOTA: diversi ceppi, generi ed età dei topi possono essere utilizzati a seconda del protocollo sperimentale. I topi femminili possono essere più difficili da intubare a causa delle dimensioni più piccole e quindi delle vie aeree più piccole. - Intubate il topo come descritto da Vandivort etal.
NOTA: la fase di intubazione è la parte più difficile di questo modello per imparare ed eseguire. Gli autori di cui sopra fanno un ottimo lavoro spiegando i passaggi nel loro video.
2. Fissare il mouse sulla scheda chirurgica
- Collegare il tubo endotracheale (ET), confermare l'aumento del torace, e posare il mouse nella posizione decubito laterale destra. Girare l'isoflurane a circa il 3% e applicare la lubrificazione su entrambi gli occhi. Il ventilatore deve essere impostato in modo da fornire circa 200 respiri al minuto e 225 lofilde di volume di marea.
NOTA: La tossicità è rapida se l'isoflurane viene lasciato al 5%. Tuttavia, la risposta all'isoflurane è variabile, quindi la portata anestetica dovrebbe essere titonata in modo tale che le contrazioni diaframiche spontanee si verifichino approssimativamente ogni 10-20 s e l'ossigenazione appare adeguata all'ispezione delle membrane mucose e dei tessuti esposti. - Fissare il tubo ET alla scheda con nastro adesivo. Estendere il braccio destro in modo che la zampa anteriore sia in linea con il naso e fissarlo con del nastro adesivo.
- Tirare la coda caudalmente per creare una linea di tensione tra il braccio destro e la coda, producendo l'estensione della colonna vertebrale.
NOTA: Fissare sia la coda che la zampa destra in linea impedisce l'inserimento o lo sloggiamento del tubo ET. - Nastro la gamba sinistra nella sua posizione naturale. Disegnare il braccio sinistro ventralmente sopra garza arrotolata e nastro verso il basso.
3. Preparazione per interventi chirurgici
- Rasare il fianco sinistro del mouse con clipper elettrici dalla spalla sinistra all'addome sinistro.
- Utilizzare un applicatore con punta di cotone per spazzolare la soluzione betadina sul sito chirurgico. Utilizzare un nuovo applicatore a punta di cotone per spazzolare la soluzione di etanolo al 70% sul sito chirurgico. Lasciare asciugare. Mettere un drappo sterile.
- AVVISO: Assicurarsi che tutto l'etanolo sia completamente essiccato prima di procedere quando viene utilizzato l'elettrocauterio e in grado di accendere l'etanolo.
4. Ingresso nel torace
- Fare un'incisione laterale di 1 cm nel punto medio dell'emitorace utilizzando forbici chirurgiche. Utilizzare l'elettrocauterio portatile per dividere gli strati muscolari fino a quando le costole sono visibili.
- Cauterizzare direttamente una porzione di 2 mm della costola.
NOTA: Quando si utilizza l'elettrocautario sulla costola, osservare la frequenza respiratoria spontanea. Se il topo ha una contrazione diaframmatica durante il cavolo, la punta può entrare nel torace e forare il polmone, che di solito è fatale in questo modello. - Utilizzando un applicatore bagnato e fine con punta di cotone nello spazio delle costole superiore alla parte cauterizzata, ruotare la punta sul tessuto per penetrare nello spazio pleirale. Mettere la spugna bagnata di 3 mm x 2 mm nel torace per aiutare a collassare il polmone.
NOTA: Lasciare solo morbido, umido, spugne contattare il polmone in quanto è estremamente delicato. - Utilizzare le forbici per tagliare lungo l'aspetto superiore della costola cauterizzata, fino a quando il diaframma è visibile.
5. Esposizione aortica
- Posizionare i retrattori delle costole e utilizzarli per aprire l'incisione della toracotomia. Rimuovere con attenzione la spugna dalla superficie del polmone.
- Posizionare la spugna bagnata di 6 mm x 4 mm in modo che si posiasca coprendo il polmone, con estremità rivolte e caudalmente. Posizionare il retrattore polmonare (largo) sulla spugna e far scorrere delicatamente il retrattore ventrally fino a quando non viene esposta l'aorta toracica discendente.
- Utilizzare #7 pinze per sezionare il tessuto connettivo e il grasso fuori dall'aorta per una sezione di circa 5 mm.
NOTA: piccole vene possono essere in esecuzione trasversalmente attraverso l'aorta; evitare di strapparli durante la dissezione (utilizzando almeno 14x ingrandimento può aiutare a evitare questa complicazione).
6. Esposizione all'elavasi
- Saturare la spugna di 0,5 mm x 1 mm con 12 - L di elastasi pancreatica porcina e posizionarla sulla superficie esposta dell'aorta.
NOTA: Non lasciare che la spugna tocchi il polmone contralaterale. - Dopo il tempo predeterminato (di solito 3-5 min), rimuovere la spugna di elastasi con #7 pinze. Rimuovere il retrattore polmonare. Irrigare la cavità toracica con 1 mL di salina sterile.
NOTA: Rimuovere il retrattore polmonare prima dell'irrigazione con la salina in quanto consentirà alla spugna polmonare di diventare satura e morbida, rendendo più facile la rimozione dalla superficie del polmone. - Utilizzare la garza arrotolata da 2" x 2" per assorbire l'irrigazione salina rimanente. Girare l'isoflurane al 2%.
7. Chiusura del torace
- Rimuovere la spugna polmonare. Rimuovere il retrattore polmonare caudale. Rimuovere il retrattore polmonare rostrale.
- Mettere 3 suture 6-0 non assorbibili interrotte per opporsi alle costole, legare un nodo sciolto in ciascuna ma non legare verso il basso. Fare molta attenzione a non toccare il polmone con l'ago di sutura.
- Ri-gonfiare il polmone occludendo il tubo di uscita sul ventilatore o soffiando rapidamente 0,5-1,0 mL di aria attraverso il tubo ET utilizzando il cazzo di arresto a 3 vie.
NOTA: Per evitare il barotrauma, evitare l'uso eccessivo della siringa riempita d'aria e utilizzare non più di 1,0 mL di aria. - Legare suture non assorbibili. Reapprossimare gli strati muscolari con una sutura multifilamento assorbibile 5-0. Girare l'isoflurane all'1%
- Pelle chiusa con 7-10 suture non assorbibili 5-0 interrotte. Girare l'isoflurane allo 0%.
8. Recupero
- Amministrare 6 g (0,02 mL di una sospensione di 0,3 mg/mL) di buprenorphine sottocutaneamente. Rimuovere il nastro dal piede destro, dalla coda e dal braccio sinistro seguiti dal nastro del braccio destro.
- Quando il mouse muove le estremità, estraitirarlo tirandolo per la coda per far scivolare fuori dal tubo ET. Posizionare nella camera più calda ad alto contenuto di ossigeno in posizione supina.
NOTA: È sicuro spostare il mouse dalla camera di ossigeno alla gabbia quando può girarsi in posizione eretta normale. Inoltre, i topi devono essere monitorati per segni di dolore, angoscia, o fallimento a prosperare frequentemente per le prime 24-48 ore dopo l'intervento chirurgico e fornito analgesia aggiuntiva o cibo morbido come indicato.
9. Esposizione dell'aneurisma aortico (procedura di raccolta terminale)
NOTA: In generale, la raccolta dei tessuti viene effettuata a 14 giorni, in quanto questo rappresenta il periodo di dilatazione massima. Tuttavia, a seconda dell'esperimento, la tempistica della procedura di raccolta può essere eseguita in qualsiasi momento tra 3 giorni e 4 settimane, a seconda dell'esperimento.
- Intubare e proteggere il mouse al campo operatorio come descritto sopra (sezioni 1-3). Utilizzare le forbici per incise la pelle mediamente dal fianco sinistro all'addome centrale facendo attenzione a non entrare nel peritoneo.
- Incise la pelle dal fianco dorsale sinistro di cui si trova il rotrally al livello della spalla sinistra. Quindi incise ad un angolo di 90 gradi attraverso l'ascellazione allo sterno.
NOTA: Questa incisione dovrebbe circondare completamente l'incisione cutanea originale. - Utilizzando cauterio, sezionare puntura della pelle verso l'aspetto ventrale del topo, esponendo l'emitorace sinistro. Utilizzare le forbici per entrare nell'addome e incise lungo il margine costale sinistro da ventrale a dorsale per esporre la parte inferiore del diaframma sinistro. Il bordo laterale più del diaframma può aprire che è desiderato.
- Se non viene creato con il passo precedente, incitare il diaframma al suo bordo più laterale. Mettere la punta del cautery in questo foro e cauterizzare il diaframma dal margine costale al processo xifoideo. Utilizzando un applicatore umido sottile punta in cotone punta, liberare delicatamente il polmone dalle adere alla parete toracica e spingere il polmone medialmente.
NOTA: Se le ademi non si staccono facilmente dalla parete toracica, utilizzare il cauterio per rimuoverle; così facendo aiuta a evitare di strappare il polmone che può causare sanguinamento pesante. - Cauterizzare l'interno della parete toracica da costola uno al margine costale, dorsale alla linea ascellare centrale ma almeno 2 mm dall'aorta. Tagliare la parete toracica lungo la linea cauterizzata.
NOTA: Questa tecnica evita il sanguinamento dalle arterie intercostali. - Tagliare lungo il margine superiore di una costola e poi caudalmente lungo il bordo laterale dello sterno, rimuovendo la gabbia toracica sinistra. Posizionare i retrattili sul polmone e tirare mediamente. Posizionare il retrattore sul diaframma e disegnare caudalmente per esporre quanto più aorta possibile.
- Utilizzare un applicatore asciutto con punta di cotone per rimuovere le adeguarzioni dall'aneurisma aortico e da un segmento distale inalterato. Misurare il diametro del segmento di controllo inalterato e la parte più ampia dell'aneurisma trattato in elastasi utilizzando la micrometria video.
NOTA: Le misurazioni della micrometria video vengono utilizzate per calcolare la dilatazione percentuale del segmento aneurisma rispetto a un segmento di controllo con l'equazione 1. Viene selezionato un segmento di controllo pari a 0,5 mm per il segmento aneurisma 1.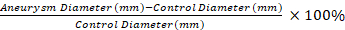 Equazione 1
Equazione 1
- Afferra l'aorta con pinze Harms, basta distale al segmento trattato. Utilizzare le forbici per tagliare distale a pinze, quindi sezionare l'aorta fuori colonna vertebrale. Tagliare l'aorta prossimaal a segmento trattato e rimuovere l'aorta aneurisma.
- Utilizzando una siringa di tubercolina e un ago, lavare il lume aortico con tessuto salino e di processo come desiderato.
Risultati
L'applicazione del nostro protocollo si traduce in robusto dTAA nei topi rispetto ai controlli salini. I TAA sviluppati sono di forma fusiforme e si verificano solo nella parte trattata dell'aorta (Figura 1 e Figura 2)11. La figura 2 mostra un esempio di misurazione della micrometria video al raccolto dei tessuti. Utilizzando l'equazione 1, la dilatazione aortica è 130% in questo esempio.
Discussione
Le aorta toraciche e addominali sono cellularalmente ed embrionalmente distinte, che è rilevante per la malattia aneurismica14,15,16. Pertanto, è necessario un modello animale specifico per studiare la TAA. Anche se altri modelli murine dTAA sono stati pubblicati8, il nostro è l'unico modello per creare dilatazione aortica toracica discendente che può essere considerata veramente aneurismatica (oltre ...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato supportato dalle sovvenzioni AHA Scientist Development Grant 14SDG187300000 (M.S.), NIH K08 HL098560 (G.A.) e RO1 HL081629 (G.R.U.). Questo progetto è stato sostenuto dalla Thoracic Surgery Foundation for Research and Education (TSFRE) Research Grant (PI: G. Ailawadi). Il contenuto è di esclusiva responsabilità degli autori e non rappresenta necessariamente le opinioni della NHLBI o del TSFRE. Ringraziamo Anthony Herring e Cindy Dodson per le loro conoscenze e competenze tecniche.
Materiali
| Name | Company | Catalog Number | Comments |
| Angiocatheter (22G) | Used for ET Tube | ||
| Dumont Tweezers; Pattern #7 x2 | Roboz | RS-4982 | |
| Graefe Tissue Forceps | Roboz | RS-5158 | |
| Harms Forceps x2 | Roboz | RS-5097 | |
| Intracardiac Needle Holder; Extra Delicate; Carbide Jaws; 7" Length | Roboz | RS-7800 | |
| KL 1500 LED Light Source | Leica | 150-400 | |
| M205A Dissction Microscope | Leica | CH 94-35 | |
| Iris Scissors, 11cm, Tungsten Carbide | World Precision Instruments | 500216-G | |
| Metal Clip board | Use with the Mouse Retractor Set | ||
| Mouse Retractor Set | Kent | SURGI-5001 | Need 2 short and 1 tall fixators |
| Mouse Ventilator MiniVent Type 845, 115 V, Power Supply with US Connector | Harvard Apparatus | 73-0043 | MiniVent Ventilator for Mice (Model 845), Single Animal, Volume Controlled |
| Sigma Aldrich | Elastase from porcine pancreas | E0258-50MG | Can be purchased in various size bottles |
| Small Vessel Cauterizer Kit | Fine Science Tools | 18000-00 | Recommend using rechargable AA batteries |
| Spring Scissors, 10.5cm | World Precision Instruments | 14127 | |
| Steril Swabs (Sponges) | Sugi | 31603 | Can be cut to size |
| Surgi Suite Surgical Platform | Kent | Attach to clip board | |
| Tech IV Isoflurane Vap | Jorgensen Laboratories | J0561A | Anesthesia vaporizer |
Riferimenti
- Coady, M. A., et al. What is the appropriate size criterion for resection of thoracic aortic aneurysms. Journal of Thoracic and Cardiovascular Surgery. 113 (3), 489-491 (1997).
- Aggarwal, S., Qamar, A., Sharma, V., Sharma, A. Abdominal aortic aneurysm: A comprehensive review. Experimental and Clinical Cardiology. 16 (1), 11-15 (2011).
- Bickerstaff, L. K., et al. Thoracic aortic aneurysms: a population-based study. Surgery. 92 (6), 1103-1108 (1982).
- Cheng, D., et al. Endovascular aortic repair versus open surgical repair for descending thoracic aortic disease a systematic review and meta-analysis of comparative studies. Journal of the American College of Cardiology. 55 (10), 986-1001 (2010).
- Walsh, S. R., et al. Endovascular stenting versus open surgery for thoracic aortic disease: systematic review and meta-analysis of perioperative results. Journal of Vascular Surgery. 47 (5), 1094-1098 (2008).
- Absi, T. S., et al. Altered patterns of gene expression distinguishing ascending aortic aneurysms from abdominal aortic aneurysms: complementary DNA expression profiling in the molecular characterization of aortic disease. The Journal of Thoracic and Cardiovascular Surgery. 126 (2), 344-357 (2003).
- Ailawadi, G., Eliason, J. L., Upchurch, G. R. Current concepts in the pathogenesis of abdominal aortic aneurysm. Journal of Vascular Surgery. 38 (3), 584-588 (2003).
- Ikonomidis, J. S., et al. A murine model of thoracic aortic aneurysms. Journal of Surgical Research. 115 (1), 157-163 (2003).
- Daugherty, A., Manning, M. W., Cassis, L. A. Angiotensin II promotes atherosclerotic lesions and aneurysms in apolipoprotein E-deficient mice. Journal of Clinical Investigation. 105 (11), 1605-1612 (2000).
- Trachet, B., et al. Ascending Aortic Aneurysm in Angiotensin II-Infused Mice: Formation, Progression, and the Role of Focal Dissections. Arteriosclerosis, Thrombosis, and Vascular Biology. 36 (4), 673-681 (2016).
- Johnston, W. F., et al. Inhibition of interleukin-1beta decreases aneurysm formation and progression in a novel model of thoracic aortic aneurysms. Circulation. 130 (11), 51-59 (2014).
- Pope, N. H., et al. Interleukin-6 Receptor Inhibition Prevents Descending Thoracic Aortic Aneurysm Formation. Annals of Thoracic Surgery. 100 (5), 1620-1626 (2015).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771 (2016).
- Ailawadi, G., et al. A nonintrinsic regional basis for increased infrarenal aortic MMP-9 expression and activity. Journal of Vascular Surgery. 37 (5), 1059-1066 (2003).
- Ruddy, J. M., Jones, J. A., Spinale, F. G., Ikonomidis, J. S. Regional heterogeneity within the aorta: relevance to aneurysm disease. Journal of Thoracic and Cardiovascular Surgery. 136 (5), 1123-1130 (2008).
- Trigueros-Motos, L., et al. Embryological-origin-dependent differences in homeobox expression in adult aorta: role in regional phenotypic variability and regulation of NF-kappaB activity. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (6), 1248-1256 (2013).
- Lu, G. S. G., Davis, J. P., Schaheen, B., Downs, E., Roy, R. J., Ailawadi, G., Upchurch, G. R. A novel chronic advanced staged abdominal aortic aneurysm murine model. Journal of Vascular Surgery. 66 (1), 232-242 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon