É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Modelo cirúrgico murino de elastase tópica induzida por aneurisma de aorta torácica descendente
Neste Artigo
Resumo
Nós descrevemos um protocolo cirúrgico para induzir consistentemente aneurismas aórticos torácicos de descida robustos nos ratos. O procedimento envolve a toracotomia esquerda, a exposição da aorta torácica e a colocação de uma esponja embebida em elastase pancreática suína na parede aórtica.
Resumo
De acordo com o centro de controle de doenças, os aneurismas aórticos (AAs) foram considerados uma das principais causas de morte em todas as raças e ambos os sexos de 1999-2016. Um aneurisma se forma como resultado de enfraquecimento progressivo e eventual dilatação da aorta, que pode romper ou rasgar uma vez que atinge um diâmetro crítico. Os aneurismas da aorta descendente no tórax, denominados aneurismas aórticos torácicos descendentes (dTAA), compõem uma grande proporção de casos de aneurisma nos Estados Unidos. A ruptura de dTAA não contida é quase universalmente letal, e a reparação eletiva tem uma alta taxa de morbidade e mortalidade. O objetivo do nosso modelo é estudar especificamente a dTAA, para elucidar a fisiopatologia da dTAA e procurar alvos moleculares para deter o crescimento ou reduzir o tamanho da dTAA. Por ter um modelo murino para estudar a patologia torácica precisamente, terapias direcionadas podem ser desenvolvidas para testar especificamente a dTAA. O método é baseado na colocação do elastase pancreatic suínos (PPE) diretamente na parede aórtica murino exterior após a exposição cirúrgica. Isso cria uma reação destrutiva e inflamatória, que enfraquece a parede aórtica e permite a formação de aneurisma ao longo de semanas a meses. Embora os modelos murinos possuam limitações, nosso modelo dTAA produz aneurismas robustos de tamanho previsível. Além disso, este modelo pode ser usado para testar alvos genéticos e farmacêuticos que podem prender o crescimento de dTAA ou impedir a ruptura. Em pacientes humanos, intervenções como essas poderiam ajudar a evitar a ruptura do aneurisma e a difícil intervenção cirúrgica.
Introdução
A finalidade deste método é estudar o desenvolvimento, a patofisiologia, e as mudanças estruturais na aorta torácica descendente murino durante a formação do aneurysm aórtico. Nosso modelo oferece um método reprodutível e consistente para induzir aneurismas aórticos torácicos (dtaa) nos ratos que permitem desse modo para o teste de vários inibidores genéticos e farmacológicos. Este trabalho pode ajudar a identificar drogas e terapias genéticas que podem ser traduzidas para uma estratégia de tratamento viável para humanos com doença de dTAA.
dTAAs forma quando a parede da aorta torácica torna-se enfraquecida e dilata ao longo do tempo até atingir um diâmetro crítico quando rasgar ou ruptura pode ocorrer. Clinicamente, a dTAA pode progredir em silêncio, aumentando em tamanho até que a estrutura da parede aórtica seja tão distorcida que eventualmente falhe, com conseqüências catastróficas. Concerningly, os sintomas desenvolvem-se geralmente somente quando o aneurysm alcangou um tamanho perigoso (dilatação de 100-150%) e está no risco elevado para a dissecção ou a ruptura1,2. a ruptura de dtaa é quase universalmente letal3, e o reparo cirúrgico eletivo carreg a morbosidade significativa4,5. Além disso, a maioria de pacientes carreg o diagnóstico de um aneurysm aórtico por aproximadamente 5 anos antes do reparo cirúrgico6,7. Esta janela representa um momento oportuno para intervir não cirurgicamente. Assim, terapias médicas para tratar ou retardar a progressão da dTAA são necessárias e representariam um avanço significativo para o campo da pesquisa de aneurisma. Não há atualmente nenhum tratamento médico para o dTAA disponível, na maior parte por causa de uma compreensão incompleta da patogénese de dTAA.
Nos últimos 20 anos, vários modelos animais da dTAA foram desenvolvidos, mas cada um desses modelos era distinto do nosso e não produziam aneurismas robustos. Um modelo de dTAA murino mais semelhante ao nosso foi desenvolvido por Ikonomidis et al.8, que inclui aplicação direta de CAcl2 à adventícia da aorta. Embora nosso modelo foi adaptado de muitas das técnicas estabelecidas por Ikonomidis, nosso modelo é único em três maneiras separadas. Em primeiro lugar, em nosso modelo a aorta é exposta a elastase tópica por 3-5 minutos, em comparação com 15 minutos de exposição ao CaCl2 . Em segundo lugar, a dilatação aórtica ocorre em 2 semanas, em comparação com 16 semanas no modelo CaCl2 . Por último, nosso modelo produz consistentemente aneurismas de aproximadamente 100% de dilatação, em comparação com as dilatações aórticas de 20-30% produzidas pela aplicação de CaCl2 (que não podem ser verdadeiramente consideradas aneurismas, pois são definidas como um aumento na aorta diâmetro > 50%). Existem outros modelos murinos não cirúrgicos de formação de aneurisma, como o rato de nocaute Apo E, que formam aneurismas robustos com infusão de angiotensina II. Entretanto, esses camundongos desenvolvem aneurismas da aorta torácica suprrenal ou ascendente em vez de aneurismas especificamente na aorta torácica descendente9,10.
O racional para este protocolo é ter uma maneira simples, barata, e tempo apropriada de estudar dtaa em um modelo murino. O modelo do mouse fornece uma oportunidade única para utilizar muitos nocautes genéticos e específicos de células que foram encontrados para ser impactantes em outras doenças vasculares. O uso de nosso modelo específico de Taa tem sido bem recebido e experimentos utilizando-o foram publicados em revistas de alto impacto11,12. A este ponto, o modelo tem sido utilizado para investigar possíveis tratamentos genéticos e farmacológicos que tiveram efeito significativo nos modelos murinos de aneurisma da aorta abdominal (AAA); no entanto, como nosso laboratório expandiu o uso do modelo da dTAA, estamos encontrando alvos exclusivos da formação da dTAA que poderiam ser usados como terapias direcionadas em humanos.
Este modelo é o mais apropriado para os laboratórios que têm capacidades micro-cirúrgicas murino. Embora seja tecnicamente desafiador, ele pode ser executado consistentemente até mesmo por pesquisadores sem experiência cirúrgica prévia. Para um pesquisador sem experiência cirúrgica murina, o modelo pode ser dominado em aproximadamente 20 sessões operatórias (ou aproximadamente 50 camundongos). Para o pesquisador com experiência cirúrgica prévia, o modelo pode ser dominado em 5 sessões operatórias (aproximadamente 20 camundongos). Acreditamos que com um vídeo de alta qualidade, o tempo de maestria pode ser ainda mais reduzido. Depois que a proficiência é conseguida, o procedimento pode ser terminado em 35 minutos para a cirurgia, e 20 minutos para a colheita terminal. Os cirurgiões em nosso laboratório podem completar 10-12 cirurgias completas por dia, com uma taxa de mortalidade operatória de 5-10%. A causa mais comum de mortalidade é a lesão pulmonar após a entrada no tórax, toxicidade anestésica ou rasgo da aorta durante a dissecção. Além da pesquisa da dTAA, este modelo também serve como um guia para o acesso seguro e fácil à aorta torácica e ao hilo pulmonar para pesquisadores que estudam outras intervenções no tórax.
Protocolo
Os protocolos animais foram aprovados pelo Comitê institucional de cuidados e uso de animais da Universidade de Virginia (n º 3634).
1. indução de anestesia e intubação
- Coloque um 8-10-week-old masculino C57BL/6 mouse em uma câmara fechada com fluxo contínuo de 5% isoflurano e mistura de oxigênio para 5 min, até que as respirações são visivelmente retardado.
Nota: diferentes cepas, gêneros e idades de camundongos podem ser usados dependendo do protocolo experimental. Camundongos fêmeas podem ser mais difíceis de intubar por causa do tamanho menor e, portanto, menor via aérea. - Intubar o rato como descrito por Vandivort et al.13.
Nota: a etapa de intubação é a parte mais difícil deste modelo para aprender e executar. Os autores mencionados acima fazem um excelente trabalho explicando as etapas em seu vídeo.
2. fixando o rato à placa cirúrgica
- Conecte o tubo endotraqueal (ET), confirme o aumento do tórax e coloque o mouse na posição decúbito lateral direita. Gire isoflurano para aproximadamente 3% e aplique lubrificação a ambos os olhos. O ventilador deve ser ajustado para fornecer aproximadamente 200 respirs por o minuto e 225 μL do volume maré.
Nota: a toxicidade é rápida se o isoflurano for deixado a 5%. Entretanto, a resposta ao isoflurano é variável assim que a taxa de fluxo anestésica deve ser titulada tal que as contrações diafragmáticas espontâneas ocorrem aproximadamente cada 10-20 s e o oxigenação parece adequado na inspeção de membranas mucous e de tecido expor. - Fixe o tubo do ET à placa com fita. Estenda o braço direito rostralmente assim que a pata dianteira está na linha do nariz e prenda-a com fita.
- Puxe a cauda caudalmente a fim de criar uma linha de tensão entre o braço direito e cauda, produzindo extensão da coluna vertebral.
Nota: fixar a cauda e a pata direita na linha impede a inserção ou o dislodgement do tubo do ET. - Tape a perna esquerda na sua posição natural. Desenhe o braço esquerdo ventralmente sobre a gaze enrolada e a fita para baixo.
3. preparação para a cirurgia
- Raspar o flanco esquerdo do mouse com cortadores elétricos do ombro esquerdo para o abdômen esquerdo.
- Use um aplicador derrubado do algodão para escovar a solução do Betadine sobre o local cirúrgico. Use um novo aplicador com ponta de algodão para escovar 70% de solução de etanol sobre o local cirúrgico. Deixe secar. Coloque um drapejar estéril.
- Cuidado: Assegure-se de que todo o etanol esteja completamente seco antes de proceder à medida que o electrocautério é utilizado e pode inflamar o etanol.
4. entrada no tórax
- Faça uma incisão lateral de 1 cm no ponto médio do hemitórax usando tesouras cirúrgicas. Use eletrocautério portátil para dividir as camadas musculares até que as costelas são visíveis.
- Cauterizar diretamente uma parcela de 2 milímetros do reforço.
Nota: quando utilizar electrocautério na costela, observar a frequência respiratória espontânea. Se o rato tem uma contração diafragmática durante o cauterização, a ponta pode entrar no tórax e perfurar o pulmão, que é geralmente fatal neste modelo. - Usando um aplicador molhado, fino do algodão-derrubado no espaço do reforço superior à parcela cauterizada, gire a ponta em cima do tecido para quebrar no espaço pleural. Coloque a esponja molhada de 3 mm x 2 mm no tórax para ajudar a colapsar o pulmão.
Nota: só deixe macio, molhado, esponjas contato com o pulmão como é extremamente delicado. - Use tesouras para cortar ao longo do aspecto superior da costela cauterizada, até que o diafragma é visível.
5. exposição aórtica
- Coloc os afastadores do reforço e use-os para abrir a incisão do toracotomia. Retire cuidadosamente a esponja da superfície do pulmão.
- Coloque a esponja molhada de 6 mm x 4 mm para que ela se cubra com o pulmão, com extremidades apontando rostralmente e caudally. Coloque o retractor pulmonar (largo) na esponja e deslize suavemente o retractor ventralmente até que a aorta torácica descendente seja exposta.
- Use #7 fórceps para dissecar o tecido conjuntivo e a gordura da aorta para uma seção de aproximadamente 5 mm.
Nota: as veias pequenas podem estar funcionando transversalmente através da aorta; Evite rasgá-los durante a dissecção (usando pelo menos 14x ampliação pode ajudar a evitar esta complicação).
6. exposição à elastase
- Saturar 0,5 mm x esponja de 1 mm com 12 μL de elastase pancreática porcina e colocá-lo sobre a superfície exposta da aorta.
Nota: não deixe a esponja tocar no pulmão contralateral. - Após o tempo predeterminado (geralmente 3-5 min), retire a esponja de elastase com #7 fórceps. Retire o retractor pulmonar. Irrigar a cavidade torácica com 1 mL de soro fisiológico estéril.
Nota: Retire o retractor pulmonar antes da irrigação com soro fisiológico, pois permitirá que a esponja do pulmão se torne saturada e macia, facilitando a remoção da superfície do pulmão. - Use laminado 2 "x 2" gaze para absorver a irrigação salina remanescente. Vire isoflurano para baixo para 2%.
7. encerramento do tórax
- Retire a esponja pulmonar. Retire o retractor pulmonar caudal. Retire o retractor pulmonar rostral.
- Coloque 3 interrompido 6-0 suturas não absorvíveis para se opor às costelas, amarrar um nó solto em cada um, mas não amarrar. Tome muito cuidado para não tocar o pulmão com a agulha de sutura.
- Re-inflar o pulmão, oclusando o tubo de saída no ventilador ou por rapidamente soprando 0.5-1.0 mL de ar através do tubo ET, utilizando o 3 caminho parar galo.
Nota: para evitar o Barotrauma, evite o uso excessivo da seringa cheia de ar e não utilize mais de 1,0 mL de ar. - Amarrar suturas não absorvíveis. Reaproximar as camadas musculares com uma sutura de multifilamento absorvível 5-0 em execução. Vire isoflurano para baixo para 1%.
- Pele estreita com 7-10 interrompido 5-0 suturas não absorvíveis. Vire isoflurano para 0%.
8. recuperação de
- Administrar 6 μg (0, 2 mL de uma suspensão de 0,3 mg/mL) de buprenorfina por via subcutânea. Retire a fita do pé direito, cauda, e braço esquerdo seguido pela fita do braço direito.
- Quando o mouse se move extremidades, extubato puxando-o por sua cauda para deslizar fora do tubo ET. Coloque na câmara de alto teor de oxigénio mais quente na posição supina.
Nota: é seguro mover o rato da câmara do oxigênio na gaiola quando pode girar-se sobre à posição ereta normal. Além disso, os camundongos devem ser monitorados quanto a sinais de dor, angústia ou incapacidade de prosperar freqüentemente durante as primeiras 24-48 horas após a cirurgia e forneceu analgesia adicional ou alimentos moles, conforme indicado.
9. exposição do aneurisma aórtico (procedimento de colheita terminal)
Nota: em geral, a colheita tecidual é realizada aos 14 dias, pois isso representa o período de dilatação máxima. No entanto, dependendo do experimento, o tempo de procedimento de colheita pode ser realizado a qualquer momento entre 3 dias e 4 + semanas, dependendo do experimento.
- Intubar e fixe o rato ao campo operativo como descrito acima (seções 1-3). Use tesouras para Incisar a pele medialmente do flanco esquerdo ao abdômen central que toma o cuidado para não entrar no peritoneum.
- Incise a pele do flanco esquerdo dorsal rostralmente ao nível do ombro esquerdo. Em seguida, incise em um ângulo de 90 ° através da axila para o esterno.
Nota: esta incisão deve cercar completamente a incisão original da pele. - Usando o cauterização, dissecar a aleta da pele para o aspecto ventral do rato, expondo o hemithorax esquerdo. Use tesouras para entrar no abdômen e incise ao longo da margem costal esquerda de ventral a dorsal para expor a parte inferior do diafragma esquerdo. A borda mais lateral do diafragma pode abrir o que é desejado.
- Se não for criado com a etapa anterior, incise o diafragma em sua borda mais lateral. Coloc a ponta do cauterização neste furo e cauterizar o diafragma fora da margem costal ao processo do xyphoid. Usando um aplicador de ponta de algodão com ponta úmida, gentilmente libertar o pulmão de aderências para a parede torácica e empurrar o pulmão medialmente.
Nota: se aderências não sair facilmente da parede torácica, use cauterização para removê-los; Isso ajuda a evitar rasgar o pulmão que pode causar sangramento intenso. - Cauterize o interior da parede torácica do canelado para a margem costal, dorsal para a linha axilar média, mas pelo menos 2 mm da aorta. Corte a parede torácica ao longo da linha cauterizada.
Nota: esta técnica evita o sangramento das artérias intercostais. - Corte ao longo da margem superior de uma costela e, em seguida, caudalmente ao longo da borda lateral do esterno, removendo a caixa torácica esquerda. Coloque retratores no pulmão e puxe medialmente. Coloc o retractor no diafragma e desenhe caudalmente para expor tanto a aorta como possível.
- Use um aplicador com ponta de algodão seco para remover aderências do aneurisma aórtico e de um segmento distal não afetado. Meça o diâmetro do segmento de controle não afetado e a porção mais larga do aneurisma tratado com elastase usando a micrometria de vídeo.
Nota: as medições de micrometria de vídeo são usadas para calcular a porcentagem de dilatação do segmento aneurismático em comparação com um segmento de controle com a equação 1. Um segmento de controle de 0,5 mm distal ao segmento aneurismático 1 é selecionado.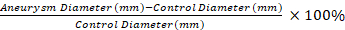 Equação 1
Equação 1
- Segure a aorta com o fórceps de Harms, apenas longe do ponto de origem ao segmento Tratado. Use tesouras para cortar distal para fórceps, em seguida, dissecar a aorta fora da coluna vertebral. Corte a aorta proximal ao segmento Tratado e remova a aorta Aneurysmal.
- Usando uma seringa e uma agulha da tuberculina, lave o lúmen aórtico com soro fisiológico e processe o tecido como desejado.
Resultados
A aplicação do nosso protocolo resulta em dTAA robusta em camundongos em comparação com os controles salinos. As TAAs desenvolvidas são de forma fusiforme e ocorrem apenas na porção tratada da aorta (Figura 1 e Figura 2)11. A Figura 2 mostra um exemplo de medição de micrometria de vídeo na colheita de tecidos. Usando a equação 1, a dilatação aórtica é de 130% neste exemplo.
Discussão
A aorta torácica e abdominal é cellularmente e Embriologicamente distinta, que é relevante à doença Aneurysmal14,15,16. Portanto, é necessário um modelo animal específico para o estudo da TAA. Embora outros modelos de dTAA murino tenham sido publicados8, o nosso é o único modelo para criar dilatação aórtica torácica descendente que pode ser considerada verdadeiramente aneurismática (mais de...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado pelas doações de desenvolvimento de cientistas AHA 14SDG18730000 (M.S.), NIH K08 HL098560 (GA) e RO1 HL081629 (GRU). Este projeto foi apoiado pela Fundação de cirurgia torácica para pesquisa e educação (TSFRE) Research Grant (PI: G. Ailawadi). O conteúdo é unicamente da responsabilidade dos autores e não representa necessariamente os pontos de vista do NHLBI ou do TSFRE. Agradecemos Anthony Herring e Cindy Dodson por seu conhecimento e perícia técnica.
Materiais
| Name | Company | Catalog Number | Comments |
| Angiocatheter (22G) | Used for ET Tube | ||
| Dumont Tweezers; Pattern #7 x2 | Roboz | RS-4982 | |
| Graefe Tissue Forceps | Roboz | RS-5158 | |
| Harms Forceps x2 | Roboz | RS-5097 | |
| Intracardiac Needle Holder; Extra Delicate; Carbide Jaws; 7" Length | Roboz | RS-7800 | |
| KL 1500 LED Light Source | Leica | 150-400 | |
| M205A Dissction Microscope | Leica | CH 94-35 | |
| Iris Scissors, 11cm, Tungsten Carbide | World Precision Instruments | 500216-G | |
| Metal Clip board | Use with the Mouse Retractor Set | ||
| Mouse Retractor Set | Kent | SURGI-5001 | Need 2 short and 1 tall fixators |
| Mouse Ventilator MiniVent Type 845, 115 V, Power Supply with US Connector | Harvard Apparatus | 73-0043 | MiniVent Ventilator for Mice (Model 845), Single Animal, Volume Controlled |
| Sigma Aldrich | Elastase from porcine pancreas | E0258-50MG | Can be purchased in various size bottles |
| Small Vessel Cauterizer Kit | Fine Science Tools | 18000-00 | Recommend using rechargable AA batteries |
| Spring Scissors, 10.5cm | World Precision Instruments | 14127 | |
| Steril Swabs (Sponges) | Sugi | 31603 | Can be cut to size |
| Surgi Suite Surgical Platform | Kent | Attach to clip board | |
| Tech IV Isoflurane Vap | Jorgensen Laboratories | J0561A | Anesthesia vaporizer |
Referências
- Coady, M. A., et al. What is the appropriate size criterion for resection of thoracic aortic aneurysms. Journal of Thoracic and Cardiovascular Surgery. 113 (3), 489-491 (1997).
- Aggarwal, S., Qamar, A., Sharma, V., Sharma, A. Abdominal aortic aneurysm: A comprehensive review. Experimental and Clinical Cardiology. 16 (1), 11-15 (2011).
- Bickerstaff, L. K., et al. Thoracic aortic aneurysms: a population-based study. Surgery. 92 (6), 1103-1108 (1982).
- Cheng, D., et al. Endovascular aortic repair versus open surgical repair for descending thoracic aortic disease a systematic review and meta-analysis of comparative studies. Journal of the American College of Cardiology. 55 (10), 986-1001 (2010).
- Walsh, S. R., et al. Endovascular stenting versus open surgery for thoracic aortic disease: systematic review and meta-analysis of perioperative results. Journal of Vascular Surgery. 47 (5), 1094-1098 (2008).
- Absi, T. S., et al. Altered patterns of gene expression distinguishing ascending aortic aneurysms from abdominal aortic aneurysms: complementary DNA expression profiling in the molecular characterization of aortic disease. The Journal of Thoracic and Cardiovascular Surgery. 126 (2), 344-357 (2003).
- Ailawadi, G., Eliason, J. L., Upchurch, G. R. Current concepts in the pathogenesis of abdominal aortic aneurysm. Journal of Vascular Surgery. 38 (3), 584-588 (2003).
- Ikonomidis, J. S., et al. A murine model of thoracic aortic aneurysms. Journal of Surgical Research. 115 (1), 157-163 (2003).
- Daugherty, A., Manning, M. W., Cassis, L. A. Angiotensin II promotes atherosclerotic lesions and aneurysms in apolipoprotein E-deficient mice. Journal of Clinical Investigation. 105 (11), 1605-1612 (2000).
- Trachet, B., et al. Ascending Aortic Aneurysm in Angiotensin II-Infused Mice: Formation, Progression, and the Role of Focal Dissections. Arteriosclerosis, Thrombosis, and Vascular Biology. 36 (4), 673-681 (2016).
- Johnston, W. F., et al. Inhibition of interleukin-1beta decreases aneurysm formation and progression in a novel model of thoracic aortic aneurysms. Circulation. 130 (11), 51-59 (2014).
- Pope, N. H., et al. Interleukin-6 Receptor Inhibition Prevents Descending Thoracic Aortic Aneurysm Formation. Annals of Thoracic Surgery. 100 (5), 1620-1626 (2015).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771 (2016).
- Ailawadi, G., et al. A nonintrinsic regional basis for increased infrarenal aortic MMP-9 expression and activity. Journal of Vascular Surgery. 37 (5), 1059-1066 (2003).
- Ruddy, J. M., Jones, J. A., Spinale, F. G., Ikonomidis, J. S. Regional heterogeneity within the aorta: relevance to aneurysm disease. Journal of Thoracic and Cardiovascular Surgery. 136 (5), 1123-1130 (2008).
- Trigueros-Motos, L., et al. Embryological-origin-dependent differences in homeobox expression in adult aorta: role in regional phenotypic variability and regulation of NF-kappaB activity. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (6), 1248-1256 (2013).
- Lu, G. S. G., Davis, J. P., Schaheen, B., Downs, E., Roy, R. J., Ailawadi, G., Upchurch, G. R. A novel chronic advanced staged abdominal aortic aneurysm murine model. Journal of Vascular Surgery. 66 (1), 232-242 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados