Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Murine Хирургическая модель Томатная Эластаза индуцированной спуск торакальной аортальной аневризмы
В этой статье
Резюме
Мы описываем хирургический протокол, чтобы последовательно индуцировать надежные нисходящие аневризмы грудной аорты у мышей. Процедура включает в себя левую торакотомию, воздействие грудной аорты и размещение губки, пропитанной свиной эластазой поджелудочной железы на стенке аорты.
Аннотация
По данным Центра по контролю заболеваний, аневризмы аорты (АА) считались основной причиной смерти во всех расах и обоих полов в 1999-2016 годах. Аневризма образуется в результате постепенного ослабления и возможного расширения аорты, которая может разрываться или разрываться, как только она достигает критического диаметра. Аневризмы нисходящей аорты в груди, называемые нисходящей аневризма миорфизма грудной аорты (dTAA), составляют большую долю случаев аневризмы в Соединенных Штатах. Несдержанный разрыв dTAA почти повсеместно летальный, и факультативное ремонт имеет высокий уровень заболеваемости и смертности. Целью нашей модели является изучение dTAA специально, чтобы выяснить патофизиологию dTAA и искать молекулярные цели, чтобы остановить рост или уменьшить размер dTAA. Имея модель мурин для изучения грудной патологии точно, целевые терапии могут быть разработаны специально для тестирования dTAA. Метод основан на размещении свиной поджелудочной эластаза (СИЗ) непосредственно на внешней стенке морины после хирургического воздействия. Это создает разрушительную и воспалительную реакцию, которая ослабляет стенку аорты и позволяет образование аневризмы в течение нескольких недель до нескольких месяцев. Хотя модели murine обладают ограничениями, наша модель dTAA производит надежные аневризмы предсказуемого размера. Кроме того, эта модель может быть использована для тестирования генетических и фармацевтических целей, которые могут остановить рост dTAA или предотвратить разрыв. У пациентов с людьми подобные вмешательства могут помочь избежать разрыва аневризмы и сложного хирургического вмешательства.
Введение
Целью данного метода является изучение развития, патофизиологии и структурных изменений в моринической нисходящей грудной аорте во время формирования аневризмы аорты. Наша модель предлагает воспроизводимый и последовательный метод индуцирования аневризмы грудной аорты (dTAA) у мышей, что позволяет для тестирования различных генетических и фармакологических ингибиторов. Эта работа может помочь определить наркотики и генной терапии, которые могут быть переведены на жизнеспособную стратегию лечения для людей с болезнью dTAA.
dTAAs форме, когда стенка грудной аорты становится ослабленным и охватывает с течением времени до достижения критического диаметра, когда разрыв или разрыв может произойти. Клинически, dTAA может прогрессировать в тишине, увеличивая в размере до тех пор пока структура стены аорты не будет настолько искажена что она окончательно терпит неудачу, с катастрофическими последствиями. Что касается, симптомы обычно развиваются только тогда, когда аневризма достигла опасного размера (100-150% расширение) и находится на высоком риске для вскрытия или разрыв1,2. разрыв dTAA почти повсеместно смертельной3, и факультативного хирургического ремонта несет значительную заболеваемость4,5. Кроме того, большинство пациентов переносят диагноз аневризмы аортыв течение примерно 5 лет до хирургического ремонта 6,7. Это окно представляет собой подходящее время для вмешательства без хирургического вмешательства. Таким образом, медицинские методы лечения или медленного прогрессирования dTAA необходимы и будет представлять собой значительный прогресс в области исследований аневризмы. В настоящее время нет доступных медицинских процедур для dTAA, главным образом из-за неполного понимания патогенеза dTAA.
За последние 20 лет было разработано несколько моделей dTAA животных, но каждая из этих моделей отличалась от наших собственных и не производила надежных аневризм. Модель murine dTAA, наиболее похожая на нашу, быларазработана компанией Ikonomidis et al. 8, которая включает в себя прямое применение CaCl2 к адвенитии аорты. Хотя наша модель была адаптирована из многих методов, изложенных Ikonomidis, наша модель уникальна в трех отдельных направлениях. Во-первых, в нашей модели аорта подвергается воздействию актуальных эластаза в течение 3-5 минут, по сравнению с 15 минут CaCl2 воздействия. Во-вторых, расширение аорты происходит в 2 недели, по сравнению с 16 недель в модели CaCl 2. Наконец, наша модель последовательно производит аневризмы примерно 100% расширения, по сравнению с аорты расширения 20-30% производства CaCl2 приложения (которые не могут быть действительно считаются аневризмы, поскольку они определяются как увеличение аорты диаметра 50%). Существуют и другие нехирургические модерации образования аневризмы, такие как мышь Apo E knockout, которые образуют надежные аневризмы с настоем ангиотензина II. Тем не менее, эти мыши развиваются над-почечной или восходящей грудной аортальной аневризмы, а не аневризмы конкретно в нисходящей грудной аорты9,10.
Рациональным для этого протокола является простой, недорогой, и время подходящий способ изучения dTAA в модели мурин. Мышь модель предоставляет уникальную возможность использовать многие генетические и клеточных нокаутов, которые были найдены, чтобы быть impactful в других сосудистых заболеваний. Использование нашей конкретной модели TAA была хорошо принята и эксперименты с ее использованием были опубликованы в высокоэффективных журналах11,12. К этому моменту модель использовалась для исследования возможных генетических и фармакологических методов лечения, которые оказали значительное влияние на моделя брюшной аневризмы аорты (AAA); однако, поскольку наша лаборатория расширила использование модели dTAA, мы находим цели, уникальные для формирования dTAA, которые могут быть использованы в качестве целевой терапии у людей.
Эта модель наиболее подходит для лабораторий, которые имеют микрохирургические возможности мурина. Хотя это технически сложной задачей, она может быть выполнена последовательно даже исследователями без предварительного хирургического опыта. Для исследователя, не опыт работы с хирургическим опытом, модель может быть освоена примерно в 20 оперативных сеансах (или примерно в 50 мышах). Для исследователя с опытом работы с хирургическим вмешательством, модель может быть освоена в 5 оперативных сессий (примерно 20 мышей). Мы считаем, что с высококачественным видео, время для освоения может быть еще больше сокращена. После достижения квалификации, процедура может быть завершена в течение 35 минут для операции, и 20 минут для конечного урожая. Хирурги в нашей лаборатории могут выполнять 10-12 полных операций в день, с оперативной смертности 5-10%. Наиболее распространенной причиной смертности является повреждение легких при поступлении в грудь, анестетик токсичность или разрыв аорты во время вскрытия. В дополнение к исследованиям dTAA, эта модель также служит в качестве руководства для безопасного и легкого доступа к грудной аорты и легких hilum для исследователей, изучающих другие вмешательства в груди.
Access restricted. Please log in or start a trial to view this content.
протокол
Протоколы о животных были одобрены Институциональным комитетом по уходу и использованию животных Университета Вирджинии (No 3634).
1. Индукция анестезии и интубации
- Поместите 8-10-недельного мужчину C57BL/6 мышь в закрытой камере с непрерывным потоком 5% изофлуран и кислородной смеси в течение 5 минут, пока дыхание заметно не замедлилось.
ПРИМЕЧАНИЕ: Различные штаммы, пол и возраст мышей могут быть использованы в зависимости от экспериментального протокола. Самки мышей может быть труднее интубировать из-за меньшего размера и, следовательно, меньше дыхательных путей. - Интубировать мышь, как описано Vandivort и др.13.
ПРИМЕЧАНИЕ: Шаг интубации является наиболее сложной частью этой модели, как учиться, так и выполнять. Вышеупомянутые авторы делают отличную работу, объясняя шаги в их видео.
2. Обеспечение мыши к хирургической доске
- Подключите эндотрахеальную трубку (ET), подтвердите рост груди и положите мышь в нужное боковое положение декубита. Поверните изофлюран примерно до 3% и нанесите смазку на оба глаза. Вентилятор должен быть установлен, чтобы обеспечить примерно 200 вдохов в минуту и 225 л приливного объема.
ПРИМЕЧАНИЕ: Токсичность быстро, если изофлуран остается на 5%. Тем не менее, ответ на изофлуран является переменной, поэтому анестезирующего потока скорость должна быть титра таким образом, что спонтанные диафрагмические сокращения происходят примерно каждые 10-20 с и кислородная система представляется адекватной при осмотре слизистых оболочек и подвергаются ткани. - Закрепите ET трубку к доске с лентой. Вытяните правую руку ростралли, чтобы передняя лапа была в соответствии с носом и закрепите ее лентой.
- Потяните хвост caudally для того, чтобы создать линию напряженности между правой рукой и хвостом, производя расширение позвоночника.
ПРИМЕЧАНИЕ: Обеспечение как хвоста, так и правой лапы в линии предотвращает вставку или выбивание ET трубки. - Лента левой ноги в ее естественном положении. Нарисуйте левую руку вентрально над прокатной марлей и лентой вниз.
3. Подготовка к операции
- Бритье левый фланг мыши с электрическими клиперами от левого плеча до левого живота.
- Используйте хлопок наконечником аппликатор аппликатор щеткой бетадин решение над хирургическим сайтом. Используйте новый хлопок наконечником аппликатор аппликатор щеткой 70% этанола раствор над хирургическим сайтом. Дайте высохнуть. Поместите стерильную драпировку.
- ВНИМАНИЕ: Убедитесь, что весь этанол полностью высушивается перед началом работы в качестве электрокаутерии используется и может воспламенить этанол.
4. Вступление в грудную клетку
- Сделайте боковой разрез 1 см в середине гемиторакса с помощью хирургических ножниц. Используйте портативный электрокаутер, чтобы разделить мышечные слои, пока ребра не видны.
- Непосредственно прижмете 2 мм части ребра.
ПРИМЕЧАНИЕ: При использовании электрокаутерии на ребре, наблюдать за спонтанной частотой дыхания. Если мышь имеет диафрагмическое сокращение во время каутерии, наконечник может войти в грудную клетку и прокол легких, которые, как правило, фатальным в этой модели. - Использование смачивается, штраф хлопка наконечником аппликатора в пространстве ребра превосходит прижигают часть, поверните кончик на ткани, чтобы ворваться в плеврального пространства. Поместите смачиваемые 3 мм х 2 мм губки в грудную клетку, чтобы помочь крах легких.
ПРИМЕЧАНИЕ: Только пусть мягкие, влажные, губки контакт легких, как это очень деликатный. - Используйте ножницы, чтобы разрезать вдоль верхнего аспекта прижига, пока диафрагма не видна.
5. Воздействие аорты
- Поместите ребра ребра и использовать их, чтобы открыть разрез торакотомии. Аккуратно снимите губку с поверхности легких.
- Место смачивается 6 мм х 4 мм губка так, что он лежит покрытие легких, с концами, указывающими на ростии и caudally. Поместите (широкий плоский) легких ретрактор на губку и осторожно слайд ретрактор ventrally до нисходящего грудной аорты подвергается.
- Используйте #7 щипцдляем, чтобы вскрыть соединительную ткань и жир от аорты для примерно 5 мм раздела.
ПРИМЕЧАНИЕ: Малые вены могут работать поперечно через аорту; избегать разрыва их во время вскрытия (использование по крайней мере 14x увеличение может помочь избежать этого осложнения).
6. Воздействие эластаза
- Насыщайте губку 0,5 мм х 1 мм 1 л с 12 л свиной эластази поджелудочной железы и поместите ее на обнажённую поверхность аорты.
ПРИМЕЧАНИЕ: Не позволяйте губке коснуться контралатерального легкого. - После заданного времени (обычно 3-5 мин) удалите губку эластаза #7 щипками. Удалите легкий ретрактор. Орошать грудную полость с 1 мл стерильного солья.
ПРИМЕЧАНИЕ: Удалить легких ретрактор перед орошением с сольнием, как это позволит губки легких, чтобы стать насыщенным и мягким, что делает его легче удалить с поверхности легких. - Используйте прокат 2 "х 2" марли, чтобы поглотить оставшиеся солевой орошения. Поверните изолюран до 2%.
7. Закрытие грудной клетки
- Удалите губку для легких. Удалите каудальный втягиватель легких. Удалите ростральный втягиватель легких.
- Место 3 прервано 6-0 непоглощаемых швов, чтобы противостоять ребрам, связать свободный узел в каждом, но не связать. Примите большое внимательность для того чтобы не коснуться легкя с иглой швы.
- Повторно надуть легкие, окклюзии из-за трубки оттока на вентилятор евлю или быстро дует 0,5-1,0 мл воздуха через ET трубки, используя 3 способ остановить петух.
ПРИМЕЧАНИЕ: Чтобы избежать баротравмы, избегайте чрезмерного использования заполненного воздухом шприца и используйте не более 1,0 мл воздуха. - Завяжите непоглощаемые швы. Повторное приближение мышечных слоев с бегущим 5-0 абсорбируемым многофиламентным швом. Поверните изолюран до 1%.
- Закройте кожу с 7-10 прерванными 5-0 непоглощаемыми швами. Поверните изофлюран до 0%.
8. Восстановление
- Администрирование 6 мкг (0,02 мл 0,3 мг/мл суспензии) бупренорфина подкожно. Снимите ленту с правой ноги, хвоста и левой руки с последующей лентой правой руки.
- Когда мышь перемещает конечности, extubate, потянув его за хвост, чтобы соскользнуть с et трубки. Место в высоком содержании кислорода теплее камеры в положении на спине.
ПРИМЕЧАНИЕ: Безопасно перемещать мышь из кислородной камеры в клетку, когда она может перевернуться в нормальное положение стоя. Кроме того, мышей следует контролировать на наличие признаков боли, бедствия или неспособности процветать часто в течение первых 24-48 часов после операции и при условии, дополнительные обезболивания или мягкой пищи, как указано.
9. Воздействие аневризмы аорты (терминальная процедура сбора урожая)
ПРИМЕЧАНИЕ: В целом, сбор тканей проводится в течение 14 дней, так как это представляет собой период максимального расширения. Однако, в зависимости от эксперимента, время проведения процедуры сбора урожая может быть проведено в любое время от 3 дней до 4 недель, в зависимости от эксперимента.
- Интубировать и защищать мышь в оперативное поле, как описано выше (разделы 1-3). Используйте ножницы, чтобы вырезовать кожу медиально от левого фланга до центрального живота, заботясь, чтобы не войти в брюшную полость.
- Разрезайте кожу с торцевого левого фланга ростально до уровня левого плеча. Затем прорезывайте под углом 90 градусов через аксилку к грудине.
ПРИМЕЧАНИЕ: Этот разрез должен полностью окружить оригинальный разрез кожи. - Используя каутерию, вскрыть кожу лоскут к брюшной аспект мыши, подвергая левый гемиторакс. Используйте ножницы, чтобы войти в живот и резцы вдоль левой дорогостоящей маржи от брюшной до вдовы подвергать нижней левой диафрагмы. Боковой самый край диафрагмы может открыться, который является желательным.
- Если не создан с предыдущим шагом, резцедить диафрагмы на ее самый боковой край. Поместите кончик каутерии в это отверстие и прижигайте диафрагму от дорогостоящего края к процессу ксифоида. Использование влажной тонкой наконечником хлопка наконечником аппликатор, мягко освободить легкое от спаек к груди стенки и нажмите легких медиально.
ПРИМЕЧАНИЕ: Если спайки не легко оторваться от грудной стенки, используйте каутери, чтобы удалить их; это помогает избежать разрыва легких, которые могут вызвать сильное кровотечение. - Прижтените внутреннюю часть грудной стенки от ребра один до костлявого края, в доиоты до середины подмышечной линии, но по крайней мере 2 мм от аорты. Вырезать грудную стенку вдоль прикожной линии.
ПРИМЕЧАНИЕ: Этот метод позволяет избежать кровотечения из межреберных артерий. - Вырезать вдоль верхнего края ребра один, а затем caudally вдоль бокового края грудины, удалив левую грудную клетку. Поместите втягивания в легкие и потяните посредничьно. Поместите ретрактор на диафрагму и нарисуйте caudally, чтобы разоблачить как можно больше аорты, как это возможно.
- Используйте сухой хлопчатобумажный аппликатор для удаления спаек из аневризмы аорты и нетронутого дистального сегмента. Измерьте диаметр незатронутого сегмента управления и широчайшую часть эластазной обработанной аневризмы с помощью видеомикрометрии.
ПРИМЕЧАНИЕ: Измерения микрометрии видео используются для расчета процентного расширения сегмента аневризмы по сравнению с контрольным сегментом с Equation 1. Выбран сегмент управления, который составляет 0,5 мм дистального к аневризму сегмента 1.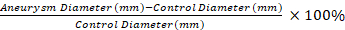 Уравнение 1
Уравнение 1
- Возьмите аорту с щипцы Хармс, просто дистальный к обработанному сегменту. Используйте ножницы, чтобы сократить дисталь ные щипцы, а затем вскрыть аорту от позвоночника. Вырезать аорты проксимал для лечения сегмента и удалить аневризмальной аорты.
- Используя трубачиновый шприц и иглу, промойте просвет аорты сольником и обработайте ткани по желанию.
Access restricted. Please log in or start a trial to view this content.
Результаты
Применение нашего протокола приводит к надежному dTAA у мышей по сравнению с сольным управлением. Разработанные TAAs являются fusiform в форме и происходят только в обработанной части аорты(Рисунок 1 и Рисунок 2)11. На рисунке 2 показа?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Торакальная и брюшная аорта клеточно и эмбрионально отличаются, что имеет отношение к аневризмальной болезни14,15,16. Поэтому необходима конкретная модель животных для изучения TAA. Хотя другие модели murine dTAA были опубликованы8,
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана AHA Scientist Development Grant 14SDG18730000 (M.S.), NIH K08 HL098560 (G.A.) и RO1 HL081629 (G.R.U.) грантами. Этот проект был поддержан Торакальной хирургии Фонд исследований и образования (TSFRE) научно-исследовательский грант (PI: Г. Ailawadi). Содержание является исключительно ответственностью авторов и не обязательно отражает мнение NHLBI или TSFRE. Мы благодарим Энтони Херринга и Синди Додсон за их знания и технический опыт.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Angiocatheter (22G) | Used for ET Tube | ||
| Dumont Tweezers; Pattern #7 x2 | Roboz | RS-4982 | |
| Graefe Tissue Forceps | Roboz | RS-5158 | |
| Harms Forceps x2 | Roboz | RS-5097 | |
| Intracardiac Needle Holder; Extra Delicate; Carbide Jaws; 7" Length | Roboz | RS-7800 | |
| KL 1500 LED Light Source | Leica | 150-400 | |
| M205A Dissction Microscope | Leica | CH 94-35 | |
| Iris Scissors, 11cm, Tungsten Carbide | World Precision Instruments | 500216-G | |
| Metal Clip board | Use with the Mouse Retractor Set | ||
| Mouse Retractor Set | Kent | SURGI-5001 | Need 2 short and 1 tall fixators |
| Mouse Ventilator MiniVent Type 845, 115 V, Power Supply with US Connector | Harvard Apparatus | 73-0043 | MiniVent Ventilator for Mice (Model 845), Single Animal, Volume Controlled |
| Sigma Aldrich | Elastase from porcine pancreas | E0258-50MG | Can be purchased in various size bottles |
| Small Vessel Cauterizer Kit | Fine Science Tools | 18000-00 | Recommend using rechargable AA batteries |
| Spring Scissors, 10.5cm | World Precision Instruments | 14127 | |
| Steril Swabs (Sponges) | Sugi | 31603 | Can be cut to size |
| Surgi Suite Surgical Platform | Kent | Attach to clip board | |
| Tech IV Isoflurane Vap | Jorgensen Laboratories | J0561A | Anesthesia vaporizer |
Ссылки
- Coady, M. A., et al. What is the appropriate size criterion for resection of thoracic aortic aneurysms. Journal of Thoracic and Cardiovascular Surgery. 113 (3), 489-491 (1997).
- Aggarwal, S., Qamar, A., Sharma, V., Sharma, A. Abdominal aortic aneurysm: A comprehensive review. Experimental and Clinical Cardiology. 16 (1), 11-15 (2011).
- Bickerstaff, L. K., et al. Thoracic aortic aneurysms: a population-based study. Surgery. 92 (6), 1103-1108 (1982).
- Cheng, D., et al. Endovascular aortic repair versus open surgical repair for descending thoracic aortic disease a systematic review and meta-analysis of comparative studies. Journal of the American College of Cardiology. 55 (10), 986-1001 (2010).
- Walsh, S. R., et al. Endovascular stenting versus open surgery for thoracic aortic disease: systematic review and meta-analysis of perioperative results. Journal of Vascular Surgery. 47 (5), 1094-1098 (2008).
- Absi, T. S., et al. Altered patterns of gene expression distinguishing ascending aortic aneurysms from abdominal aortic aneurysms: complementary DNA expression profiling in the molecular characterization of aortic disease. The Journal of Thoracic and Cardiovascular Surgery. 126 (2), 344-357 (2003).
- Ailawadi, G., Eliason, J. L., Upchurch, G. R. Current concepts in the pathogenesis of abdominal aortic aneurysm. Journal of Vascular Surgery. 38 (3), 584-588 (2003).
- Ikonomidis, J. S., et al. A murine model of thoracic aortic aneurysms. Journal of Surgical Research. 115 (1), 157-163 (2003).
- Daugherty, A., Manning, M. W., Cassis, L. A. Angiotensin II promotes atherosclerotic lesions and aneurysms in apolipoprotein E-deficient mice. Journal of Clinical Investigation. 105 (11), 1605-1612 (2000).
- Trachet, B., et al. Ascending Aortic Aneurysm in Angiotensin II-Infused Mice: Formation, Progression, and the Role of Focal Dissections. Arteriosclerosis, Thrombosis, and Vascular Biology. 36 (4), 673-681 (2016).
- Johnston, W. F., et al. Inhibition of interleukin-1beta decreases aneurysm formation and progression in a novel model of thoracic aortic aneurysms. Circulation. 130 (11), Suppl 1 51-59 (2014).
- Pope, N. H., et al. Interleukin-6 Receptor Inhibition Prevents Descending Thoracic Aortic Aneurysm Formation. Annals of Thoracic Surgery. 100 (5), 1620-1626 (2015).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771(2016).
- Ailawadi, G., et al. A nonintrinsic regional basis for increased infrarenal aortic MMP-9 expression and activity. Journal of Vascular Surgery. 37 (5), 1059-1066 (2003).
- Ruddy, J. M., Jones, J. A., Spinale, F. G., Ikonomidis, J. S. Regional heterogeneity within the aorta: relevance to aneurysm disease. Journal of Thoracic and Cardiovascular Surgery. 136 (5), 1123-1130 (2008).
- Trigueros-Motos, L., et al. Embryological-origin-dependent differences in homeobox expression in adult aorta: role in regional phenotypic variability and regulation of NF-kappaB activity. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (6), 1248-1256 (2013).
- Lu, G. S. G., Davis, J. P., Schaheen, B., Downs, E., Roy, R. J., Ailawadi, G., Upchurch, G. R. A novel chronic advanced staged abdominal aortic aneurysm murine model. Journal of Vascular Surgery. 66 (1), 232-242 (2017).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены