JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
국소 엘라스타아제의 뮤린 외과 모델은 내림차순 흉부 대동맥류를 유도
요약
우리는 마우스에 있는 강력한 내림차순 흉부 대동맥류를 일관되게 유도하는 외과 프로토콜을 기술합니다. 절차는 왼쪽 흉부 절제술, 흉부 대동맥 노출, 대동맥 벽에 돼지 췌장 엘라스타제에 담근 스폰지의 배치를 포함한다.
초록
질병 통제 센터에 따르면, 대동맥류 (AA)는 1999-2016년의 모든 인종과 남녀 모두에서 주요 사망 원인으로 간주되었습니다. 동맥류는 임계 직경에 도달하면 파열되거나 찢어질 수 있는 대동맥의 점진적인 약화 및 최종 팽창의 결과로 형성됩니다. 가슴에 내림차순 대동맥의 동맥류, 하강 흉부 대동맥류라고 (dTAA), 미국에서 동맥류 케이스의 큰 비율을 구성. 포함되지 않은 dTAA 파열은 거의 보편적으로 치명적이며, 선택적 수리는 사망률과 사망률이 높습니다. 우리의 모형의 목적은 dTAA를 구체적으로 공부하고, dTAA의 병리생리학을 해명하고 성장을 중단하거나 dTAA의 크기를 감소시키기 위하여 분자 표적을 검색하는 것입니다. 흉부 병리학을 정확하게 연구하는 뮤린 모델을 가함으로써, 표적 치료법은 dTAA를 구체적으로 시험하기 위해 개발될 수 있다. 이 방법은 외과 적 노출 후 외부 뮤린 대동맥 벽에 직접 돼지 췌장 엘라스타제 (PPE)의 배치를 기반으로합니다. 이것은 대동맥 벽을 약화시키고 몇 주에서 몇 달에 걸쳐 동맥류 형성을 허용하는 파괴적이고 선동적인 반응을 일으킵니다. 뮤린 모델은 한계가 있지만, 우리의 dTAA 모델은 예측 가능한 크기의 강력한 동맥류를 생성합니다. 더욱이, 이 모형은 dTAA 성장을 체포하거나 파열을 방지할 수 있는 유전과 약제학적 표적을 시험하기 위하여 이용될 수 있습니다. 인간 적인 환자에서는, 이와 같은 내정간섭은 동맥류 파열, 및 어려운 외과 적 개입을 피하는 것을 도울 수 있었습니다.
서문
이 방법의 목적은 대동맥류 형성 동안 유방 내림차순 흉부 대동맥의 발달, 병리생리학 및 구조적 변화를 연구하는 것입니다. 우리의 모형은 다양한 유전과 약리학 억제제의 시험을 허용하는 마우스에 있는 흉부 대동맥류 (dTAA)를 유도하는 재현가능하고 일관된 방법을 제안합니다. 이 일은 dTAA 질병을 가진 인간을 위한 실행 가능한 처리 전략으로 번역될 수 있던 약 과 유전자 치료를 확인하는 것을 도울 수 있습니다.
dTAA는 흉부 대동맥의 벽이 약해지고 찢어지거나 파열될 때 임계 직경에 도달할 때까지 시간이 지남에 따라 팽창할 때 형성됩니다. 임상적으로, dTAA는 대동맥 벽의 구조가 너무 왜곡되어 결국 실패할 때까지 크기가 증가하여 치명적인 결과를 초래할 수 있습니다. 이와 관련하여, 증상은 일반적으로 동맥류가 위험한 크기 (100-150 % 팽창)에 도달하고 해부 또는 파열위험이높은 경우에만 발생합니다 1,2. dTAA 파열은 거의보편적으로 치명적인 3, 및 선택 외과 수리는 상당한 사망률을 운반4,5. 게다가, 대부분의 환자는 외과 수선6,7의앞에 대략 5 년 동안 대동맥류의 진단을 전송합니다. 이 창은 비수술적으로 개입할 수 있는 적절한 시간을 나타냅니다. 따라서, dTAA의 치료 또는 느린 진행을 치료 하는 의료 치료 필요 하 고 동맥 류 연구의 분야에 중요 한 발전을 나타낼 것 이다. dTAA 병인의 불완전한 이해 때문에 현재 유효한 dTAA를 위한 아무 의학 처리도 없습니다.
지난 20 년 동안, 몇몇 dTAA 동물 모형은 개발되었습니다, 그러나 이 모형의 각각은 우리 자신과 구별되고 튼튼한 동맥류를 생성하지 않았습니다. 우리와 가장 유사한 뮤린 dTAA 모델은 대강절에 CaCl 2의 직접 적용을 포함하는 Ikonomidis 등8에의해 개발되었다. 우리의 모델은 이코노미디스에 의해 명시된 많은 기술에서 적응되었지만, 우리의 모델은 세 가지 방법으로 독특합니다. 첫째, 우리의 모델에서 대류는 CaCl2 노출의 15 분에 비해 3-5 분 동안 국소 엘라스타제에 노출됩니다. 둘째, 대동맥 팽창은 CaCl2 모델에서 16 주에 비해 2 주 에서 발생합니다. 마지막으로, 우리의 모델은 지속적으로 약 100 % 팽창의 동맥류를 생산,CaCl에 의해 생성 된 20-30 %의 대동맥 팽창에 비해 (이는 진정으로 동맥류로 정의 될 수 없다 대동맥의 증가로 정의 직경 >50%). angiotensin II의 주입으로 강력한 동맥류를 형성하는 Apo E 녹아웃 마우스와 같은 동맥류 형성의 그밖 비 수술 뮤린 모형이 있습니다. 그러나, 이들 마우스는 내림차순 흉부 대동맥9,10에서특별히 동맥류보다는 상신또는 오름차순 흉부 대동맥류를 개발한다.
이 프로토콜에 대한 합리적 은 murine 모델에서 dTAA를 연구하는 간단하고 저렴하고 시간에 적합한 방법을 가지는 것입니다. 마우스 모형은 그밖 혈관 질병에 있는 충격이 있기 위하여 찾아낸 많은 유전과 세포 특정 녹아웃을 이용하는 유일한 기회를 제공합니다. 우리의 특정 TAA 모델의 사용은 잘 수신되었으며 이를 활용한 실험은 고충격 저널11,12에게재되었습니다. 이 시점까지, 모델은 복부 대동맥류(AAA) 뮤린 모델에 상당한 영향을 미쳤던 가능한 유전적 및 약리학적 치료를 조사하는데 사용되어 왔다; 그러나, 우리의 실험실은 dTAA 모형의 사용을 확장했기 때문에, 우리는 인간에 있는 표적으로 한 치료로 이용될 수 있던 dTAA 대형에 유일한 표적을 찾아내고 있습니다.
이 모델은 뮤린 마이크로 수술 기능이 있는 실험실에 가장 적합합니다. 그것은 기술적으로 도전, 그것은 심지어 이전 수술 경험이 없는 연구원에 의해 일관 되 게 실행할 수 있습니다. 뮤린 수술 경험이없는 연구원의 경우 모델은 약 20 회의 수술 세션 (또는 약 50 마우스)에서 마스터 할 수 있습니다. 이전 수술 경험이있는 연구원의 경우, 모델은 5 회의 수술 세션 (약 20 마우스)에서 마스터 할 수 있습니다. 우리는 고품질의 비디오로 숙달 시간을 더 줄일 수 있다고 믿습니다. 숙련도가 달성되면 수술시 35분, 말기 수확을 위해 20분 안에 수술을 완료할 수 있습니다. 우리 실험실의 외과 의사는 하루에 10-12 번의 전체 수술을 완료 할 수 있으며 수술 사망률은 5-10 %입니다. 사망의 가장 흔한 원인은 가슴에 입력시 폐 부상, 마취 독성, 또는 해부 동안 대동맥의 눈물. dTAA 연구 이외에, 이 모형은 또한 가슴에 있는 그밖 내정간섭을 공부하는 연구원을 위한 흉부 대흉 및 폐 hilum에 안전하고 쉬운 접근을 위한 가이드역할을 합니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
동물 프로토콜은 버지니아 대학 기관 동물 관리 및 사용위원회 (No. 3634)에 의해 승인되었습니다.
1. 마취 및 삽관의 유도
- 8-10주 된 수컷 C57BL/6 마우스를 5% 이소플루란과 산소 혼합물의 연속 흐름이 있는 밀폐된 챔버에 넣고 호흡이 눈에 띄게 느려질 때까지 5분 동안 하십시오.
참고: 실험 프로토콜에 따라 다른 균주, 성별 및 생쥐의 나이를 사용할 수 있습니다. 암컷 마우스는 더 작은 크기 및 이렇게 더 작은 기도 때문에 삽관하기 더 어려울 지도 모릅니다. - Vandivort 외13에의해 설명 된 대로 마우스를 삽관 .
참고: 삽관 단계는 이 모델에서 학습하고 수행하는 데 가장 어려운 부분입니다. 위에서 언급한 저자는 비디오의 단계를 설명하는 훌륭한 작업을 수행합니다.
2. 수술 판에 마우스 고정
- 내측구 (ET) 튜브를 연결하고, 가슴 상승을 확인하고, 오른쪽 측면 방수 위치에 마우스를 놓습니다. 이소플루란을 약 3%로 돌리고 두 눈에 윤활유를 바치십시오. 인공호흡기는 분당 약 200회 호흡과 225μL의 조수량을 제공하도록 설정해야 합니다.
참고: 이소플루란이 5%로 방치되면 독성이 빠를 수 있습니다. 그러나, 이소플루란에 대한 반응은 가변적이기 때문에 마취 유량은 약 10-20s마다 자연적인 횡격막 수축이 발생하고 산소화가 점막과 노출된 조직의 검사에 적절히 나타나는 등 적정되어야 한다. - ET 튜브를 테이프로 보드에 고정합니다. 앞발이 코와 일렬로 맞서 오른쪽 팔을 장밋빛으로 확장하고 테이프로 고정합니다.
- 오른쪽 팔과 꼬리 사이의 장력 선을 만들기 위해 꼬리를 꼬리를 꼬리를 잡아 당겨 척추의 확장을 생성합니다.
참고: 꼬리와 오른쪽 발을 일렬로 고정하면 ET 튜브의 삽입 또는 이탈을 방지할 수 있습니다. - 왼쪽 다리를 자연스러운 위치에 테이프로 가보자. 왼쪽 팔을 구르게 하고 테이프를 아래로 굴절시로 그립니다.
3. 수술 준비
- 마우스의 왼쪽 측면을 왼쪽 어깨에서 왼쪽 복부까지 전기 클리퍼로 면도합니다.
- 면 팁 어플리케이터를 사용하여 수술 부위에 베타딘 용액을 브러쉬하십시오. 새로운 면 팁 어플리케이터를 사용하여 수술 부위에 70% 에탄올 용액을 브러시하십시오. 건조시키십시오. 멸균 드레이프를 놓습니다.
- 주의: 전기 캐터링이 사용되고 에탄올을 점화할 수 있는 경우 모든 에탄올이 완전히 건조되었는지 확인하십시오.
4. 흉부 입력
- 수술 용 가위를 사용하여 헴쇼락스의 중간점에서 1cm 측면 절개를합니다. 핸드헬드 일렉트로카우터를 사용하여 갈비뼈가 보일 때까지 근육 층을 나눕니다.
- 갈비뼈의 2mm 부분을 직접 소작시하십시오.
참고 : 갈비뼈에 전기 캐터를 사용할 때, 자발적호흡 주파수를 관찰하십시오. 마우스가 소작 도중 횡격막 수축이 있는 경우에, 끝은 흉부로 들어가고 이 모형에서 일반적으로 치명적인 폐를 뚫을 수 있습니다. - 젖고 미세한 면 팁 어플리케이터를 사용하여 소작 된 부분보다 우수한 리브 공간에 팁을 회전하여 조직에 팁을 회전시 흉막 공간으로 침입합니다. 젖은 3mm x 2mm 스폰지를 흉부에 넣고 폐를 붕괴시도록 합니다.
참고 : 부드럽고 젖은 스폰지만 매우 섬세하기 때문에 폐에 닿습니다. - 가위를 사용하여 소작 된 갈비뼈의 상단 측면을 따라 다이어프램이 보일 때까지 잘라냅니다.
5. 대동맥 노출
- 늑골 리트랙터를 놓고 흉부 절개를 여는 데 사용합니다. 조심스럽게 폐 표면에서 스폰지를 제거하십시오.
- 젖은 6mm x 4mm 스폰지를 놓고 폐를 덮고 끝끝을 rostally 및 caudally로 가리키게합니다. 스폰지에 (넓은 평평한) 폐 리트랙터를 놓고 내림차순 흉부 대원이 노출 될 때까지 리트랙터를 통풍구로 부드럽게 밀어 놓습니다.
- #7 포셉을 사용하여 약 5mm 섹션동안 대동맥에서 결합 조직과 지방을 해부하십시오.
참고: 작은 정맥이 대역을 가로질러 횡단적으로 실행될 수 있습니다. 해부 중에 찢어지지 마십시오 (적어도 14 배율을 사용하면이 합병증을 피하는 데 도움이 될 수 있습니다).
6. 엘라타아제 노출
- 12 μL의 돼지 췌장 엘라스타아제로 0.5 mm x 1mm 스폰지를 포화시키고 대동맥의 노출 된 표면에 놓습니다.
참고 : 스폰지가 반대쪽 폐를 만지지 않도록하십시오. - 소정의 시간(보통 3-5분) 후, #7 포셉으로 엘라타아제 스폰지를 제거합니다. 폐 리트랙터를 제거합니다. 멸균 식염수 1mL로 흉강을 관개합니다.
참고 : 폐 스폰지가 포화되고 부드러워지므로 식염수로 관개하기 전에 폐 리트랙터를 제거하여 폐 표면에서 쉽게 제거 할 수 있습니다. - 압연 2" x 2" 거즈를 사용하여 남은 식염수 관개를 흡수하십시오. 이소플루란을 2%로 돌립니다.
7. 가슴의 폐쇄
- 폐 스폰지를 제거합니다. 꼬리 폐 리트랙터를 제거합니다. 로스트랄 폐 리트랙터를 제거합니다.
- 3 을 방해 하여 6-0 비 흡수성 봉합사를 놓아 갈비뼈를 반대하고 각각 느슨한 매듭을 묶지만 묶지 마십시오. 봉합사 바늘로 폐를 만지지 않도록주의하십시오.
- 환기기구에서 유출관을 폐로 막거나 ET 튜브를 통해 0.5-1.0 mL의 공기를 빠르게 분사하여 폐를 재팽창시켜 3방향 스톱 콕을 활용한다.
참고: 기압외상을 피하려면 공기가 채워진 주사기를 과도하게 사용하지 말고 1.0mL 이하의 공기를 사용하십시오. - 흡수할 수 없는 봉합사를 묶습니다. 5-0 의 흡수성 멀티 필라멘트 봉합사를 실행하여 근육 층을 재흡수하십시오. 이소플루란을 1%로 돌립니다.
- 7-10으로 피부를 닫아 5-0 흡수성 봉합사를 중단했습니다. 이소플루란을 0%로 돌립니다.
8. 복구
- 피하의 부프레노르핀 6 μg (0.3 mg/mL 현탁액0.02 mL)를 투여하십시오. 오른쪽 발, 꼬리 및 왼쪽 팔에서 테이프를 제거한 다음 오른쪽 팔 테이프를 제거합니다.
- 마우스가 사지를 움직일 때 꼬리를 당겨 ET 튜브에서 미끄러져 나갑니다. 높은 산소 함량의 따뜻한 챔버에 소핀 위치에 놓습니다.
참고 : 산소 챔버에서 케이지로 마우스를 이동하는 것이 안전합니다. 게다가, 마우스는 고통의 표시를 위해 감시되어야 합니다, 고민, 또는 수술 후에 첫번째 24-48 시간 동안 빈번하게 번창하는 실패및 지시된 대로 추가 진통 또는 연약한 음식을 제공하.
9. 대동맥류 의 노출 (말기 수확 절차)
참고 : 일반적으로 조직 수확은 최대 팽창 기간을 나타내기 때문에 14 일에서 수행됩니다. 그러나, 실험에 따라, 수확 절차 타이밍은 실험에 따라 3 일 및 4 + 주 사이에 언제든지 수행 될 수있다.
- 전술한 바와 같이 수술 장에 마우스를 삽관하고 고정한다(섹션 1-3). 가위를 사용하여 왼쪽 측면에서 중앙 복부까지 피부 내측으로 절개하여 복막에 들어가지 않도록 주의하십시오.
- 등지 왼쪽 에서 피부를 절개 왼쪽 어깨의 수준으로 장대하게. 그런 다음 겨드랑이에서 흉골까지 90° 각도로 절개합니다.
참고 : 이 절개는 완전히 원래피부 절개를 둘러싸야한다. - 소작을 사용하여 마우스의 복부 측면을 향해 피부 플랩을 해부하여 왼쪽 헴쇼락스를 노출시하십시오. 가위를 사용하여 복부에 들어가 복부에서 등쪽으로 왼쪽 늑골 여백을 따라 절개를하여 왼쪽 횡격막의 밑면을 노출시하십시오. 다이어프램의 측면 최단 가장자리가 원하는 개방될 수 있습니다.
- 이전 단계로 작성하지 않은 경우 다이어프램을 가장 측면 가장자리로 절개합니다. 이 구멍에 소작 의 끝을 놓고 자피드 공정에 비용 마진떨어져 다이어프램을 소작. 젖은 미세 한 팁 면 팁 어플리케이터를 사용하여, 부드럽게 가슴 벽에 접착에서 폐를 해제하고 폐를 내측밀어 밀어.
참고 : 유착이 흉벽에서 쉽게 떨어지지 않으면 소작을 사용하여 제거하십시오. 이렇게 하면 무거운 출혈을 일으킬 수 있는 폐 찢 어 하지 않도록 하는 데 도움이. - 늑골 하나에서 늑골 마진까지 가슴 벽의 내부를 소작하고, 등쪽에서 중간 겨드랑이 선까지 는 대동맥에서 적어도 2mm. 소작 된 라인을 따라 가슴 벽을 잘라.
참고 :이 기술은 늑간 동맥에서 출혈을 방지합니다. - 갈비뼈의 우수한 여백을 따라 잘라 낸 다음 흉골의 측면 가장자리를 따라 좌측 갈비뼈 케이지를 제거합니다. 폐에 리트랙터를 놓고 중간으로 당깁니다. 다이어프램에 리트랙터를 놓고 가능한 한 많은 대반을 노출시키기 위해 가시적으로 그립니다.
- 마른 면 팁 어플리케이터를 사용하여 대동맥류와 영향을 받지 않는 말단의 유착을 제거하십시오. 비디오 미세 측정을 사용하여 영향을 받지 않는 대조군 세그먼트의 직경과 엘라스타아제 처리 동맥류의 가장 넓은 부분을 측정합니다.
참고: 비디오 미세 측정값은 수학식 1을 사용하는 대조군 세그먼트와 비교하여 동맥류 세그먼트의 퍼센트 팽창을 계산하는 데 사용됩니다. 동맥류 분절 1에 대한 0.5 mm 말단인 대조군 세그먼트가 선택된다.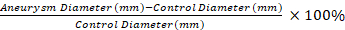 방정식 1
방정식 1
- 해의 집게로 대위를 잡고, 처리 된 세그먼트에 말단. 가위를 사용하여 집안말기를 절단한 다음 대인척을 척추에서 해부합니다. 대동맥을 처리된 세그먼트로 근위를 절단하고 동맥류 대동맥을 제거합니다.
- 결핵 주사기와 바늘을 사용하여, 식염수로 대동맥 루멘을 씻고 원하는대로 조직을 처리하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
우리의 프로토콜의 응용 은 식염수 컨트롤에 비해 마우스에서 강력한 dTAA 결과. 개발된 TAA는 대불의 처리된 부분에서만 발생하며 형태가 퍼지포름(도1 및 도2)11이다. 도 2는 조직 수확시 비디오 미세 측정 측정의 예를 나타낸다. 방정식 1을 사용하면 이 예제에서 대동맥 팽창이 130%입니다.
John...
Access restricted. Please log in or start a trial to view this content.
토론
흉부 및 복부 대동맥은 세포적으로 배아적으로 구별되며, 이는 동맥류 질환14,15,16과관련이 있다. 따라서 TAA를 연구하기 위한 특정 동물 모델이 필요합니다. 다른 murine dTAA 모델이8에 게시되었지만, 우리의 진정한 동맥류 (50 % 이상 팽창)로 간주 될 수있는 내림차순 흉부 대동맥 팽창을 만들 수있는 유일한 모델...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없다.
감사의 말
이 작품은 AHA 과학자 개발 보조금 14SDG18730000 (M.S.), NIH K08 HL098560 (G.A.) 및 RO1 HL081629 (G.R.U.) 보조금에 의해 지원되었다. 이 프로젝트는 연구 및 교육을위한 흉부 수술 재단에 의해 지원되었다 (TSFRE) 연구 보조금 (PI: G. Ailawadi). 콘텐츠는 전적으로 저자의 책임이며 반드시 NHLBI 또는 TSFRE의 견해를 나타내는 것은 아닙니다. 우리는 그들의 지식과 기술 적 전문 지식에 대한 앤서니 청어와 신디 도슨 에게 감사드립니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Angiocatheter (22G) | Used for ET Tube | ||
| Dumont Tweezers; Pattern #7 x2 | Roboz | RS-4982 | |
| Graefe Tissue Forceps | Roboz | RS-5158 | |
| Harms Forceps x2 | Roboz | RS-5097 | |
| Intracardiac Needle Holder; Extra Delicate; Carbide Jaws; 7" Length | Roboz | RS-7800 | |
| KL 1500 LED Light Source | Leica | 150-400 | |
| M205A Dissction Microscope | Leica | CH 94-35 | |
| Iris Scissors, 11cm, Tungsten Carbide | World Precision Instruments | 500216-G | |
| Metal Clip board | Use with the Mouse Retractor Set | ||
| Mouse Retractor Set | Kent | SURGI-5001 | Need 2 short and 1 tall fixators |
| Mouse Ventilator MiniVent Type 845, 115 V, Power Supply with US Connector | Harvard Apparatus | 73-0043 | MiniVent Ventilator for Mice (Model 845), Single Animal, Volume Controlled |
| Sigma Aldrich | Elastase from porcine pancreas | E0258-50MG | Can be purchased in various size bottles |
| Small Vessel Cauterizer Kit | Fine Science Tools | 18000-00 | Recommend using rechargable AA batteries |
| Spring Scissors, 10.5cm | World Precision Instruments | 14127 | |
| Steril Swabs (Sponges) | Sugi | 31603 | Can be cut to size |
| Surgi Suite Surgical Platform | Kent | Attach to clip board | |
| Tech IV Isoflurane Vap | Jorgensen Laboratories | J0561A | Anesthesia vaporizer |
참고문헌
- Coady, M. A., et al. What is the appropriate size criterion for resection of thoracic aortic aneurysms. Journal of Thoracic and Cardiovascular Surgery. 113 (3), 489-491 (1997).
- Aggarwal, S., Qamar, A., Sharma, V., Sharma, A. Abdominal aortic aneurysm: A comprehensive review. Experimental and Clinical Cardiology. 16 (1), 11-15 (2011).
- Bickerstaff, L. K., et al. Thoracic aortic aneurysms: a population-based study. Surgery. 92 (6), 1103-1108 (1982).
- Cheng, D., et al. Endovascular aortic repair versus open surgical repair for descending thoracic aortic disease a systematic review and meta-analysis of comparative studies. Journal of the American College of Cardiology. 55 (10), 986-1001 (2010).
- Walsh, S. R., et al. Endovascular stenting versus open surgery for thoracic aortic disease: systematic review and meta-analysis of perioperative results. Journal of Vascular Surgery. 47 (5), 1094-1098 (2008).
- Absi, T. S., et al. Altered patterns of gene expression distinguishing ascending aortic aneurysms from abdominal aortic aneurysms: complementary DNA expression profiling in the molecular characterization of aortic disease. The Journal of Thoracic and Cardiovascular Surgery. 126 (2), 344-357 (2003).
- Ailawadi, G., Eliason, J. L., Upchurch, G. R. Current concepts in the pathogenesis of abdominal aortic aneurysm. Journal of Vascular Surgery. 38 (3), 584-588 (2003).
- Ikonomidis, J. S., et al. A murine model of thoracic aortic aneurysms. Journal of Surgical Research. 115 (1), 157-163 (2003).
- Daugherty, A., Manning, M. W., Cassis, L. A. Angiotensin II promotes atherosclerotic lesions and aneurysms in apolipoprotein E-deficient mice. Journal of Clinical Investigation. 105 (11), 1605-1612 (2000).
- Trachet, B., et al. Ascending Aortic Aneurysm in Angiotensin II-Infused Mice: Formation, Progression, and the Role of Focal Dissections. Arteriosclerosis, Thrombosis, and Vascular Biology. 36 (4), 673-681 (2016).
- Johnston, W. F., et al. Inhibition of interleukin-1beta decreases aneurysm formation and progression in a novel model of thoracic aortic aneurysms. Circulation. 130 (11), Suppl 1 51-59 (2014).
- Pope, N. H., et al. Interleukin-6 Receptor Inhibition Prevents Descending Thoracic Aortic Aneurysm Formation. Annals of Thoracic Surgery. 100 (5), 1620-1626 (2015).
- Vandivort, T. C., An, D., Parks, W. C. An Improved Method for Rapid Intubation of the Trachea in Mice. Journal of Visualized Experiments. (108), e53771(2016).
- Ailawadi, G., et al. A nonintrinsic regional basis for increased infrarenal aortic MMP-9 expression and activity. Journal of Vascular Surgery. 37 (5), 1059-1066 (2003).
- Ruddy, J. M., Jones, J. A., Spinale, F. G., Ikonomidis, J. S. Regional heterogeneity within the aorta: relevance to aneurysm disease. Journal of Thoracic and Cardiovascular Surgery. 136 (5), 1123-1130 (2008).
- Trigueros-Motos, L., et al. Embryological-origin-dependent differences in homeobox expression in adult aorta: role in regional phenotypic variability and regulation of NF-kappaB activity. Arteriosclerosis, Thrombosis, and Vascular Biology. 33 (6), 1248-1256 (2013).
- Lu, G. S. G., Davis, J. P., Schaheen, B., Downs, E., Roy, R. J., Ailawadi, G., Upchurch, G. R. A novel chronic advanced staged abdominal aortic aneurysm murine model. Journal of Vascular Surgery. 66 (1), 232-242 (2017).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유