Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Formación de micro y nanoplásticos a partir de películas plásticas agrícolas para el empleo en estudios de investigación fundamental
En este artículo
Resumen
Mostramos la formación y caracterización dimensional de micro y nanoplásticos (MPs y NPs, respectivamente) utilizando un proceso paso a paso de fresado mecánico, rectificado y análisis de imágenes.
Resumen
Los microplásticos (MP) y los nanoplásticos (NP) dispersos en los ecosistemas agrícolas pueden representar una grave amenaza para la biota en el suelo y las vías fluviales cercanas. Además, los productos químicos como los pesticidas adsorbidos por las NP pueden dañar los organismos del suelo y potencialmente entrar en la cadena alimentaria. En este contexto, los plásticos utilizados en la agricultura, como las películas de mantillo de plástico, contribuyen significativamente a la contaminación plástica en los ecosistemas agrícolas. Sin embargo, la mayoría de los estudios fundamentales sobre el destino y la ecotoxicidad emplean materiales MP idealizados y poco representativos, como las microesferas de poliestireno.
Por lo tanto, como se describe en este documento, desarrollamos un procedimiento de múltiples pasos a escala de laboratorio para formar mecánicamente MP y NP representativos para dichos estudios. El material plástico se preparó a partir de películas de mantillo de plástico disponibles comercialmente de adipato-co-tereftalato de polibutirato (PBAT) que se rompieron mediante tratamiento criogénico (CRYO) o intemperie ambiental (W), y a partir de gránulos de PBAT no tratados. Los materiales plásticos fueron tratados por fresado mecánico para formar MPs con un tamaño de 46-840 μm, imitando la abrasión de fragmentos de plástico por el viento y la maquinaria mecánica. Luego, los parlamentarios se tamizaron en varias fracciones de tamaño para permitir un análisis adicional. Finalmente, la fracción de tamiz de 106 μm se sometió a molienda húmeda para generar NP de 20-900 nm, un proceso que imita el lento proceso de reducción de tamaño para los MP terrestres. Las dimensiones y la forma de los MP se determinaron mediante el análisis de imágenes de estereomicrografías, y se empleó la dispersión dinámica de la luz (DLS) para evaluar el tamaño de partícula para las NP. Los MP y NP formados a través de este proceso poseían formas irregulares, lo que está en línea con las propiedades geométricas de los MP recuperados de los campos agrícolas. En general, este método de reducción de tamaño demostró ser eficiente para formar MPs y NP compuestos de plásticos biodegradables como el adipato de polibutileno-co-tereftalato (PBAT), que representa materiales de mantillo utilizados para la producción de cultivos agrícolas especializados.
Introducción
En las últimas décadas, el rápido aumento de la producción mundial de plásticos y la eliminación inadecuada y la falta de reciclaje de residuos plásticos ha llevado a la contaminación ambiental que ha afectado a los ecosistemas marinos y terrestres 1,2,3. Los materiales plásticos son esenciales para la agricultura contemporánea, particularmente para cultivar verduras, frutas pequeñas y otros cultivos especiales. Su uso como películas de mantillo, cubiertas de túneles altos y bajos, cinta de goteo y otras aplicaciones tienen como objetivo mejorar el rendimiento y la calidad de los cultivos, reducir los costos de producción y promover métodos agrícolas sostenibles 4,5. Sin embargo, el creciente empleo de la "plasticultura" ha generado preocupaciones sobre la formación, distribución y retención de piezas de plástico en entornos agrícolas. Después de un proceso de fragmentación continua causado por la fragilidad a través de la degradación ambiental durante la vida útil, los fragmentos de plástico más grandes forman micro y nanoplásticos (MNP), que persisten en el suelo o migran a las vías fluviales adyacentes a través de la escorrentía de agua y el viento 6,7,8. Factores ambientales como la radiación ultravioleta (UV) a través de la luz solar, las fuerzas mecánicas del agua y los factores biológicos desencadenan la fragilización plástica de los plásticos dispersos ambientalmente, lo que resulta en la descomposición de fragmentos de plástico más grandes en partículas macro o mesoplásticas 9,10. La desfragmentación adicional forma microplásticos (MPs) y nanoplásticos (NPs), reflejando partículas de tamaño promedio (diámetro nominal; dp) de 1-5000 μm y 1-1000 nm, respectivamente11. Sin embargo, el límite superior dp para NP (es decir, un límite inferior para MPs) no está universalmente acordado y en varios documentos, esto se enumera como 100 nm12.
Los MNP de los desechos plásticos representan una amenaza global emergente para la salud del suelo y los servicios ecosistémicos. La adsorción de metales pesados del agua dulce por parte de los parlamentarios condujo a una concentración 800 veces mayor de metales pesados en comparación con el medio ambiente circundante13. Además, los MP en los ecosistemas acuáticos plantean múltiples factores estresantes y contaminantes al alterar la penetración de la luz, causar el agotamiento del oxígeno y causar la adhesión a diversas biotas, incluida la penetración y acumulación en organismos acuáticos14.
Estudios recientes sugieren que los MNP pueden afectar la geoquímica del suelo y la biota, incluidas las comunidades microbianas y las plantas15,16,17. Además, las NP amenazan la red alimentaria17,18,19,20. Dado que los MNP se someten fácilmente al transporte vertical y horizontal en el suelo, pueden transportar contaminantes absorbidos como pesticidas, plastificantes y microorganismos a través del suelo hacia aguas subterráneas o ecosistemas acuáticos como ríos y arroyos21,22,23,24. Los plásticos agrícolas convencionales, como las películas de mantillo, están hechos de polietileno, que debe retirarse del campo después de su uso y eliminarse en vertederos. Sin embargo, la eliminación incompleta conduce a una acumulación sustancial de desechos plásticos en los suelos 9,25,26. Alternativamente, los mantillos plásticos biodegradables (BDM) del suelo están diseñados para ser cultivados en el suelo después de su uso, donde se degradarán con el tiempo. Sin embargo, los BDM persisten temporalmente en el suelo y gradualmente se degradan y fragmentan en MP y NPs 9,27.
Muchos estudios ecotoxicológicos y de destino ambientales actuales emplean materiales modelo idealizados y no representativos de MP y NPs. Los MNP sustitutos más utilizados son las micro o nanoesferas de poliestireno monodisperso, que no reflejan los MNP reales que residen en el medio ambiente12,28. En consecuencia, la selección de MP y NP no representativos puede dar lugar a mediciones y resultados inexactos. Sobre la base de la falta de modelos apropiados de ΜNP para estudios ambientales terrestres, los autores se motivaron para preparar tales modelos a partir de plásticos agrícolas. Anteriormente informamos sobre la formación de MNPs a partir de BDMs y pellets de polietileno a través del fresado mecánico y molienda de pellets plásticos y materiales de película y las características dimensionales y moleculares de los MNPs29. El documento actual proporciona un protocolo más detallado para preparar MNP que se puede aplicar más ampliamente a todos los plásticos agrícolas, como películas de mantillo o sus materias primas peletizadas (Figura 1). Aquí, para servir como ejemplo, elegimos una película de mantillo y pellets esféricos del polímero biodegradable tereftalato de adipato de polibutileno (PBAT) para representar plásticos agrícolas.
Protocolo
1. Procesamiento de MPs a partir de pellets de plástico mediante pretratamiento criogénico y molienda
NOTA: Esta metodología se basa en un procedimiento descrito en otra parte, empleando una película PBAT compuesta del mismo material utilizado para este estudio presentado29.
- Pesar muestras de pellets de polímero de ~1 g y transferirlas a un frasco de vidrio de 50 ml.
- Coloque el tubo de "entrega rectangular" con un tamiz de malla 20 (840 μm) en la ranura frente al molino de corte rotativo y levante el tubo de suministro hasta que toque el pasador de cierre.
- Coloque la placa de vidrio sobre la cara de la cámara de fresado y asegúrela con la abrazadera ajustable. A continuación, coloque un frasco de vidrio de 50 ml debajo de la salida del molino (Figura 2).
- Coloque el soporte del brazo lateral deslizante en el molino (ubicado en el lado superior derecho) en el centro del vidrio frontal y apriete con el perno moleteado. Asegúrese de que el vidrio frontal del molino esté bien colocado (Figura 2a).
- Inserte el embudo de la tolva en la parte superior del molino en la abertura de la cámara de molienda superior.
- Enchufe un cable de línea en una toma de corriente y el interruptor del cable de prensa para iniciar el funcionamiento del molino.
NOTA: Para evitar atascos, alimente solo el material después de que el molino esté encendido y girando. Además, use protección para los ojos y los oídos durante todo el procedimiento de fresado. - Introduzca la muestra lentamente en la tolva (alrededor de 10 pellets / min) para evitar que se ralentice o se atasque. Después de reducir el ruido audible, agregue el siguiente lote de pellets (~ 10 piezas). Después de procesar los pellets (1 g), presione el interruptor del cable para detener el funcionamiento del molino durante ~ 20 minutos para enfriarse. Utilice un émbolo de madera para alimentar la muestra y evitar la expulsión y aglomeración de partículas dentro de la tolva de alimentación.
PRECAUCIÓN: La velocidad de alimentación óptima varía según el tipo de material de procesamiento. Apague inmediatamente el molino si la velocidad de procesamiento disminuye debido a la fricción de partículas en la cámara de corte, o si se observa formación de polímero fundido en la placa de vidrio, para evitar el sobrecalentamiento y la fusión adicional de las partículas de polímero. - Retire el tubo de suministro de malla 20 (840 μm) y reemplácelo con el tubo de suministro de malla 60 (250 μm) al finalizar el primer lote (figura 2b).
- Vuelva a introducir el material recogido en la tolva del molino. Siga los pasos 1.1 y 1.7 para la fracción de molienda de 250 μm.
- Realimente las fracciones de 250 μm recogidas hasta tres veces.
- Recupere las partículas restantes en la cámara y agréguelas a la fracción principal recolectada.
2. Procesamiento de películas plásticas mediante pretratamiento criogénico y molienda
- Recupere una muestra de película del rollo y corte la muestra en tiras de ~120 mm (dirección transversal) x 20 mm (dirección de la máquina) con un cortador de papel.
- Remoje previamente fragmentos (~1 g) en 800 ml de agua desionizada (DI) durante 10 min en un vaso de precipitados de vidrio de 1000 ml. Este paso mejora la fragilidad para el posterior procedimiento de enfriamiento criogénico al remojar previamente el polímero.
PRECAUCIÓN: Manipule el nitrógeno líquido con el equipo de seguridad usando guantes criogénicos y gafas de seguridad. - Agregue lentamente 200 ml de nitrógeno líquido (N2) a un recipiente criogénico.
- Transfiera las partículas de película remojadas previamente cuidadosamente al contenedor criogénico con pinzas de acero. Remojar previamente durante 3 min en líquidoN2.
- Transfiera los fragmentos de película congelados a una licuadora de 200 W y 14 velocidades.
- Procese el material congelado a un nivel de velocidad de 3 durante 10 s para romper la estructura de la película de vidrio congelado. Para promover una mayor reducción de tamaño, agregue 400 ml de agua DI y mezcle la suspensión de película y agua durante 5 minutos.
- Transfiera la suspensión a un embudo Büchner con filtro (malla de 1 μm) y aplique vacío durante al menos 1 h.
- Secar al vacío las partículas sólidas a 30 °C durante al menos 48 h en un plato de aluminio.
- Alimente partículas secas en el molino con pinzas. Para el fresado, siga los pasos 1.1-1.11.
3. Procesamiento de películas plásticas pretratadas a través de la intemperie ambiental y la molienda
- Coloque los fragmentos de película plástica recuperados del campo sobre una superficie lisa (banco de laboratorio). Retire cuidadosamente las partículas de tierra absorbidas y los restos de plantas con el cepillo de cerdas suaves.
- Corte la película con tijeras en ~4 cm2 muestras de ~1.0 g.
- Agregue fragmentos de película en un vaso de precipitados de 1000 ml lleno de 500 ml de agua DI. Revuelva a una velocidad de 300 min-1 con una barra de agitación de 20 mm durante 1 h.
- Elimine las partículas de tierra disueltas decantando y reintroduciendo agua DI bajo una ligera agitación del vaso de precipitados en un fregadero o cubo de plástico. Repita este paso tres veces. La agitación continua mantiene las partículas del suelo dispersas en el agua y puede ser más fácil de decantar.
- Transfiera muestras del vaso de precipitados a un plato de aluminio. Secar al aire las muestras de plástico durante 12 h, y luego transferir y secar en un horno de vacío durante 24 h a 30 °C. Para el fresado, siga los pasos 1.1-1.11.
4. Procedimiento de tamizado a través de tamices en cascada
- Apile los tamices (3 pulgadas de diámetro) comenzando con la sartén en la parte inferior, seguido por el tamiz más fino (# 325; 45 μm), y luego por tamices cada vez más gruesos (como # 140; 106 μm y # 60; 250 μm, donde el tamiz # 20; 840 μm es el más grueso), y coloque la tapa en la parte superior.
- Monte los cuatro tamices en el agitador insertando cuatro pasadores en las aberturas del agitador de tamiz.
- Transfiera fracciones individuales recogidas en los pasos 1, 2 o 3 sobre los cuatro tamices en cascada. Agitar durante 10 min a 300 min-1.
- Recupere la fracción más grande (superior) por separado, que se someterá a un fresado adicional.
NOTA: Ajuste la velocidad de agitación en el agitador según sea necesario. Alternativamente, es posible agitar los tamices a mano. Use solo un tamiz a la vez, comenzando con el tamiz de malla #20: sostenga la parte inferior y la tapa firmemente contra el tamiz con la mano, y agite axial y horizontalmente durante 5 minutos. - Reintroducir partículas tamizadas de dp > 106 μm en el molino de corte rotativo como se describe en los pasos 1.6-1.10.
- Recupere las fracciones inferiores de la bandeja y vuelva a introducir las partículas al siguiente tamaño de tamiz más pequeño. Repita el procedimiento hasta que las partículas de 106 μm representen la fracción principal.
- Combine las fracciones de 106 μm recogidas y almacene las partículas en un área seca (desecador o bolsa de plástico sellada al aire).
NOTA: La fracción de 45 μm es parte de la fracción de 106 μm; Sin embargo, la primera fracción no se aisló y se analizó por separado, ya que el rendimiento es generalmente muy bajo. Las recuperaciones de rendimiento y las fracciones de tamaño de partícula de fracciones individuales se pueden determinar mediante mediciones gravimétricas en % en peso para cada fracción de tamizado (malla # 20 - malla # 325) en relación con la fracción de alimentación inicial utilizando una microbalanza de alta precisión.
5. Preparación de una suspensión NP acuosa para molienda húmeda
- Prepare una suspensión de MPs dispersos en agua DI agregando 800 ml de agua destilada en el vaso de precipitados de vidrio de 1000 ml e insertando una barra de agitación (diámetro = 8 mm, longitud = 50.8 mm).
- Introduzca 8 g de la fracción plástica de 106 μm de los pasos 1, 2, 3 o 4 en agua DI, produciendo una suspensión del 1% en peso.
- Coloque el vaso de precipitados de vidrio en una placa de agitación y revuelva magnéticamente durante 24 h a 400 min-1 para remojar las partículas en agua para promover el ablandamiento de las partículas.
- Transfiera las partículas a un recipiente de plástico de 1000 ml.
- Llene dos recipientes de plástico adicionales de 1000 ml con agua DI, que se utilizarán para enjuagar las partículas adheridas en la tolva del molinillo durante el proceso de molienda.
6. Preparación de la rectificadora húmeda para la producción de NP
- Coloque las piedras con un tamaño de 46 granos (grano de una piedra de moler = 297-420 μm) en la amoladora de fricción húmeda y sujete las tuercas centrales herméticamente con una llave de 17 mm.
- Agregue la tolva en la parte superior y sujete las tres tuercas y pernos con la llave de 17 mm.
- Coloque un frasco de recolección de plástico de 1 L debajo de la salida del colisionador. Coloque un segundo cubo vacío de 1 L junto a la salida, que se utilizará para intercambiar durante el procesamiento.
- Ajuste la holgura del medidor a + 1,0, lo que corresponde a un desplazamiento positivo de 0,10 μm desde la posición cero.
- Encienda la alimentación y gire con cuidado la rueda de ajuste en el sentido de las agujas del reloj hasta que escuche el toque de las piedras de moler. Luego, ajuste el anillo de medición flexible a cero y gire la rueda en sentido contrario a las agujas del reloj inmediatamente. De forma predeterminada, la velocidad se ajusta a 1500 min-1.
NOTA: Evite la "molienda en seco" de las piedras, ya que esto crea un calor excesivo en las piedras de moler. - Gire la rueda de ajuste en el sentido de las agujas del reloj hasta que las piedras toquen y llene suavemente la suspensión de agua-NP en la tolva. Disminuya la brecha continuamente a un indicador de holgura de -2.0, correspondiente a un desplazamiento negativo de 0.20 μm desde la posición cero después de que se introdujo la suspensión. Las lodos de partículas plásticas y agua entre los dos discos de piedra promueven la transformación de MP en NP y evitan la fricción directa entre las piedras de moler.
- Recoja la suspensión intercambiando los cubos de recolección una vez que el nivel de llenado en el cubo supere los 0,5 L.
- Recoja y reintroduzca las partículas en el molinillo entre 30 y 60 veces; Los pases más altos (número de reintroducciones) dan como resultado tamaños de partícula más pequeños.
- Lave las partículas adheridas adsorbidas a la tolva con la botella de agua DI preparada para permitir una mezcla adecuada de lodo durante el procesamiento.
NOTA: La recolección de muestras intermedias durante el proceso es posible manteniendo viales de vidrio de 20 ml en la corriente de salida. Los pasos individuales evaluarán los mecanismos de fragmentación de partículas mientras aumenta la gravedad del proceso (número de pasadas). Recuperar el purín y remover durante 4 h a 400 min-1 a 25 °C para una buena mezcla; Deje reposar la suspensión durante 48 h para estabilizarse.
7. Recuperación y secado de NPs del purín
- Aísle la fracción inferior (o fase con la concentración de NP más alta) si se observan múltiples capas en la suspensión vertiendo lentamente la suspensión en un vaso de precipitados de vidrio adicional de 1000 ml.
- Transfiera las fracciones a viales de centrifugación (50 ml) y centrifugar durante 10 min (fuerza centrífuga relativa [RCF] = 20 x 102 g). El RCF (también denominado fuerza g) es la fuerza radial generada en función del radio del rotor y la velocidad del rotor, lo que provoca la separación de las partículas más pesadas y el agua de la lechada.
- Retire la capa superior transparente decantándola en una bandeja de aluminio separada.
- Transfiera la capa inferior restante (que contiene una suspensión NP) a un plato de aluminio adicional y colóquelo en un horno de vacío a 30 °C durante 48 h.
- Recupere el material seco con una espátula debajo de una campana extractora o guantera mientras usa una máscara respiratoria. Transfiera el contenido seco a un recipiente de vidrio de 100 ml y selle con una tapa.
- Contenga NP en un vial y guárdelos en un lugar hermético, seco y fresco (por ejemplo, un desecador).
NOTA: Los MNP liberados en el medio ambiente durante el proceso de fabricación (aquí, ya sea durante el proceso de molienda húmeda o como partículas secas) pueden representar una grave amenaza para los ecosistemas acuáticos y terrestres. En particular, las medidas reglamentarias están diseñadas para minimizar el riesgo para su producción y uso de nanomateriales artificiales30. Por lo tanto, la formación de MNP requiere medidas de precaución específicas, como la manipulación de materiales en una campana extractora o guantera. Además, las soluciones de residuos acuosos formadas durante el aislamiento de las NP (pasos 6.7-6.9) estarán sujetas a un procedimiento de eliminación al final de la vida útil realizado por el Departamento de Salud y Seguridad Ambiental.
8. Imágenes MP a través de microscopía estereoscópica
- Dispersar ~20 mg de partículas (recogidas en el paso 4) sobre una superficie de ~4 cm2. Extienda los parlamentarios blancos o translúcidos sobre una superficie oscura y extienda los diputados negros o de color oscuro sobre un fondo blanco (hoja de papel) para maximizar el contraste de fondo.
- Ajuste el microscopio al aumento más bajo para capturar el área más grande posible (centro del área de partícula). A continuación, dirija la lámpara externa al centro de enfoque para lograr la iluminación en las regiones de interés.
- Aplique un aumento que permita la detección de >50 partículas en el centro del campo de visión. Esta cantidad se recomienda para obtener resultados estadísticos sólidos de evaluación.
- Concéntrese en áreas sin superposición de partículas o con poca o ninguna y buen contraste de color.
- Capture al menos cinco imágenes representativas centrándose en las formas de las partículas exteriores. El equipo local utilizado para la creación de imágenes guarda las imágenes de alta resolución como un mapa de bits en el software.
- Guarde las imágenes grabadas con microscopio estereoscópico en un formato de archivo reconocido por ImageJ (mapa de bits, tiff o jpeg) para el siguiente análisis cuantitativo de datos.
NOTA: Tome una imagen de referencia en la configuración de ampliación exacta para la que se tomó la imagen principal utilizando una regla o cualquier otro objeto de referencia registrado en la imagen. Este procedimiento permitirá una fácil calibración de las imágenes al preparar y analizar a través del software ImageJ.
9. Análisis de imágenes a través de ImageJ
- Abra el softwareImageJ 31 y prepare la importación de archivos ingresando (CTRL + L) para abrir el Buscador de comandos. A continuación, ingrese Bio-Formatos en la esquina inferior derecha. Esta función activa la ruta del menú Archivo > Importar formatos > Bio (> se refiere a los pasos de navegación dentro del software). Busque el directorio de archivos de imagen almacenados.
NOTA: Si el paquete Bio-Formats no aparece en el buscador de comandos, busque en línea en Bio-Formats ImageJ. Siga las instrucciones para descargar e instalar ImageJ. El importador Bio-Formats permite un manejo simple de importar / exportar archivos de imagen dentro de ImageJ y buscar comandos. - Abra la imagen (alternativamente, la importación de bioformatos como se describe en el paso 9.1) haciendo clic en Archivo > Abrir > seleccione la imagen de partícula en la ubicación del archivo recopilada en el paso 4.7 y la imagen de referencia de regla descrita en el paso 1.6. Se recomienda crear una imagen duplicada haciendo clic en Mayús + Comando + D para comparar con la imagen original mientras se ajusta la configuración de umbral de la imagen de copia.
NOTA: El comando Abrir > archivo abre varios formatos compatibles de forma nativa con ImageJ como se describe en el paso 8.7. Alternativamente, seleccione la ubicación de la imagen en la computadora y arrastre y suelte el archivo en la barra de estado de la ventana principal de ImageJ. El archivo de imagen se abrirá automáticamente en una ventana separada. - Acercar y alejar la imagen usando CTRL + y CTRL -, respectivamente.
- Para definir las medidas, haga clic en Analizar > en Establecer medidas y, a continuación, seleccione Descriptores de área y forma como valores predeterminados.
- Defina la barra de escala dibujando una línea recta sobre la longitud de la barra de escala utilizando la imagen de referencia de regla como se describe en el paso 8. Pulse Analizar > Definir escala e introduzca el valor numérico de la longitud de la barra en Distancia conocida y la unidad de la longitud correspondiente.
- Visualice la barra de escala en la imagen haciendo clic en Analizar > herramientas > barra de escala y ajuste la configuración, como mostrar un contraste nítido en la imagen. Seleccione una posición en la imagen donde se debe colocar la barra de escala para la configuración de la barra de escala. Seleccione Ancho para ajustar la barra en unidades calibradas, Altura de la barra en píxeles y Tamaño de fuente de la etiqueta de la barra de escala. Seleccione fondo para ajustar el color de relleno del cuadro de texto de la etiqueta.
NOTA: Para micrómetros, la entrada de μm es suficiente; El programa adapta μm automáticamente en la salida de datos. - Transforme la imagen en una imagen de 8 bits seleccionando Imagen > Tipo > 8 bits.
- Convierta la imagen copiada a 8 bits seleccionando Imagen > Tipo > 8 bits.
- Ajuste seleccionando Imagen > Ajustar > Umbral > Establecer (comparar tamaño con la imagen original).
- Determine qué medidas tomar seleccionando Analizar > Establecer medidas.
- Seleccione Analizar partículas > 0-infinito, haga clic en Mostrar resultados y mostrar in situ.
- Almacene los resultados del ROI (.zip) en Guardar mediciones y Seleccionar carpeta.
- Guarde los resultados (*.csv) en Archivo > Guardar como > Seleccione Carpeta.
10. Diámetro de partícula (dp) y cálculo del factor de forma en software de hoja de cálculo
NOTA: El conocimiento del diámetro de las partículas y los factores de forma son esenciales para el comportamiento de las partículas (destino, transporte) en el medio ambiente y la determinación del área superficial. Por lo tanto, la geometría es esencial cuando los MP se utilizan para estudios ambientales. Por ejemplo, se observaron diferentes mecanismos de interacción con el suelo dependiendo de los tamaños y formas de los MP, como las aglomeraciones de suelo MP-MP y MP-suelo, que influyen en el movimiento de partículas en el suelo15,32. Por lo tanto, se sugieren los siguientes pasos para determinar la distribución del tamaño de partícula p d y el parámetro geométrico.
- Importe el archivo *.csv correspondiente obtenido y guardado del análisis ImageJ (paso 9.13) en el software de hoja de cálculo.
NOTA: Los valores numéricos en cada línea de columna reflejan cálculos individuales para cada partícula de acuerdo con la ecuación 1 y la ecuación 2. - Evalúe los valores promedio de los parámetros de forma, como la circularidad (CIR) y la relación de aspecto (AR), introduciendo = promedio (x,y) en la parte inferior de cada columna, donde x representa la primera línea e y la última línea de la columna y, a continuación, presione Entrar. Los valores CIR describen la relación entre el área proyectada y el círculo perfecto con el CIR = 1 de una partícula individual (ecuación 1). El AR representa la relación longitud/anchura de partícula descrita en la ecuación 2.
- Determine si el AR promedio < 2.5, luego calcule los valores dp en una nueva columna usando la ecuación 3. Si AR ≥ 2.5, entonces calcule dvalores de p que reflejen la ecuación 4. Agregue una nueva columna para calcular dp en función de la columna de área recibida de la salida de ImageJ.
NOTA: La selección de los valores umbral de AR ≥ 2.5 representa más partículas de forma rectangular, mientras que AR < 2.5 refleja partículas de forma más redonda. Esta selección permite minimizar el error de cálculo dp derivado del área medida por microscopía y determinada a través de ImageJ.
(1)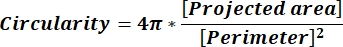
(2)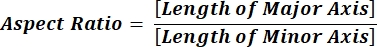
(3)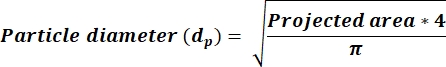
(4)
11. Análisis estadístico para MP y NPs
- Abra el archivo de datos *.csv con el software estadístico por Archivo > Abra > Seleccione la ubicación del archivo correspondiente como se creó en el paso 9.13.
NOTA: Alternativamente, la tabla se puede transferir directamente a través de la función de copiar y pegar en el software estadístico. Consulte la Tabla de materiales para la marca y la versión del software estadístico Editar > Pegar con nombres de columna. - Evalúe los datos dp seleccionando Analizar > distribución.
- Seleccione dp, que refleja los datos de la columna, arrastre y suelte en columnas Y y pulse el botón OK. Esta característica crea un histograma con una salida estadística que incluye los valores de Summary Statistics, Mean y Std Dev en una ventana separada.
- Evalúe si el histograma sigue una distribución normal (o el mejor ajuste para d p) con la curva de mejor ajuste seleccionando el triángulo junto a d p > Ajuste continuo y, a continuación, seleccione la curva recibida como la mejor opción (por ejemplo, Ajuste normal). Este paso superpone el histograma con un ajuste distribuido normalmente.
- Determine e informe los valores de media y desviación estándar de la salida de estadísticas de resumen de los valores de los parámetros de forma promedio de circularidad (Cir), relación de aspecto (AR), redondez (Redondeo) y solidez (Sol).
NOTA: Se recomienda un nivel de significación estadística de α = 0,05 y se empleó para todas las evaluaciones. El nivel de significación es la probabilidad de rechazar la hipótesis nula cuando es verdadera al comparar resultados numéricos.
12. Mejor ajuste de la distribución del tamaño d p y los factores de forma de partícula
- Cargue el conjunto de datos en un software estadístico y utilice el mismo conjunto de datos *.csv para la distribución de dp calculado en el paso 10.
- Seleccione Analizar > la fiabilidad y la supervivencia > la distribución de la vida.
- Arrastre la columna dp al campo Y, Tiempo hasta el evento y seleccione Aceptar. Esta característica crea una salida con una gráfica de probabilidad en función de dp.
- Determine la distribución óptima en Comparar distribuciones marcando No paramétrico, Lognormal, Weibull, Loglogistic y Normal.
- Evalúe la calidad del modelo ajustado por los valores numéricos más bajos para los criterios de información de Akaike y Bayesian (AIC y BIC, respectivamente) en la Tabla de comparación del modelo estadístico debajo del gráfico por los números BIC más bajos. El modelo de mejor ajuste se presenta en la primera fila de forma predeterminada. Los campos de salida de estimación paramétrica o no paramétrica para cada evaluación de distribución se encuentran debajo del gráfico Comparar distribuciones .
- Guarde el script de salida en la tabla de datos seleccionando el triángulo desplegable rojo en la esquina superior izquierda mediante Guardar script > en tabla de datos. A continuación, guarde la tabla de datos original en la ubicación de archivo deseada seleccionando Archivo > Guardar como > *.jmp.
13. Caracterización dimensional de NPs a través de dispersión dinámica de luz
- Inicie el software de dispersión dinámica de luz (DLS) haciendo doble clic en el icono del escritorio. Seleccione Archivo > Nuevo > SOP. Agregue el nombre de la muestra y seleccione el índice de refracción del material a 1.33 para agua destilada y 1.59 para polímeros33 en el software DLS en Configuración de muestra. Seleccione Material en el menú desplegable y, a continuación, haga clic en Aceptar.
NOTA: Al hacer clic en el menú desplegable, se abre el Administrador de materiales, que ofrece agregar nuevas muestras o modificar muestras existentes cambiando el índice de refracción y la absorción. Seleccione como dispersante Agua. - Seleccione la celda adecuada en Celda > Tipo de celda y seleccione Informes para determinar qué salida se presentará después de cada medición.
- Inicie el instrumento cerrando la tapa del instrumento y encendiendo el sistema cerrando la tapa (si está abierta) y pulsando el botón ON. Espere después del primer pitido y espere alrededor de 30 minutos para permitir la estabilización del haz.
- Espere hasta que se complete la rutina de inicialización y espere un segundo pitido, que indique que se ha alcanzado la temperatura preestablecida (generalmente 25 °C).
- Prepare una suspensión de muestra de NP (como se recibió en el paso 7) y agua DI en un vial de 15 ml a una concentración de ~0.1% en peso agitando magnéticamente durante ~ 1 h para permitir que se mezcle bien.
- Agite la suspensión antes de transferir ~ 1.0 ml en la cubeta de cuarzo de 4.5 ml y abra la tapa. Luego, inserte cuidadosamente la celda de muestra en el soporte de muestra del instrumento DLS.
NOTA: Preparar tres muestras del mismo lote de purín a la misma concentración descrita en el paso 13.5. - Realice tres mediciones (selección en el software DLS) para cada muestra. Entre mediciones, retire la celda de muestra y agite suavemente las muestras durante 5 s para permitir la mezcla de la muestra.
- Extraiga y exporte datos a través del software DLS, transfiera el conjunto de datos al software de hoja de cálculo y cree histogramas para MP y NP como se describe en los pasos 11.1-11.5 (Figura 1). Copie desde la pestaña Vista de registros una tabla o un gráfico seleccionando Editar y copiar, que se puede pegar en otra aplicación, como el software de hoja de cálculo.
14. Análisis químico de MNPs utilizando espectrometría de reflectancia total atenuada (ATR) por espectrometría infrarroja de transformación de Fourier (FTIR)
NOTA: Los análisis químicos de MNPs mediante espectroscopias infrarrojas de transformación de Fourier (FTIR) y de resonancia magnética nuclear (RMN) son herramientas adecuadas para evaluar el impacto de la molienda húmeda en las propiedades de enlace químico, así como las cantidades relativas de los componentes principales y los constituyentes monoméricos de los polímeros, respectivamente10. Además, las propiedades térmicas y la estabilidad de los constituyentes poliméricos de los MNP pueden evaluarse mediante calorimetría diferencial de barrido (DSC) y análisis termogravimétrico (TGA), respectivamente29.
- Limpie el sistema de detección (superficie de cristal ATR) con etanol y un paño sin pelusa.
- Inicie el software y pulse el botón de fondo en la barra de comandos para realizar un escaneo de fondo en el aire despejando la trayectoria del haz del instrumento. El espectro de fondo se muestra poco después de la recolección.
- Introduzca ID de muestra y Descripción de muestra en la barra de herramientas de configuración del instrumento.
- Ajuste el número de onda espectral entre 4000 cm-1 y 600 cm-1 y seleccione una resolución de 2,0 cm-1 en modo de absorbancia. Seleccione 32 escaneos por espectro e inicie.
- Coloque una muestra de plástico (~20 mg o ~ 1-3 mm3) de MPs (106 μm) y NPs (~300 nm) dentro de una arandela de acero con un diámetro interior de ~10 mm, o equivalente, en la superficie del cristal.
NOTA: La lavadora evita la dispersión en el cristal cuando el portamuestras comprime la muestra, lo que resulta en inhomogeneidades del material y sesgo de datos debido a mediciones inconsistentes. - Coloque la arandela en el centro del cristal ATR y agregue la muestra de polímero en el centro de la abertura de la arandela con una espátula.
- Gire la palanca de la muestra hacia arriba en el centro de la muestra y gire la perilla en el sentido de las agujas del reloj monitoreando la fuerza del medidor de fuerza entre 50-90. La muestra muestra los espectros preliminares. Presione el botón Escanear por segunda vez para recopilar el espectro.
- Recopile entre 8 y 10 espectros haciendo clic en el botón Escanear y mezcle las muestras cuidadosamente después de cada medición con una espátula para permitir la recolección de resultados representativos.
- Haga clic en la carpeta Vista de muestra en el Explorador de datos para mostrar todas las muestras recopiladas superpuestas en el área de visualización. Primero, elimine los espectros significativamente desviados que representan valores atípicos. A continuación, seleccione el modo Absorbancia o Transmitancia en la barra de herramientas.
- Guarde espectros seleccionando la carpeta Vista de muestra que contiene los espectros y seleccionando Guardar como en el menú de archivo. La ventana de diálogo habilita el nombre de archivo, el directorio de destino y el cambio de ubicación predeterminado para todos los espectros.
NOTA: Alternativamente, los espectros se pueden guardar como un archivo *.sp seleccionando un espectro y haciendo clic con el botón derecho para mostrar la opción Binario. Seleccione Guardar binario y busque la ubicación final de Guardar. - Realice la corrección de línea base y la normalización media seleccionando un solo espectro en el Explorador de datos seleccionando Proceso > normalización en el menú, ya sea a través del software o en el siguiente paso.
NOTA: La normalización media compensa los errores espectrales debidos al espesor o a la variación del material en la muestra. - Limpie el área cristalina con etanol y paño sin pelusa al finalizar la recopilación de datos.
- Interpretar las diferencias entre MPs y NPs de acuerdo con las bandas de vibración FTIR asignadas, asignadas y evaluadas en una publicación anterior10.
Resultados
Para validar el método y análisis del procedimiento experimental, se formaron MP y NP a partir de pellets y materiales de película y se compararon por tamaño y forma utilizando imágenes microscópicas. El método descrito en la Figura 1 formó eficientemente MP y NP a partir de gránulos y películas de plástico biodegradables; Esto se logró a través del enfriamiento criogénico, el molienda y la molienda húmeda y la caracterización. El primer paso era innecesario para las películ...
Discusión
Este método describe un proceso efectivo descrito inicialmente en una publicación anterior29, para preparar MNP obtenidos de pellets y películas de mantillo para estudios ambientales. El proceso de reducción de tamaño involucró enfriamiento criogénico (solo para película), molienda en seco y etapas de molienda húmeda, para fabricar modelos MNP. Hemos aplicado este método para preparar MNPs a partir de una amplia gama de materias primas poliméricas, incluyendo polietileno de baja densida...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación fue financiada por el Herbert College of Agriculture, el Departamento de Ingeniería de Biosistemas y Suelos, y la Alianza de Ciencias de la Universidad de Tennessee, Knoxville. Además, los autores agradecen el apoyo financiero proporcionado a través de la subvención del USDA 2020-67019-31167 para esta investigación. Las materias primas iniciales para preparar MNP de película de mantillo biodegradable a base de PBAT fueron amablemente proporcionadas por BioBag Americas, Inc. (Dunevin, FL, EUA), y los pellets PBAT por Mobius, LLC (Lenoir City, TN).
Materiales
| Name | Company | Catalog Number | Comments |
| Aluminum dish, 150 mL | Fisher Scientific, Waltham, MA, USA | 08-732-103 | Drying of collected NPs |
| Aluminum dish, 500 mL | VWR International, Radnor, PA, USA | 25433-018 | Collecting NPs after wet-grinding |
| Centrifuge | Fisher Scientific, Waltham, MA, USA | Centrific 228 | Container for centrifugation |
| Delivery tube, #20, 840 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M30 | Sieving of the first fraction during milling |
| Delivery tube, #60, 250 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M45 | Sieving of the second fraction (3x) during milling |
| Thermomixer, 5350 Mixer | Eppendorf North America, Enfield, CT, USA | 05-400-200 | Analysis of sieving experiments |
| FT-IR Spectrum Two, spectrometer with attenuated total reflectance (ATR) | Perkin Elmer, Waltham, MA, USA | L1050228 | Measuring FTIR spectra |
| Glass beaker, 1000 mL | DWK Life Sciences, Milville, NJ, USA | 02-555-113 | Stirring of MPs-water slurry before grinding |
| Glass front plate | Thomas Scientific, Swedesboro, NJ, USA | 3383N55 | Front cover plaste for Wiley Mini Mill |
| Glass jar, 50 mL | Uline, Pleasant Prairie, WI, USA | S-15846P | Collective MPs after milling |
| Glove Box, neoprene | Bel-Art-SP Scienceware, Wayne, NJ, USA | BEL-H500290000 | 22-Inch, Size 10 |
| Zetasizer Nano ZS 90 size analyzer | Malvern Panalytical, Worcestershire, UK | Zetasizer Nano ZS | Measuring nanoplastics dispersed in DI-water |
| Microscope camera | Nikon, Tokyo, 108-6290, Japan | Nikon Digital Sight 10 | Combined with Olympus microscope to receive digital images |
| Microscope | Olympus, Shinjuku, Tokyo, Japan | Model SZ 61 | Imaging of MPs |
| Nitrogen jar, low form dewar flasks | Cole-Palmer, Vernon Hills, IL, USA | UX-03771-23 | Storage of liquid nitrogen during cryogenic cooling |
| Accurate Blend 200, 12-speed blender | Oster, Boca Raton, FL, USA | 6684 | Initiating the size reduction of cryogenically treated plastic film |
| PBAT film, - BioAgri™ (Mater-Bi®) | BioBag Americas, Inc, Dunedin, FL, USA | 0.7 mm thick | Feedstock to form MPs and NPs, agricultural mulch film |
| PBAT pellets | Mobius, LLC, Lenoir City, TN, USA | Diameter 3 mm | Feedstock to form microplastics (MPs) and nanoplastics (NPs) trough milling and grinding |
| Plastic centrifuge tubes, 50 mL | Fisher Scientific, Waltham, MA, USA | 06-443-18 | Centrifugation of slurry after wet-grinding |
| Plastic jar, 1000 mL, pre-cleaned, straight sided | Fisher Scientific, Waltham, MA, USA | 05-719-733 | Collection of NPs during and after wet grinding |
| Polygon stir bars, diameterø=8 mm, length=50.8 mm | Fisher Scientific, Waltham, MA, USA | 14-512-127 | Stirring of MPs slurry prior to wet-grinding |
| Scissors, titanium bonded | Westcott, Shelton, CT, USA | 13901 | Cutting of initial PBAT film feedstocks |
| Square glass cell with square aperture and cap, 12 mm O.D. | Malvern Panalytical, Worcestershire, UK | PCS1115 | Measuring of NPs particle size |
| Stainless steel bottom, 3 inch, pan | Hogentogler & Co. Inc, Columbia, MD, USA | 8401 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 140 (106 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1308 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 20 (850 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1296 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 325 (45 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1313 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 60 (250 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1303 | Sieving of MPs after Wiley-milling |
| Stainless steel top cover, 3 inch | Hogentogler & Co. Inc, Columbia, MD, USA | 8406 | Sieving of MPs after Wiley-milling |
| Stainless steel tweezers | Global Industrial, Port Washington, NY, USA | T9FB2264892 | Transferring of frozen film particles from jar into blender |
| Vacuum oven, model 281A | Fisher Scientific, Waltham, MA, USA | 13-262-50 | Vacuum oven to dry NPs after wet-grinding |
| Friction grinding machine, Supermass Colloider | Masuko Sangyo, Tokyo, Japan | MKCA6-2J | Grinding machine to form NPs from MPs |
| Wet-grinding stone, grit size: 297 μm -420 μm | Masuko Sangyo, Tokyo, Japan | MKE6-46DD | Grinding stone to form NPs from MPs |
| Wiley Mini Mill, rotary cutting mill | Thomas Scientific, Swedesboro, NJ, USA | NC1346618 | Size reduction of pellets and film into MPs and NPs |
| Software | |||
| FTIR-Spectroscopy software | Perkin Elmer, Waltham, MA, USA | Spectrum 10 | Collection of spectra from the initial plastic, MPs and NPs |
| Image J, image processing program | National Institutes of Health, Bethesda, MD, USA | Version 1.53n | Analysis of digital images received from microscopy |
| Microscope software, ds-fi1 software | Malvern Panalytical , Malvern, UK | Firmware DS-U1 Ver3.10 | Recording of digital images |
| Microsoft, Windows, Excel 365, spreadsheet software | Microsoft, Redmond, WA, USA | Office 365 | Calculating the average particle size and creating FTIR spectra images |
| JMP software, statistical software | SAS Institute Inc., Cary, NC, 1989-2021 | Version 15 | Statistical analysis of particle size and perform best fit of data set |
| Unscrambler software | Camo Analytics, Oslo, Norway | Version 9.2 | Normalizing and converting FTIR spectra into .csv fromat |
Referencias
- Jin, Z., Dan, L. Review on the occurrence, analysis methods, toxicity and health effects of micro-and nano-plastics in the environment. Environmental Chemistry. (1), 28-40 (2021).
- Kumar, M., et al. Current research trends on micro-and nano-plastics as an emerging threat to global environment: a review. Journal of Hazardous Materials. 409, 124967 (2021).
- Alimba, C. G., Faggio, C., Sivanesan, S., Ogunkanmi, A. L., Krishnamurthi, K. Micro (nano)-plastics in the environment and risk of carcinogenesis: Insight into possible mechanisms. Journal of Hazardous Materials. 416, 126143 (2021).
- Serrano-Ruiz, H., Martin-Closas, L., Pelacho, A. M. Biodegradable plastic mulches: Impact on the agricultural biotic environment. Science of The Total Environment. 750, 141228 (2021).
- Hayes, D. G., et al. Biodegradable plastic mulch films for sustainable specialty crop production. Polymers for Agri-Food Applications. , 183-213 (2019).
- Viaroli, S., Lancia, M., Re, V. Microplastics contamination of groundwater: Current evidence and future perspectives. A review. Science of The Total Environment. , 153851 (2022).
- Rillig, M. C., Lehmann, A. Microplastic in terrestrial ecosystems. Science. 368 (6498), 1430-1431 (2020).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. Journal of Polymers and the Environment. 29 (9), 2916-2931 (2021).
- Yang, Y., et al. Kinetics of microplastic generation from different types of mulch films in agricultural soil. Science of The Total Environment. 814, 152572 (2022).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Schwaferts, C., Niessner, R., Elsner, M., Ivleva, N. P. Methods for the analysis of submicrometer-and nanoplastic particles in the environment. TrAC Trends in Analytical Chemistry. 112, 52-65 (2019).
- Gigault, J., et al. Current opinion: what is a nanoplastic. Environmental Pollution. 235, 1030-1034 (2018).
- Naqash, N., Prakash, S., Kapoor, D., Singh, R. Interaction of freshwater microplastics with biota and heavy metals: a review. Environmental Chemistry Letters. 18 (6), 1813-1824 (2020).
- Manzoor, S., Naqash, N., Rashid, G., Singh, R. Plastic material degradation and formation of microplastic in the environment: A review. Materials Today: Proceedings. , 3254-3260 (2022).
- de Souza Machado, A. A., et al. Impacts of microplastics on the soil biophysical environment. Environmental Science & Technology. 52 (17), 9656-9665 (2018).
- Jacques, O., Prosser, R. A probabilistic risk assessment of microplastics in soil ecosystems. Science of The Total Environment. 757, 143987 (2021).
- Kwak, J. I., An, Y. -. J. Microplastic digestion generates fragmented nanoplastics in soils and damages earthworm spermatogenesis and coelomocyte viability. Journal of Hazardous Materials. 402, 124034 (2021).
- Wahl, A., et al. Nanoplastic occurrence in a soil amended with plastic debris. Chemosphere. 262, 127784 (2021).
- Vighi, M., et al. Micro and nano-plastics in the environment: research priorities for the near future. Reviews of Environmental Contamination and Toxicology Volume 257. , 163-218 (2021).
- Pironti, C., et al. Microplastics in the environment: intake through the food web, human exposure and toxicological effects. Toxics. 9 (9), 224 (2021).
- Zurier, H. S., Goddard, J. M. Biodegradation of microplastics in food and agriculture. Current Opinion in Food Science. 37, 37-44 (2021).
- Horton, A. A., Dixon, S. J. Microplastics: An introduction to environmental transport processes. Wiley Interdisciplinary Reviews: Water. 5 (2), 1268 (2018).
- Panno, S. V., et al. Microplastic contamination in karst groundwater systems. Groundwater. 57 (2), 189-196 (2019).
- Su, Y., et al. Delivery, uptake, fate, an transport of engineered nanoparticles in plants: a critical review and data analysis. Environmental Science: Nano. 6 (8), 2311-2331 (2019).
- Yu, Y., Griffin-LaHue, D. E., Miles, C. A., Hayes, D. G., Flury, M. Are micro-and nanoplastics from soil-biodegradable plastic mulches an environmental concern. Journal of Hazardous Materials Advances. 4, 100024 (2021).
- Hayes, D. G. Enhanced end-of-life performance for biodegradable plastic mulch films through improving standards and addressing research gaps. Current Opinion in Chemical Engineering. 33, 100695 (2021).
- Qin, M., et al. A review of biodegradable plastics to biodegradable microplastics: Another ecological threat to soil environments. Journal of Cleaner Production. 312, 127816 (2021).
- Phuong, N. N., et al. Is there any consistency between the microplastics found in the field and those used in laboratory experiments. Environmental Pollution. 211, 111-123 (2016).
- Astner, A., et al. Mechanical formation of micro-and nano-plastic materials for environmental studies in agricultural ecosystems. Science of The Total Environment. 685, 1097-1106 (2019).
- Rist, S., Hartmann, N. B. Aquatic ecotoxicity of microplastics and nanoplastics: lessons learned from engineered nanomaterials. Freshwater Microplastics. , 25-49 (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Raju, S., et al. Improved methodology to determine the fate and transport of microplastics in a secondary wastewater treatment plant. Water Research. 173, 115549 (2020).
- Caputo, F., et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: addressing some analytical challenges in the sub-micron size range. Journal of Colloid and Interface Science. 588, 401-417 (2021).
- Xu, M., et al. Polystyrene microplastics alleviate the effects of sulfamethazine on soil microbial communities at different CO2 concentrations. Journal of Hazardous Materials. 413, 125286 (2021).
- Ding, L., et al. Insight into interactions of polystyrene microplastics with different types and compositions of dissolved organic matter. Science of The Total Environment. 824, 153883 (2022).
- Abbasimaedeh, P., Ghanbari, A., O'Kelly, B. C., Tavanafar, M., Irdmoosa, K. G. Geomechanical behaviour of uncemented expanded polystyrene (EPS) beads-clayey soil mixtures as lightweight fill. Geotechnics. 1 (1), 38-58 (2021).
- Li, Z., Li, Q., Li, R., Zhou, J., Wang, G. The distribution and impact of polystyrene nanoplastics on cucumber plants. Environmental Science and Pollution Research. 28 (13), 16042-16053 (2021).
- Sobhani, Z., Panneerselvan, L., Fang, C., Naidu, R., Megharaj, M. Chronic and transgenerational effects of polystyrene microplastics at environmentally relevant concentrations in earthworms (Eisenia fetida). Environmental Toxicology and Chemistry. 40 (8), 2240-2246 (2021).
- Lionetto, F., Esposito Corcione, C., Rizzo, A., Maffezzoli, A. Production and characterization of polyethylene terephthalate nanoparticles. Polymers. 13 (21), 3745 (2021).
- Dümichen, E., et al. Analysis of polyethylene microplastics in environmental samples, using a thermal decomposition method. Water Research. 85, 451-457 (2015).
- Robotti, M., et al. Attrition and cryogenic milling production for low pressure cold gas spray and composite coatings characterization. Advanced Powder Technology. 27 (4), 1257-1264 (2016).
- Ducoli, S., et al. A different protein corona cloaks "true-to-life" nanoplastics with respect to synthetic polystyrene nanobeads. Environmental Science: Nano. 9 (4), 1414-1426 (2022).
- El Hadri, H., Gigault, J., Maxit, B., Grassl, B., Reynaud, S. Nanoplastic from mechanically degraded primary and secondary microplastics for environmental assessments. NanoImpact. 17, 100206 (2020).
- Eitzen, L., et al. The challenge in preparing particle suspensions for aquatic microplastic research. Environmental research. 168, 490-495 (2019).
- Ekvall, M. T., et al. Nanoplastics formed during the mechanical breakdown of daily-use polystyrene products. Nanoscale advances. 1 (3), 1055-1061 (2019).
- Caldwell, J., et al. Fluorescent plastic nanoparticles to track their interaction and fate in physiological environments. Environmental Science: Nano. 8 (2), 502-513 (2021).
- Zeb, A., et al. Evaluating the knowledge structure of micro-and nanoplastics in terrestrial environment through scientometric assessment. Applied Soil Ecology. 177, 104507 (2022).
- Ji, Z., et al. Effects of pristine microplastics and nanoplastics on soil invertebrates: A systematic review and meta-analysis of available data. Science of The Total Environment. 788, 147784 (2021).
- de Alkimin, G. D., Gonçalves, J. M., Nathan, J., Bebianno, M. J. Impact of micro and nanoplastics in the marine environment. Assessing the Effects of Emerging Plastics on the Environment and Public Health. , 172-225 (2022).
- Pires, A., Cuccaro, A., Sole, M., Freitas, R. Micro (nano) plastics and plastic additives effects in marine annelids: A literature review. Environmental Research. , 113642 (2022).
- Hurley, R. R., Nizzetto, L. Fate and occurrence of micro (nano) plastics in soils: Knowledge gaps and possible risks. Current Opinion in Environmental Science & Health. 1, 6-11 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados