É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Formação de Micro e Nano-Plásticos de Filmes plásticos agrícolas para emprego em estudos de pesquisa fundamental
Neste Artigo
Resumo
Mostramos a formação e caracterização dimensional de micro e nanoplásticos (MPs e NPs, respectivamente) utilizando um processo stepwise de moagem mecânica, moagem e análise de imagens.
Resumo
Microplásticos (PMs) e nanoplásticos (NPs) dispersos em ecossistemas agrícolas podem representar uma grave ameaça à biota no solo e nas vias navegáveis próximas. Além disso, produtos químicos como pesticidas adsorvidos por NPs podem prejudicar organismos do solo e potencialmente entrar na cadeia alimentar. Nesse contexto, plásticos utilizados agrícolamente, como filmes de mulch plástico, contribuem significativamente para a poluição plástica nos ecossistemas agrícolas. No entanto, a maioria dos estudos fundamentais sobre destino e ecotoxicidade empregam materiais mp idealizados e pouco representativos, como microesferas de poliestireno.
Portanto, como descrito aqui, desenvolvemos um procedimento em escala laboratoriar para formar mecanicamente MPs e NPs representativos para tais estudos. O material plástico foi preparado a partir de filmes de mulch plástico comercialmente disponíveis de adipato-co-tereftalato de polibutirato (PBAT) que foram embrittled através do tratamento criogênico (CRYO) ou do intemperismo ambiental (W), e de pelotas PBAT não tratadas. Os materiais plásticos foram então tratados por fresagem mecânica para formar PMs com um tamanho de 46-840 μm, imitando a abrasão de fragmentos plásticos pelo vento e máquinas mecânicas. Os PMs foram então peneirados em várias frações de tamanho para permitir uma análise mais aprofundada. Finalmente, a fração de peneira de 106 μm foi submetida à moagem úmida para gerar NPs de 20-900 nm, um processo que imita o processo de redução de tamanho lento para MPs terrestres. As dimensões e a forma dos PMs foram determinadas por meio da análise de imagem de estereomicrografos, e a dispersão dinâmica de luz (DLS) foi empregada para avaliar o tamanho das partículas para NPs. MPs e NPs formados através desse processo possuíam formas irregulares, que estão em consonância com as propriedades geométricas dos PMs recuperados dos campos agrícolas. No geral, este método de redução de tamanho mostrou-se eficiente para a formação de PMs e NPs compostos de plásticos biodegradáveis, como o polibutileno adipate-co-tereftalato (PBAT), representando materiais mulch utilizados para a produção agrícola de culturas especiais.
Introdução
Nas últimas décadas, o rápido aumento da produção global de plásticos e o descarte inadequado e a falta de reciclagem de resíduos plásticos levaram à poluição ambiental que impactou os ecossistemas marinhos e terrestresem 1,2,3. Os materiais plásticos são essenciais para a agricultura contemporânea, particularmente para cultivar vegetais, frutas pequenas e outras culturas especiais. Seu uso como filmes de mulch, revestimentos de túneis altos e baixos, fita de gotejamento e outras aplicações visam aumentar o rendimento e a qualidade das culturas, reduzir os custos de produção e promover métodos de agricultura sustentável 4,5. No entanto, a expansão do emprego da "plasticulture" levantou preocupações sobre a formação, distribuição e retenção de peças plásticas em ambientes agrícolas. Após um processo contínuo de fragmentação causado pela degradação ambiental durante a vida útil, fragmentos plásticos maiores formam micro e nanoplásticos (MNPs), que persistem no solo ou migram para as vias navegáveis adjacentes via escoamento de água e vento 6,7,8. Fatores ambientais como a radiação ultravioleta (UV) através da luz solar, forças mecânicas da água e fatores biológicos desencadeiam a empreitada plástica de plásticos dispersos ambientalmente, resultando na quebra de fragmentos plásticos maiores em partículas macro ou meso-plásticas 9,10. Outra desfragmentação forma microplásticos (MPs) e nanoplásticos (NPs), refletindo partículas de tamanho médio (diâmetro nominal; d p) de 1-5000 μm e 1-1000 nm, respectivamente11. No entanto, o limite superior d p para NPs (ou seja, um limite menor para MPs) não é universalmente acordado e em vários artigos, este é listado como 100 nm12.
Os PMs de resíduos plásticos representam uma ameaça global emergente aos serviços de saúde e ecossistema do solo. A adsorção de metais pesados de água doce pelos PMs levou a uma concentração 800 vezes maior de metais pesados em comparação com o ambiente circundante13. Além disso, os PMs em ecossistemas aquáticos apresentam múltiplos estressores e contaminantes alterando a penetração da luz, causando esgotamento de oxigênio e causando adesão a várias biotas, incluindo penetração e acúmulo em organismos aquáticos14.
Estudos recentes sugerem que os MNPs podem impactar a geoquímica do solo e a biota, incluindo comunidades microbianas e plantas 15,16,17. Além disso, os PMs ameaçam a web alimentar 17,18,19,20. Uma vez que os MNPs passam prontamente pelo transporte vertical e horizontal no solo, eles podem transportar contaminantes absorvidos, como pesticidas, plastificantes e microrganismos através do solo em ecossistemasubterrâneos ou aquáticos, como rios e córregos 21,22,23,24. Plásticos agrícolas convencionais, como filmes de mulch, são feitos de polietileno, que devem ser removidos do campo após o uso e descartados em aterros sanitários. No entanto, a remoção incompleta leva ao acúmulo substancial de detritos plásticos nos solos 9,25,26. Alternativamente, as mulas plásticas biodegradáveis do solo (BDMs) são projetadas para serem colocadas no solo após o uso, onde se degradarão ao longo do tempo. No entanto, os BDMs persistem temporariamente no solo e gradualmente degradam e se fragmentam em MPs e NPs 9,27.
Muitos estudos ecotoxiológicos ambientais atuais e de destino empregam PMs e NPs idealizados e não representativos. Os MNPs substitutos mais usados são micro-instilares monodispersos de poliestireno ou nanosferas, que não refletem os MNPs reais residentes no ambiente12,28. Consequentemente, a seleção de PMs e NPs não representativos pode resultar em medidas e resultados imprecisos. A partir da falta de modelos adequados para estudos ambientais terrestres, os autores foram motivados a preparar tais modelos a partir de plásticos agrícolas. Relatamos anteriormente a formação de MNPs de BDMs e pelotas de polietileno através de fresagem mecânica e moagem de pelotas plásticas e materiais de filme e as características dimensionais e moleculares dos MNPs29. O documento atual fornece um protocolo mais detalhado para a preparação de MNPs que podem ser aplicados de forma mais ampla a todos os plásticos agrícolas, como filmes de mulch ou suas matérias-primas pelletizadas (Figura 1). Aqui, para servir de exemplo, escolhemos um filme de mulch e pelotas esféricas do polímero biodegradável polibutileno tereftalato (PBAT) para representar plásticos agrícolas.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Processamento de PMs a partir de pelotas plásticas através de pré-tratamento criogênico e fresagem
NOTA: Esta metodologia baseia-se em um procedimento descrito em outros lugares, empregando um filme PBAT composto pelo mesmo material utilizado para este estudo apresentado29.
- Pese amostras de pelotas de polímero de ~1 g e transfira para um frasco de vidro de 50 mL.
- Coloque o tubo de "entrega retangular" com uma peneira de 20 malha (840 μm) na ranhura em frente à usina de corte rotativa e levante o tubo de entrega até atingir o pino de parada.
- Posicione a placa de vidro sobre o rosto da câmara de fresagem e fixe-a com o grampo ajustável. Em seguida, coloque um frasco de vidro de 50 mL sob a tomada do moinho (Figura 2).
- Posicione o suporte do braço lateral deslizante no moinho (localizado no lado superior direito) no meio do vidro frontal e aperte com o parafuso amassado. Certifique-se de que o vidro frontal da usina esteja bem posicionado (Figura 2a).
- Insira o funil de funil em cima do moinho na abertura da câmara superior de fresagem.
- Conecte um cabo de linha em uma tomada de alimentação e o interruptor do cabo de prensa para iniciar a operação do moinho.
NOTA: Para evitar interferências, só alimente o material após a ingeração da usina e gire. Além disso, use proteção ocular e auricular durante todo o procedimento de fresagem. - Alimente a amostra lentamente no funil (cerca de 10 pelotas/min) para evitar a lentidão ou a interferência. Após a redução do ruído sonoro, adicione o próximo lote de pelotas (~10 peças). Depois de processar as pelotas (1 g), pressione o interruptor do cabo para interromper a operação do moinho por ~20 min para esfriar. Use um êmbolo de madeira para alimentar a amostra e evitar a ejeção e aglomeração das partículas dentro do funil de alimentação.
ATENÇÃO: A taxa de alimentação ideal varia dependendo do tipo de material de processamento. Desligue imediatamente o moinho se a velocidade de processamento diminuir devido ao atrito de partículas na câmara de corte, ou se a formação de polímero derretido for observada na placa de vidro, para evitar superaquecimento e derretimento das partículas de polímero. - Remova o tubo de entrega de 20 malhas (840 μm) e substitua-o pelo tubo de entrega de 60 malhas (250 μm) após a conclusão do primeiro lote (Figura 2b).
- Reintroduza o material coletado no funil da fábrica. Siga as etapas 1.1 e 1.7 para a fração de fresagem de 250 μm.
- Realimentar as frações coletadas de 250 μm até três vezes.
- Recupere as partículas restantes na câmara e adicione-as à fração principal coletada.
2. Processamento de filmes plásticos por pré-tratamento criogênico e fresagem
- Recupere um espécime de filme do rolo e corte o espécime em tiras de ~120 mm (sentido transversal) x 20 mm (direção da máquina) com um cortador de papel.
- Fragmentos presoak (~1 g) em 800 mL de água deionizada (DI) por 10 minutos em um copo de vidro de 1000 mL. Esta etapa melhora a embrittlement para o procedimento de resfriamento criogênico subsequente, pré-aquecendo o polímero.
ATENÇÃO: Manuseie nitrogênio líquido com equipamentos de segurança usando luvas criogênicas e óculos de segurança. - Adicione lentamente 200 mL de nitrogênio líquido (N2) a um recipiente criogênico.
- Transfira cuidadosamente as partículas de filme presos para o recipiente criogênico com pinças de aço. Presoak por 3 min em líquido N2.
- Transfira os fragmentos de filme congelados para um liquidificador de 200 W, 14 velocidades.
- Processe o material congelado no nível de velocidade 3 por 10 s para quebrar a estrutura da luturbra de vidro congelado. Para promover uma redução de tamanho adicional, adicione 400 mL de água DI e misture o chorume de água de filme por 5 minutos.
- Transfira o chorume para um funil Büchner com filtro (malha de 1 μm) e aplique vácuo por pelo menos 1 h.
- Partículas sólidas a vácuo a 30 °C por pelo menos 48 h em um prato de alumínio.
- Alimente partículas secas no moinho com pinças. Para moagem, siga os passos 1.1-1.11.
3. Processamento de filmes plásticos pré-tratados através de intemperidade ambiental e fresagem
- Coloque fragmentos de filme plástico recuperados do campo em uma superfície lisa (banco de laboratório). Remova cuidadosamente partículas de solo absorvidas e restos de plantas com a escova de cerdas macias.
- Corte o filme com uma tesoura em ~4 cm2 amostras de ~1,0 g.
- Adicione fragmentos de filme em um béquer de 1000 mL cheio de 500 mL de água DI. Mexa a uma velocidade de 300 min-1 com barra de agitação de 20 mm por 1 h.
- Remova partículas de solo dissolvidas decantando e reintroduzindo água DI sob leve agitação do béquer em uma pia ou balde de plástico. Repita este passo três vezes. A agitação contínua mantém as partículas do solo dispersas na água e pode ser mais facilmente decantada.
- Transfira amostras do béquer para um prato de alumínio. Seque as amostras de plástico por 12 h e, em seguida, transfira e seque em um forno a vácuo por 24 h a 30 °C. Para moagem, siga os passos 1.1-1.11.
4. Procedimento peneirado através de peneiras em cascata
- Empilhe as peneiras (3 polegadas de diâmetro) começando com a panela na parte inferior, seguido pela peneira mais fina (#325; 45 μm), e depois por peneiras cada vez mais grosseiras (como #140; 106 μm, e #60; 250 μm, onde a peneira #20; 840 μm é a mais grosseira), e coloque a tampa em cima.
- Monte todas as quatro peneiras no agitador inserindo quatro pinos nas aberturas do agitador de peneira.
- Transfira frações individuais coletadas nas etapas 1, 2 ou 3 em cima das quatro peneiras em cascata. Agite por 10 min a 300 min-1.
- Recupere a fração maior (superior) separadamente, que será submetida a mais fresagem.
NOTA: Ajuste a velocidade de agitação no agitador conforme necessário. Alternativamente, tremer peneiras à mão é possível. Use apenas uma peneira de cada vez, começando com a peneira de malha #20: segure a parte inferior e a tampa firmemente contra a peneira à mão, e agite axialicamente e horizontalmente por 5 minutos. - Reintroduzir partículas peneiradas de dp > 106 μm à usina de corte rotativa, conforme descrito nas etapas 1.6-1.10.
- Recupere as frações inferiores da panela e reintroduza as partículas para o próximo tamanho menor da peneira. Repita o procedimento até que as partículas de 106 μm representem a fração principal.
- Mescle as frações coletadas de 106 μm e armazene as partículas em uma área seca (desiccador ou saco plástico selado a ar).
NOTA: A fração de 45 μm faz parte da fração de 106 μm; no entanto, a fração anterior não foi isolada e analisada separadamente, uma vez que o rendimento é geralmente muito baixo. Recuperações de rendimento e frações de tamanho de partículas de frações individuais podem ser determinadas por medidas gravimétricas em wt% para cada fração de peneira (malha #20 - malha #325) em relação à fração inicial de alimentação usando um microequilípmo de alta precisão.
5. Preparação de um chorume NP aquoso para moagem molhada
- Prepare um chorume de MPs dispersos em água DI adicionando 800 mL de água destilada no copo de vidro de 1000 mL e inserindo uma barra de agitação (diâmetro = 8 mm, comprimento = 50,8 mm).
- Introduza 8 g da fração de plástico de 106 μm das etapas 1, 2, 3 ou 4 na água DI, produzindo um chorume de 1 wt%.
- Coloque o béquer de vidro em uma placa de agitação e mexa magneticamente por 24 horas a 400 min-1 para absorver as partículas na água para promover o amolecimento de partículas.
- Transfira as partículas para um recipiente plástico de 1000 mL.
- Encha dois recipientes de plástico adicionais de 1000 mL com água DI, que serão usados para enxaguar partículas de adesão no funil do moedor durante o processo de moagem.
6. Preparação da máquina de moagem molhada para produção de PN
- Coloque pedras com um tamanho de 46 grãos (grão de uma pedra de moagem = 297-420 μm) no moedor de fricção molhado e aperte as porcas centrais com uma chave de 17 mm.
- Adicione o funil por cima e aperte as três porcas e parafusos com a chave de 17 mm.
- Coloque um frasco de coleta de plástico 1 L sob a saída do colisor. Coloque um segundo balde 1 L vazio ao lado da tomada, que será usado para troca durante o processamento.
- Ajuste a folga do medidor para + 1.0, correspondendo a uma mudança positiva de 0,10 μm da posição zero.
- Ligue a energia e gire cuidadosamente a roda de ajuste no sentido horário até ouvir o toque das pedras de moagem. Em seguida, ajuste o anel de medição flexível para zero e gire a roda imediatamente no sentido anti-horário. Por padrão, a velocidade é ajustada para 1500 min-1.
NOTA: Evite "moagem a seco" das pedras, pois isso cria calor excessivo nas pedras de moagem. - Gire a roda de ajuste no sentido horário até que as pedras toquem e encha suavemente o chorume água-NP no funil. Diminua a diferença continuamente para um medidor de desembaraço de -2,0, correspondendo a uma mudança negativa de 0,20 μm da posição zero após a introdução do chorume. As partículas plásticas entre os dois discos de pedra promovem a transformação dos PMs em NPs e evitam atritos diretos entre as pedras de moagem.
- Recolhe o chorume trocando os baldes de coleta uma vez que o nível de enchimento no balde excede 0,5 L.
- Coletar e reintroduzir as partículas no moedor entre 30-60 vezes; passes mais altos (número de reintroduções) resultam em tamanhos menores de partículas.
- Lave as partículas de adesão adsorvidas ao funil com a garrafa de água DI preparada para permitir a mistura adequada de chorume durante o processamento.
NOTA: A coleta de amostras intermediárias durante o processo é possível segurando frascos de vidro de 20 mL no fluxo de saída. As etapas individuais avaliarão os mecanismos de fragmentação de partículas enquanto a gravidade do processo (número de passes) aumenta. Recupere o chorume e mexa por 4h a 400 min-1 a 25 °C para uma boa mistura; Deixe o chorume ficar por 48 horas para estabilizar.
7. Recuperação e secagem de NPs do chorume
- Isole a fração inferior (ou fase com a maior concentração de NP) se várias camadas no chorume forem observadas despejando lentamente o chorume em um copo de vidro adicional de 1000 mL.
- Transfira as frações em frascos de centrifugação (50 mL) e centrífuga por 10 min (força centrífuga relativa [RCF] = 20 x 102 g). O RCF (também chamado de g-force) é a força radial gerada em função do raio do rotor e da velocidade do rotor, o que causa a separação das partículas mais pesadas e da água do chorume.
- Remova a camada superior transparente decantando-a em uma panela de alumínio separada.
- Transfira a camada inferior restante (contendo um chorume NP) em um prato de alumínio adicional e coloque-a em um forno a vácuo a 30 °C por 48 h.
- Recupere o material seco com uma espátula sob um capô de fumaça ou porta-luvas enquanto usa uma máscara respiratória. Transfira o conteúdo seco para um recipiente de vidro de 100 mL e vedação com tampa.
- Contenha NPs em um frasco e armazene-os em um lugar hermético, seco e frio (por exemplo, um desiccator).
NOTA: Os MNPs lançados no ambiente durante o processo de fabricação (aqui, seja durante o processo de moagem úmida ou como partículas secas) podem representar uma grave ameaça aos ecossistemas aquáticos e terrestres. Em particular, as medidas regulatórias são projetadas para minimizar o risco de sua produção e uso para nanomateriaisprojetados 30. Portanto, a formação de MNPs requer medidas de precaução específicas, como manuseio de material em um capô de fumaça ou porta-luvas. Além disso, as soluções aquosas de resíduos formadas durante o isolamento das NPs (etapas 6.7-6.9) estarão sujeitas a um procedimento de eliminação de vida por parte da Secretaria de Saúde e Segurança Ambiental.
8. Imagem de MP via microscopia estéreo
- Disperse ~20 mg de partículas (coletadas na etapa 4) em uma superfície de área ~4 cm2. Espalhe MPs brancos ou translúcidos em uma superfície escura e espalhe MPs pretos ou de cor escura em um fundo branco (folha de papel) para maximizar o contraste de fundo.
- Ajuste o microscópio para a menor ampliação para capturar a maior área possível (meio da área de partículas). Em seguida, direcione a lâmpada externa para o centro de foco para alcançar a iluminação sobre as regiões de interesse.
- Aplique uma ampliação que permita a detecção de >50 partículas no meio do campo de visão. Este montante é recomendado para obter resultados robustos de avaliação estatística.
- Concentre-se em áreas sem sobreposição de partículas ou menores e bom contraste de cores.
- Capture pelo menos cinco imagens representativas focando nas formas externas de partículas. O computador local usado para imagens salva imagens de alta resolução como um bitmap no software.
- Salve as imagens gravadas pelo estereómico em um formato de arquivo reconhecido pelo ImageJ (bitmap, tiff ou jpeg) para a seguinte análise quantitativa de dados.
NOTA: Tome uma imagem de referência nas configurações exatas de ampliação para as quais a imagem principal foi tirada usando uma régua ou qualquer outro objeto de referência gravado na imagem. Este procedimento permitirá fácil calibração das imagens ao preparar e analisar através do software ImageJ.
9. Análise de imagem através do ImageJ
- Abra o software ImageJ31 e prepare a importação de arquivos inserindo (CTRL + L) para abrir o localizador de comando. Em seguida, digite Bio-Formats no canto inferior direito. Esta função ativa o caminho do menu Arquivo > importar formatos > Bio (> refere-se a etapas de navegação dentro do software). Procure o diretório de arquivos de imagem armazenados.
NOTA: Se o pacote Bio-Formats não aparecer no localizador de comando, pesquise on-line em Bio-Formats ImageJ. Siga as instruções para download e instalação do ImageJ. O importador bio-formatos permite um simples manuseio de arquivos de imagem de importação/exportação dentro do ImageJ e busca de comandos. - Abra a imagem (alternativamente, a importação de Bio-Formats conforme descrito na etapa 9.1) clicando em Arquivo > Abrir > selecionar imagem de partícula no local do arquivo coletado na etapa 4.7 e na imagem de referência de régua descrita na etapa 1.6. A criação de uma imagem duplicada é recomendada clicando em Shift + Command + D para comparar com a imagem original enquanto ajusta as configurações limiares da imagem de cópia.
NOTA: O comando Arquivo > Open abre vários formatos apoiados nativamente pelo ImageJ, conforme descrito na etapa 8.7. Alternativamente, selecione o local da imagem no computador e arraste e solte o arquivo na barra de status principal da janela ImageJ. O arquivo de imagem será aberto automaticamente em uma janela separada. - Aproxime-se e desça para a imagem usando CTRL + e CTRL -, respectivamente.
- Defina as medidas clicando em Analisar > definir medidas e selecione Descritores de Área e Forma como os valores padrão.
- Defina a barra de escala desenhando uma linha em linha reta sobre o comprimento da barra de escala usando a imagem de referência da régua, conforme descrito na etapa 8. Pressione Analisar > Escala de conjunto e digite o valor numérico do comprimento da barra em distância conhecida e na unidade do comprimento correspondente.
- Visualize a barra de escala na imagem clicando em Analisar > Ferramentas > Barra de Escala e ajustar configurações como mostrar contraste nítido na imagem. Selecione uma posição na imagem onde a barra de escala deve ser colocada para as configurações da barra de escala. Selecione Largura para ajustar a barra em unidades calibradas, Altura da barra em pixels e Tamanho da fonte da etiqueta da barra de escala. Selecione o plano de fundo para ajustar a cor de enchimento da caixa de texto da etiqueta.
NOTA: Para micrômetros, a entrada de μm é suficiente; o programa se adapta automaticamente à saída de dados. - Transforme a imagem em uma imagem de 8 bits selecionando > de imagem Tipo > 8 bits.
- Converta a imagem copiada em 8 bits selecionando > tipo de imagem > 8 bits.
- Ajuste selecionando > de imagem Ajuste > limite > set (compare o tamanho da imagem original).
- Determine quais medidas tomar, selecionando Analisar > definir medidas.
- Selecione Analisar partículas > 0-infinito, clique em Exibir resultados e in situ show.
- Armazene os resultados do ROI (.zip) em "Salvar medidas e selecionar pasta".
- Salvar resultados (*.csv) em Arquivo > Salvar como > selecionar pasta.
10. Diâmetro de partículas (dp) e cálculo do fator de forma no software de planilha
NOTA: O conhecimento do diâmetro das partículas e dos fatores de forma são essenciais para o comportamento das partículas (destino, transporte) no ambiente e a determinação da área da superfície. Portanto, a geometria é essencial quando os PMs são utilizados para estudos ambientais. Por exemplo, diferentes mecanismos de interação com o solo foram observados dependendo dos tamanhos e formas dos PMs, como as aglomerações MP-MP e MP-solo, que influenciam o movimento de partículas no solo15,32. Portanto, sugere-se que as seguintes etapas determinem a distribuição do tamanho da p-partícula d e o parâmetro geométrico.
- Importe o arquivo *.csv correspondente obtido e salvo da análise ImageJ (etapa 9.13) para o software de planilha.
NOTA: Os valores numéricos em cada linha de coluna refletem cálculos individuais para cada partícula de acordo com a equação 1 e a equação 2. - Avalie os valores médios dos parâmetros de forma, como circularidade (CIR) e proporção (AR) inserindo = média (x,y) na parte inferior de cada coluna, onde x representa a primeira linha e a última linha da coluna, em seguida, pressione Enter. Os valores cir descrevem a relação entre a área projetada e o círculo perfeito com a CIR de uma partícula individual = 1 (equação 1). O AR representa a relação comprimento/largura da partícula descrita pela equação 2.
- Determine se a média ar < 2,5, em seguida, calcule os valores dp em uma nova coluna usando a equação 3. Se ar ≥ 2,5, então calcule dp valores refletindo a equação 4. Adicione uma nova coluna para calcular dp com base na coluna de área recebida da saída ImageJ.
NOTA: A seleção dos valores do limiar de AR ≥ 2,5 representa partículas em forma mais retangular, enquanto ar < 2.5 refletem partículas em forma mais redonda. Esta seleção permite minimizar o erro de cálculo dp derivado da área medida por microscopia e determinado através do ImageJ.
(1)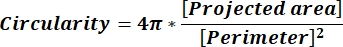
(2)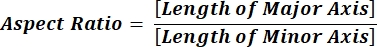
(3)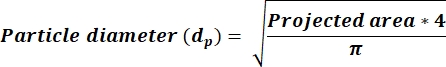
(4)
11. Análise estatística para PMs e NPs
- Abra o arquivo de dados *.csv com o software estatístico por Arquivo > Abra > Selecione a localização do arquivo do arquivo correspondente, conforme criado na etapa 9.13.
NOTA: Alternativamente, a tabela pode ser transferida diretamente através do recurso copiador para o software estatístico. Consulte a Tabela de Materiais para a marca e versão do software estatístico Editar > Colar com nomes de colunas. - Avalie os dados dp selecionando Analisar > Distribuição.
- Selecione dp, que reflete os dados da coluna, arraste e solte em colunas Y e pressione o botão OK. Esse recurso cria um histograma com uma saída estatística, incluindo estatísticas sumárias, médias e valores de Dev em uma janela separada.
- Avalie se o histograma segue uma distribuição normal (ou o melhor ajuste para dp) com a melhor curva de ajuste selecionando o triângulo ao lado de d p > Ajuste Contínuo e, em seguida, selecione a curva recebida como o melhor ajuste (por exemplo, Fit Normal). Esta etapa sobrepõe o histograma com um ajuste normalmente distribuído.
- Determine e reporte os valores médios e de desvio padrão da saída das estatísticas sumárias dos valores médios dos parâmetros de forma da circularidade (Cir), proporção (AR), arredondamento (Round) e solidez (Sol).
NOTA: Recomenda-se um nível de significância estatística de α = 0,05 e foi empregado para todas as avaliações. O nível de significância é a probabilidade de rejeitar a hipótese nula quando é verdade ao comparar resultados numéricos.
12. Melhor ajuste de dp tamanho distribuição e fatores de forma de partículas
- Carregue os dados definidos em software estatístico e use o mesmo conjunto de dados *.csv para a distribuição de dp como calculado na etapa 10.
- Selecione Analisar > confiabilidade e sobrevivência > distribuição de vida.
- Arraste a coluna dp para o campo Y, Time to Event e selecione OK. Este recurso cria uma saída com um plot de probabilidade em função de dp.
- Determine a distribuição ideal em Compare Distribuições verificando Não-paramétrica, Lognormal, Weibull, Loglogistic e Normal.
- Avaliar a qualidade do modelo se encaixa pelos menores valores numéricos para os critérios de informação de Akaike e Bayesian (AIC e BIC, respectivamente) na Tabela de Comparação do Modelo estatístico abaixo do gráfico pelos menores números de BIC . O modelo de melhor ajuste é apresentado na primeira linha por padrão. Os campos de saída de estimativa paramétrica ou não paramétrica para cada avaliação de distribuição estão localizados abaixo do gráfico Compare Distributions .
- Salve o script de saída na tabela de dados selecionando o triângulo vermelho pull-down no canto superior esquerdo pelo Save Script > Para a Tabela de Dados. Em seguida, salve a tabela de dados original no local de arquivo desejado selecionando Arquivo > Salvar como > *.jmp.
13. Caracterização dimensional de NPs através da dispersão dinâmica da luz
- Inicie o software DLS (Dynamic Light Scattering, dispersão de luz dinâmica) clicando duas vezes no ícone da área de trabalho. Selecione Arquivo > SOP de nova >. Adicione o nome da amostra e selecione o índice de refração do material para 1,33 para água destilada e 1,59 para polímeros33 no software DLS em Configuração de Amostra. Selecione Material no menu Pull-Down e clique em OK.
NOTA: Clicar no menu pull-down abre o Gerenciador de Materiais, que oferece adicionar novas amostras ou modificar amostras existentes alterando o índice de refração e absorção. Selecione como água dispersante. - Selecione a célula adequada sob o tipo celular > celular e selecione Relatórios para determinar qual saída será apresentada após cada medição.
- Inicie o instrumento fechando a tampa do instrumento e ligando o sistema fechando a tampa (se aberta) e pressionando o botão ON . Aguarde após o primeiro bipe e espere cerca de 30 minutos para permitir a estabilização do feixe.
- Aguarde até que a rotina de inicialização seja concluída e aguarde um segundo som de bipe, indicando que a temperatura pré-definida (geralmente 25 °C) foi atingida.
- Prepare uma amostra de chorume de NPs (como recebido na etapa 7) e água DI em um frasco de 15 mL a ~0,1 wt% de concentração por agitação magnética por ~1 h para permitir misturar bem.
- Agite o chorume antes de transferir ~1,0 mL para a cuvette de quartzo de 4,5 mL e abra a tampa. Em seguida, insira cuidadosamente a célula amostral no suporte amostral do instrumento DLS.
NOTA: Prepare três amostras do mesmo lote de chorume na mesma concentração descrita na etapa 13.5. - Execute três medidas (seleção no software DLS) para cada amostra. Entre as medições, remova a célula amostral e agite suavemente as amostras por 5 s para permitir a mistura da amostra.
- Extrair e exportar dados através do software DLS, transferir o conjunto de dados para o software de planilha e criar histogramas para MPs e NPs conforme descrito nas etapas 11.1-11.5 (Figura 1). Cópia da Guia de exibição de registros ou uma tabela ou gráfico selecionando editar cópia, que pode ser colada em outro aplicativo, como o software de planilha.
14. Análise química dos MNPs utilizando a espectrometria total atenuada da espectrometria de transformação fourier (FTIR)
NOTA: As análises químicas dos MNPs por fourier transformação infravermelha (FTIR) e espectroscopias de ressonância magnética nuclear (NMR) são ferramentas adequadas para avaliar o impacto da moagem úmida nas propriedades de ligação química, bem como as quantidades relativas de componentes principais e os constituintes monoméicos dos polímeros, respectivamente10. Além disso, as propriedades térmicas e a estabilidade dos constituintes polimédicos dos MNPs podem ser avaliadas por meio da calorimetria de digitalização diferencial (DSC) e da análise termogravimétrica (TGA), respectivamente29.
- Limpe o sistema de detecção (superfície de cristal ATR) com etanol e um pano sem fiapos.
- Inicie o software e pressione o botão de fundo na barra de comando para realizar uma varredura de fundo no ar, limpando o caminho do feixe de instrumentos. O espectro de fundo é exibido logo após a coleta.
- Digite O ID da amostra e a descrição da amostra na barra de ferramentas de configuração do instrumento.
- Ajuste o número de ondas espectrais entre 4000 cm-1 e 600 cm-1 e selecione uma resolução de 2,0 cm-1 no modo de absorção. Selecione 32 varreduras por espectro e inicie.
- Coloque uma amostra plástica (~20 mgs ou ~ 1-3 mm3) de MPs (106 μm) e NPs (~300 nm) dentro de uma arruela de aço com diâmetro interno de ~10 mm, ou equivalente, na superfície cristalina.
NOTA: A arruela evita a dispersão no cristal quando o porta-amostras comprime a amostra, resultando em inhomogeneidades materiais e viés de dados devido a medidas inconsistentes. - Coloque a arruela no centro do cristal ATR e adicione a amostra de polímero no meio da abertura da lavadora com uma espátula.
- Gire a alavanca da amostra acima para o centro da amostra e gire o botão no sentido horário monitorando a força do Medidor de Força entre 50-90. A amostra mostra os espectros preliminares. Pressione o botão Digitalizar uma segunda vez para coletar o espectro.
- Colecione entre 8-10 espectros clicando no botão Digitalizar e misture as amostras cuidadosamente após cada medição com uma espátula para permitir a coleta de resultados representativos.
- Clique na pasta Exibição de amostras no Data Explorer para exibir todas as amostras coletadas sobrepostas na área de visualização. Primeiro, remova espectros significativamente desviantes representando outliers. Em seguida, selecione o modo de absorção ou transmissão na barra de ferramentas.
- Salve espectros selecionando a pasta Exibição de amostras contendo o espectro e selecionando Salvar Como no menu de arquivos. A janela de diálogo permite o nome do arquivo, o diretório de destino e a alteração de localização padrão para todos os espectros.
NOTA: Alternativamente, o espectro pode ser salvo como um arquivo *.sp selecionando um espectro e clicando com o botão direito do mouse para exibir a opção Binário. Selecione Salvar binário e navegue no local final do Salvar. - Execute a correção da linha de base e a normalização média selecionando um único espectro no Explorador de Dados selecionando processo > Normalização no menu, seja através do software ou na próxima etapa.
NOTA: A normalização média compensa os erros espectrais devido à espessura ou variação material da amostra. - Limpe a área de cristal com etanol e pano sem fiapos após a conclusão da coleta de dados.
- Interprete diferenças entre MPs e NPs de acordo com as bandas de vibração FTIR atribuídas, atribuídas e avaliadas em uma publicação anterior10.
Access restricted. Please log in or start a trial to view this content.
Resultados
Para validar o método e análise do procedimento experimental, os PMs e NPs foram formados a partir de pelotas e materiais de filme e comparados por tamanho e forma utilizando imagens microscópicas. O método descrito na Figura 1 formou eficientemente MPs e NPs a partir de pelotas e filmes plásticos biodegradáveis; isso foi conseguido através do resfriamento criogênico, moagem e moagem úmida e caracterização. O primeiro passo era desnecessário para filmes ambientalmente intemperado...
Access restricted. Please log in or start a trial to view this content.
Discussão
Este método descreve um processo eficaz inicialmente descrito em uma publicação anterior29, para preparar MNPs originários de pelotas e filmes de mulch para estudos ambientais. O processo de redução de tamanho envolveu resfriamento criogênico (apenas para filme), fresagem seca e estágios de moagem úmida, para a fabricação de MNPs modelo. Aplicamos este método para preparar MNPs de uma ampla gama de matérias-primas poliméricas, incluindo polietileno de baixa densidade (LDPE), adipate-...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Esta pesquisa foi financiada pela Herbert College of Agriculture, pelo Departamento de Engenharia e Solo de Biossistemas e pela Aliança científica da Universidade do Tennessee, Knoxville. Além disso, os autores reconhecem com gratidão o apoio financeiro fornecido através do USDA Grant 2020-67019-31167 para esta pesquisa. As matérias-primas iniciais para a preparação de MNPs do filme biodegradável mulch baseado em PBAT foram gentilmente fornecidas pela BioBag Americas, Inc. (Dunevin, FL, USA), e por PBAT por Mobius, LLC (Lenoir City, TN).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Aluminum dish, 150 mL | Fisher Scientific, Waltham, MA, USA | 08-732-103 | Drying of collected NPs |
| Aluminum dish, 500 mL | VWR International, Radnor, PA, USA | 25433-018 | Collecting NPs after wet-grinding |
| Centrifuge | Fisher Scientific, Waltham, MA, USA | Centrific 228 | Container for centrifugation |
| Delivery tube, #20, 840 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M30 | Sieving of the first fraction during milling |
| Delivery tube, #60, 250 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M45 | Sieving of the second fraction (3x) during milling |
| Thermomixer, 5350 Mixer | Eppendorf North America, Enfield, CT, USA | 05-400-200 | Analysis of sieving experiments |
| FT-IR Spectrum Two, spectrometer with attenuated total reflectance (ATR) | Perkin Elmer, Waltham, MA, USA | L1050228 | Measuring FTIR spectra |
| Glass beaker, 1000 mL | DWK Life Sciences, Milville, NJ, USA | 02-555-113 | Stirring of MPs-water slurry before grinding |
| Glass front plate | Thomas Scientific, Swedesboro, NJ, USA | 3383N55 | Front cover plaste for Wiley Mini Mill |
| Glass jar, 50 mL | Uline, Pleasant Prairie, WI, USA | S-15846P | Collective MPs after milling |
| Glove Box, neoprene | Bel-Art-SP Scienceware, Wayne, NJ, USA | BEL-H500290000 | 22-Inch, Size 10 |
| Zetasizer Nano ZS 90 size analyzer | Malvern Panalytical, Worcestershire, UK | Zetasizer Nano ZS | Measuring nanoplastics dispersed in DI-water |
| Microscope camera | Nikon, Tokyo, 108-6290, Japan | Nikon Digital Sight 10 | Combined with Olympus microscope to receive digital images |
| Microscope | Olympus, Shinjuku, Tokyo, Japan | Model SZ 61 | Imaging of MPs |
| Nitrogen jar, low form dewar flasks | Cole-Palmer, Vernon Hills, IL, USA | UX-03771-23 | Storage of liquid nitrogen during cryogenic cooling |
| Accurate Blend 200, 12-speed blender | Oster, Boca Raton, FL, USA | 6684 | Initiating the size reduction of cryogenically treated plastic film |
| PBAT film, - BioAgri™ (Mater-Bi®) | BioBag Americas, Inc, Dunedin, FL, USA | 0.7 mm thick | Feedstock to form MPs and NPs, agricultural mulch film |
| PBAT pellets | Mobius, LLC, Lenoir City, TN, USA | Diameter 3 mm | Feedstock to form microplastics (MPs) and nanoplastics (NPs) trough milling and grinding |
| Plastic centrifuge tubes, 50 mL | Fisher Scientific, Waltham, MA, USA | 06-443-18 | Centrifugation of slurry after wet-grinding |
| Plastic jar, 1000 mL, pre-cleaned, straight sided | Fisher Scientific, Waltham, MA, USA | 05-719-733 | Collection of NPs during and after wet grinding |
| Polygon stir bars, diameterø=8 mm, length=50.8 mm | Fisher Scientific, Waltham, MA, USA | 14-512-127 | Stirring of MPs slurry prior to wet-grinding |
| Scissors, titanium bonded | Westcott, Shelton, CT, USA | 13901 | Cutting of initial PBAT film feedstocks |
| Square glass cell with square aperture and cap, 12 mm O.D. | Malvern Panalytical, Worcestershire, UK | PCS1115 | Measuring of NPs particle size |
| Stainless steel bottom, 3 inch, pan | Hogentogler & Co. Inc, Columbia, MD, USA | 8401 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 140 (106 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1308 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 20 (850 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1296 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 325 (45 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1313 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 60 (250 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1303 | Sieving of MPs after Wiley-milling |
| Stainless steel top cover, 3 inch | Hogentogler & Co. Inc, Columbia, MD, USA | 8406 | Sieving of MPs after Wiley-milling |
| Stainless steel tweezers | Global Industrial, Port Washington, NY, USA | T9FB2264892 | Transferring of frozen film particles from jar into blender |
| Vacuum oven, model 281A | Fisher Scientific, Waltham, MA, USA | 13-262-50 | Vacuum oven to dry NPs after wet-grinding |
| Friction grinding machine, Supermass Colloider | Masuko Sangyo, Tokyo, Japan | MKCA6-2J | Grinding machine to form NPs from MPs |
| Wet-grinding stone, grit size: 297 μm -420 μm | Masuko Sangyo, Tokyo, Japan | MKE6-46DD | Grinding stone to form NPs from MPs |
| Wiley Mini Mill, rotary cutting mill | Thomas Scientific, Swedesboro, NJ, USA | NC1346618 | Size reduction of pellets and film into MPs and NPs |
| Software | |||
| FTIR-Spectroscopy software | Perkin Elmer, Waltham, MA, USA | Spectrum 10 | Collection of spectra from the initial plastic, MPs and NPs |
| Image J, image processing program | National Institutes of Health, Bethesda, MD, USA | Version 1.53n | Analysis of digital images received from microscopy |
| Microscope software, ds-fi1 software | Malvern Panalytical , Malvern, UK | Firmware DS-U1 Ver3.10 | Recording of digital images |
| Microsoft, Windows, Excel 365, spreadsheet software | Microsoft, Redmond, WA, USA | Office 365 | Calculating the average particle size and creating FTIR spectra images |
| JMP software, statistical software | SAS Institute Inc., Cary, NC, 1989-2021 | Version 15 | Statistical analysis of particle size and perform best fit of data set |
| Unscrambler software | Camo Analytics, Oslo, Norway | Version 9.2 | Normalizing and converting FTIR spectra into .csv fromat |
Referências
- Jin, Z., Dan, L. Review on the occurrence, analysis methods, toxicity and health effects of micro-and nano-plastics in the environment. Environmental Chemistry. (1), 28-40 (2021).
- Kumar, M., et al. Current research trends on micro-and nano-plastics as an emerging threat to global environment: a review. Journal of Hazardous Materials. 409, 124967(2021).
- Alimba, C. G., Faggio, C., Sivanesan, S., Ogunkanmi, A. L., Krishnamurthi, K. Micro (nano)-plastics in the environment and risk of carcinogenesis: Insight into possible mechanisms. Journal of Hazardous Materials. 416, 126143(2021).
- Serrano-Ruiz, H., Martin-Closas, L., Pelacho, A. M. Biodegradable plastic mulches: Impact on the agricultural biotic environment. Science of The Total Environment. 750, 141228(2021).
- Hayes, D. G., et al. Biodegradable plastic mulch films for sustainable specialty crop production. Polymers for Agri-Food Applications. , Springer. Cham. 183-213 (2019).
- Viaroli, S., Lancia, M., Re, V. Microplastics contamination of groundwater: Current evidence and future perspectives. A review. Science of The Total Environment. , 153851(2022).
- Rillig, M. C., Lehmann, A. Microplastic in terrestrial ecosystems. Science. 368 (6498), 1430-1431 (2020).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. Journal of Polymers and the Environment. 29 (9), 2916-2931 (2021).
- Yang, Y., et al. Kinetics of microplastic generation from different types of mulch films in agricultural soil. Science of The Total Environment. 814, 152572(2022).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Schwaferts, C., Niessner, R., Elsner, M., Ivleva, N. P. Methods for the analysis of submicrometer-and nanoplastic particles in the environment. TrAC Trends in Analytical Chemistry. 112, 52-65 (2019).
- Gigault, J., et al. Current opinion: what is a nanoplastic. Environmental Pollution. 235, 1030-1034 (2018).
- Naqash, N., Prakash, S., Kapoor, D., Singh, R. Interaction of freshwater microplastics with biota and heavy metals: a review. Environmental Chemistry Letters. 18 (6), 1813-1824 (2020).
- Manzoor, S., Naqash, N., Rashid, G., Singh, R. Plastic material degradation and formation of microplastic in the environment: A review. Materials Today: Proceedings. , 3254-3260 (2022).
- de Souza Machado, A. A., et al. Impacts of microplastics on the soil biophysical environment. Environmental Science & Technology. 52 (17), 9656-9665 (2018).
- Jacques, O., Prosser, R. A probabilistic risk assessment of microplastics in soil ecosystems. Science of The Total Environment. 757, 143987(2021).
- Kwak, J. I., An, Y. -J. Microplastic digestion generates fragmented nanoplastics in soils and damages earthworm spermatogenesis and coelomocyte viability. Journal of Hazardous Materials. 402, 124034(2021).
- Wahl, A., et al. Nanoplastic occurrence in a soil amended with plastic debris. Chemosphere. 262, 127784(2021).
- Vighi, M., et al. Micro and nano-plastics in the environment: research priorities for the near future. Reviews of Environmental Contamination and Toxicology Volume 257. , 163-218 (2021).
- Pironti, C., et al. Microplastics in the environment: intake through the food web, human exposure and toxicological effects. Toxics. 9 (9), 224(2021).
- Zurier, H. S., Goddard, J. M. Biodegradation of microplastics in food and agriculture. Current Opinion in Food Science. 37, 37-44 (2021).
- Horton, A. A., Dixon, S. J. Microplastics: An introduction to environmental transport processes. Wiley Interdisciplinary Reviews: Water. 5 (2), 1268(2018).
- Panno, S. V., et al. Microplastic contamination in karst groundwater systems. Groundwater. 57 (2), 189-196 (2019).
- Su, Y., et al. Delivery, uptake, fate, an transport of engineered nanoparticles in plants: a critical review and data analysis. Environmental Science: Nano. 6 (8), 2311-2331 (2019).
- Yu, Y., Griffin-LaHue, D. E., Miles, C. A., Hayes, D. G., Flury, M. Are micro-and nanoplastics from soil-biodegradable plastic mulches an environmental concern. Journal of Hazardous Materials Advances. 4, 100024(2021).
- Hayes, D. G. Enhanced end-of-life performance for biodegradable plastic mulch films through improving standards and addressing research gaps. Current Opinion in Chemical Engineering. 33, 100695(2021).
- Qin, M., et al. A review of biodegradable plastics to biodegradable microplastics: Another ecological threat to soil environments. Journal of Cleaner Production. 312, 127816(2021).
- Phuong, N. N., et al. Is there any consistency between the microplastics found in the field and those used in laboratory experiments. Environmental Pollution. 211, 111-123 (2016).
- Astner, A., et al. Mechanical formation of micro-and nano-plastic materials for environmental studies in agricultural ecosystems. Science of The Total Environment. 685, 1097-1106 (2019).
- Rist, S., Hartmann, N. B. Aquatic ecotoxicity of microplastics and nanoplastics: lessons learned from engineered nanomaterials. Freshwater Microplastics. , Springer. Cham. 25-49 (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Raju, S., et al. Improved methodology to determine the fate and transport of microplastics in a secondary wastewater treatment plant. Water Research. 173, 115549(2020).
- Caputo, F., et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: addressing some analytical challenges in the sub-micron size range. Journal of Colloid and Interface Science. 588, 401-417 (2021).
- Xu, M., et al. Polystyrene microplastics alleviate the effects of sulfamethazine on soil microbial communities at different CO2 concentrations. Journal of Hazardous Materials. 413, 125286(2021).
- Ding, L., et al. Insight into interactions of polystyrene microplastics with different types and compositions of dissolved organic matter. Science of The Total Environment. 824, 153883(2022).
- Abbasimaedeh, P., Ghanbari, A., O'Kelly, B. C., Tavanafar, M., Irdmoosa, K. G. Geomechanical behaviour of uncemented expanded polystyrene (EPS) beads-clayey soil mixtures as lightweight fill. Geotechnics. 1 (1), 38-58 (2021).
- Li, Z., Li, Q., Li, R., Zhou, J., Wang, G. The distribution and impact of polystyrene nanoplastics on cucumber plants. Environmental Science and Pollution Research. 28 (13), 16042-16053 (2021).
- Sobhani, Z., Panneerselvan, L., Fang, C., Naidu, R., Megharaj, M. Chronic and transgenerational effects of polystyrene microplastics at environmentally relevant concentrations in earthworms (Eisenia fetida). Environmental Toxicology and Chemistry. 40 (8), 2240-2246 (2021).
- Lionetto, F., Esposito Corcione, C., Rizzo, A., Maffezzoli, A. Production and characterization of polyethylene terephthalate nanoparticles. Polymers. 13 (21), 3745(2021).
- Dümichen, E., et al. Analysis of polyethylene microplastics in environmental samples, using a thermal decomposition method. Water Research. 85, 451-457 (2015).
- Robotti, M., et al. Attrition and cryogenic milling production for low pressure cold gas spray and composite coatings characterization. Advanced Powder Technology. 27 (4), 1257-1264 (2016).
- Ducoli, S., et al. A different protein corona cloaks "true-to-life" nanoplastics with respect to synthetic polystyrene nanobeads. Environmental Science: Nano. 9 (4), 1414-1426 (2022).
- El Hadri, H., Gigault, J., Maxit, B., Grassl, B., Reynaud, S. Nanoplastic from mechanically degraded primary and secondary microplastics for environmental assessments. NanoImpact. 17, 100206(2020).
- Eitzen, L., et al. The challenge in preparing particle suspensions for aquatic microplastic research. Environmental research. 168, 490-495 (2019).
- Ekvall, M. T., et al. Nanoplastics formed during the mechanical breakdown of daily-use polystyrene products. Nanoscale advances. 1 (3), 1055-1061 (2019).
- Caldwell, J., et al. Fluorescent plastic nanoparticles to track their interaction and fate in physiological environments. Environmental Science: Nano. 8 (2), 502-513 (2021).
- Zeb, A., et al. Evaluating the knowledge structure of micro-and nanoplastics in terrestrial environment through scientometric assessment. Applied Soil Ecology. 177, 104507(2022).
- Ji, Z., et al. Effects of pristine microplastics and nanoplastics on soil invertebrates: A systematic review and meta-analysis of available data. Science of The Total Environment. 788, 147784(2021).
- de Alkimin, G. D., Gonçalves, J. M., Nathan, J., Bebianno, M. J. Impact of micro and nanoplastics in the marine environment. Assessing the Effects of Emerging Plastics on the Environment and Public Health. , IGI Global. 172-225 (2022).
- Pires, A., Cuccaro, A., Sole, M., Freitas, R. Micro (nano) plastics and plastic additives effects in marine annelids: A literature review. Environmental Research. , 113642(2022).
- Hurley, R. R., Nizzetto, L. Fate and occurrence of micro (nano) plastics in soils: Knowledge gaps and possible risks. Current Opinion in Environmental Science & Health. 1, 6-11 (2018).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados