Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bildung von Mikro- und Nanoplastik aus Agrarkunststofffolien für den Einsatz in Grundlagenforschung
In diesem Artikel
Zusammenfassung
Wir zeigen die Bildung und dimensionale Charakterisierung von Mikro- und Nanoplastik (MPs bzw. NPs) mittels eines schrittweisen Prozesses aus mechanischem Fräsen, Schleifen und bildgebender Analyse.
Zusammenfassung
Mikroplastik (MP) und Nanoplastik (NP), die in landwirtschaftlichen Ökosystemen verteilt sind, können eine ernsthafte Bedrohung für Biota im Boden und in nahe gelegenen Wasserstraßen darstellen. Darüber hinaus können Chemikalien wie Pestizide, die von NPs adsorbiert werden, Bodenorganismen schädigen und möglicherweise in die Nahrungskette gelangen. In diesem Zusammenhang tragen landwirtschaftlich genutzte Kunststoffe wie Kunststoffmulchfolien wesentlich zur Plastikverschmutzung in landwirtschaftlichen Ökosystemen bei. Die meisten grundlegenden Studien über Verbleib und Ökotoxizität verwenden jedoch idealisierte und schlecht repräsentative MP-Materialien wie Polystyrol-Mikrosphären.
Daher haben wir, wie hier beschrieben, ein mehrstufiges Verfahren im Labormaßstab entwickelt, um repräsentative MPs und NPs für solche Studien mechanisch zu bilden. Das Kunststoffmaterial wurde aus handelsüblichen Kunststoffmulchfolien aus Polybutyratadipat-Co-terephthalat (PBAT), die entweder durch kryogene Behandlung (CRYO) oder Umweltverwitterung (W) versprödet wurden, sowie aus unbehandelten PBAT-Pellets hergestellt. Die Kunststoffmaterialien wurden dann durch mechanisches Fräsen zu MPs mit einer Größe von 46-840 μm behandelt, die den Abrieb von Kunststofffragmenten durch Wind und mechanische Maschinen nachahmen. Die Abgeordneten wurden dann in mehrere Größenfraktionen gesiebt, um weitere Analysen zu ermöglichen. Schließlich wurde die 106 μm Siebfraktion einer Nassvermahlung unterzogen, um NPs von 20-900 nm zu erzeugen, ein Prozess, der den langsamen Zerkleinerungsprozess für terrestrische MPs nachahmt. Die Abmessungen und die Form für MPs wurden durch Bildanalyse von Stereomikroaufnahmen bestimmt, und dynamische Lichtstreuung (DLS) wurde verwendet, um die Partikelgröße für NPs zu bestimmen. MPs und NPs, die durch diesen Prozess gebildet wurden, besaßen unregelmäßige Formen, was den geometrischen Eigenschaften von MPs entspricht, die von landwirtschaftlichen Feldern gewonnen wurden. Insgesamt erwies sich diese Zerkleinerungsmethode als effizient für die Bildung von MPs und NPs, die aus biologisch abbaubaren Kunststoffen wie Polybutylenadipat-Co-Terephthalat (PBAT) bestehen, die Mulchmaterialien darstellen, die für die landwirtschaftliche Sonderpflanzenproduktion verwendet werden.
Einleitung
In den letzten Jahrzehnten haben die weltweit rasant steigende Produktion von Kunststoffen und die unsachgemäße Entsorgung und das fehlende Recycling von Kunststoffabfällen zu einer Umweltverschmutzung geführt, die sich auf marine und terrestrische Ökosysteme ausgewirkt hat 1,2,3. Kunststoffmaterialien sind für die moderne Landwirtschaft unerlässlich, insbesondere für den Anbau von Gemüse, Kleinobst und anderen Sonderkulturen. Ihre Verwendung als Mulchfolien, hohe und niedrige Tunnelabdeckungen, Tropfband und andere Anwendungen zielen darauf ab, den Ernteertrag und die Qualität zu verbessern, die Produktionskosten zu senken und nachhaltige Anbaumethoden zu fördern 4,5. Der zunehmende Einsatz von "Plastikultur" hat jedoch Bedenken hinsichtlich der Bildung, Verteilung und Aufbewahrung von Kunststoffteilen in landwirtschaftlichen Umgebungen aufgeworfen. Nach einem kontinuierlichen Fragmentierungsprozess durch Versprödung durch Umweltzerstörung während der Lebensdauer bilden größere Kunststofffragmente Mikro- und Nanoplastik (MNPs), die im Boden persistieren oder über Wasserabfluss und Wind in benachbarte Gewässer wandern 6,7,8. Umweltfaktoren wie ultraviolette (UV) Strahlung durch Sonnenlicht, mechanische Kräfte von Wasser und biologische Faktoren lösen die plastische Versprödung von umweltverteilten Kunststoffen aus, was zum Zerfall größerer Kunststofffragmente in makro- oder mesoplastische Partikel führt 9,10. Durch die weitere Defragmentierung entstehen Mikroplastik (MPs) und Nanoplastik (NP), die Partikel mittlerer Größe (Nenndurchmesser; dp) von 1-5000 μm bzw. 1-1000 nm bzw.11. Die obere dp-Grenze für NPs (dh eine untere Grenze für MPs) ist jedoch nicht allgemein vereinbart und in mehreren Papieren wird dies als 100 nm12 aufgeführt.
MNPs aus Kunststoffabfällen stellen eine zunehmende globale Bedrohung für die Bodengesundheit und die Ökosystemdienstleistungen dar. Die Adsorption von Schwermetallen aus Süßwasser durch MPs führte zu einer 800-fach höheren Konzentration von Schwermetallen im Vergleich zur Umgebung13. Darüber hinaus stellen MPs in aquatischen Ökosystemen mehrere Stressoren und Schadstoffe dar, indem sie die Lichtdurchdringung verändern, Sauerstoffmangel verursachen und eine Adhäsion an verschiedenen Biota verursachen, einschließlich Penetration und Akkumulation in aquatischen Organismen14.
Neuere Studien deuten darauf hin, dass MNPs die Bodengeochemie und Biota beeinflussen können, einschließlich mikrobieller Gemeinschaften und Pflanzen15,16,17. Darüber hinaus bedrohen NPs das Nahrungsnetz17,18,19,20. Da MNPs im Boden leicht vertikal und horizontal transportiert werden, können sie absorbierte Schadstoffe wie Pestizide, Weichmacher und Mikroorganismen durch den Boden in das Grundwasser oder aquatische Ökosysteme wie Flüsse und Bächetransportieren 21,22,23,24. Herkömmliche Agrarkunststoffe wie Mulchfolien werden aus Polyethylen hergestellt, das nach Gebrauch vom Feld entfernt und auf Deponien entsorgt werden muss. Eine unvollständige Entfernung führt jedoch zu einer erheblichen Ansammlung von Kunststoffabfällen in Böden 9,25,26. Alternativ sind bodenbiologisch abbaubare Kunststoffmulche (BDMs) so konzipiert, dass sie nach Gebrauch in den Boden gepflügt werden, wo sie im Laufe der Zeit abgebaut werden. BDMs verbleiben jedoch vorübergehend im Boden und zerfallen allmählich und fragmentieren sich in MPs und NPs 9,27.
Viele aktuelle umweltökotoxikologische und Schicksalsstudien verwenden idealisierte und nicht repräsentative MP- und NP-Modellmaterialien. Die am häufigsten verwendeten Ersatz-MNPs sind monodisperse Polystyrol-Mikro- oder Nanokugeln, die nicht die tatsächlichen MNPs widerspiegeln, die sich in der Umwelt befinden 12,28. Folglich kann die Auswahl von nicht repräsentativen Abgeordneten und NPs zu ungenauen Messungen und Ergebnissen führen. Aufgrund des Mangels geeigneter Modell-ΜNPs für terrestrische Umweltstudien waren die Autoren motiviert, solche Modelle aus landwirtschaftlichen Kunststoffen herzustellen. Wir berichteten bereits über die Bildung von MNPs aus BDMs und Polyethylenpellets durch mechanisches Mahlen und Mahlen von Kunststoffpellets und Folienmaterialien sowie über die dimensionalen und molekularen Eigenschaften vonMNPs 29. Das vorliegende Papier bietet ein detaillierteres Protokoll für die Herstellung von MNPs, das breiter auf alle landwirtschaftlichen Kunststoffe wie Mulchfolien oder deren pelletierte Rohstoffe angewendet werden kann (Abbildung 1). Hier haben wir beispielhaft eine Mulchfolie und kugelförmige Pellets des biologisch abbaubaren Polymers Polybutylenterephthalat (PBAT) gewählt, um landwirtschaftliche Kunststoffe darzustellen.
Protokoll
1. Verarbeitung von MPs aus Kunststoffpellets durch kryogene Vorbehandlung und Mahlung
ANMERKUNG: Diese Methodik basiert auf einem an anderer Stelle beschriebenen Verfahren, bei dem ein PBAT-Film verwendet wird, der aus demselben Material besteht, das für diese vorgestellte Studie verwendetwurde 29.
- Polymerpelletproben von ~ 1 g wiegen und in ein 50 ml Glasgefäß geben.
- Legen Sie das "rechteckige Förderrohr" mit einem Sieb mit 20 Maschen (840 μm) in den Schlitz vor der Rotationsschneidmühle und heben Sie das Förderrohr an, bis es auf den Anschlagstift trifft.
- Positionieren Sie die Glasplatte über der Oberfläche der Fräskammer und sichern Sie sie mit der verstellbaren Klemme. Stellen Sie anschließend ein 50-ml-Glas unter den Mühlenauslass (Abbildung 2).
- Positionieren Sie die verschiebbare Seitenarmstütze auf der Mühle (rechts oben) in der Mitte der Frontscheibe und ziehen Sie sie mit dem Rändelbolzen fest. Stellen Sie sicher, dass das Frontglas der Mühle sicher positioniert ist (Abbildung 2a).
- Führen Sie den Trichtertrichter oben auf der Mühle in die Öffnung der oberen Mahlkammer ein.
- Stecken Sie ein Leitungskabel in eine Steckdose und den Presskabelschalter, um den Mühlenbetrieb zu starten.
HINWEIS: Um ein Verklemmen zu vermeiden, führen Sie nur Material zu, nachdem die Mühle eingeschaltet und gedreht wurde. Tragen Sie auch Augen- und Gehörschutz während des gesamten Fräsvorgangs. - Geben Sie die Probe langsam in den Trichter (ca. 10 Pellets/min), um ein Verlangsamen oder Verklemmen zu vermeiden. Nachdem das hörbare Geräusch nachgelassen hat, fügen Sie die nächste Charge Pellets (~ 10 Stück) hinzu. Drücken Sie nach der Verarbeitung der Pellets (1 g) den Kabelschalter, um den Mühlenbetrieb für ~20 min zum Abkühlen zu stoppen. Verwenden Sie einen Holzkolben, um die Probe zuzuführen und das Auswerfen und Agglomerieren von Partikeln im Einfülltrichter zu verhindern.
ACHTUNG: Die optimale Vorschubgeschwindigkeit variiert je nach Art des Verarbeitungsmaterials. Schalten Sie die Mühle sofort aus, wenn die Verarbeitungsgeschwindigkeit aufgrund von Partikelreibung in der Schneidkammer abnimmt oder wenn die Bildung von geschmolzenem Polymer auf der Glasplatte beobachtet wird, um eine Überhitzung und ein weiteres Schmelzen der Polymerpartikel zu verhindern. - Entfernen Sie das 20-mesh-Abgaberöhrchen (840 μm), und ersetzen Sie es nach Abschluss der ersten Charge durch das Verabreichungsröhrchen mit 60 Mesh (250 μm) (Abbildung 2b).
- Geben Sie das gesammelte Material wieder in den Mühlentrichter. Befolgen Sie die Schritte 1.1 und 1.7 für die 250 μm Mahlfraktion.
- Führen Sie die gesammelten 250 μm-Fraktionen bis zu dreimal wieder ein.
- Gewinnen Sie die verbleibenden Partikel in der Kammer zurück und fügen Sie sie der gesammelten Hauptfraktion hinzu.
2. Verarbeitung von Kunststofffolien durch kryogene Vorbehandlung und Mahlen
- Entnehmen Sie eine Folienprobe von der Rolle und schneiden Sie die Probe mit einem Papierschneider in Streifen von ~120 mm (Querrichtung) x 20 mm (Maschinenrichtung).
- Fragmente (~1 g) in 800 mL entionisiertem (DI) Wasser für 10 min in einem 1000 ml Glasbecher voreinweichen. Dieser Schritt verbessert die Versprödung für den anschließenden kryogenen Kühlprozess durch Vortränken des Polymers.
ACHTUNG: Behandeln Sie flüssigen Stickstoff mit Sicherheitsausrüstung mit kryogenen Handschuhen und Schutzbrillen. - Geben Sie langsam 200 ml flüssigen Stickstoff (N2) in einen kryogenen Behälter.
- Die vorgetränkten Filmpartikel werden vorsichtig mit einer Stahlpinzette in den kryogenen Behälter überführt. 3 min in FlüssigkeitN2 voreinweichen.
- Die gefrorenen Filmfragmente werden in einen 200-W-Mischer mit 14 Gängen überführt.
- Verarbeiten Sie das gefrorene Material auf Geschwindigkeitsstufe 3 für 10 s, um die gefrorene Glasfilmstruktur zu brechen. Um eine weitere Zerkleinerung zu fördern, fügen Sie 400 mL DI-Wasser hinzu und mischen Sie die Film-Wasser-Aufschlämmung für 5 min.
- Die Gülle in einen Büchner-Trichter mit Filter (1 μm Maschenweite) geben und mindestens 1 h Vakuum anlegen.
- Vakuumtrockene Feststoffpartikel bei 30 °C für mindestens 48 h in einer Aluminiumschale.
- Trockene Partikel mit einer Pinzette in die Mühle geben. Führen Sie zum Fräsen die Schritte 1.1-1.11 aus.
3. Verarbeitung von Kunststofffolien, die durch Umweltverwitterung und Fräsen vorbehandelt wurden
- Legen Sie Kunststofffolienfragmente, die vom Feld geborgen wurden, auf einer glatten Oberfläche (Labortisch) aus. Absorbierte Bodenpartikel und Pflanzenreste vorsichtig mit der Weichborstenbürste entfernen.
- Schneiden Sie den Film mit einer Schere in ~4 cm2 Proben von ~1,0 g.
- Filmfragmente in ein 1000-ml-Becherglas geben, das mit 500 mL DI-Wasser gefüllt ist. Mit einer Geschwindigkeit von 300 min-1 mit 20 mm Rührstab 1 h rühren.
- Entfernen Sie gelöste Bodenpartikel durch Dekantieren und erneutes Einbringen von DI-Wasser unter leichtem Rühren des Becherglases in eine Spüle oder einen Plastikeimer. Wiederholen Sie diesen Schritt dreimal. Kontinuierliches Rühren hält Bodenpartikel im Wasser verteilt und kann leichter dekantiert werden.
- Proben aus dem Becherglas in eine Aluminiumschale geben. Die Kunststoffproben werden 12 h an der Luft getrocknet und anschließend 24 h in einem Vakuumofen bei 30 °C umgefüllt und getrocknet. Führen Sie zum Fräsen die Schritte 1.1-1.11 aus.
4. Siebvorgang durch kaskadierte Siebe
- Stapeln Sie die Siebe (3 Zoll im Durchmesser), beginnend mit der Pfanne am Boden, gefolgt vom feinsten Sieb (# 325; 45 μm) und dann von immer gröberen Sieben (wie # 140; 106 μm und # 60; 250 μm, wobei das # 20; 840 μm Sieb das gröbste ist) und legen Sie den Deckel darauf.
- Montieren Sie alle vier Siebe auf dem Shaker, indem Sie vier Stifte in die Öffnungen des Siebschüttlers einführen.
- Übertragen Sie einzelne Fraktionen, die in Schritt 1, 2 oder 3 gesammelt wurden, auf die vier kaskadierten Siebe. 10 min bei 300 min-1 schütteln.
- Gewinnen Sie die größere (obere) Fraktion separat zurück, die einem weiteren Mahlen unterzogen wird.
HINWEIS: Stellen Sie die Schüttelgeschwindigkeit am Shaker nach Bedarf ein. Alternativ ist ein Schütteln von Sieben von Hand möglich. Verwenden Sie jeweils nur ein Sieb, beginnend mit dem Sieb Maschen #20: Halten Sie den Boden und den Deckel von Hand fest gegen das Sieb und schütteln Sie axial und horizontal für 5 Minuten. - Siebpartikel von dp > 106 μm werden wie in den Schritten 1.6-1.10 beschrieben wieder in die Rotationsschneidmühle eingebracht.
- Gewinnen Sie die unteren Fraktionen aus der Pfanne zurück und führen Sie die Partikel wieder in die nächstkleinere Siebgröße ein. Wiederholen Sie den Vorgang, bis 106 μm Partikel die Hauptfraktion darstellen.
- Die gesammelten 106 μm Fraktionen zusammenführen und die Partikel an einem trockenen Ort (Exsikkator oder luftversiegelter Plastikbeutel) aufbewahren.
HINWEIS: Die 45 μm Fraktion ist Teil der 106 μm Fraktion; Die erste Fraktion wurde jedoch nicht isoliert und separat analysiert, da die Ausbeute im Allgemeinen sehr gering ist. Ausbeutegewinnungsraten und Partikelgrößenanteile einzelner Fraktionen können durch gravimetrische Messungen in Gew.-% für jede Siebfraktion (Mesh #20 - Mesh #325) in Bezug auf die anfängliche Fütterungsfraktion unter Verwendung einer hochpräzisen Mikrowaage bestimmt werden.
5. Vorbereitung einer wässrigen NP-Aufschlämmung für die Nassvermahlung
- Bereiten Sie eine Aufschlämmung aus in DI-Wasser dispergierten MPs vor, indem Sie 800 mL destilliertes Wasser in das 1000-ml-Glasbecherglas geben und einen Rührstab einführen (Durchmesser = 8 mm, Länge = 50,8 mm).
- 8 g der 106 μm Kunststofffraktion aus den Schritten 1, 2, 3 oder 4 werden in DI-Wasser eingebracht, wodurch eine Aufschlämmung von 1 Gew.-% entsteht.
- Stellen Sie das Glasbecherglas auf eine Rührplatte und rühren Sie 24 h bei 400 min-1 magnetisch um, um die Partikel in Wasser einzuweichen und die Partikelenthärtung zu fördern.
- Die Partikel in einen 1000 ml Kunststoffbehälter geben.
- Füllen Sie zwei weitere 1000-ml-Kunststoffbehälter mit DI-Wasser, mit dem während des Mahlvorgangs anhaftende Partikel auf dem Trichter des Mahlwerks abgespült werden.
6. Vorbereitung der Nassschleifmaschine für die NP-Produktion
- Legen Sie Steine mit einer Korngröße von 46 (Körnung eines Schleifsteins = 297-420 μm) in die nasse Friktionsschleifmaschine und befestigen Sie die Mittelmuttern handfest mit einem 17 mm Schraubenschlüssel.
- Fügen Sie den Trichter oben hinzu und befestigen Sie die drei Muttern und Schrauben mit dem 17-mm-Schlüssel.
- Stellen Sie ein 1 L Plastiksammelgefäß unter den Auslass des Colliders. Stellen Sie einen zweiten leeren 1-L-Eimer neben den Auslass, der während der Verarbeitung zum Austausch verwendet wird.
- Stellen Sie das Messspiel auf + 1,0 ein, was einer positiven Verschiebung von 0,10 μm von der Nullstellung entspricht.
- Schalten Sie das Gerät ein und drehen Sie das Einstellrad vorsichtig im Uhrzeigersinn, bis sich die Schleifsteine berühren. Stellen Sie dann den flexiblen Messring auf Null und drehen Sie das Rad sofort gegen den Uhrzeigersinn. Standardmäßig ist die Drehzahl auf 1500 min-1 eingestellt.
HINWEIS: Vermeiden Sie das "Trockenschleifen" der Steine, da dies zu viel Hitze auf den Schleifsteinen erzeugt. - Drehen Sie das Einstellrad im Uhrzeigersinn, bis sich die Steine berühren und füllen Sie vorsichtig die Wasser-NP-Aufschlämmung in den Trichter. Verringern Sie den Spalt kontinuierlich auf ein Lichtraumprofil von -2,0, was einer negativen Verschiebung von 0,20 μm von der Nullposition nach dem Einbringen der Gülle entspricht. Kunststoffpartikel-Wasser-Schlämme zwischen den beiden Steinscheiben fördern die Umwandlung von MPs in NPs und vermeiden direkte Reibung zwischen den Schleifsteinen.
- Sammeln Sie die Gülle, indem Sie die Auffangeimer austauschen, sobald der Füllstand im Eimer 0,5 l überschreitet.
- Sammeln Sie die Partikel und führen Sie sie zwischen 30-60 Mal wieder in die Mühle ein; Höhere Durchgänge (Anzahl der Wiedereinführungen) führen zu kleineren Partikelgrößen.
- An den Trichter adsorbierte Partikel mit der vorbereiteten DI-Wasserflasche waschen, um eine geeignete Güllemischung während der Verarbeitung zu ermöglichen.
HINWEIS: Die Entnahme von Zwischenproben während des Prozesses ist möglich, indem 20-ml-Glasfläschchen in den Auslassstrom gehalten werden. In den einzelnen Schritten werden die Partikelfragmentierungsmechanismen bewertet, während der Schweregrad des Prozesses (Anzahl der Durchgänge) zunimmt. Die Aufschlämmung zurückgewinnen und 4 h bei 400 min-1 bei 25 °C für eine gute Mischung rühren; Lassen Sie die Gülle 48 h stehen, um sich zu stabilisieren.
7. Rückgewinnung und Trocknung von NP aus der Gülle
- Isolieren Sie die untere Fraktion (oder Phase mit der höchsten NP-Konzentration), wenn mehrere Schichten in der Aufschlämmung beobachtet werden, indem Sie die Aufschlämmung langsam in ein zusätzliches 1000-ml-Glasbecherglas gießen.
- Die Fraktionen in Zentrifugationsfläschchen (50 ml) geben und 10 min zentrifugieren (relative Zentrifugalkraft [RCF] = 20 x 102 g). Die RCF (auch g-Kraft genannt) ist die erzeugte Radialkraft in Abhängigkeit vom Rotorradius und der Rotordrehzahl, die eine Trennung der schwereren Partikel und des Wassers der Gülle bewirkt.
- Entfernen Sie die transparente Deckschicht, indem Sie sie in eine separate Aluminiumpfanne dekantieren.
- Die restliche untere Schicht (mit NP-Aufschlämmung) in eine zusätzliche Aluminiumschale geben und für 48 h in einen Vakuumofen bei 30 °C legen.
- Erholen Sie getrocknetes Material mit einem Spatel unter einem Abzug oder Handschuhfach, während Sie eine Atemschutzmaske tragen. Den getrockneten Inhalt in einen 100 ml Glasbehälter geben und mit einem Deckel verschließen.
- NPs in einer Durchstechflasche enthalten und an einem luftdichten, trockenen und kühlen Ort (z. B. einem Exsikkator) aufbewahren.
HINWEIS: MNPs, die während des Herstellungsprozesses (hier entweder während des Nassmahlprozesses oder als getrocknete Partikel) in die Umwelt freigesetzt werden, können eine ernsthafte Bedrohung für aquatische und terrestrische Ökosysteme darstellen. Insbesondere sollen regulatorische Maßnahmen das Risiko für ihre Herstellung und Verwendung für technisch hergestellte Nanomaterialien minimieren30. Daher erfordert die Bildung von MNPs spezifische Vorsichtsmaßnahmen wie die Materialhandhabung in einem Abzug oder Handschuhfach. Darüber hinaus werden wässrige Abfalllösungen, die bei der Isolierung von NPs entstehen (Schritte 6.7-6.9), einem End-of-Life-Entsorgungsverfahren unterzogen, das von der Abteilung für Umweltgesundheit und -sicherheit durchgeführt wird.
8. MP-Bildgebung mittels Stereomikroskopie
- Dispergieren Sie ~ 20 mg Partikel (gesammelt in Schritt 4) auf einer Oberfläche von ~ 4 cm2. Verteilen Sie weiße oder durchscheinende Abgeordnete auf einer dunklen Oberfläche und verteilen Sie schwarze oder dunkle Abgeordnete auf einem weißen Hintergrund (Papierblatt), um den Hintergrundkontrast zu maximieren.
- Stellen Sie das Mikroskop auf die niedrigste Vergrößerung ein, um den größtmöglichen Bereich (Mitte des Partikelbereichs) zu erfassen. Als nächstes richten Sie die externe Lampe auf das Fokuszentrum, um die Beleuchtung der interessierenden Bereiche zu erreichen.
- Wenden Sie eine Vergrößerung an, die die Detektion von >50 Partikeln in der Mitte des Sichtfeldes ermöglicht. Dieser Betrag wird empfohlen, um belastbare statistische Auswertungsergebnisse zu erhalten.
- Konzentrieren Sie sich auf Bereiche ohne oder mit geringer Partikelüberlappung und gutem Farbkontrast.
- Nehmen Sie mindestens fünf repräsentative Bilder auf, indem Sie sich auf die äußeren Partikelformen konzentrieren. Der lokale Computer, der für das Imaging verwendet wird, speichert hochauflösende Bilder als Bitmap in der Software.
- Speichern Sie die vom Stereomikroskop aufgenommenen Bilder in einem von ImageJ erkannten Dateiformat (Bitmap, tiff oder jpeg) für die folgende quantitative Datenanalyse.
HINWEIS: Nehmen Sie ein Referenzbild mit den genauen Vergrößerungseinstellungen auf, für die das Hauptbild mit einem Lineal oder einem anderen im Bild aufgezeichneten Referenzobjekt aufgenommen wurde. Dieses Verfahren ermöglicht eine einfache Kalibrierung der Bilder bei der Vorbereitung und Analyse durch die ImageJ-Software.
9. Bildanalyse durch ImageJ
- Öffnen Sie die ImageJ-Software31 und bereiten Sie den Dateiimport vor, indem Sie (STRG + L) eingeben, um den Befehlsfinder zu öffnen. Als nächstes geben Sie Bio-Formate in der rechten unteren Ecke ein. Diese Funktion aktiviert den Menüpfad Datei > Import > Bioformate (> bezieht sich auf Navigationsschritte innerhalb der Software). Suchen Sie nach dem Verzeichnis der gespeicherten Bilddateien.
HINWEIS: Wenn das Paket Bio-Formate nicht im Befehlsfinder angezeigt wird, suchen Sie online unter Bio-Formats ImageJ. Folgen Sie den Anweisungen zum Herunterladen und Installieren von ImageJ. Der Bio-Formate-Importer ermöglicht die einfache Handhabung des Importierens/Exportierens von Bilddateien in ImageJ und die Suche nach Befehlen. - Öffnen Sie das Bild (alternativ Import von Bioformaten wie in Schritt 9.1 beschrieben), indem Sie auf Datei > Öffnen klicken > Partikelbild an dem in Schritt 4.7 gesammelten Dateispeicherort und das in Schritt 1.6 beschriebene Linealreferenzbild auswählen. Es wird empfohlen, ein dupliziertes Bild zu erstellen, indem Sie Umschalt + Befehl + D drücken, um es mit dem Originalbild zu vergleichen, während Sie die Schwellenwerteinstellungen des Kopierbilds anpassen.
Hinweis: Der Befehl Datei > Öffnen öffnet verschiedene Formate, die von ImageJ nativ unterstützt werden, wie in Schritt 8.7 beschrieben. Alternativ können Sie den Bildspeicherort auf dem Computer auswählen und die Datei per Drag & Drop in die Statusleiste des ImageJ-Hauptfensters ziehen. Die Bilddatei wird automatisch in einem separaten Fenster geöffnet. - Vergrößern und verkleinern Sie das Bild mit STRG+ bzw. STRG -.
- Legen Sie die Maße fest, indem Sie auf Analysieren > Maße festlegen klicken und dann Flächen- und Formdeskriptoren als Standardwerte auswählen.
- Definieren Sie die Maßstabsleiste, indem Sie eine Linie gerade über die Länge der Maßstabsleiste zeichnen, indem Sie das Lineal-Referenzbild verwenden, wie in Schritt 8 beschrieben. Drücken Sie Analysieren > Skala festlegen und geben Sie unter Bekannter Abstand den numerischen Wert der Balkenlänge und die Einheit der entsprechenden Länge ein.
- Visualisieren Sie die Maßstabsleiste auf dem Bild, indem Sie auf > Tools analysieren > Maßstabsleiste klicken, und passen Sie Einstellungen an, z. B. die Anzeige eines gestochen scharfen Kontrasts im Bild. Wählen Sie eine Position im Bild aus, an der die Maßstabsleiste für die Einstellungen der Maßstabsleiste platziert werden soll. Wählen Sie Breite , um den Balken in kalibrierten Einheiten anzupassen, Höhe des Balkens in Pixel und Schriftgrad der Maßstabsleistenbeschriftung. Wählen Sie Hintergrund aus, um die Füllfarbe des Beschriftungstextfelds anzupassen.
HINWEIS: Für Mikrometer ist die Eingabe von μm ausreichend; Das Programm passt μm automatisch in der Datenausgabe an. - Wandeln Sie das Bild in ein 8-Bit-Bild um, indem Sie Bild > Typ > 8-Bit auswählen.
- Konvertieren Sie das kopierte Bild in 8-Bit, indem Sie Bild auswählen > Geben Sie > 8-Bit ein.
- Anpassen durch Auswahl von Bild > Anpassen > Schwellenwert > Festlegen (Größe mit dem Originalbild vergleichen).
- Bestimmen Sie, welche Messungen durchgeführt werden sollen, indem Sie Analysieren > Messungen festlegen auswählen.
- Wählen Sie Partikel analysieren > 0-unendlich aus, klicken Sie auf Ergebnisse anzeigen, und zeigen Sie sie vor Ort an.
- Speichern Sie die ROI-Ergebnisse (.zip) unter Messungen speichern und Ordner auswählen.
- Speichern Sie die Ergebnisse (*.csv) unter Datei > Speichern unter > Ordner auswählen.
10. Partikeldurchmesser (dp) und Formfaktorberechnung in Tabellenkalkulationssoftware
HINWEIS: Die Kenntnis des Partikeldurchmessers und der Formfaktoren ist für das Partikelverhalten (Verbleib, Transport) in der Umwelt und die Bestimmung der Oberfläche unerlässlich. Daher ist die Geometrie unerlässlich, wenn MPs für Umweltstudien verwendet werden. Zum Beispiel wurden unterschiedliche Wechselwirkungsmechanismen mit dem Boden in Abhängigkeit von den Größen und Formen der MPs beobachtet, wie MP-MP und MP-Bodenagglomerationen, die die Partikelbewegung im Boden beeinflussen15,32. Daher werden die folgenden Schritte vorgeschlagen, um die d p-Partikelgrößenverteilung und den geometrischen Parameter zu bestimmen.
- Importieren Sie die entsprechende *.csv-Datei, die Sie aus der ImageJ-Analyse (Schritt 9.13) erhalten und gespeichert haben, in die Tabellenkalkulationssoftware.
HINWEIS: Die numerischen Werte in jeder Spaltenzeile spiegeln individuelle Berechnungen für jedes Teilchen gemäß Gleichung 1 und Gleichung 2 wider. - Werten Sie die durchschnittlichen Formparameterwerte wie Zirkularität (CIR) und Seitenverhältnis (AR) aus, indem Sie = Durchschnitt (x,y) am unteren Rand jeder Spalte eingeben, wobei x die erste Zeile und y letzte Zeile der Spalte darstellt, und drücken Sie dann die EINGABETASTE. Die CIR-Werte beschreiben die Beziehung zwischen der projizierten Fläche und dem perfekten Kreis mit dem CIR = 1 eines einzelnen Teilchens (Gleichung 1). Der AR stellt das in Gleichung 2 beschriebene Verhältnis von Partikellänge zu Breite dar.
- Bestimmen Sie, ob der durchschnittliche AR 2,5 <, und berechnen Sie dann dp-Werte in einer neuen Spalte mithilfe von Gleichung 3. Wenn AR 2,5 ≥, berechnen Sie dp-Werte , die Gleichung 4 widerspiegeln. Fügen Sie eine neue Spalte hinzu, um dp basierend auf der von der ImageJ-Ausgabe empfangenen Flächenspalte zu berechnen.
HINWEIS: Die Auswahl der AR-Schwellenwerte ≥ 2,5 steht für mehr rechteckige Partikel, während AR < 2,5 mehr runde Partikel widerspiegelt. Diese Auswahl ermöglicht es, den dp-Berechnungsfehler zu minimieren, der sich aus der mikroskopisch gemessenen und durch ImageJ ermittelten Fläche ergibt.
(1)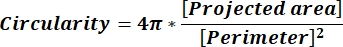
(2)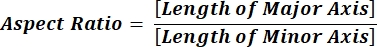
(3)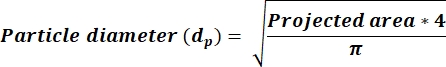
(4)
11. Statistische Auswertung für Abgeordnete und NPs
- Öffnen Sie die *.csv Datendatei mit der Statistiksoftware über Datei > Öffnen > Wählen Sie den Dateispeicherort der entsprechenden Datei aus, wie in Schritt 9.13 erstellt.
HINWEIS: Alternativ kann die Tabelle auch direkt über die Copy-Paste-Funktion in die Statistiksoftware übertragen werden. Im Materialverzeichnis finden Sie die Marke und die Version der Statistiksoftware Edit > Paste with column names. - Werten Sie die dp-Daten aus, indem Sie Analyze > Distribution auswählen.
- Wählen Sie dp aus , das die Daten der Spalte widerspiegelt, ziehen Sie es per Drag & Drop in Y-Spalten und drücken Sie die Taste OK . Diese Funktion erstellt ein Histogramm mit einer statistischen Ausgabe, einschließlich Zusammenfassungsstatistiken, Mittelwert und Std Dev-Werte in einem separaten Fenster.
- Bewerten Sie, ob das Histogramm einer Normalverteilung (oder der besten Anpassung für d p) mit der besten Anpassungskurve folgt, indem Sie das Dreieck neben d p > Kontinuierliche Anpassung auswählen und dann die erhaltene Kurve als beste Anpassung auswählen (z. B. An Normal anpassen). Dieser Schritt überlagert das Histogramm mit einer normalverteilten Anpassung.
- Bestimmen und melden Sie die Mittelwert- und Standardabweichungswerte aus der Zusammenfassungsstatistikausgabe der durchschnittlichen Formparameterwerte für Zirkularität (Cir), Seitenverhältnis (AR), Rundheit (Rund) und Festigkeit (Sol).
HINWEIS: Ein statistisches Signifikanzniveau von α = 0,05 wird empfohlen und wurde für alle Auswertungen verwendet. Das Signifikanzniveau ist die Wahrscheinlichkeit, die Nullhypothese abzulehnen, wenn sie beim Vergleich numerischer Ergebnisse wahr ist.
12. Beste Anpassung der dp Größenverteilung und Partikelformfaktoren
- Laden Sie den Datensatz in eine Statistiksoftware und verwenden Sie den gleichen *.csv Datensatz für die Verteilung von dp , wie in Schritt 10 berechnet.
- Wählen Sie Analyze > Reliability and Survival > Life Distribution aus.
- Ziehen Sie die Spalte dp in das Feld Y, Time to Event, und wählen Sie OK aus. Dieses Feature erzeugt eine Ausgabe mit einem Wahrscheinlichkeitsdiagramm als Funktion von dp.
- Bestimmen Sie die optimale Verteilung unter Verteilungen vergleichen , indem Sie Nichtparametrisch, Lognormal, Weibull, Loglogistic und Normal aktivieren.
- Bewerten Sie die Qualität der Modellanpassungen anhand der niedrigsten numerischen Werte für die Akaike- und Bayes'schen Informationskriterien (AIC bzw. BIC) in der Vergleichstabelle des Statistikmodells unterhalb der Grafik anhand der niedrigsten BIC-Zahlen . Das Modell mit der besten Passform wird standardmäßig in der ersten Zeile angezeigt. Parametrische oder nicht parametrische Schätzungsausgabefelder für jede Verteilungsauswertung befinden sich unterhalb des Diagramms Verteilungen vergleichen .
- Speichern Sie das Ausgabeskript in der Datentabelle, indem Sie das rote Pulldown-Dreieck in der oberen linken Ecke unter Skript speichern > In Datentabelle auswählen. Speichern Sie anschließend die ursprüngliche Datentabelle am gewünschten Dateispeicherort, indem Sie Datei > Speichern unter > *.jmp auswählen.
13. Dimensionale Charakterisierung von NPs durch dynamische Lichtstreuung
- Starten Sie die Software zur dynamischen Lichtstreuung (DLS), indem Sie auf das Desktop-Symbol doppelklicken. Wählen Sie Datei > Neu > SOP aus. Fügen Sie den Probennamen hinzu und wählen Sie den Materialbrechungsindex auf 1,33 für destilliertes Wasser und 1,59 für Polymere33 in der DLS-Software unter Probeneinrichtung aus. Wählen Sie im Pulldown-Menü Material aus, und klicken Sie dann auf OK.
HINWEIS: Durch Klicken auf das Pulldown-Menü wird der Materialmanager geöffnet, in dem Sie neue Proben hinzufügen oder vorhandene Proben durch Ändern des Brechungsindex und der Absorption ändern können. Wählen Sie als Dispergiermittel Wasser. - Wählen Sie die richtige Zelle unter Zelle > Zelltyp aus, und wählen Sie Berichte aus, um festzulegen, welche Ausgabe nach jeder Messung angezeigt wird.
- Starten Sie das Gerät, indem Sie den Instrumentendeckel schließen und das System einschalten, indem Sie den Deckel schließen (falls geöffnet) und die ON-Taste drücken. Warten Sie nach dem ersten Signalton und warten Sie etwa 30 Minuten, um die Stabilisierung des Strahls zu ermöglichen.
- Warten Sie, bis die Initialisierungsroutine abgeschlossen ist, und warten Sie auf einen zweiten Signalton, der anzeigt, dass die voreingestellte Temperatur (in der Regel 25 °C) erreicht wurde.
- Bereiten Sie eine Probenaufschlämmung aus NPs (wie in Schritt 7 erhalten) und DI-Wasser in einer 15-ml-Durchstechflasche bei einer Konzentration von ~ 0,1 Gew.-% durch magnetisches Rühren für ~ 1 h vor, damit sich gut mischen kann.
- Schütteln Sie die Aufschlämmung, bevor Sie ~ 1,0 ml in die 4,5 ml Quarzküvette geben und den Deckel öffnen. Führen Sie dann die Probenzelle vorsichtig in den Probenhalter des DLS-Instruments ein.
ANMERKUNG: Bereiten Sie drei Proben derselben Güllecharge in derselben Konzentration vor, wie in Schritt 13.5 beschrieben. - Führen Sie für jede Probe drei Messungen (Auswahl in der DLS-Software) durch. Entfernen Sie zwischen den Messungen die Probenzelle und schütteln Sie die Proben vorsichtig für 5 s, um das Mischen der Probe zu ermöglichen.
- Extrahieren und exportieren Sie Daten über die DLS-Software, übertragen Sie das Dataset in die Tabellenkalkulationssoftware, und erstellen Sie Histogramme für MPs und NPs, wie in den Schritten 11.1-11.5 beschrieben (Abbildung 1). Kopieren Sie von der Registerkarte Datensatzansicht entweder eine Tabelle oder ein Diagramm , indem Sie Bearbeiten-Kopie auswählen, die in eine andere Anwendung wie die Tabellenkalkulationssoftware eingefügt werden kann.
14. Chemische Analyse von MNPs mittels Fourier-Transformations-Infrarot (FTIR)-Spektrometrie-attenuated total reflectance (ATR)
HINWEIS: Chemische Analysen von MNPs mittels Fourier-Transformations-Infrarot- (FTIR) und Kernspinresonanzspektroskopie (NMR) sind gut geeignete Werkzeuge, um den Einfluss des Nassmahlens auf die chemischen Bindungseigenschaften sowie die relativen Mengen der Hauptkomponenten und der monomeren Bestandteile der Polymere zu beurteilen10. Darüber hinaus können die thermischen Eigenschaften und die Stabilität der polymeren Bestandteile von MNPs durch dynamische Differenzkalorimetrie (DSC) bzw. thermogravimetrische Analyse (TGA) beurteilt werden29.
- Reinigen Sie das Detektionssystem (ATR-Kristalloberfläche) mit Ethanol und einem fusselfreien Tuch.
- Starten Sie die Software und drücken Sie die Hintergrundtaste in der Befehlsleiste, um einen Hintergrundscan in der Luft durchzuführen, indem Sie den Instrumentenstrahlpfad löschen. Das Hintergrundspektrum wird kurz nach der Erfassung angezeigt.
- Geben Sie Sample-ID und Sample Description ( Proben-ID ) und Sample Description (Proben-ID ) in der Symbolleiste der Geräteeinstellungen ein.
- Stellen Sie die Spektralwellenzahl zwischen 4000 cm-1 und 600 cm-1 ein und wählen Sie eine Auflösung von 2,0 cm-1 im Absorptionsmodus. Wählen Sie 32 Scans pro Spektrum aus und starten Sie.
- Legen Sie eine Kunststoffprobe (~20 mg oder ~ 1-3 mm3) von MPs (106 μm) und NPs (~300 nm) in eine Stahlscheibe mit einem Innendurchmesser von ~10 mm oder gleichwertig auf die Kristalloberfläche.
HINWEIS: Die Unterlegscheibe verhindert die Dispergierung auf Kristall, wenn der Probenhalter die Probe komprimiert, was zu Materialinhomogenitäten und Datenverzerrungen aufgrund inkonsistenter Messungen führt. - Platzieren Sie die Unterlegscheibe in der Mitte des ATR-Kristalls und geben Sie die Polymerprobe mit einem Spatel in die Mitte der Unterlegscheibenöffnung.
- Schwenken Sie den Probenhebel oben in die Mitte der Probe und drehen Sie den Knopf im Uhrzeigersinn, indem Sie die Kraftmesskraft zwischen 50-90 überwachen. Das Beispiel zeigt die vorläufigen Spektren. Drücken Sie die Scan-Taste ein zweites Mal, um das Spektrum zu erfassen.
- Sammeln Sie zwischen 8-10 Spektren, indem Sie auf die Schaltfläche Scannen klicken, und mischen Sie die Proben nach jeder Messung sorgfältig mit einem Spatel, um die Sammlung repräsentativer Ergebnisse zu ermöglichen.
- Klicken Sie im Daten-Explorer auf den Ordner Beispielansicht, um alle gesammelten Samples im Anzeigebereich anzuzeigen. Entfernen Sie zunächst deutlich abweichende Spektren, die Ausreißer darstellen. Wählen Sie anschließend entweder Absorptions- oder Transmissionsmodus in der Symbolleiste aus.
- Speichern Sie Spektren, indem Sie den Ordner Beispielansicht auswählen, der die Spektren enthält, und im Menü Datei die Option Speichern unter auswählen . Das Dialogfenster aktiviert den Dateinamen, das Zielverzeichnis und die Standardspeicherortänderung für alle Spektren.
HINWEIS: Alternativ können die Spektren als *.sp-Datei gespeichert werden, indem Sie ein Spektrum auswählen und mit der rechten Maustaste klicken, um die Option Binary anzuzeigen. Wählen Sie Binärdatei speichern aus, und durchsuchen Sie den endgültigen Speicherort. - Führen Sie die Baseline-Korrektur und die mittlere Normalisierung durch, indem Sie ein einzelnes Spektrum im Daten-Explorer auswählen, indem Sie im Menü entweder über die Software oder im nächsten Schritt Process > Normalization auswählen.
HINWEIS: Die mittlere Normalisierung kompensiert spektrale Fehler aufgrund der Dicke oder Materialvariation in der Probe. - Reinigen Sie den Kristallbereich nach Abschluss der Datenerfassung mit Ethanol und fusselfreiem Tuch.
- Interpretieren Sie Unterschiede zwischen MPs und NPs gemäß den zugewiesenen FTIR-Vibrationsbändern, die in einer früheren Publikation zugewiesen und bewertetwurden 10.
Ergebnisse
Zur Validierung der experimentellen Verfahrensmethode und Analyse wurden MPs und NPs aus Pellets und Folienmaterialien gebildet und anhand mikroskopischer Bilder nach Größe und Form verglichen. Das in Abbildung 1 beschriebene Verfahren formte effizient MPs und NPs aus biologisch abbaubaren Kunststoffpellets und -folien; Dies wurde durch kryogene Kühlung, Mahlen und Nassmahlen und Charakterisierung erreicht. Der erste Schritt war für umweltverwitterte Folien unnötig, da die Verwitterung ...
Diskussion
Diese Methode beschreibt ein effektives Verfahren, das erstmals in einer früheren Veröffentlichung29 beschrieben wurde, um MNPs aus Pellets und Mulchfolien für Umweltstudien herzustellen. Der Zerkleinerungsprozess umfasste kryogene Kühlung (nur für Folien), Trockenmahlen und Nassmahlstufen, um Modell-MNPs herzustellen. Wir haben diese Methode angewendet, um MNPs aus einer Vielzahl von polymeren Rohstoffen herzustellen, darunter Polyethylen niedriger Dichte (LDPE), Polybutyratadipat-Co-Terepht...
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Diese Forschung wurde vom Herbert College of Agriculture, dem Biosystems Engineering and Soil Department und der Science Alliance an der University of Tennessee, Knoxville, finanziert. Darüber hinaus danken die Autoren für die finanzielle Unterstützung durch den USDA Grant 2020-67019-31167 für diese Forschung. Die ersten Rohstoffe für die Herstellung von MNPs aus PBAT-basierter biologisch abbaubarer Mulchfolie wurden freundlicherweise von BioBag Americas, Inc. (Dunevin, FL, USA) und PBAT-Pellets von Mobius, LLC (Lenoir City, TN) zur Verfügung gestellt.
Materialien
| Name | Company | Catalog Number | Comments |
| Aluminum dish, 150 mL | Fisher Scientific, Waltham, MA, USA | 08-732-103 | Drying of collected NPs |
| Aluminum dish, 500 mL | VWR International, Radnor, PA, USA | 25433-018 | Collecting NPs after wet-grinding |
| Centrifuge | Fisher Scientific, Waltham, MA, USA | Centrific 228 | Container for centrifugation |
| Delivery tube, #20, 840 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M30 | Sieving of the first fraction during milling |
| Delivery tube, #60, 250 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M45 | Sieving of the second fraction (3x) during milling |
| Thermomixer, 5350 Mixer | Eppendorf North America, Enfield, CT, USA | 05-400-200 | Analysis of sieving experiments |
| FT-IR Spectrum Two, spectrometer with attenuated total reflectance (ATR) | Perkin Elmer, Waltham, MA, USA | L1050228 | Measuring FTIR spectra |
| Glass beaker, 1000 mL | DWK Life Sciences, Milville, NJ, USA | 02-555-113 | Stirring of MPs-water slurry before grinding |
| Glass front plate | Thomas Scientific, Swedesboro, NJ, USA | 3383N55 | Front cover plaste for Wiley Mini Mill |
| Glass jar, 50 mL | Uline, Pleasant Prairie, WI, USA | S-15846P | Collective MPs after milling |
| Glove Box, neoprene | Bel-Art-SP Scienceware, Wayne, NJ, USA | BEL-H500290000 | 22-Inch, Size 10 |
| Zetasizer Nano ZS 90 size analyzer | Malvern Panalytical, Worcestershire, UK | Zetasizer Nano ZS | Measuring nanoplastics dispersed in DI-water |
| Microscope camera | Nikon, Tokyo, 108-6290, Japan | Nikon Digital Sight 10 | Combined with Olympus microscope to receive digital images |
| Microscope | Olympus, Shinjuku, Tokyo, Japan | Model SZ 61 | Imaging of MPs |
| Nitrogen jar, low form dewar flasks | Cole-Palmer, Vernon Hills, IL, USA | UX-03771-23 | Storage of liquid nitrogen during cryogenic cooling |
| Accurate Blend 200, 12-speed blender | Oster, Boca Raton, FL, USA | 6684 | Initiating the size reduction of cryogenically treated plastic film |
| PBAT film, - BioAgri™ (Mater-Bi®) | BioBag Americas, Inc, Dunedin, FL, USA | 0.7 mm thick | Feedstock to form MPs and NPs, agricultural mulch film |
| PBAT pellets | Mobius, LLC, Lenoir City, TN, USA | Diameter 3 mm | Feedstock to form microplastics (MPs) and nanoplastics (NPs) trough milling and grinding |
| Plastic centrifuge tubes, 50 mL | Fisher Scientific, Waltham, MA, USA | 06-443-18 | Centrifugation of slurry after wet-grinding |
| Plastic jar, 1000 mL, pre-cleaned, straight sided | Fisher Scientific, Waltham, MA, USA | 05-719-733 | Collection of NPs during and after wet grinding |
| Polygon stir bars, diameterø=8 mm, length=50.8 mm | Fisher Scientific, Waltham, MA, USA | 14-512-127 | Stirring of MPs slurry prior to wet-grinding |
| Scissors, titanium bonded | Westcott, Shelton, CT, USA | 13901 | Cutting of initial PBAT film feedstocks |
| Square glass cell with square aperture and cap, 12 mm O.D. | Malvern Panalytical, Worcestershire, UK | PCS1115 | Measuring of NPs particle size |
| Stainless steel bottom, 3 inch, pan | Hogentogler & Co. Inc, Columbia, MD, USA | 8401 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 140 (106 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1308 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 20 (850 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1296 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 325 (45 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1313 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 60 (250 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1303 | Sieving of MPs after Wiley-milling |
| Stainless steel top cover, 3 inch | Hogentogler & Co. Inc, Columbia, MD, USA | 8406 | Sieving of MPs after Wiley-milling |
| Stainless steel tweezers | Global Industrial, Port Washington, NY, USA | T9FB2264892 | Transferring of frozen film particles from jar into blender |
| Vacuum oven, model 281A | Fisher Scientific, Waltham, MA, USA | 13-262-50 | Vacuum oven to dry NPs after wet-grinding |
| Friction grinding machine, Supermass Colloider | Masuko Sangyo, Tokyo, Japan | MKCA6-2J | Grinding machine to form NPs from MPs |
| Wet-grinding stone, grit size: 297 μm -420 μm | Masuko Sangyo, Tokyo, Japan | MKE6-46DD | Grinding stone to form NPs from MPs |
| Wiley Mini Mill, rotary cutting mill | Thomas Scientific, Swedesboro, NJ, USA | NC1346618 | Size reduction of pellets and film into MPs and NPs |
| Software | |||
| FTIR-Spectroscopy software | Perkin Elmer, Waltham, MA, USA | Spectrum 10 | Collection of spectra from the initial plastic, MPs and NPs |
| Image J, image processing program | National Institutes of Health, Bethesda, MD, USA | Version 1.53n | Analysis of digital images received from microscopy |
| Microscope software, ds-fi1 software | Malvern Panalytical , Malvern, UK | Firmware DS-U1 Ver3.10 | Recording of digital images |
| Microsoft, Windows, Excel 365, spreadsheet software | Microsoft, Redmond, WA, USA | Office 365 | Calculating the average particle size and creating FTIR spectra images |
| JMP software, statistical software | SAS Institute Inc., Cary, NC, 1989-2021 | Version 15 | Statistical analysis of particle size and perform best fit of data set |
| Unscrambler software | Camo Analytics, Oslo, Norway | Version 9.2 | Normalizing and converting FTIR spectra into .csv fromat |
Referenzen
- Jin, Z., Dan, L. Review on the occurrence, analysis methods, toxicity and health effects of micro-and nano-plastics in the environment. Environmental Chemistry. (1), 28-40 (2021).
- Kumar, M., et al. Current research trends on micro-and nano-plastics as an emerging threat to global environment: a review. Journal of Hazardous Materials. 409, 124967 (2021).
- Alimba, C. G., Faggio, C., Sivanesan, S., Ogunkanmi, A. L., Krishnamurthi, K. Micro (nano)-plastics in the environment and risk of carcinogenesis: Insight into possible mechanisms. Journal of Hazardous Materials. 416, 126143 (2021).
- Serrano-Ruiz, H., Martin-Closas, L., Pelacho, A. M. Biodegradable plastic mulches: Impact on the agricultural biotic environment. Science of The Total Environment. 750, 141228 (2021).
- Hayes, D. G., et al. Biodegradable plastic mulch films for sustainable specialty crop production. Polymers for Agri-Food Applications. , 183-213 (2019).
- Viaroli, S., Lancia, M., Re, V. Microplastics contamination of groundwater: Current evidence and future perspectives. A review. Science of The Total Environment. , 153851 (2022).
- Rillig, M. C., Lehmann, A. Microplastic in terrestrial ecosystems. Science. 368 (6498), 1430-1431 (2020).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. Journal of Polymers and the Environment. 29 (9), 2916-2931 (2021).
- Yang, Y., et al. Kinetics of microplastic generation from different types of mulch films in agricultural soil. Science of The Total Environment. 814, 152572 (2022).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Schwaferts, C., Niessner, R., Elsner, M., Ivleva, N. P. Methods for the analysis of submicrometer-and nanoplastic particles in the environment. TrAC Trends in Analytical Chemistry. 112, 52-65 (2019).
- Gigault, J., et al. Current opinion: what is a nanoplastic. Environmental Pollution. 235, 1030-1034 (2018).
- Naqash, N., Prakash, S., Kapoor, D., Singh, R. Interaction of freshwater microplastics with biota and heavy metals: a review. Environmental Chemistry Letters. 18 (6), 1813-1824 (2020).
- Manzoor, S., Naqash, N., Rashid, G., Singh, R. Plastic material degradation and formation of microplastic in the environment: A review. Materials Today: Proceedings. , 3254-3260 (2022).
- de Souza Machado, A. A., et al. Impacts of microplastics on the soil biophysical environment. Environmental Science & Technology. 52 (17), 9656-9665 (2018).
- Jacques, O., Prosser, R. A probabilistic risk assessment of microplastics in soil ecosystems. Science of The Total Environment. 757, 143987 (2021).
- Kwak, J. I., An, Y. -. J. Microplastic digestion generates fragmented nanoplastics in soils and damages earthworm spermatogenesis and coelomocyte viability. Journal of Hazardous Materials. 402, 124034 (2021).
- Wahl, A., et al. Nanoplastic occurrence in a soil amended with plastic debris. Chemosphere. 262, 127784 (2021).
- Vighi, M., et al. Micro and nano-plastics in the environment: research priorities for the near future. Reviews of Environmental Contamination and Toxicology Volume 257. , 163-218 (2021).
- Pironti, C., et al. Microplastics in the environment: intake through the food web, human exposure and toxicological effects. Toxics. 9 (9), 224 (2021).
- Zurier, H. S., Goddard, J. M. Biodegradation of microplastics in food and agriculture. Current Opinion in Food Science. 37, 37-44 (2021).
- Horton, A. A., Dixon, S. J. Microplastics: An introduction to environmental transport processes. Wiley Interdisciplinary Reviews: Water. 5 (2), 1268 (2018).
- Panno, S. V., et al. Microplastic contamination in karst groundwater systems. Groundwater. 57 (2), 189-196 (2019).
- Su, Y., et al. Delivery, uptake, fate, an transport of engineered nanoparticles in plants: a critical review and data analysis. Environmental Science: Nano. 6 (8), 2311-2331 (2019).
- Yu, Y., Griffin-LaHue, D. E., Miles, C. A., Hayes, D. G., Flury, M. Are micro-and nanoplastics from soil-biodegradable plastic mulches an environmental concern. Journal of Hazardous Materials Advances. 4, 100024 (2021).
- Hayes, D. G. Enhanced end-of-life performance for biodegradable plastic mulch films through improving standards and addressing research gaps. Current Opinion in Chemical Engineering. 33, 100695 (2021).
- Qin, M., et al. A review of biodegradable plastics to biodegradable microplastics: Another ecological threat to soil environments. Journal of Cleaner Production. 312, 127816 (2021).
- Phuong, N. N., et al. Is there any consistency between the microplastics found in the field and those used in laboratory experiments. Environmental Pollution. 211, 111-123 (2016).
- Astner, A., et al. Mechanical formation of micro-and nano-plastic materials for environmental studies in agricultural ecosystems. Science of The Total Environment. 685, 1097-1106 (2019).
- Rist, S., Hartmann, N. B. Aquatic ecotoxicity of microplastics and nanoplastics: lessons learned from engineered nanomaterials. Freshwater Microplastics. , 25-49 (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Raju, S., et al. Improved methodology to determine the fate and transport of microplastics in a secondary wastewater treatment plant. Water Research. 173, 115549 (2020).
- Caputo, F., et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: addressing some analytical challenges in the sub-micron size range. Journal of Colloid and Interface Science. 588, 401-417 (2021).
- Xu, M., et al. Polystyrene microplastics alleviate the effects of sulfamethazine on soil microbial communities at different CO2 concentrations. Journal of Hazardous Materials. 413, 125286 (2021).
- Ding, L., et al. Insight into interactions of polystyrene microplastics with different types and compositions of dissolved organic matter. Science of The Total Environment. 824, 153883 (2022).
- Abbasimaedeh, P., Ghanbari, A., O'Kelly, B. C., Tavanafar, M., Irdmoosa, K. G. Geomechanical behaviour of uncemented expanded polystyrene (EPS) beads-clayey soil mixtures as lightweight fill. Geotechnics. 1 (1), 38-58 (2021).
- Li, Z., Li, Q., Li, R., Zhou, J., Wang, G. The distribution and impact of polystyrene nanoplastics on cucumber plants. Environmental Science and Pollution Research. 28 (13), 16042-16053 (2021).
- Sobhani, Z., Panneerselvan, L., Fang, C., Naidu, R., Megharaj, M. Chronic and transgenerational effects of polystyrene microplastics at environmentally relevant concentrations in earthworms (Eisenia fetida). Environmental Toxicology and Chemistry. 40 (8), 2240-2246 (2021).
- Lionetto, F., Esposito Corcione, C., Rizzo, A., Maffezzoli, A. Production and characterization of polyethylene terephthalate nanoparticles. Polymers. 13 (21), 3745 (2021).
- Dümichen, E., et al. Analysis of polyethylene microplastics in environmental samples, using a thermal decomposition method. Water Research. 85, 451-457 (2015).
- Robotti, M., et al. Attrition and cryogenic milling production for low pressure cold gas spray and composite coatings characterization. Advanced Powder Technology. 27 (4), 1257-1264 (2016).
- Ducoli, S., et al. A different protein corona cloaks "true-to-life" nanoplastics with respect to synthetic polystyrene nanobeads. Environmental Science: Nano. 9 (4), 1414-1426 (2022).
- El Hadri, H., Gigault, J., Maxit, B., Grassl, B., Reynaud, S. Nanoplastic from mechanically degraded primary and secondary microplastics for environmental assessments. NanoImpact. 17, 100206 (2020).
- Eitzen, L., et al. The challenge in preparing particle suspensions for aquatic microplastic research. Environmental research. 168, 490-495 (2019).
- Ekvall, M. T., et al. Nanoplastics formed during the mechanical breakdown of daily-use polystyrene products. Nanoscale advances. 1 (3), 1055-1061 (2019).
- Caldwell, J., et al. Fluorescent plastic nanoparticles to track their interaction and fate in physiological environments. Environmental Science: Nano. 8 (2), 502-513 (2021).
- Zeb, A., et al. Evaluating the knowledge structure of micro-and nanoplastics in terrestrial environment through scientometric assessment. Applied Soil Ecology. 177, 104507 (2022).
- Ji, Z., et al. Effects of pristine microplastics and nanoplastics on soil invertebrates: A systematic review and meta-analysis of available data. Science of The Total Environment. 788, 147784 (2021).
- de Alkimin, G. D., Gonçalves, J. M., Nathan, J., Bebianno, M. J. Impact of micro and nanoplastics in the marine environment. Assessing the Effects of Emerging Plastics on the Environment and Public Health. , 172-225 (2022).
- Pires, A., Cuccaro, A., Sole, M., Freitas, R. Micro (nano) plastics and plastic additives effects in marine annelids: A literature review. Environmental Research. , 113642 (2022).
- Hurley, R. R., Nizzetto, L. Fate and occurrence of micro (nano) plastics in soils: Knowledge gaps and possible risks. Current Opinion in Environmental Science & Health. 1, 6-11 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten