JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
기초 연구 연구에 고용을위한 농업 플라스틱 필름에서 마이크로 및 나노 플라스틱 형성
요약
우리는 기계적 밀링, 연삭 및 이미징 분석의 단계적 공정을 사용하여 마이크로 및 나노 플라스틱 (각각 MPs 및 NP)의 형성 및 치수 특성을 보여줍니다.
초록
농업 생태계에 분산된 미세플라스틱(MPs)과 나노플라스틱(NP)은 토양과 인근 수로에서 바이오타에 심각한 위협이 될 수 있습니다. 또한 NP에 의해 흡착 된 살충제와 같은 화학 물질은 토양 유기체에 해를 끼칠 수 있으며 잠재적으로 먹이 사슬에 들어갈 수 있습니다. 이러한 맥락에서 플라스틱 뿌리 덮개 필름과 같은 농업적으로 활용 된 플라스틱은 농업 생태계의 플라스틱 오염에 크게 기여합니다. 그러나 운명과 생태 독성에 대한 대부분의 근본적인 연구는 폴리스티렌 미소 구체와 같은 이상화되고 잘 대표되지 않는 MP 물질을 사용합니다.
따라서, 본원에 기재된 바와 같이, 우리는 이러한 연구를 위해 대표적인 MPs 및 NP를 기계적으로 형성하기 위한 실험실 규모의 다단계 절차를 개발하였다. 플라스틱 재료는 극저온 처리 (CRYO) 또는 환경 내후성 (W) 및 처리되지 않은 PBAT 펠릿을 통해 취화 된 폴리 부티레이트 아디페이트 - 코-테레프탈레이트 (PBAT)의 상업적으로 이용 가능한 플라스틱 멀치 필름으로부터 제조되었다. 그런 다음 플라스틱 재료를 기계적 밀링으로 처리하여 46-840 μm 크기의 MP를 형성하고 바람 및 기계 기계에 의한 플라스틱 조각의 마모를 모방했습니다. 그런 다음 MP를 여러 크기 분수로 체질하여 추가 분석을 가능하게했습니다. 마지막으로, 106 μm 체 분획을 습식 분쇄하여 20-900 nm의 NPs를 생성하였으며, 이는 육상 MPs에 대한 느린 크기 감소 공정을 모방하는 과정이다. MP의 치수와 모양은 입체 현미경 사진의 이미지 분석을 통해 결정되었으며, NP의 입자 크기를 평가하기 위해 동적 광산란 (DLS)이 사용되었습니다.이 과정을 통해 형성된 MP와 NP는 불규칙한 모양을 가지고 있었으며, 이는 농업 분야에서 회수 된 MP의 기하학적 특성과 일치합니다. 전반적으로,이 크기 감소 방법은 농업 특수 작물 생산에 사용되는 뿌리 덮개 재료를 대표하는 폴리 부틸렌 아디페이트 - 코 테레프탈레이트 (PBAT)와 같은 생분해 성 플라스틱으로 구성된 MPs 및 NP를 형성하는 데 효율적임을 입증했습니다.
서문
최근 수십 년 동안 전 세계적으로 플라스틱 생산이 급속히 증가하고 부적절한 폐기와 플라스틱 폐기물의 재활용 부족으로 인해 해양 및 육상 생태계 1,2,3에 영향을 미치는 환경 오염이 발생했습니다. 플라스틱 재료는 현대 농업, 특히 야채, 작은 과일 및 기타 특수 작물을 재배하는 데 필수적입니다. 뿌리 덮개 필름, 높고 낮은 터널 덮개, 물방울 테이프 및 기타 응용 프로그램으로서의 사용은 작물 수확량과 품질을 향상시키고 생산 비용을 낮추며 지속 가능한 농업 방법 4,5을 촉진하는 것을 목표로합니다. 그러나 "가소성"의 고용 확대는 농업 환경에서 플라스틱 조각의 형성, 유통 및 보존에 대한 우려를 불러 일으켰습니다. 사용 기간 동안 환경 파괴를 통한 취성으로 인한 지속적인 단편화 공정 후, 더 큰 플라스틱 파편은 미세 및 나노 플라스틱 (MNPs)을 형성하며, 이는 토양에서 지속되거나 물 유출 및 바람을 통해 인접한 수로로 이동합니다 6,7,8. 햇빛을 통한 자외선(UV) 방사선, 물의 기계적 힘 및 생물학적 요인과 같은 환경적 요인은 환경적으로 분산된 플라스틱의 플라스틱 취성을 유발하여 더 큰 플라스틱 파편을 거대 또는 메조 플라스틱 입자로 분해합니다9,10. 또한 단편 분해는 미세 플라스틱 (MPs) 및 나노 플라스틱 (NPs)을 형성하며, 평균 크기 (공칭 직경)의 입자를 반영합니다. dp) 각각 1-5000 μm 및 1-1000 nm의11. 그러나, NPs에 대한 상한 dp 한계(즉, MPs에 대한 하한)는 보편적으로 합의되지 않으며, 몇몇 논문들에서, 이것은 100 nm12로 열거된다.
플라스틱 폐기물의 MNP는 토양 건강 및 생태계 서비스에 대한 새로운 세계적 위협을 제기합니다. MPs에 의한 담수로부터 중금속의 흡착은 주변 환경에 비해 중금속의 농도가 800배 더 높았다(13). 또한, 수생 생태계의 MPs는 빛 침투를 변경하고, 산소 고갈을 일으키고, 수생 생물의 침투 및 축적을 포함한 다양한 생물체에 대한 부착을 유발함으로써 여러 스트레스 요인 및 오염 물질을 제기합니다14.
최근 연구에 따르면 MNP는 미생물 군집 및 식물15,16,17을 포함한 토양 지구 화학 및 생물에 영향을 줄 수 있습니다. 또한 NP는 푸드 웹을 위협합니다17,18,19,20. MNP는 토양에서 수직 및 수평 운송을 쉽게 거치기 때문에 토양을 통해 농약, 가소제 및 미생물과 같은 흡수 된 오염 물질을 지하수 또는 하천 및 하천과 같은 수생 생태계로 운반 할 수 있습니다21,22,23,24. 뿌리 덮개 필름과 같은 기존의 농업 플라스틱은 폴리에틸렌으로 만들어지며, 사용 후 현장에서 제거하고 매립지에서 폐기해야합니다. 그러나 불완전한 제거는 토양 9,25,26에 상당한 플라스틱 파편이 축적됩니다. 또는 토양 생분해 성 플라스틱 멀치 (BDM)는 사용 후 토양으로 경작되도록 설계되어 시간이 지남에 따라 분해됩니다. 그러나 BDM은 토양에서 일시적으로 지속되며 점차적으로 MPs 및 NP 9,27로 분해되고 조각화됩니다.
현재의 많은 환경 생태 독성 및 운명 연구는 이상화되고 대표적이지 않은 MPs 및 NP 모델 재료를 사용합니다. 가장 일반적으로 사용되는 대리 MNP는 단분산 폴리스티렌 마이크로 또는 나노 구이며, 이는 환경12,28에 거주하는 실제 MNP를 반영하지 않습니다. 결과적으로, 대표적이지 않은 MP와 NP를 선택하면 부정확한 측정 및 결과가 발생할 수 있습니다. 육상 환경 연구를위한 적절한 모델 ΜNP의 부족을 바탕으로, 저자는 농업 플라스틱에서 이러한 모델을 준비하도록 동기를 부여했다. 우리는 이전에 플라스틱 펠릿 및 필름 재료의 기계적 밀링 및 분쇄를 통해 BDM 및 폴리에틸렌 펠릿에서 MNP의 형성과 MNP29의 치수 및 분자 특성에 대해보고했습니다. 현재 논문은 멀치 필름 또는 펠릿화된 공급 원료와 같은 모든 농업 플라스틱에 보다 광범위하게 적용할 수 있는 MNP를 제조하기 위한 보다 상세한 프로토콜을 제공합니다(그림 1). 여기서, 일례로 작용하기 위해, 농업용 플라스틱을 대표하기 위해 생분해성 고분자인 폴리부틸렌 아디페이트 테레프탈레이트(PBAT)의 뿌리덮개 필름과 구형 펠렛을 선택하였다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 극저온 전처리 및 밀링을 통한 플라스틱 펠릿에서 MPs 처리
참고: 이 방법론은 다른 곳에서 설명된 절차에 기초하며, 본 제시된 연구29에 사용된 동일한 재료로 구성된 PBAT 필름을 채용한다.
- ∼1 g의 중합체 펠릿 샘플을 계량하고 50 mL 유리 병에 옮긴다.
- 20메쉬(840μm) 체가 있는 "직사각형 전달" 튜브를 회전식 절단 밀 앞의 슬롯에 놓고 정지 핀에 닿을 때까지 전달 튜브를 들어 올립니다.
- 유리판을 밀링 챔버의 면 위에 놓고 조정 가능한 클램프로 고정하십시오. 그런 다음 50 mL 유리 용기를 밀 배출구 아래에 놓습니다 (그림 2).
- 슬라이딩 사이드 암 지지대를 전면 유리 중앙의 밀(오른쪽 상단에 위치)에 놓고 널링된 볼트로 조이십시오. 밀링의 전면 유리가 단단히 배치되어 있는지 확인하십시오(그림 2a).
- 밀링 상단의 호퍼 깔때기를 상부 밀링 챔버의 개구부에 삽입합니다.
- 라인 코드를 전원 콘센트와 프레스 코드 스위치에 꽂아 밀링 작업을 시작합니다.
주: 방해를 방지하려면 밀링의 전원을 켜고 회전한 후에 재료만 공급하십시오. 또한 전체 밀링 절차 중에 눈과 귀 보호 장치를 착용하십시오. - 속도가 느려지거나 방해받지 않도록 샘플을 호퍼에 천천히 공급하십시오 (약 10 펠릿 / 분). 가청 소음이 감소 한 후 다음 펠릿 배치 (~ 10 개)를 추가하십시오. 펠릿 (1g)을 처리 한 후 코드 스위치를 눌러 ~ 20 분 동안 밀 작동을 중지하여 식히십시오. 나무 플런저를 사용하여 시료를 공급하고 공급 호퍼 내부에서 입자의 배출 및 응집을 방지하십시오.
주의: 최적의 이송 속도는 가공 재료의 종류에 따라 다릅니다. 절삭 챔버의 입자 마찰로 인해 처리 속도가 감소하거나 유리 판에서 용융 폴리머의 형성이 관찰되면 폴리머 입자의 과열 및 추가 용융을 방지하기 위해 즉시 밀을 끄십시오. - 20메쉬(840μm) 전달 튜브를 분리하고 첫 번째 배치가 완료되면 60메쉬(250μm) 전달 튜브로 교체합니다(그림 2b).
- 수집 된 재료를 밀 호퍼에 다시 도입하십시오. 250 μm 밀링 분획에 대해 단계 1.1 및 1.7을 따른다.
- 수집된 250 μm 분획을 최대 세 번까지 재공급한다.
- 챔버 내에 남아있는 입자를 회수하고 수집된 주 분획에 첨가한다.
2. 극저온 전처리 및 밀링에 의한 플라스틱 필름 가공
- 롤에서 필름 시편을 회수하고 시편을 종이 절단기로 ~ 120mm (교차 방향) x 20mm (기계 방향)의 스트립으로 자릅니다.
- 절편(~1 g)을 1000 mL 유리 비이커에 10분 동안 탈이온화(DI) 물 800 mL에 미리 담그십시오. 이 단계는 중합체를 미리 담그면서 후속 극저온 냉각 절차에 대한 취성을 향상시킨다.
주의: 극저온 장갑과 안전 안경을 착용하여 안전 장비로 액체 질소를 다루십시오. - 200 mL의 액체 질소 (N2)를 극저온 용기에 천천히 첨가하십시오.
- 미리 담근 필름 입자를 강철 핀셋으로 극저온 용기에 조심스럽게 옮깁니다. 액체N2에 3 분 동안 미리 담그십시오.
- 냉동된 필름 단편을 200W, 14단 블렌더로 옮깁니다.
- 냉동된 재료를 10초 동안 속도 레벨 3에서 처리하여 동결된 유리 필름 구조를 깨뜨립니다. 추가 크기 감소를 촉진하려면 DI 물 400mL를 넣고 필름-물 슬러리를 5분 동안 혼합합니다.
- 슬러리를 필터(1μm 메쉬)가 있는 뷔흐너 깔때기로 옮기고 최소 1시간 동안 진공을 가합니다.
- 진공-건조된 고체 입자는 알루미늄 접시에서 적어도 48시간 동안 30°C에서 건조된다.
- 핀셋으로 건조한 입자를 공장에 공급하십시오. 밀링의 경우 1.1-1.11단계를 수행합니다.
3. 환경 풍화 및 밀링을 통해 전처리 된 플라스틱 필름 가공
- 현장에서 회수 된 플라스틱 필름 조각을 매끄러운 표면 (실험실 벤치)에 배치하십시오. 조심스럽게 흡수 된 토양 입자를 제거하고 부드러운 강모 브러시로 잔해를 심습니다.
- 가위로 필름을 ~ 4cm ~ 1.0g의2 샘플로 자릅니다.
- 필름 단편을 DI 물 500mL로 채워진 1000mL 비이커에 넣는다. 1 h 동안 20 mm 교반 막대로 300 min-1의 속도로 저어줍니다.
- 비커를 싱크대 또는 플라스틱 양동이에 약간 교반하여 DI 물을 디캔팅하고 다시 도입하여 용해 된 토양 입자를 제거하십시오. 이 단계를 세 번 반복합니다. 지속적인 교반은 토양 입자를 물에 분산시키고 쉽게 디캔팅 할 수 있습니다.
- 비커에서 샘플을 알루미늄 접시로 옮깁니다. 플라스틱 샘플을 12 h 동안 공기 건조시킨 다음, 30°C에서 24 h 동안 진공 오븐에서 이송 및 건조시켰다. 밀링의 경우 1.1-1.11단계를 수행합니다.
4. 계단식 체를 통한 체질 절차
- 바닥에 팬으로 시작하여 가장 미세한 체 (#325; 45 μm)를 쌓은 다음 점점 더 거친 체 (예 : #140; 106 μm 및 #60; 250 μm, 여기서 #20; 840 μm 체가 가장 거친 체)를 쌓고 뚜껑을 위에 놓습니다.
- 체 셰이커의 개구부에 네 개의 핀을 삽입하여 셰이커에 네 개의 체를 모두 장착하십시오.
- 단계 1, 2 또는 3에서 수집된 개별 분획을 네 개의 계단식 체 위에 옮깁니다. 300 분 1에서 10 분 동안 흔들어주십시오.
- 더 큰 (상단) 분율을 별도로 회수하고, 이는 추가 밀링을 거칠 것이다.
참고: 필요에 따라 셰이커의 흔들림 속도를 조정하십시오. 또는 손으로 체를 흔드는 것이 가능합니다. 메쉬 # 20 체로 시작하여 한 번에 하나의 체 만 사용하십시오 : 바닥과 뚜껑을 손으로 체에 단단히 고정하고 5 분 동안 축 방향 및 수평으로 흔드십시오. - 단계 1.6-1.10에 기술된 바와 같이 dp>106 μm의 체질된 입자를 회전 절단 분쇄기에 재도입한다.
- 팬에서 바닥 분획을 회수하고 입자를 다음으로 작은 체 크기로 다시 도입하십시오. 106 μm 입자가 주 분획을 나타낼 때까지 절차를 반복하십시오.
- 수집 된 106 μm 분획을 병합하고 입자를 건조 영역 (데시케이터 또는 공기 밀봉 비닐 봉지)에 보관하십시오.
주: 45 μm 분획은 106 μm 분획의 일부이고; 그러나, 이전 분획은 수율이 일반적으로 매우 낮기 때문에 단리되고 개별적으로 분석되지 않았다. 개별 분획의 수율 회수 및 입자 크기 분율은 고정밀 마이크로밸런스를 사용하는 초기 공급 분율과 관련하여 각 체질 분획(메쉬 #20 - 메쉬 #325)에 대한 중량%의 중량 측정에 의해 결정될 수 있다.
5. 습식 분쇄를 위한 수성 NP 슬러리의 제조
- 증류수 800 mL를 유리 비이커에 넣고 교반 막대(직경 = 8 mm, 길이 = 50.8 mm)를 삽입하여 DI 물에 분산된 MPs 슬러리를 제조하였다.
- 단계 1, 2, 3, 또는 4로부터의 106 μm 플라스틱 분획 8 g을 DI 물에 도입하여, 1 wt% 슬러리를 제조하였다.
- 유리 비커를 교반 플레이트 위에 놓고 400 min-1 에서 24 시간 동안 자기적으로 교반하여 입자를 물에 담가 입자 연화를 촉진합니다.
- 입자를 1000 mL 플라스틱 용기로 옮긴다.
- 추가로 두 개의 1000 mL 플라스틱 용기를 DI 물로 채우면 분쇄 공정 중에 분쇄기의 호퍼에 부착 된 입자를 헹구는 데 사용됩니다.
6. NP 생산을 위한 습식 분쇄기의 제조
- 습식 마찰 그라인더에 46 그레인 크기 (연삭 석재 그릿 = 297-420 μm)의 돌을 놓고 중앙 너트를 17mm 렌치로 손으로 단단히 고정하십시오.
- 호퍼를 위에 추가하고 세 개의 너트와 볼트를 17mm 렌치로 고정하십시오.
- 1L 플라스틱 수집 항아리를 콜라이더 배출구 아래에 놓습니다. 두 번째 빈 1L 버킷을 콘센트 옆에 놓으면 처리하는 동안 교환하는 데 사용됩니다.
- 게이지 클리어런스를 + 1.0으로 조정하여 제로 위치에서 양수 0.10μm 시프트에 해당합니다.
- 전원을 켜고 연삭 돌이 닿는 소리가 들릴 때까지 조정 휠을 시계 방향으로 조심스럽게 돌립니다. 그런 다음 유연한 측정 링을 0으로 조정하고 휠을 시계 반대 방향으로 즉시 돌립니다. 기본적으로 속도는 1500 min-1로 조정됩니다.
참고 : 연삭 돌에 과도한 열을 발생시키기 때문에 돌의 "건식 연삭"을 피하십시오. - 돌이 닿을 때까지 조정 휠을 시계 방향으로 돌리고 물-NP 슬러리를 호퍼에 부드럽게 채 웁니다. 갭을 -2.0의 클리어런스 게이지로 지속적으로 감소시키고, 슬러리가 도입된 후 제로 위치로부터 음의 0.20 μm 시프트에 상응한다. 두 돌 디스크 사이의 플라스틱 입자 - 물 슬러리는 MP에서 NP로의 변환을 촉진하고 연삭 돌 사이의 직접적인 마찰을 피합니다.
- 버킷의 충전 레벨이 0.5 L를 초과하면 수집 버킷을 교환하여 슬러리를 수집합니다.
- 30-60 번 사이에 입자를 수집하고 분쇄기에 다시 도입하십시오. 가공 패스가 높을수록 (재도입 횟수) 입자 크기가 작아집니다.
- 호퍼에 흡착된 부착 입자를 제조된 DI 물병으로 세척하여 가공 중에 적절한 슬러리 혼합을 허용한다.
참고: 공정 중 중간 샘플의 수집은 20 mL 유리 바이알을 출구 스트림 내로 유지함으로써 가능합니다. 개별 단계는 공정 심각도(통과 수)가 증가하는 동안 입자 단편화 메커니즘을 평가합니다. 슬러리를 회수하고 양호한 혼합을 위해 25°C에서 400 min-1 에서 4 h 동안 교반하고; 안정화를 위해 슬러리를 48 시간 동안 방치하십시오.
7. 슬러리로부터의 NPs의 회수 및 건조
- 슬러리 내의 다중 층이 추가로 1000 mL 유리 비이커에 슬러리를 천천히 붓는 것에 의해 관찰되는 경우 바닥 분획 (또는 가장 높은 NP 농도를 갖는 상)을 분리한다.
- 분획을 원심분리 바이알(50 mL) 내로 옮기고 10분 동안 원심분리한다(상대 원심력 [RCF] = 20 x 102 g). RCF (g-force라고도 함)는 로터 반경과 로터 속도의 함수로 생성 된 방사상 힘으로, 슬러리의 무거운 입자와 물의 분리를 일으 킵니다.
- 투명한 최상층을 별도의 알루미늄 팬에 디캔팅하여 제거하십시오.
- 나머지 바닥층(NP 슬러리 함유)을 추가 알루미늄 디쉬로 옮기고 이를 30°C의 진공 오븐에 48시간 동안 놓는다.
- 호흡기 마스크를 착용 한 상태에서 흄 후드 또는 글로브 박스 아래에 주걱으로 건조 된 물질을 회수하십시오. 건조된 내용물을 100 mL 유리 용기에 옮기고 뚜껑으로 밀봉한다.
- 바이알에 NP를 넣고 밀폐되고 건조하며 서늘한 장소(예: 데시케이터)에 보관하십시오.
참고: 제조 공정 중에(여기서는 습식 분쇄 공정 중 또는 건조된 입자로) 환경으로 방출되는 MNP는 수생 및 육상 생태계에 심각한 위협이 될 수 있습니다. 특히, 규제 조치는 조작된 나노재료(30)에 대한 그들의 생산 및 사용에 대한 위험을 최소화하도록 설계된다. 따라서 MNP를 형성하려면 흄 후드 또는 글로브 박스에서의 재료 취급과 같은 특정 예방 단계가 필요합니다. 또한, NP의 격리 기간 동안 형성된 수성 폐기물 용액(단계 6.7-6.9)은 환경 보건 및 안전부에서 수행하는 수명 종료 폐기 절차를 거치게 됩니다.
8. 스테레오 현미경을 통한 MP 이미징
- ~20 mg의 입자(단계 4에서 수집)를 ~4cm2 면적의 표면에 분산시킨다. 어두운 표면에 흰색 또는 반투명 MP를 펼치고 흰색 배경(종이 시트)에 검은색 또는 어두운 색의 MP를 펼쳐 배경 대비를 극대화합니다.
- 현미경을 가장 낮은 배율로 조정하여 가능한 가장 큰 영역 (입자 영역의 중간)을 캡처하십시오. 그런 다음 외부 램프를 초점 센터로 보내 관심 영역에서 조명을 얻습니다.
- 시야각의 중간에서 >50 입자를 검출 할 수있는 배율을 적용하십시오. 이 양은 강력한 통계 평가 결과를 얻기 위해 권장됩니다.
- 입자가 겹치거나 작은 부분이 없고 색상 대비가 좋은 영역에 초점을 맞춥니다.
- 외부 입자 모양에 초점을 맞추어 적어도 다섯 개의 대표적인 이미지를 캡처합니다. 이미징에 사용되는 로컬 컴퓨터는 고해상도 이미지를 소프트웨어의 비트맵으로 저장합니다.
- 다음과 같은 정량적 데이터 분석을 위해 입체 현미경으로 녹화된 이미지를 ImageJ에서 인식하는 파일 형식(비트맵, 티프 또는 jpeg)으로 저장합니다.
참고: 눈금자 또는 이미지에 기록된 다른 참조 개체를 사용하여 기본 이미지를 촬영한 정확한 배율 설정에서 하나의 참조 이미지를 가져옵니다. 이 절차를 통해 ImageJ 소프트웨어를 통해 준비하고 분석 할 때 이미지를 쉽게 보정 할 수 있습니다.
9. ImageJ를 통한 이미지 분석
- ImageJ 소프트웨어(31)를 열고 명령 파인더를 열기 위해 입력(CTRL+L)하여 파일 가져오기를 준비한다. 다음으로 오른쪽 하단에 Bio-Format을 입력하십시오. 이 기능은 메뉴 경로를 활성화합니다 파일 > 가져 오기 > Bio 형식 (>은 소프트웨어 내의 탐색 단계를 나타냄). 저장된 이미지 파일의 디렉토리를 검색합니다.
참고: Bio-Formats 패키지가 명령 파인더에 나타나지 않으면 Bio-Formats ImageJ에서 온라인으로 검색하십시오. ImageJ의 다운로드 및 설치에 대한 지침을 따르십시오. Bio-Formats 임포터를 사용하면 ImageJ 내에서 그림 파일을 가져오거나 내보내고 명령을 검색하는 작업을 간단하게 처리할 수 있습니다. - 파일 열기를 클릭하여 이미지를 열고(또는 단계 9.1에서 설명된 대로 Bio-Formats 가져오기) 4.7단계에서 수집된 파일 위치에서 파티클 이미지를 선택>> 단계 1.6에서 설명된 눈금자-참조 이미지를 선택합니다. Shift + Command + D 를 클릭하여 복사 이미지의 임계값 설정을 조정하면서 원본 이미지와 비교하면 중복 이미지를 만드는 것이 좋습니다.
참고: 파일 > 열기 명령은 8.7단계에서 설명한 대로 ImageJ에서 기본적으로 지원하는 다양한 형식을 엽니다. 또는 컴퓨터에서 이미지 위치를 선택하고 기본 ImageJ 창 상태 표시줄에 파일을 끌어다 놓습니다. 이미지 파일은 별도의 창에서 자동으로 열립니다. - 각각 Ctrl + 및 CTRL -을 사용하여 이미지를 확대 및 축소합니다.
- 분석 > 측정 설정을 클릭하여 측정값을 설정한 다음 영역 및 모양 설명자를 기본값으로 선택합니다.
- 8단계에서 설명한 대로 눈금자 참조 이미지를 사용하여 눈금자 막대의 길이에 대해 직선으로 선을 그려 배율 막대를 정의합니다. 분석 > 배율 설정을 누르고 알려진 거리 아래에 막대 길이의 숫자 값과 해당 길이의 단위를 입력합니다.
- > 도구 > [비율 표시줄]을 클릭하여 이미지의 배율 표시줄을 시각화하고 이미지에 선명한 대비를 표시하는 등의 설정을 조정합니다. 이미지에서 배율 막대 설정을 위해 배율 막대를 배치해야 하는 위치를 선택합니다. 너비(Width )를 선택하여 보정된 단위의 막대, 막대의 높이 (픽셀 단위) 및 배율 막대 레이블의 글꼴 크기를 조정합니다. 배경을 선택하여 레이블 텍스트 상자의 채우기 색상을 조정합니다.
참고: 마이크로미터의 경우 μm의 입력으로 충분합니다. 이 프로그램은 데이터 출력에서 μm을 자동으로 조정합니다. - 이미지 > 유형(Image)을 선택하여 8비트 이미지로 변환>니다.
- 이미지 > 유형 > 8비트를 선택하여 복사한 이미지를 8비트로 변환합니다.
- 이미지 > 임계값 > 세트 조정> 선택하여 조정합니다(원본 이미지와 크기 비교).
- 분석 > 측정 설정을 선택하여 수행할 측정값을 결정합니다.
- 0-무한대> 파티클 분석을 선택하고 결과 표시를 클릭한 다음 in situ show를 클릭합니다.
- ROI(.zip) 결과를 측정값 저장 및 폴더 선택 아래에 저장합니다.
- 파일 .csv 폴더 선택 아래의 결과(*>)> 저장합니다.
10. 스프레드시트 소프트웨어의 입자 직경(dp) 및 형상 계수 계산
참고 : 입자 직경 및 모양 요인에 대한 지식은 환경에서의 입자 행동 (운명, 운송) 및 표면적 결정에 필수적입니다. 따라서 MP가 환경 연구에 사용될 때 기하학은 필수적입니다. 예를 들어, 토양15,32의 입자 이동에 영향을 미치는 MP-MP 및 MP-토양 응집과 같은 MPs의 크기 및 모양에 따라 토양과의 다른 상호 작용 메커니즘이 관찰되었습니다. 따라서 다음 단계는 dp-입자 크기 분포 및 기하학적 매개 변수를 결정하는 것이 좋습니다.
- ImageJ 분석(9.13단계)에서 획득하여 저장한 해당 *.csv 파일을 스프레드시트 소프트웨어로 가져옵니다.
참고: 각 열 줄의 숫자 값은 수식 1 및 수식 2에 따른 각 파티클에 대한 개별 계산을 반영합니다. - 각 열의 맨 아래에 = 평균(x,y)을 입력하여 원형도(CIR) 및 종횡비(AR)와 같은 평균 모양 매개 변수 값을 평가합니다. 여기서 x는 열의 첫 번째 줄과 y의 마지막 줄을 나타내는 다음 Enter 키를 누릅니다. CIR 값은 개별 파티클의 CIR = 1(방정식 1)을 사용하여 투영된 영역과 완벽한 원 간의 관계를 설명합니다. AR은 수학식 2에 의해 설명된 입자 길이/폭 비율을 나타낸다.
- 평균 AR이 2.5인지 확인< 방정식 3을 사용하여 새 열에서 dp 값을 계산합니다. AR이 2.5≥면 방정식 4를 반영하는 dp 값을 계산합니다. 새 열을 추가하여 ImageJ 출력에서 받은 영역 열을 기반으로 dp를 계산합니다.
참고: AR 임계값 2.5≥ 선택하면 직사각형 모양의 입자를 나타내는 반면, AR < 2.5는 더 많은 둥근 모양의 입자를 반영합니다. 이 선택을 통해 현미경으로 측정되고 ImageJ를 통해 결정된 영역에서 파생된 dp 계산 오류를 최소화할 수 있습니다.
(1)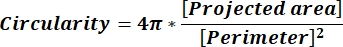
(2)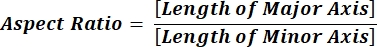
(3)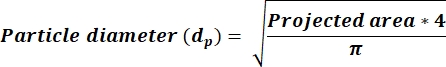
(4)
11. MPs 및 NP에 대한 통계 분석
- 통계 소프트웨어로 *.csv 데이터 파일을 열고 파일 > 열기 > 9.13단계에서 만든 해당 파일의 파일 위치를 선택합니다 .
참고: 또는 테이블을 복사-붙여넣기 기능을 통해 통계 소프트웨어로 직접 전송할 수 있습니다. 통계 소프트웨어 편집 및 열 이름으로 붙여 넣기의 브랜드 및 버전에 대한 자료 표를 참조하>시오. - > 분포 분석을 선택하여 dp 데이터를 평가합니다.
- 열의 데이터를 반영하는 dp를 선택하고 Y 열로 끌어다 놓은 다음 OK 버튼을 누릅니다. 이 기능은 요약 통계, 평균 및 Std Dev 값을 포함한 통계 출력이 포함된 히스토그램을 별도의 창에 만듭니다.
- 히스토그램이 dp > 연속 맞춤 옆의 삼각형을 선택하여 최적 적합 곡선을 갖는 정규 분포(또는 dp에 가장 적합)를 따르는지 평가한 다음 최적 적합으로 받은 곡선을 최적 적합(예: 노멀 맞춤)으로 선택합니다. 이 단계에서는 히스토그램을 정상적으로 분포된 적합치로 겹쳐씁니다.
- 원형도(Cir), 종횡비(AR), 원형도(Round) 및 견고도(Sol)의 평균 형상 파라미터 값의 요약 통계 출력에서 평균 및 표준 편차 값을 결정하고 보고합니다.
참고: α = 0.05의 통계적 유의성 수준이 권장되며 모든 평가에 사용되었습니다. 유의 수준은 수치 결과를 비교할 때 귀무 가설이 참일 때 기각할 확률입니다.
12. dp 크기 분포 및 입자 모양 요인의 최적 적합도
- 데이터 세트를 통계 소프트웨어로 로드하고 단계 10에서 계산 된 dp의 분포를 위해 동일한 *.csv 데이터 세트를 사용하십시오.
- > 신뢰성 및 수명 분포> 생존률 분석을 선택합니다.
- dp 열을 Y, 이벤트 시간 필드로 드래그하고 확인을 선택합니다. 이 피쳐는 확률도를 dp의 함수로 사용하여 출력을 생성합니다.
- 분포 비교에서 비모수, 로그 노멀, Weibull, 물류 및 보통을 확인하여 최적의 분포를 결정합니다.
- 그래프 아래의 통계 모델 비교 표 에서 Akaike 및 Bayesian 정보 기준(AIC 및 BIC에 대해 각각 AIC 및 BIC)에 대한 가장 낮은 수치 값으로 모형의 품질을 가장 낮은 BIC 숫자로 평가합니다. 가장 적합한 모델은 기본적으로 첫 번째 행에 표시됩니다. 각 분포 평가에 대한 파라메트릭 또는 비모수 추정 출력 필드는 분포 비교 그래프 아래에 있습니다.
- 데이터 테이블에 스크립트 저장(Save Script > To Data Table)의 왼쪽 위 모서리에 있는 빨간색 풀다운 삼각형을 선택하여 출력 스크립트를 데이터 테이블에 저장합니다. 그런 다음 파일 > 다른 이름으로 저장 *.jmp를 선택하여 원하는 파일 위치> 원본 데이터 테이블을 저장합니다.
13. 동적 광산란을 통한 NP의 치수 특성화
- 바탕 화면 아이콘을 두 번 클릭하여 동적 광산란(DLS) 소프트웨어를 시작합니다. SOP> 새 파일 > 선택합니다. 샘플 이름을 추가하고 샘플 설정의 DLS 소프트웨어에서 증류수의 경우 1.33, 폴리머33의 경우 1.59로 재료 굴절률을 선택합니다. 풀다운 메뉴에서 재질을 선택하고 확인을 클릭합니다.
참고: 풀다운 메뉴를 클릭하면 재료 관리자가 열리며, 재료 관리자는 굴절률 및 흡수율을 변경하여 새 샘플을 추가하거나 기존 샘플을 수정할 수 있습니다. 분산제 물로 선택하십시오. - 셀 > 셀 유형 에서 적절한 셀을 선택하고 보고서를 선택하여 각 측정 후에 표시할 출력을 결정합니다.
- 기기 뚜껑을 닫고 뚜껑을 닫고(열린 경우) ON 버튼을 눌러 시스템을 켜서 계측기를 시작합니다. 첫 번째 비프음 후 기다렸다가 빔의 안정화를 위해 약 30 분 정도 기다리십시오.
- 초기화 루틴이 완료될 때까지 기다렸다가 사전 설정된 온도(일반적으로 25°C)에 도달했음을 나타내는 두 번째 비프음이 울릴 때까지 기다립니다.
- 잘 혼합될 수 있도록 하기 위해 NPs(단계 7에서 받은 바와 같이) 및 DI 물 15 mL 바이알을 ∼0.1 wt% 농도로 자기적으로 교반함으로써 ∼1 h 동안 자석적으로 교반함으로써 NPs의 샘플 슬러리를 제조하였다.
- ~1.0 mL를 4.5 mL 석영 큐벳에 옮기기 전에 슬러리를 흔들고 뚜껑을 여십시오. 그런 다음 샘플 셀을 DLS 장비의 샘플 홀더에 조심스럽게 삽입하십시오.
참고: 단계 13.5에 설명된 것과 동일한 농도로 동일한 슬러리 배치로부터 세 개의 샘플을 준비한다. - 각 샘플에 대해 세 가지 측정(DLS 소프트웨어에서 선택)을 수행합니다. 측정 사이에, 샘플 셀을 제거하고 샘플의 혼합을 허용하기 위해 5 초 동안 샘플을 부드럽게 흔든다.
- DLS 소프트웨어를 통해 데이터를 추출 및 내보내고, 데이터 세트를 스프레드시트 소프트웨어로 전송하고, 11.1-11.5단계에 설명된 대로 MPs 및 NP에 대한 히스토그램을 만듭니다(그림 1). 레코드 보기 탭 에서 테이블 또는 그래프 를 복사하여 편집-복사를 선택하여 스프레드시트 소프트웨어와 같은 다른 응용 프로그램에 붙여 넣을 수 있습니다.
14. 푸리에 변환 적외선(FTIR) 분광법을 이용한 MNP의 화학적 분석 감쇠 총 반사율(ATR)
참고: 푸리에 변환 적외선(FTIR) 및 핵 자기 공명(NMR) 분광법에 의한 MNP의 화학적 분석은 습식 분쇄가 화학 결합 특성에 미치는 영향뿐만 아니라 주요 구성 요소 및 폴리머의 단량체 구성 요소의 상대적 양을 각각 평가하는 데 적합한 도구입니다(10). 또한, MNP의 고분자 구성성분의 열적 특성 및 안정성은 시차 주사 열량계(DSC) 및 열중량 분석(TGA)을 통해 각각 평가될 수 있다(29).
- 검출 시스템(ATR 크리스탈 표면)을 에탄올과 보풀이 없는 천으로 청소하십시오.
- 소프트웨어를 시작하고 명령 모음에서 배경 버튼을 눌러 계측기 빔 경로를 지워 공중에서 배경 스캔 을 수행합니다. 배경 스펙트럼은 수집 직후에 표시됩니다.
- 계측기 설정 도구 모음에 샘플 ID 및 샘플 설명을 입력합니다.
- 스펙트럼 파수를 4000cm-1에서 600cm-1 사이로 조정하고 흡광도 모드에서 2.0cm-1의 해상도를 선택합니다. 스펙트럼 당 32 스캔을 선택하고 시작하십시오.
- MPs(106 μm) 및 NP(~300 nm)의 플라스틱 샘플(~20 mg 또는 ~1-3 mm3)을 내경이 ~10 mm 또는 이에 상응하는 강철 와셔 내부에 결정질 표면에 놓습니다.
참고: 와셔는 샘플 홀더가 샘플을 압축할 때 크리스탈에 분산되는 것을 방지하여 일관되지 않은 측정으로 인한 재료 불균질성 및 데이터 편향을 초래합니다. - 세탁기를 ATR 결정의 중앙에 놓고 주걱으로 세탁기 개구부의 중간에 중합체 샘플을 추가하십시오.
- 위의 샘플 레버를 샘플 중앙으로 스윙하고 50-90 사이의 힘 게이지 힘을 모니터링하여 손잡이를 시계 방향으로 돌립니다. 샘플은 예비 스펙트럼을 보여줍니다. 스캔 버튼을 두 번 눌러 스펙트럼을 수집합니다.
- 스캔 버튼을 클릭하여 8-10 스펙트럼 을 수집하고 각 측정 후 샘플을 주걱과 조심스럽게 혼합하여 대표적인 결과를 수집 할 수 있도록하십시오.
- 데이터 탐색기에서 샘플 보기 폴더를 클릭하여 보기 영역에 겹쳐진 수집된 모든 샘플을 표시합니다. 먼저, 이상값을 나타내는 상당히 이탈하는 스펙트럼을 제거합니다. 그런 다음 도구 모음에서 흡광도 또는 투과율 모드를 선택합니다.
- 스펙트럼이 포함된 샘플 뷰 폴더를 선택하고 파일 메뉴에서 다른 이름으로 저장 을 선택하여 스펙트럼을 저장합니다. 대화상자 창 에서는 파일 이름, 대상 디렉토리 및 모든 스펙트럼의 기본 위치 변경을 사용할 수 있습니다.
참고: 또는 스펙트럼을 선택하고 마우스 오른쪽 버튼을 클릭하여 이진 옵션을 표시하여 스펙트럼을 *.sp 파일로 저장할 수 있습니다. 이진 저장을 선택하고 최종 저장 위치를 찾습니다. - 소프트웨어를 통해 또는 다음 단계에서 메뉴에서 정규화 프로세스를 선택하여 데이터 탐색기에서 단일 스펙트럼을 선택하여 기준선 보정 > 평균 정규화를 수행합니다.
참고: 평균 정규화는 샘플의 두께 또는 재료 변화로 인한 스펙트럼 오류를 보상합니다. - 데이터 수집이 완료되면 에탄올과 보풀이없는 천으로 크리스탈 영역을 청소하십시오.
- 이전 간행물10에서 할당되고 평가된 할당된 FTIR 진동 대역에 따라 MP와 NP 간의 차이를 해석한다.
Access restricted. Please log in or start a trial to view this content.
결과
실험 절차 방법 및 분석을 검증하기 위해 MPs 및 NP를 펠렛 및 필름 재료로 형성하고 현미경 이미지를 사용하여 크기와 모양별로 비교했습니다. 도 1에 기재된 방법은 생분해성 플라스틱 펠릿 및 필름으로부터 MPs 및 NPs를 효율적으로 형성하고; 이것은 극저온 냉각, 밀링, 습식 연삭 및 특성화를 통해 달성되었습니다. 이전 단계는 풍화로 인해 취성이 유발되기 때문에 환경 풍화...
Access restricted. Please log in or start a trial to view this content.
토론
이 방법은 환경 연구를 위해 펠릿 및 멀치 필름으로부터 공급되는 MNP를 제조하기 위해, 이전 간행물29에서 초기에 기술된 효과적인 공정을 기술한다. 크기 감소 공정에는 극저온 냉각(필름에만 해당), 건식 밀링 및 습식 분쇄 단계가 포함되어있어 모델 MNP를 제조했습니다. 우리는 저밀도 폴리에틸렌 (LDPE), 폴리 부티레이트 아디페이트 - 코-테레프탈레이트 (PBAT) 및 폴리 락트산 (PLA...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 허버트 농업 대학, 생물 시스템 공학 및 토양 부서, 녹스빌 테네시 대학의 과학 얼라이언스가 자금을 지원했습니다. 또한, 저자는이 연구를 위해 USDA Grant 2020-67019-31167을 통해 제공되는 재정적 지원을 감사하게 인정합니다. PBAT 기반 생분해성 멀치 필름의 MNPs를 제조하기 위한 초기 공급원료는 BioBag Americas, Inc. (Dunevin, FL, USA) 및 Mobius, LLC (Lenoir City, TN)에 의해 PBAT 펠릿에 의해 친절하게 제공되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Aluminum dish, 150 mL | Fisher Scientific, Waltham, MA, USA | 08-732-103 | Drying of collected NPs |
| Aluminum dish, 500 mL | VWR International, Radnor, PA, USA | 25433-018 | Collecting NPs after wet-grinding |
| Centrifuge | Fisher Scientific, Waltham, MA, USA | Centrific 228 | Container for centrifugation |
| Delivery tube, #20, 840 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M30 | Sieving of the first fraction during milling |
| Delivery tube, #60, 250 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M45 | Sieving of the second fraction (3x) during milling |
| Thermomixer, 5350 Mixer | Eppendorf North America, Enfield, CT, USA | 05-400-200 | Analysis of sieving experiments |
| FT-IR Spectrum Two, spectrometer with attenuated total reflectance (ATR) | Perkin Elmer, Waltham, MA, USA | L1050228 | Measuring FTIR spectra |
| Glass beaker, 1000 mL | DWK Life Sciences, Milville, NJ, USA | 02-555-113 | Stirring of MPs-water slurry before grinding |
| Glass front plate | Thomas Scientific, Swedesboro, NJ, USA | 3383N55 | Front cover plaste for Wiley Mini Mill |
| Glass jar, 50 mL | Uline, Pleasant Prairie, WI, USA | S-15846P | Collective MPs after milling |
| Glove Box, neoprene | Bel-Art-SP Scienceware, Wayne, NJ, USA | BEL-H500290000 | 22-Inch, Size 10 |
| Zetasizer Nano ZS 90 size analyzer | Malvern Panalytical, Worcestershire, UK | Zetasizer Nano ZS | Measuring nanoplastics dispersed in DI-water |
| Microscope camera | Nikon, Tokyo, 108-6290, Japan | Nikon Digital Sight 10 | Combined with Olympus microscope to receive digital images |
| Microscope | Olympus, Shinjuku, Tokyo, Japan | Model SZ 61 | Imaging of MPs |
| Nitrogen jar, low form dewar flasks | Cole-Palmer, Vernon Hills, IL, USA | UX-03771-23 | Storage of liquid nitrogen during cryogenic cooling |
| Accurate Blend 200, 12-speed blender | Oster, Boca Raton, FL, USA | 6684 | Initiating the size reduction of cryogenically treated plastic film |
| PBAT film, - BioAgri™ (Mater-Bi®) | BioBag Americas, Inc, Dunedin, FL, USA | 0.7 mm thick | Feedstock to form MPs and NPs, agricultural mulch film |
| PBAT pellets | Mobius, LLC, Lenoir City, TN, USA | Diameter 3 mm | Feedstock to form microplastics (MPs) and nanoplastics (NPs) trough milling and grinding |
| Plastic centrifuge tubes, 50 mL | Fisher Scientific, Waltham, MA, USA | 06-443-18 | Centrifugation of slurry after wet-grinding |
| Plastic jar, 1000 mL, pre-cleaned, straight sided | Fisher Scientific, Waltham, MA, USA | 05-719-733 | Collection of NPs during and after wet grinding |
| Polygon stir bars, diameterø=8 mm, length=50.8 mm | Fisher Scientific, Waltham, MA, USA | 14-512-127 | Stirring of MPs slurry prior to wet-grinding |
| Scissors, titanium bonded | Westcott, Shelton, CT, USA | 13901 | Cutting of initial PBAT film feedstocks |
| Square glass cell with square aperture and cap, 12 mm O.D. | Malvern Panalytical, Worcestershire, UK | PCS1115 | Measuring of NPs particle size |
| Stainless steel bottom, 3 inch, pan | Hogentogler & Co. Inc, Columbia, MD, USA | 8401 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 140 (106 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1308 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 20 (850 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1296 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 325 (45 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1313 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 60 (250 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1303 | Sieving of MPs after Wiley-milling |
| Stainless steel top cover, 3 inch | Hogentogler & Co. Inc, Columbia, MD, USA | 8406 | Sieving of MPs after Wiley-milling |
| Stainless steel tweezers | Global Industrial, Port Washington, NY, USA | T9FB2264892 | Transferring of frozen film particles from jar into blender |
| Vacuum oven, model 281A | Fisher Scientific, Waltham, MA, USA | 13-262-50 | Vacuum oven to dry NPs after wet-grinding |
| Friction grinding machine, Supermass Colloider | Masuko Sangyo, Tokyo, Japan | MKCA6-2J | Grinding machine to form NPs from MPs |
| Wet-grinding stone, grit size: 297 μm -420 μm | Masuko Sangyo, Tokyo, Japan | MKE6-46DD | Grinding stone to form NPs from MPs |
| Wiley Mini Mill, rotary cutting mill | Thomas Scientific, Swedesboro, NJ, USA | NC1346618 | Size reduction of pellets and film into MPs and NPs |
| Software | |||
| FTIR-Spectroscopy software | Perkin Elmer, Waltham, MA, USA | Spectrum 10 | Collection of spectra from the initial plastic, MPs and NPs |
| Image J, image processing program | National Institutes of Health, Bethesda, MD, USA | Version 1.53n | Analysis of digital images received from microscopy |
| Microscope software, ds-fi1 software | Malvern Panalytical , Malvern, UK | Firmware DS-U1 Ver3.10 | Recording of digital images |
| Microsoft, Windows, Excel 365, spreadsheet software | Microsoft, Redmond, WA, USA | Office 365 | Calculating the average particle size and creating FTIR spectra images |
| JMP software, statistical software | SAS Institute Inc., Cary, NC, 1989-2021 | Version 15 | Statistical analysis of particle size and perform best fit of data set |
| Unscrambler software | Camo Analytics, Oslo, Norway | Version 9.2 | Normalizing and converting FTIR spectra into .csv fromat |
참고문헌
- Jin, Z., Dan, L. Review on the occurrence, analysis methods, toxicity and health effects of micro-and nano-plastics in the environment. Environmental Chemistry. (1), 28-40 (2021).
- Kumar, M., et al. Current research trends on micro-and nano-plastics as an emerging threat to global environment: a review. Journal of Hazardous Materials. 409, 124967(2021).
- Alimba, C. G., Faggio, C., Sivanesan, S., Ogunkanmi, A. L., Krishnamurthi, K. Micro (nano)-plastics in the environment and risk of carcinogenesis: Insight into possible mechanisms. Journal of Hazardous Materials. 416, 126143(2021).
- Serrano-Ruiz, H., Martin-Closas, L., Pelacho, A. M. Biodegradable plastic mulches: Impact on the agricultural biotic environment. Science of The Total Environment. 750, 141228(2021).
- Hayes, D. G., et al. Biodegradable plastic mulch films for sustainable specialty crop production. Polymers for Agri-Food Applications. , Springer. Cham. 183-213 (2019).
- Viaroli, S., Lancia, M., Re, V. Microplastics contamination of groundwater: Current evidence and future perspectives. A review. Science of The Total Environment. , 153851(2022).
- Rillig, M. C., Lehmann, A. Microplastic in terrestrial ecosystems. Science. 368 (6498), 1430-1431 (2020).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. Journal of Polymers and the Environment. 29 (9), 2916-2931 (2021).
- Yang, Y., et al. Kinetics of microplastic generation from different types of mulch films in agricultural soil. Science of The Total Environment. 814, 152572(2022).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Schwaferts, C., Niessner, R., Elsner, M., Ivleva, N. P. Methods for the analysis of submicrometer-and nanoplastic particles in the environment. TrAC Trends in Analytical Chemistry. 112, 52-65 (2019).
- Gigault, J., et al. Current opinion: what is a nanoplastic. Environmental Pollution. 235, 1030-1034 (2018).
- Naqash, N., Prakash, S., Kapoor, D., Singh, R. Interaction of freshwater microplastics with biota and heavy metals: a review. Environmental Chemistry Letters. 18 (6), 1813-1824 (2020).
- Manzoor, S., Naqash, N., Rashid, G., Singh, R. Plastic material degradation and formation of microplastic in the environment: A review. Materials Today: Proceedings. , 3254-3260 (2022).
- de Souza Machado, A. A., et al. Impacts of microplastics on the soil biophysical environment. Environmental Science & Technology. 52 (17), 9656-9665 (2018).
- Jacques, O., Prosser, R. A probabilistic risk assessment of microplastics in soil ecosystems. Science of The Total Environment. 757, 143987(2021).
- Kwak, J. I., An, Y. -J. Microplastic digestion generates fragmented nanoplastics in soils and damages earthworm spermatogenesis and coelomocyte viability. Journal of Hazardous Materials. 402, 124034(2021).
- Wahl, A., et al. Nanoplastic occurrence in a soil amended with plastic debris. Chemosphere. 262, 127784(2021).
- Vighi, M., et al. Micro and nano-plastics in the environment: research priorities for the near future. Reviews of Environmental Contamination and Toxicology Volume 257. , 163-218 (2021).
- Pironti, C., et al. Microplastics in the environment: intake through the food web, human exposure and toxicological effects. Toxics. 9 (9), 224(2021).
- Zurier, H. S., Goddard, J. M. Biodegradation of microplastics in food and agriculture. Current Opinion in Food Science. 37, 37-44 (2021).
- Horton, A. A., Dixon, S. J. Microplastics: An introduction to environmental transport processes. Wiley Interdisciplinary Reviews: Water. 5 (2), 1268(2018).
- Panno, S. V., et al. Microplastic contamination in karst groundwater systems. Groundwater. 57 (2), 189-196 (2019).
- Su, Y., et al. Delivery, uptake, fate, an transport of engineered nanoparticles in plants: a critical review and data analysis. Environmental Science: Nano. 6 (8), 2311-2331 (2019).
- Yu, Y., Griffin-LaHue, D. E., Miles, C. A., Hayes, D. G., Flury, M. Are micro-and nanoplastics from soil-biodegradable plastic mulches an environmental concern. Journal of Hazardous Materials Advances. 4, 100024(2021).
- Hayes, D. G. Enhanced end-of-life performance for biodegradable plastic mulch films through improving standards and addressing research gaps. Current Opinion in Chemical Engineering. 33, 100695(2021).
- Qin, M., et al. A review of biodegradable plastics to biodegradable microplastics: Another ecological threat to soil environments. Journal of Cleaner Production. 312, 127816(2021).
- Phuong, N. N., et al. Is there any consistency between the microplastics found in the field and those used in laboratory experiments. Environmental Pollution. 211, 111-123 (2016).
- Astner, A., et al. Mechanical formation of micro-and nano-plastic materials for environmental studies in agricultural ecosystems. Science of The Total Environment. 685, 1097-1106 (2019).
- Rist, S., Hartmann, N. B. Aquatic ecotoxicity of microplastics and nanoplastics: lessons learned from engineered nanomaterials. Freshwater Microplastics. , Springer. Cham. 25-49 (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Raju, S., et al. Improved methodology to determine the fate and transport of microplastics in a secondary wastewater treatment plant. Water Research. 173, 115549(2020).
- Caputo, F., et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: addressing some analytical challenges in the sub-micron size range. Journal of Colloid and Interface Science. 588, 401-417 (2021).
- Xu, M., et al. Polystyrene microplastics alleviate the effects of sulfamethazine on soil microbial communities at different CO2 concentrations. Journal of Hazardous Materials. 413, 125286(2021).
- Ding, L., et al. Insight into interactions of polystyrene microplastics with different types and compositions of dissolved organic matter. Science of The Total Environment. 824, 153883(2022).
- Abbasimaedeh, P., Ghanbari, A., O'Kelly, B. C., Tavanafar, M., Irdmoosa, K. G. Geomechanical behaviour of uncemented expanded polystyrene (EPS) beads-clayey soil mixtures as lightweight fill. Geotechnics. 1 (1), 38-58 (2021).
- Li, Z., Li, Q., Li, R., Zhou, J., Wang, G. The distribution and impact of polystyrene nanoplastics on cucumber plants. Environmental Science and Pollution Research. 28 (13), 16042-16053 (2021).
- Sobhani, Z., Panneerselvan, L., Fang, C., Naidu, R., Megharaj, M. Chronic and transgenerational effects of polystyrene microplastics at environmentally relevant concentrations in earthworms (Eisenia fetida). Environmental Toxicology and Chemistry. 40 (8), 2240-2246 (2021).
- Lionetto, F., Esposito Corcione, C., Rizzo, A., Maffezzoli, A. Production and characterization of polyethylene terephthalate nanoparticles. Polymers. 13 (21), 3745(2021).
- Dümichen, E., et al. Analysis of polyethylene microplastics in environmental samples, using a thermal decomposition method. Water Research. 85, 451-457 (2015).
- Robotti, M., et al. Attrition and cryogenic milling production for low pressure cold gas spray and composite coatings characterization. Advanced Powder Technology. 27 (4), 1257-1264 (2016).
- Ducoli, S., et al. A different protein corona cloaks "true-to-life" nanoplastics with respect to synthetic polystyrene nanobeads. Environmental Science: Nano. 9 (4), 1414-1426 (2022).
- El Hadri, H., Gigault, J., Maxit, B., Grassl, B., Reynaud, S. Nanoplastic from mechanically degraded primary and secondary microplastics for environmental assessments. NanoImpact. 17, 100206(2020).
- Eitzen, L., et al. The challenge in preparing particle suspensions for aquatic microplastic research. Environmental research. 168, 490-495 (2019).
- Ekvall, M. T., et al. Nanoplastics formed during the mechanical breakdown of daily-use polystyrene products. Nanoscale advances. 1 (3), 1055-1061 (2019).
- Caldwell, J., et al. Fluorescent plastic nanoparticles to track their interaction and fate in physiological environments. Environmental Science: Nano. 8 (2), 502-513 (2021).
- Zeb, A., et al. Evaluating the knowledge structure of micro-and nanoplastics in terrestrial environment through scientometric assessment. Applied Soil Ecology. 177, 104507(2022).
- Ji, Z., et al. Effects of pristine microplastics and nanoplastics on soil invertebrates: A systematic review and meta-analysis of available data. Science of The Total Environment. 788, 147784(2021).
- de Alkimin, G. D., Gonçalves, J. M., Nathan, J., Bebianno, M. J. Impact of micro and nanoplastics in the marine environment. Assessing the Effects of Emerging Plastics on the Environment and Public Health. , IGI Global. 172-225 (2022).
- Pires, A., Cuccaro, A., Sole, M., Freitas, R. Micro (nano) plastics and plastic additives effects in marine annelids: A literature review. Environmental Research. , 113642(2022).
- Hurley, R. R., Nizzetto, L. Fate and occurrence of micro (nano) plastics in soils: Knowledge gaps and possible risks. Current Opinion in Environmental Science & Health. 1, 6-11 (2018).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유