このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
農業用プラスチックフィルムからのマイクロ・ナノプラスチックの形成と基礎研究への応用
要約
我々は、メカニカルミリング、研削、およびイメージング分析の段階的なプロセスを使用して、マイクロプラスチックおよびナノプラスチック(それぞれMPおよびNP)の形成および寸法特性評価を示す。
要約
農業生態系に分散しているマイクロプラスチック(MPs)とナノプラスチック(NP)は、土壌や近くの水路の生物相に深刻な脅威をもたらす可能性があります。さらに、NPによって吸着された農薬などの化学物質は、土壌生物に害を及ぼし、食物連鎖に入る可能性があります。この文脈では、プラスチックマルチフィルムなどの農業利用プラスチックは、農業生態系におけるプラスチック汚染に大きく寄与する。しかし、運命と生態毒性に関するほとんどの基礎的研究は、ポリスチレンミクロスフェアなどの理想化された、あまり代表性の低いMP材料を採用している。
したがって、本明細書に記載されるように、我々は、そのような研究のために代表的なMPおよびNPを機械的に形成するためのラボ規模のマルチステップ手順を開発した。プラスチック材料は、極低温処理(CRYO)または環境風化(W)のいずれかによって脆化したポリ酪酸アジピン酸 - コテレフタレート(PBAT)の市販のプラスチックマルチフィルム、および未処理のPBATペレットから調製した。次いで、プラスチック材料をメカニカルミリングによって処理し、風力および機械機械によるプラスチック破片の摩耗を模倣して、46〜840μmのサイズのMPを形成した。その後、MPsをいくつかのサイズ画分にふるい分けて、さらなる分析を可能にしました。最後に、106μmのふるい画分を湿式粉砕に供して、陸上MPsの遅いサイズ縮小プロセスを模倣するプロセスである20〜900nmのNPを生成する。MPの寸法と形状は、実体顕微鏡写真の画像解析により決定し、動的光散乱(DLS)を用いてNPの粒径を評価した。全体として、このサイズ縮小方法は、農業特殊作物の生産に使用されるマルチ材料を表すポリブチレンアジペート - コテレフタレート(PBAT)などの生分解性プラスチックからなるMPおよびNPを形成するのに効率的であることが証明された。
概要
ここ数十年で、プラスチックの世界的な生産の急速な増加とプラスチック廃棄物の不適切な処分とリサイクルの欠如は、海洋および陸上生態系に影響を与えている環境汚染につながっています1,2,3。プラスチック材料は、現代の農業、特に野菜、小さな果物、その他の特殊作物を栽培するために不可欠です。マルチフィルム、トンネル被覆の高低、ドリップテープ、その他の用途としての使用は、作物の収量と品質を向上させ、生産コストを削減し、持続可能な農法を促進することを目的としています4,5。しかし、「プラスチック」の雇用拡大により、農業環境におけるプラスチック片の形成、流通、保持に関する懸念が生じています。耐用年数中の環境劣化による脆化によって引き起こされる連続的な断片化プロセスの後、より大きなプラスチック断片は、土壌中に持続するか、または水の流出および風を介して隣接する水路に移動するマイクロおよびナノプラスチック(MNP)を形成する6,7,8。太陽光による紫外線(UV)放射、水の機械的力、生物学的要因などの環境要因は、環境分散プラスチックのプラスチック脆化を引き起こし、より大きなプラスチック断片をマクロまたはメソプラスチック粒子に分解する9,10。さらなるデフラグは、マイクロプラスチック(MPs)およびナノプラスチック(NP)を形成し、平均サイズ(公称直径;dp)それぞれ1〜5000μmおよび1〜1000nmの11.しかし、NPの上限dp限界(すなわち、MPの下限)は普遍的に合意されておらず、いくつかの論文では、これは100nm12としてリストされている。
プラスチック廃棄物からのMNPは、土壌の健康と生態系サービスに対する新たな世界的な脅威となっています。MPsによる淡水からの重金属の吸着は、周囲の環境と比較して800倍の高濃度の重金属をもたらした13。さらに、水生生態系のMPは、光の浸透を変化させ、酸素枯渇を引き起こし、水生生物への浸透と蓄積を含む様々な生物相への付着を引き起こすことによって、複数のストレッサーおよび汚染物質をもたらす14。
最近の研究は、MNPsが微生物群集や植物を含む土壌地球化学と生物相に影響を与える可能性があることを示唆しています15,16,17。さらに、NPは食物網17、18、19、20を脅かしている。MNPは土壌中で垂直および水平輸送を容易に受けるため、農薬、可塑剤、微生物などの吸収された汚染物質を土壌を通って地下水や河川や小川などの水生生態系に運ぶことができます21,22,23,24。マルチフィルムなどの従来の農業用プラスチックはポリエチレン製で、使用後に畑から取り出して埋め立て処分する必要があります。しかし、不完全な除去は、土壌中の実質的なプラスチック破片の蓄積につながる9、25、26。あるいは、土壌生分解性プラスチックマルチ(BDM)は、使用後に土壌に耕され、そこで時間の経過とともに劣化するように設計されています。しかし、BDMは一時的に土壌中に持続し、徐々に分解され、MPsとNPに断片化します9,27。
現在の多くの環境生態毒性学的および運命的研究は、理想化された非代表的なMPおよびNPモデル材料を採用している。最も一般的に使用される代理MNPは、単分散ポリスチレンマイクロまたはナノスフィアであり、環境12,28に存在する実際のMNPを反映していない。その結果、代表的でない国会議員やNPを選ぶと、測定や結果が不正確になる可能性があります。陸生環境研究のための適切なモデルΜNPの欠如に基づいて、著者らは農業用プラスチックからそのようなモデルを準備することに動機づけられた。我々は以前、プラスチックペレットおよびフィルム材料の機械的粉砕および粉砕によるBDMおよびポリエチレンペレットからのMNPsの形成ならびにMNPsの寸法および分子特性について報告した29。現在の論文は、マルチフィルムやペレット化された原料など、すべての農業用プラスチックに広く適用できるMNPを調製するためのより詳細なプロトコルを提供しています(図1)。ここでは、一例として、農業用プラスチックを表すために生分解性ポリマーポリブチレンアジペートテレフタレート(PBAT)のマルチフィルムおよび球状ペレットを選択した。
プロトコル
1. 極低温前処理とフライス加工によるプラスチックペレットからのMPsの加工
注:この方法論は、この提示された研究29に使用されたのと同じ材料からなるPBATフィルムを使用して、他の場所に記載されている手順に基づいている。
- 約1gのポリマーペレットサンプルを計量し、50mLのガラス瓶に移す。
- 回転切断ミルの前のスロットに20メッシュ(840μm)のふるいを備えた「長方形の送達」チューブを置き、停止ピンに当たるまで送達チューブを持ち上げます。
- ガラス板をフライス盤の表面の上に置き、調整可能なクランプで固定します。次に、50 mLのガラス瓶をミル出口の下に置きます(図2)。
- スライド式サイドアームサポートをミル(右上側にあります)の前面ガラスの中央に置き、ローレットボルトで締め付けます。ミルの前面ガラスがしっかりと配置されていることを確認します(図2a)。
- ミル上部のホッパー漏斗を上部フライスチャンバーの開口部に挿入します。
- ラインコードを電源コンセントとプレスコードスイッチに差し込み、ミル運転を開始します。
メモ:詰まりを防ぐため、ミルの電源を入れて回転させた後に材料のみを供給してください。また、フライス加工手順全体を通して目と耳の保護具を着用してください。 - サンプルをホッパーにゆっくりと供給し(約10ペレット/分)、減速や詰まりを防ぎます。可聴ノイズが減少したら、次のバッチのペレット(〜10個)を追加します。ペレット(1g)を処理した後、コードスイッチを押してミル操作を約20分間停止して冷却します。木製のプランジャーを使用してサンプルを供給し、供給ホッパー内での粒子の排出と凝集を防ぎます。
警告: 最適な送り速度は、加工材料の種類によって異なります。切断チャンバ内の粒子摩擦により処理速度が低下した場合、またはガラス板上に溶融ポリマーの形成が観察された場合は、ポリマー粒子の過熱およびさらなる溶融を防ぐために、直ちにミルをオフにする。 - 20メッシュ(840μm)の送達管を取り外し、最初のバッチの完了時に60メッシュ(250μm)の送達管と交換します(図2b)。
- 回収した材料をミルホッパーに再導入します。ステップ 1.1 および 1.7 に従って、250 μm の粉砕分画を取得します。
- 収集した250μm画分を最大3回まで再供給する。
- チャンバー内の残りの粒子を回収し、収集したメインフラクションに追加します。
2. 極低温前処理とフライス加工によるプラスチックフィルムの加工
- ロールからフィルム試料を取り出し、ペーパーカッターで約120mm(交差方向)x 20mm(機械方向)の短冊状に切断する。
- 1000 mLのガラスビーカーに800 mLの脱イオン(DI)水に断片(〜1 g)を10分間浸します。このステップは、ポリマーを予め浸漬することによって、その後の極低温冷却手順のための脆化を改善する。
警告: 液体窒素は、極低温手袋と安全メガネを着用して、安全装置で取り扱います。 - 200mLの液体窒素(N2)を極低温容器にゆっくりと加える。
- 予め浸漬されたフィルム粒子を、スチールピンセットで極低温容器に慎重に移します。液体N2に3分間プレソークする。
- 凍結したフィルム断片を200W、14速ブレンダーに移します。
- 凍結した材料を速度レベル3で10秒間処理し、凍結ガラス膜構造を壊します。さらなる小型化を促進するために、400mLのDI水を加え、フィルム水スラリーを5分間ブレンドする。
- スラリーをフィルター(1μmメッシュ)付きのビュヒナー漏斗に移し、少なくとも1時間真空をかけます。
- 真空乾燥固体粒子を30°Cで少なくとも48時間、アルミニウム皿中で乾燥させる。
- ピンセットで乾燥粒子をミルに送ります。ミリングの場合は、ステップ 1.1 ~ 1.11 に従います。
3. 環境風化・フライス加工による前処理プラスチックフィルムの加工
- 現場から回収したプラスチックフィルムの破片を滑らかな表面(ラボベンチ)にレイアウトします。吸収された土壌粒子や植物の残骸を柔らかい毛のブラシで慎重に取り除きます。
- はさみでフィルムを〜4cm2 の〜1.0gのサンプルに切り取る。
- フィルム断片を500mLのDI水で満たされた1000mLビーカーに加える。20mmの攪拌棒で300分-1の速度で1時間攪拌する。
- ビーカーのわずかな攪拌下でDI水をシンクまたはプラスチックバケツにデカントして再導入することにより、溶解した土壌粒子を除去する。この手順を 3 回繰り返します。連続攪拌は、土壌粒子を水中に分散させ、デカンテーションを容易にすることができる。
- ビーカーからアルミ皿にサンプルを移します。プラスチックサンプルを12時間風乾した後、真空オーブンで30°Cで24時間移送して乾燥させます。 ミリングの場合は、ステップ 1.1 ~ 1.11 に従います。
4. カスケードふるいによるふるい分け手順
- ふるい(直径3インチ)を底の鍋から始めて、次に最も細かいふるい(#325;45 μm)を積み重ね、次にますます粗いふるい(#140;106 μm、#60;250 μmなど、#20;840 μmのふるいが最も粗い)を積み重ね、蓋を上に置きます。
- ふるいシェーカーの開口部に4本のピンを挿入して、4つのふるいすべてをシェーカーに取り付けます。
- ステップ1、2、または3のいずれかで収集された個々の画分を、4つのカスケードシーブの上に移します。300分-1で10分間振る。
- より大きな(上の)画分を別々に回収し、さらに粉砕に供する。
メモ: 必要に応じて、シェーカーの振とう速度を調整します。あるいは、手でふるいを振ることも可能です。メッシュ#20ふるいから始めて、一度に1つのふるいだけを使用してください:底と蓋を手でふるいにしっかりと押し付け、軸方向と水平方向に5分間振ってください。 - 工程1.6〜1.10に記載されるようにdp>106μmの篩い分け粒子を回転式カッティングミルに再導入する。
- 鍋から底部分画を回収し、粒子を次の小さなふるいサイズに再導入する。106 μmの粒子が主分率を表すまでこの手順を繰り返します。
- 収集した106μmの画分をマージし、乾燥した領域(デシケーターまたは空気密封ビニール袋)に粒子を保管します。
注: 45 μm フラクションは 106 μm フラクションの一部です。しかし、前者の画分は、収量が一般に非常に低いため、単離および別々に分析されなかった。個々のフラクションの収率回収率および粒径フラクションは、高精度マイクロバランスを使用して、初期供給フラクションに関連して、各ふるい分けフラクション(メッシュ#20〜メッシュ#325)の重量%単位の重量測定によって決定することができる。
湿式粉砕用の水性NPスラリーの調製
- 1000 mLのガラスビーカーに800 mLの蒸留水を加え、攪拌棒(直径=8 mm、長さ=50.8 mm)を挿入して、DI水に分散したMPsのスラリーを調製した。
- 工程1、2、3、又は4からの106μmプラスチック画分8gをDI水に導入し、1重量%スラリーを製造する。
- ガラスビーカーを攪拌盤の上に置き、400分-1 で24時間磁気攪拌して粒子を水に浸し、粒子軟化を促進する。
- 粒子を1000mLのプラスチック容器に移す。
- さらに2つの1000 mLプラスチック容器にDI水を充填し、粉砕プロセス中にグラインダーのホッパーに付着した粒子を洗い流すために使用されます。
NP生産のための湿式粉砕機の準備
- 46グレインサイズの石(砥石のグリット=297-420μm)を湿式摩擦グラインダーに入れ、センターナットを17mmレンチで手締めします。
- ホッパーを上に追加し、3つのナットとボルトを17mmレンチで固定します。
- 1 L のプラスチック製の収集瓶をコライダーの出口の下に置きます。2 つ目の空の 1 L バケットをコンセントの横に置き、処理中の交換に使用されます。
- ゲージクリアランスを+1.0に調整し、ゼロ位置からの正の0.10μmシフトに対応します。
- 電源を入れ、砥石が触れるまで調整ホイールを時計回りに慎重に回します。次に、フレキシブル測定リングをゼロに調整し、ホイールをすぐに反時計回りに回します。デフォルトでは、速度は1500分-1に調整されています。
注:砥石に過度の熱が発生するため、石の「乾式研削」は避けてください。 - 石が触れるまで調整ホイールを時計回りに回し、水-NPスラリーをホッパーに静かに充填します。スラリーが導入された後のゼロ位置からの負の0.20μmシフトに対応する-2.0のクリアランスゲージまでギャップを連続的に減少させる。2つの石の円盤の間のプラスチック粒子 - 水スラリーは、MPからNPへの変換を促進し、砥石間の直接摩擦を回避します。
- バケット内の充填レベルが0.5 Lを超えたら、収集バケットを交換してスラリーを収集します。
- 粒子を収集し、30〜60回粉砕機に再導入する。パス(再導入回数)が多いほど、粒子サイズが小さくなります。
- ホッパーに吸着した付着粒子を調製したDI水ボトルで洗浄し、処理中に適切なスラリー混合を可能にする。
注:プロセス中の中間サンプルの収集は、20 mLのガラスバイアルを出口ストリームに保持することによって可能です。個々のステップは、プロセスの重大度(パス数)が増加する一方で、粒子フラグメンテーションメカニズムを評価します。スラリーを回収し、良好な混合のために25°Cで400分-1 で4時間攪拌する。スラリーを48時間放置して安定させます。
7. スラリーからのNPの回収と乾燥
- スラリーを追加の1000 mLガラスビーカーにゆっくりと注ぐことによってスラリー中の複数の層が観察される場合は、底部画分(またはNP濃度が最も高い相)を分離します。
- 画分を遠心分離バイアル(50mL)に移し、10分間遠心分離する(相対遠心力[RCF]=20 x102g )。RCF(g力とも呼ばれる)は、ローター半径とローター速度の関数として生成された半径方向の力であり、スラリーのより重い粒子と水の分離を引き起こします。
- 透明な最上層を別のアルミパンにデカントして取り外します。
- 残りの最下層(NPスラリーを含む)を追加のアルミニウム皿に移し、30°Cの真空オーブンに48時間入れる。
- 呼吸マスクを着用したまま、ヒュームフードまたはグローブボックスの下にヘラで乾燥した材料を回収します。乾燥した内容物を100mLのガラス容器に移し、蓋で密封する。
- バイアルにNPを入れ、気密で乾燥した涼しい場所(デシケーターなど)に保管してください。
注:製造プロセス中(ここでは、湿式粉砕プロセス中または乾燥粒子として)に環境に放出されるMNPは、水生および陸上の生態系に深刻な脅威をもたらす可能性があります。特に、規制措置は、工学的ナノ材料30に対するそれらの製造および使用に対するリスクを最小限に抑えるように設計されている。したがって、MNPの形成には、ヒュームフードまたはグローブボックス内のマテリアルハンドリングなどの特定の予防措置が必要です。さらに、NPの単離中に形成された水性廃液(ステップ6.7-6.9)は、環境安全衛生部によって実施される使用済み廃棄手順の対象となります。
8. 実体顕微鏡 による MPイメージング
- 〜20mgの粒子(ステップ4で収集)を〜4cm2の表面上に分散させる。背景のコントラストを最大にするために、暗い表面に白または半透明のMPを広げ、白い背景(紙シート)に黒または濃い色のMPを広げます。
- 顕微鏡を最低倍率に調整して、可能な限り大きな領域(粒子領域の中央)をキャプチャします。次に、外部ランプをフォーカスセンターに向け、関心領域の照明を取得します。
- 視野の中央に>50個の粒子を検出できる倍率を適用します。この量は、堅牢な統計的評価結果を得るために推奨されます。
- パーティクルの重なりがない、または小さな粒子があり、色のコントラストが良い領域に焦点を当てます。
- 外側の粒子形状に焦点を合わせることによって、少なくとも5つの代表的な画像をキャプチャする。イメージングに使用されるローカルコンピュータは、高解像度の画像をビットマップとしてソフトウェアに保存します。
- 実体顕微鏡で記録した画像をImageJで認識されるファイル形式(ビットマップ、tiff、jpeg)で保存し、以下の定量データ解析を行います。
メモ:メイン画像が定規または画像に記録された他の参照オブジェクトを使用して撮影された正確な倍率設定で1つの参照画像を撮影します。この手順により、ImageJソフトウェアを使用して準備および分析するときに、画像を簡単にキャリブレーションできます。
9. ImageJによる画像解析
- ImageJソフトウェア31を開き、コマンドファインダーを開くために(CTRL+L)と入力してファイルインポートを準備します。次に、右下隅にバイオフォーマットを入力します。この機能は、メニューパスのファイル>インポート>バイオフォーマットをアクティブにします(>はソフトウェア内のナビゲーションステップを参照します)。保存されているイメージファイルのディレクトリを検索します。
メモ: Bio-Formats パッケージが コマンドファインダーに表示されない場合は、 Bio-Formats ImageJ でオンラインで検索してください。ImageJ のダウンロードとインストールの指示に従ってください。Bio-Formatインポーターを使用すると、ImageJ内の画像ファイルのインポート/エクスポートとコマンドの検索を簡単に処理できます。 - [ファイル] > [開く] をクリックしてイメージを開き (手順 9.1 で説明したように Bio-Formats のインポートも行います)、手順 4.7 で収集したファイルの場所にあるパーティクル イメージと、手順 1.6 で説明した定規参照 イメージ>選択します 。複製イメージを作成するには、 Shift + Command + D をクリックして、コピーイメージのしきい値設定を調整しながら元のイメージと比較することをお勧めします。
メモ: ファイル> 開くコマンドは、手順 8.7 で説明したように、ImageJ でネイティブにサポートされているさまざまな形式を開きます。または、コンピュータ上のイメージの場所を選択し、メインのImageJウィンドウのステータスバーにファイルをドラッグアンドドロップします。画像ファイルは別のウィンドウで自動的に開きます。 - 画像にズームインおよびズームアウトするには、それぞれ Ctrl + と CTRL - を使用します。
- 測定値を設定するには、「分析」>「測定値を設定」をクリックし、デフォルト値として「面積記述子」と「形状記述子」を選択します。
- 手順 8 で説明したように、定規参照画像を使用してスケール バーの長さに直線の線を描画して、スケール バーを定義します。 [分析]>[スケールの設定]を押し、 既知の距離の下にバーの長さの数値と対応する長さの単位を入力します。
- [ >ツールの分析] > [スケール バー] をクリックして画像上のスケール バーを視覚化し、画像に鮮明なコントラストを表示するなどの設定を調整します。スケールバーの設定でスケールバーを配置する画像上の位置を選択します。「 幅 」を選択して、バーをキャリブレーションされた単位で、「バー の高さを ピクセル単位で」、および「スケールバーラベルの フォントサイズ」 を調整します。 背景 を選択して、ラベルテキストボックスの塗りつぶし色を調整します。
メモ: マイクロメータの場合は、μm の入力で十分です。プログラムは、μmをデータ出力に自動的に適応させます。 - 「イメージ」 >「タイプ」を選択して、イメージを 8 ビット・イメージ>変換します。
- コピーしたイメージを 8 ビットに変換する には、[イメージ > タイプ] > 8 ビットを選択します。
- 「 画像」または「しきい値>>設定 」(元の画像とサイズを比較)>選択して調整します。
- [分析] または [測定値 の設定] を選択して、実行する測定>決定します。
- [パーティクルを 0-無限大>解析] を選択し、[結果の表示] をクリックして、その場で表示します。
- ROI (.zip) 結果を [ 測定値の保存] と [フォルダーの選択] に保存します。
- [ファイル] の [ファイル] の下の [結果の保存 (*.csv) > [フォルダ>選択] として保存します。
10. 表計算ソフトでの粒子径(dp)と形状係数計算
注:粒子径と形状要因の知識は、環境中の粒子の挙動(運命、輸送)と表面積の決定に不可欠です。したがって、MPが環境研究に使用される場合、幾何学は不可欠です。例えば、土壌中の粒子移動に影響を与えるMP-MPやMP土壌凝集など、MPのサイズや形状によって土壌との相互作用メカニズムが異なることが観察された15,32。したがって、以下のステップは、dp−粒径分布および幾何学的パラメータを決定するために推奨される。
- ImageJ解析(ステップ9.13)で取得・保存した*.csvファイルを表計算ソフトにインポートします。
注: 各列行の数値は、式 1 および式 2 に従って各粒子の個別の計算を反映しています。 - 円形度 (CIR) や縦横比 (AR) などの平均形状パラメーター値を評価するには、各列の下部に = 平均 (x,y) と入力します (x は列の最初の行、y は列の最後の行を表します) 次に Enter キーを押します。CIR 値は、投影面積と個々のパーティクルの CIR = 1 (式 1) を持つ真円の関係を表します。ARは、 式2によって記述される粒子の長さ/幅比を表す。
- 平均ARが2.5<かどうかを判断し、式3を使用して新しい列のdp値を計算します。AR ≥ 2.5 の場合、式 4 を反映して dp 値を計算します。新しい列を追加して、ImageJ 出力から受信した面積列に基づいて dp を計算します。
メモ: AR しきい値を 2.5 ≥選択すると、より長方形のパーティクルを表し、AR < 2.5 はより丸い形状のパーティクルを反映します。この選択により、顕微鏡によって測定され、ImageJを介して決定された領域から導出 されるdp 計算誤差を最小限に抑えることができる。
(1)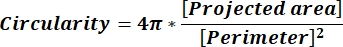
(2)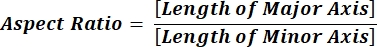
(3)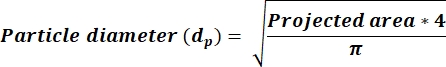
(4)
11. 国会議員とNPの統計分析
- *.csvデータファイルを統計ソフトウェアでファイル>開き、手順9.13で作成した対応する ファイルのファイル>場所を選択します 。
メモ: または、コピー&ペースト機能を使用してテーブルを統計ソフトウェアに直接転送することもできます。統計ソフトウェア「Edit > Past」のブランドとバージョンについては、資料表を参照してください。 - dpデータを評価するには、分布の分析>選択します。
- 列のデータを反映する dp を選択し、Y 列にドラッグ アンド ドロップして OK ボタンを押します。この機能は、要約統計量、平均値、および標準偏差値を含む統計出力を含むヒストグラムを別のウィンドウに作成します。
- ヒストグラムが、D p > 連続適合 (連続適合) の横の三角形を選択して、最適適合曲線を持つ正規分布 (または dp に最適) に従っているかどうかを評価し、最適として受け取った曲線 (たとえば、適合正規) を選択します。このステップでは、ヒストグラムを正規分布の適合度で重ね合わせます。
- 円形度(Cir)、アスペクト比(AR)、真円度(円形)、および固体度(Sol)の平均形状パラメータ値の要約統計出力から平均値と標準偏差値を決定し、報告します。
注: 統計的有意水準 α = 0.05 が推奨され、すべての評価に採用されました。有意水準は、数値結果を比較するときに帰無仮説が真である場合に帰無仮説を棄却する確率です。
12. dpサイズ分布と粒子形状係数の最適適合
- データ・セットを統計ソフトウェアにロードし、ステップ 10 で計算 した dp の分布に同じ *.csv データ・セットを使用します。
- [>の信頼性と生存期間の分析 > 寿命分布] を選択します。
- dp 列を Y、イベントまでの時間フィールドまでドラッグし、「OK」を選択します。この機能は、dp の関数として確率プロットを持つ出力を作成します。
- 分布の比較で、ノンパラメトリック、対数正規、ワイブル、対数ロジスティック、正規をチェックして、最適な分布を決定します。
- グラフの下の 統計モデル比較表 の赤池情報基準とベイズ情報基準 (それぞれ AIC と BIC) の最小数値でモデル適合の品質を、最も低い BIC 数値で評価します。デフォルトで、最適モデルは最初の行に表示されます。各分布評価のパラメトリックまたはノンパラメトリック推定値の出力フィールドは、 分布の比較 グラフの下にあります。
- [スクリプトをデータテーブルに保存]で左上隅にある赤いプルダウン三角形を選択して、出力スクリプトをデータテーブルに保存>ます。次に、[ファイル] を選択して目的のファイルの場所に元のデータ テーブル>保存し、[名前を付けて保存] *.jmp >選択します。
13. 動的光散乱によるNPの次元特性評価
- デスクトップアイコンをダブルクリックして、動的光散乱(DLS)ソフトウェアを起動します。[ファイル>新規> SOP] を選択します。サンプル名を追加し、サンプルセットアップの下のDLSソフトウェアで、蒸留水の場合は1.33、ポリマーの場合は1.59に材料屈折率を選択します。プルダウンメニューで材料を選択し、「OK」をクリックします。
メモ: プルダウン メニューをクリックすると、 材料マネージャが開き、 屈折率 と 吸収を変更して新しいサンプルを追加したり、既存のサンプルを変更したりできます。分散剤として 水を選択します。 - [セル タイプ] で適切なセル>選択し、[レポート] を選択して、各測定後に表示する出力を決定します。
- 計測器のふたを閉め、ふたを閉めて(開いている場合)、 ON ボタンを押してシステムの電源を入れて、計測器を起動します。最初のビープ音が鳴った後、ビームを安定させるために約30分待ちます。
- 初期化ルーチンが完了するまで待ってから、あらかじめ設定された温度(通常は25°C)に達したことを示す2回目のビープ音が鳴るのを待ちます。
- NPs(ステップ7で受け取ったように)とDI水のサンプルスラリーを約0.1重量%濃度の15mLバイアルに調製し、磁気的に〜1時間攪拌してよく混合できるようにします。
- スラリーを振ってから、約1.0 mLを4.5 mLの石英キュベットに移し、蓋を開けます。次に、サンプルセルをDLS装置のサンプルホルダーに慎重に挿入します。
注: ステップ 13.5 で説明したのと同じ濃度で、同じスラリーバッチから 3 つのサンプルを調製します。 - 各サンプルについて3つの測定(DLSソフトウェアでの選択)を実行します。測定の合間には、サンプルセルを取り出し、サンプルを5秒間静かに振ってサンプルを混合できるようにします。
- DLS ソフトウェアを使用してデータを抽出およびエクスポートし、データセットをスプレッドシート ソフトウェアに転送し、手順 11.1 ~ 11.5 (図 1) の説明に従って MP と NP のヒストグラムを作成します。「レコードの表示」タブから「編集/コピー」を選択して表またはグラフをコピーします。このコピーは、スプレッドシート・ソフトウェアなどの別のアプリケーションに貼り付けることができます。
14. フーリエ変換赤外(FTIR)分光減衰全反射率(ATR)を用いたMNPの化学分析
注:フーリエ変換赤外(FTIR)および核磁気共鳴(NMR)分光法によるMNPの化学分析は、湿式粉砕が化学結合特性に及ぼす影響、ならびに主要成分およびポリマーのモノマー成分の相対量を評価するのに適したツールです10。さらに、MNPsのポリマー成分の熱特性および安定性は、それぞれ示差走査熱量測定(DSC)および熱重量分析(TGA)によって評価することができる29。
- 検出システム(ATR結晶表面)をエタノールと糸くずの出ない布で拭きます。
- ソフトウェアを起動し、コマンドバー の背景ボタンを押し て、計器ビームパスをクリアして空中で バックグラウンドスキャン を実行します。背景スペクトルは、収集後すぐに表示されます。
- 計測器設定ツールバーにサンプル ID と サンプル説明 を入力します。
- スペクトル波数を4000 cm-1~600 cm-1の範囲で調整し、吸光度モードでは2.0 cm-1の分解能を選択します。スペクトルごとに32スキャンを選択して開始します。
- MPs(106 μm)とNP(~300 nm)のプラスチックサンプル(~20 mgまたは~1-3 mm 3)を、内径が約10 mm(または同等)のスチールワッシャーの内側に結晶表面に置きます。
注:ワッシャーは、サンプルホルダーがサンプルを圧縮するときに結晶上の分散を防ぎ、一貫性のない測定による材料の不均一性とデータバイアスをもたらします。 - ワッシャーをATRクリスタルの中央に置き、ヘラでワッシャー開口部の中央にポリマーサンプルを追加します。
- 上記のサンプルレバーをサンプルの中央に回し、50〜90の間のフォースゲージ力を監視してノブを時計回りに回します。サンプルは予備スペクトルを示す。 [スキャン ]ボタンをもう一度押して、スペクトルを収集します。
- 「 スキャン 」ボタンをクリックして8~10個のスペクトルを収集し、各測定後にサンプルをヘラで慎重に混合して、代表的な結果を収集できるようにします。
- データエクスプローラーの「サンプルビュー」フォルダーをクリックして、収集されたすべてのサンプルを表示領域に重ねて表示します。まず、外れ値を表す大きく外れたスペクトルを削除します。次に、ツールバーの「吸光度」モードまたは「透過率」モードを選択します。
- スペクトルを保存するには、スペクトルを含む サンプルビュー フォルダを選択し、ファイルメニューから [名前を付けて保存] を選択します。 ダイアログウィンドウ では、ファイル名、宛先ディレクトリ、およびすべてのスペクトルのデフォルトの場所の変更が有効になります。
メモ: または、スペクトルを選択して右クリックしてバイナリオプションを表示することで、スペクトルを*.spファイルとして保存することもできます。[バイナリの保存] を選択し、最終的な保存場所を参照します。 - ベースライン補正と平均正規化を実行するには、ソフトウェアまたは次の手順でメニューの [プロセス>正規化] を選択して、データ エクスプローラーで 1 つのスペクトルを選択します。
注: 平均正規化は、サンプルの厚さまたは材料の変動によるスペクトル誤差を補正します。 - データ収集が完了したら、エタノールと糸くずの出ない布で結晶領域を清掃します。
- 以前の出版物10で割り当てられ、評価された割り当てられたFTIR振動バンドに従って、MPとNPの違いを解釈する。
結果
実験手順の方法と分析を検証するために、ペレットとフィルム材料からMPsとNPを形成し、顕微鏡画像を使用してサイズと形状で比較しました。図1に記載の方法は、生分解性プラスチックペレットおよびフィルムからMPsおよびNPを効率的に形成した。これは、極低温冷却、粉砕、湿式粉砕および特性評価によって達成された。前者のステップは、風化が脆化を誘発したた?...
ディスカッション
この方法は、環境研究のためにペレットおよびマルチフィルムから供給されたMNPsを調製するための、以前の刊行物29に最初に記載された有効なプロセスを記載している。サイズ縮小プロセスには、モデルMNPを製造するために、極低温冷却(フィルムのみ)、乾式粉砕、および湿式粉砕段階が含まれていました。我々は、低密度ポリエチレン(LDPE)、ポリ酪酸アジピン酸コテレフ?...
開示事項
著者らには開示するものは何もありません。
謝辞
この研究は、ハーバート農業大学、バイオシステム工学・土壌学部、テネシー大学ノックスビル校のサイエンスアライアンスから資金提供を受けた。さらに、著者らは、この研究のためにUSDA助成金2020-67019-31167を通じて提供された財政的支援に感謝しています。PBATベースの生分解性マルチフィルムのMNPsを調製するための初期原料は、BioBag Americas, Inc.(米国フロリダ州Dunevin)によって親切に提供され、PBATペレットはMobius, LLC(テネシー州レノアシティ)によって提供されました。
資料
| Name | Company | Catalog Number | Comments |
| Aluminum dish, 150 mL | Fisher Scientific, Waltham, MA, USA | 08-732-103 | Drying of collected NPs |
| Aluminum dish, 500 mL | VWR International, Radnor, PA, USA | 25433-018 | Collecting NPs after wet-grinding |
| Centrifuge | Fisher Scientific, Waltham, MA, USA | Centrific 228 | Container for centrifugation |
| Delivery tube, #20, 840 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M30 | Sieving of the first fraction during milling |
| Delivery tube, #60, 250 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M45 | Sieving of the second fraction (3x) during milling |
| Thermomixer, 5350 Mixer | Eppendorf North America, Enfield, CT, USA | 05-400-200 | Analysis of sieving experiments |
| FT-IR Spectrum Two, spectrometer with attenuated total reflectance (ATR) | Perkin Elmer, Waltham, MA, USA | L1050228 | Measuring FTIR spectra |
| Glass beaker, 1000 mL | DWK Life Sciences, Milville, NJ, USA | 02-555-113 | Stirring of MPs-water slurry before grinding |
| Glass front plate | Thomas Scientific, Swedesboro, NJ, USA | 3383N55 | Front cover plaste for Wiley Mini Mill |
| Glass jar, 50 mL | Uline, Pleasant Prairie, WI, USA | S-15846P | Collective MPs after milling |
| Glove Box, neoprene | Bel-Art-SP Scienceware, Wayne, NJ, USA | BEL-H500290000 | 22-Inch, Size 10 |
| Zetasizer Nano ZS 90 size analyzer | Malvern Panalytical, Worcestershire, UK | Zetasizer Nano ZS | Measuring nanoplastics dispersed in DI-water |
| Microscope camera | Nikon, Tokyo, 108-6290, Japan | Nikon Digital Sight 10 | Combined with Olympus microscope to receive digital images |
| Microscope | Olympus, Shinjuku, Tokyo, Japan | Model SZ 61 | Imaging of MPs |
| Nitrogen jar, low form dewar flasks | Cole-Palmer, Vernon Hills, IL, USA | UX-03771-23 | Storage of liquid nitrogen during cryogenic cooling |
| Accurate Blend 200, 12-speed blender | Oster, Boca Raton, FL, USA | 6684 | Initiating the size reduction of cryogenically treated plastic film |
| PBAT film, - BioAgri™ (Mater-Bi®) | BioBag Americas, Inc, Dunedin, FL, USA | 0.7 mm thick | Feedstock to form MPs and NPs, agricultural mulch film |
| PBAT pellets | Mobius, LLC, Lenoir City, TN, USA | Diameter 3 mm | Feedstock to form microplastics (MPs) and nanoplastics (NPs) trough milling and grinding |
| Plastic centrifuge tubes, 50 mL | Fisher Scientific, Waltham, MA, USA | 06-443-18 | Centrifugation of slurry after wet-grinding |
| Plastic jar, 1000 mL, pre-cleaned, straight sided | Fisher Scientific, Waltham, MA, USA | 05-719-733 | Collection of NPs during and after wet grinding |
| Polygon stir bars, diameterø=8 mm, length=50.8 mm | Fisher Scientific, Waltham, MA, USA | 14-512-127 | Stirring of MPs slurry prior to wet-grinding |
| Scissors, titanium bonded | Westcott, Shelton, CT, USA | 13901 | Cutting of initial PBAT film feedstocks |
| Square glass cell with square aperture and cap, 12 mm O.D. | Malvern Panalytical, Worcestershire, UK | PCS1115 | Measuring of NPs particle size |
| Stainless steel bottom, 3 inch, pan | Hogentogler & Co. Inc, Columbia, MD, USA | 8401 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 140 (106 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1308 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 20 (850 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1296 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 325 (45 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1313 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 60 (250 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1303 | Sieving of MPs after Wiley-milling |
| Stainless steel top cover, 3 inch | Hogentogler & Co. Inc, Columbia, MD, USA | 8406 | Sieving of MPs after Wiley-milling |
| Stainless steel tweezers | Global Industrial, Port Washington, NY, USA | T9FB2264892 | Transferring of frozen film particles from jar into blender |
| Vacuum oven, model 281A | Fisher Scientific, Waltham, MA, USA | 13-262-50 | Vacuum oven to dry NPs after wet-grinding |
| Friction grinding machine, Supermass Colloider | Masuko Sangyo, Tokyo, Japan | MKCA6-2J | Grinding machine to form NPs from MPs |
| Wet-grinding stone, grit size: 297 μm -420 μm | Masuko Sangyo, Tokyo, Japan | MKE6-46DD | Grinding stone to form NPs from MPs |
| Wiley Mini Mill, rotary cutting mill | Thomas Scientific, Swedesboro, NJ, USA | NC1346618 | Size reduction of pellets and film into MPs and NPs |
| Software | |||
| FTIR-Spectroscopy software | Perkin Elmer, Waltham, MA, USA | Spectrum 10 | Collection of spectra from the initial plastic, MPs and NPs |
| Image J, image processing program | National Institutes of Health, Bethesda, MD, USA | Version 1.53n | Analysis of digital images received from microscopy |
| Microscope software, ds-fi1 software | Malvern Panalytical , Malvern, UK | Firmware DS-U1 Ver3.10 | Recording of digital images |
| Microsoft, Windows, Excel 365, spreadsheet software | Microsoft, Redmond, WA, USA | Office 365 | Calculating the average particle size and creating FTIR spectra images |
| JMP software, statistical software | SAS Institute Inc., Cary, NC, 1989-2021 | Version 15 | Statistical analysis of particle size and perform best fit of data set |
| Unscrambler software | Camo Analytics, Oslo, Norway | Version 9.2 | Normalizing and converting FTIR spectra into .csv fromat |
参考文献
- Jin, Z., Dan, L. Review on the occurrence, analysis methods, toxicity and health effects of micro-and nano-plastics in the environment. Environmental Chemistry. (1), 28-40 (2021).
- Kumar, M., et al. Current research trends on micro-and nano-plastics as an emerging threat to global environment: a review. Journal of Hazardous Materials. 409, 124967 (2021).
- Alimba, C. G., Faggio, C., Sivanesan, S., Ogunkanmi, A. L., Krishnamurthi, K. Micro (nano)-plastics in the environment and risk of carcinogenesis: Insight into possible mechanisms. Journal of Hazardous Materials. 416, 126143 (2021).
- Serrano-Ruiz, H., Martin-Closas, L., Pelacho, A. M. Biodegradable plastic mulches: Impact on the agricultural biotic environment. Science of The Total Environment. 750, 141228 (2021).
- Hayes, D. G., et al. Biodegradable plastic mulch films for sustainable specialty crop production. Polymers for Agri-Food Applications. , 183-213 (2019).
- Viaroli, S., Lancia, M., Re, V. Microplastics contamination of groundwater: Current evidence and future perspectives. A review. Science of The Total Environment. , 153851 (2022).
- Rillig, M. C., Lehmann, A. Microplastic in terrestrial ecosystems. Science. 368 (6498), 1430-1431 (2020).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. Journal of Polymers and the Environment. 29 (9), 2916-2931 (2021).
- Yang, Y., et al. Kinetics of microplastic generation from different types of mulch films in agricultural soil. Science of The Total Environment. 814, 152572 (2022).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Schwaferts, C., Niessner, R., Elsner, M., Ivleva, N. P. Methods for the analysis of submicrometer-and nanoplastic particles in the environment. TrAC Trends in Analytical Chemistry. 112, 52-65 (2019).
- Gigault, J., et al. Current opinion: what is a nanoplastic. Environmental Pollution. 235, 1030-1034 (2018).
- Naqash, N., Prakash, S., Kapoor, D., Singh, R. Interaction of freshwater microplastics with biota and heavy metals: a review. Environmental Chemistry Letters. 18 (6), 1813-1824 (2020).
- Manzoor, S., Naqash, N., Rashid, G., Singh, R. Plastic material degradation and formation of microplastic in the environment: A review. Materials Today: Proceedings. , 3254-3260 (2022).
- de Souza Machado, A. A., et al. Impacts of microplastics on the soil biophysical environment. Environmental Science & Technology. 52 (17), 9656-9665 (2018).
- Jacques, O., Prosser, R. A probabilistic risk assessment of microplastics in soil ecosystems. Science of The Total Environment. 757, 143987 (2021).
- Kwak, J. I., An, Y. -. J. Microplastic digestion generates fragmented nanoplastics in soils and damages earthworm spermatogenesis and coelomocyte viability. Journal of Hazardous Materials. 402, 124034 (2021).
- Wahl, A., et al. Nanoplastic occurrence in a soil amended with plastic debris. Chemosphere. 262, 127784 (2021).
- Vighi, M., et al. Micro and nano-plastics in the environment: research priorities for the near future. Reviews of Environmental Contamination and Toxicology Volume 257. , 163-218 (2021).
- Pironti, C., et al. Microplastics in the environment: intake through the food web, human exposure and toxicological effects. Toxics. 9 (9), 224 (2021).
- Zurier, H. S., Goddard, J. M. Biodegradation of microplastics in food and agriculture. Current Opinion in Food Science. 37, 37-44 (2021).
- Horton, A. A., Dixon, S. J. Microplastics: An introduction to environmental transport processes. Wiley Interdisciplinary Reviews: Water. 5 (2), 1268 (2018).
- Panno, S. V., et al. Microplastic contamination in karst groundwater systems. Groundwater. 57 (2), 189-196 (2019).
- Su, Y., et al. Delivery, uptake, fate, an transport of engineered nanoparticles in plants: a critical review and data analysis. Environmental Science: Nano. 6 (8), 2311-2331 (2019).
- Yu, Y., Griffin-LaHue, D. E., Miles, C. A., Hayes, D. G., Flury, M. Are micro-and nanoplastics from soil-biodegradable plastic mulches an environmental concern. Journal of Hazardous Materials Advances. 4, 100024 (2021).
- Hayes, D. G. Enhanced end-of-life performance for biodegradable plastic mulch films through improving standards and addressing research gaps. Current Opinion in Chemical Engineering. 33, 100695 (2021).
- Qin, M., et al. A review of biodegradable plastics to biodegradable microplastics: Another ecological threat to soil environments. Journal of Cleaner Production. 312, 127816 (2021).
- Phuong, N. N., et al. Is there any consistency between the microplastics found in the field and those used in laboratory experiments. Environmental Pollution. 211, 111-123 (2016).
- Astner, A., et al. Mechanical formation of micro-and nano-plastic materials for environmental studies in agricultural ecosystems. Science of The Total Environment. 685, 1097-1106 (2019).
- Rist, S., Hartmann, N. B. Aquatic ecotoxicity of microplastics and nanoplastics: lessons learned from engineered nanomaterials. Freshwater Microplastics. , 25-49 (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Raju, S., et al. Improved methodology to determine the fate and transport of microplastics in a secondary wastewater treatment plant. Water Research. 173, 115549 (2020).
- Caputo, F., et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: addressing some analytical challenges in the sub-micron size range. Journal of Colloid and Interface Science. 588, 401-417 (2021).
- Xu, M., et al. Polystyrene microplastics alleviate the effects of sulfamethazine on soil microbial communities at different CO2 concentrations. Journal of Hazardous Materials. 413, 125286 (2021).
- Ding, L., et al. Insight into interactions of polystyrene microplastics with different types and compositions of dissolved organic matter. Science of The Total Environment. 824, 153883 (2022).
- Abbasimaedeh, P., Ghanbari, A., O'Kelly, B. C., Tavanafar, M., Irdmoosa, K. G. Geomechanical behaviour of uncemented expanded polystyrene (EPS) beads-clayey soil mixtures as lightweight fill. Geotechnics. 1 (1), 38-58 (2021).
- Li, Z., Li, Q., Li, R., Zhou, J., Wang, G. The distribution and impact of polystyrene nanoplastics on cucumber plants. Environmental Science and Pollution Research. 28 (13), 16042-16053 (2021).
- Sobhani, Z., Panneerselvan, L., Fang, C., Naidu, R., Megharaj, M. Chronic and transgenerational effects of polystyrene microplastics at environmentally relevant concentrations in earthworms (Eisenia fetida). Environmental Toxicology and Chemistry. 40 (8), 2240-2246 (2021).
- Lionetto, F., Esposito Corcione, C., Rizzo, A., Maffezzoli, A. Production and characterization of polyethylene terephthalate nanoparticles. Polymers. 13 (21), 3745 (2021).
- Dümichen, E., et al. Analysis of polyethylene microplastics in environmental samples, using a thermal decomposition method. Water Research. 85, 451-457 (2015).
- Robotti, M., et al. Attrition and cryogenic milling production for low pressure cold gas spray and composite coatings characterization. Advanced Powder Technology. 27 (4), 1257-1264 (2016).
- Ducoli, S., et al. A different protein corona cloaks "true-to-life" nanoplastics with respect to synthetic polystyrene nanobeads. Environmental Science: Nano. 9 (4), 1414-1426 (2022).
- El Hadri, H., Gigault, J., Maxit, B., Grassl, B., Reynaud, S. Nanoplastic from mechanically degraded primary and secondary microplastics for environmental assessments. NanoImpact. 17, 100206 (2020).
- Eitzen, L., et al. The challenge in preparing particle suspensions for aquatic microplastic research. Environmental research. 168, 490-495 (2019).
- Ekvall, M. T., et al. Nanoplastics formed during the mechanical breakdown of daily-use polystyrene products. Nanoscale advances. 1 (3), 1055-1061 (2019).
- Caldwell, J., et al. Fluorescent plastic nanoparticles to track their interaction and fate in physiological environments. Environmental Science: Nano. 8 (2), 502-513 (2021).
- Zeb, A., et al. Evaluating the knowledge structure of micro-and nanoplastics in terrestrial environment through scientometric assessment. Applied Soil Ecology. 177, 104507 (2022).
- Ji, Z., et al. Effects of pristine microplastics and nanoplastics on soil invertebrates: A systematic review and meta-analysis of available data. Science of The Total Environment. 788, 147784 (2021).
- de Alkimin, G. D., Gonçalves, J. M., Nathan, J., Bebianno, M. J. Impact of micro and nanoplastics in the marine environment. Assessing the Effects of Emerging Plastics on the Environment and Public Health. , 172-225 (2022).
- Pires, A., Cuccaro, A., Sole, M., Freitas, R. Micro (nano) plastics and plastic additives effects in marine annelids: A literature review. Environmental Research. , 113642 (2022).
- Hurley, R. R., Nizzetto, L. Fate and occurrence of micro (nano) plastics in soils: Knowledge gaps and possible risks. Current Opinion in Environmental Science & Health. 1, 6-11 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved