Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Formation de micro et nanoplastiques à partir de films plastiques agricoles pour l’emploi dans les études de recherche fondamentale
Dans cet article
Résumé
Nous montrons la formation et la caractérisation dimensionnelle des micro et nanoplastiques (MP et NP, respectivement) en utilisant un processus par étapes de fraisage mécanique, de meulage et d’analyse d’imagerie.
Résumé
Les microplastiques (MP) et les nanoplastiques (NP) dispersés dans les écosystèmes agricoles peuvent constituer une grave menace pour le biote dans le sol et les cours d’eau avoisinants. En outre, les produits chimiques tels que les pesticides adsorbés par les NP peuvent nuire aux organismes du sol et potentiellement entrer dans la chaîne alimentaire. Dans ce contexte, les plastiques utilisés à des fins agricoles, tels que les films de paillis plastique, contribuent de manière significative à la pollution plastique dans les écosystèmes agricoles. Cependant, la plupart des études fondamentales sur le devenir et l’écotoxicité utilisent des matériaux MP idéalisés et peu représentatifs, tels que les microsphères de polystyrène.
Par conséquent, comme décrit ici, nous avons développé une procédure en plusieurs étapes à l’échelle du laboratoire pour former mécaniquement des MP et des IP représentatifs pour de telles études. La matière plastique a été préparée à partir de pellicules de paillis plastique disponibles dans le commerce de polybutyrate d’adipate-co-téréphtalate (PBAT) qui ont été fragilisées par traitement cryogénique (CRYO) ou altération environnementale (W), et à partir de granulés PBAT non traités. Les matières plastiques ont ensuite été traitées par fraisage mécanique pour former des MPs d’une taille de 46 à 840 μm, imitant l’abrasion des fragments de plastique par le vent et les machines mécaniques. Les MP ont ensuite été tamisés en plusieurs fractions de taille pour permettre une analyse plus approfondie. Enfin, la fraction tamisée de 106 μm a été soumise à un broyage humide pour générer des NP de 20 à 900 nm, un processus qui imite le processus de réduction lente de la taille pour les MP terrestres. Les dimensions et la forme des MP ont été déterminées par l’analyse d’images de stéréomicrographies, et la diffusion dynamique de la lumière (DLS) a été utilisée pour évaluer la taille des particules pour les NP. Les MP et les IP formés par ce processus possédaient des formes irrégulières, ce qui correspond aux propriétés géométriques des MP récupérés dans les champs agricoles. Dans l’ensemble, cette méthode de réduction de la taille s’est avérée efficace pour former des MP et des NP composés de plastiques biodégradables tels que le polybutylène adipate-co-téréphtalate (PBAT), représentant des matériaux de paillis utilisés pour la production de cultures spéciales agricoles.
Introduction
Au cours des dernières décennies, l’augmentation rapide de la production mondiale de plastiques, l’élimination inappropriée et le manque de recyclage des déchets plastiques ont entraîné une pollution environnementale qui a eu un impact sur les écosystèmes marins et terrestres 1,2,3. Les matières plastiques sont essentielles pour l’agriculture contemporaine, en particulier pour cultiver des légumes, des petits fruits et d’autres cultures spéciales. Leur utilisation comme films de paillis, revêtements de tunnel hauts et bas, ruban d’égouttage et autres applications vise à améliorer le rendement et la qualité des cultures, à réduire les coûts de production et à promouvoir des méthodes agricoles durables 4,5. Cependant, l’emploi croissant de la « plasticulture » a soulevé des préoccupations concernant la formation, la distribution et la rétention de morceaux de plastique dans les environnements agricoles. Après un processus de fragmentation continu causé par la fragilisation par dégradation de l’environnement pendant la durée de vie, des fragments de plastique plus gros forment des micro- et nanoplastiques (MNP), qui persistent dans le sol ou migrent vers les cours d’eau adjacents par le ruissellement de l’eau et le vent 6,7,8. Les facteurs environnementaux tels que le rayonnement ultraviolet (UV) à travers la lumière du soleil, les forces mécaniques de l’eau et les facteurs biologiques déclenchent la fragilisation plastique des plastiques dispersés dans l’environnement, entraînant la décomposition de fragments de plastique plus gros en particules macro ou mésoplastiques 9,10. Une défragmentation ultérieure forme des microplastiques (MP) et des nanoplastiques (NP), réfléchissant des particules de taille moyenne (diamètre nominal; dp) de 1-5000 μm et 1-1000 nm, respectivement11. Cependant, la limite supérieure dp pour les IP (c.-à-d. une limite inférieure pour les députés) n’est pas universellement acceptée et, dans plusieurs documents, elle est de 100 nm12.
Les MNP provenant des déchets plastiques constituent une menace mondiale émergente pour la santé des sols et les services écosystémiques. L’adsorption des métaux lourds de l’eau douce par les MP a conduit à une concentration de métaux lourds 800 fois plus élevée que dans le milieu environnant13. De plus, les MP dans les écosystèmes aquatiques posent de multiples facteurs de stress et contaminants en modifiant la pénétration de la lumière, en provoquant un appauvrissement en oxygène et en provoquant l’adhésion à divers biotes, y compris la pénétration et l’accumulation dans les organismes aquatiques14.
Des études récentes suggèrent que les PMN peuvent avoir un impact sur la géochimie et le biote du sol, y compris les communautés microbiennes et les plantes15,16,17. De plus, les IP menacent le réseau trophique17,18,19,20. Étant donné que les PMN subissent facilement un transport vertical et horizontal dans le sol, ils peuvent transporter les contaminants absorbés tels que les pesticides, les plastifiants et les microorganismes dans le sol dans les eaux souterraines ou les écosystèmes aquatiques tels que les rivières et les ruisseaux21,22,23,24. Les plastiques agricoles conventionnels tels que les films de paillis sont fabriqués à partir de polyéthylène, qui doit être retiré du champ après utilisation et éliminé dans des sites d’enfouissement. Cependant, l’enlèvement incomplet entraîne une accumulation importante de débris plastiques dans les sols 9,25,26. Alternativement, les paillis en plastique biodégradables au sol (BDM) sont conçus pour être labourés dans le sol après utilisation, où ils se dégraderont avec le temps. Cependant, les BDM persistent temporairement dans le sol et se dégradent et se fragmentent progressivement en MP et NPs 9,27.
De nombreuses études environnementales écotoxicologiques et de devenir actuelles utilisent des matériaux modèles idéalisés et non représentatifs de MP et de NP. Les PMN de substitution les plus couramment utilisés sont les microsphères ou nanosphères de polystyrène monodispersé, qui ne reflètent pas les PMN réels résidant dans l’environnement12,28. Par conséquent, la sélection de députés et d’IP non représentatifs peut donner lieu à des mesures et à des résultats inexacts. En raison de l’absence de modèles ΜNP appropriés pour les études environnementales terrestres, les auteurs ont été motivés à préparer de tels modèles à partir de plastiques agricoles. Nous avons déjà fait état de la formation de MNP à partir de BDM et de granulés de polyéthylène par broyage mécanique et broyage de granulés de plastique et de matériaux de film, ainsi que des caractéristiques dimensionnelles et moléculaires des PMN29. Le présent document fournit un protocole plus détaillé pour la préparation des PMN qui peut être appliqué plus largement à tous les plastiques agricoles, comme les pellicules de paillis ou leurs matières premières granulées (figure 1). Ici, à titre d’exemple, nous avons choisi un film de paillis et des granulés sphériques du polymère biodégradable polybutylène adipate téréphtalate (PBAT) pour représenter les plastiques agricoles.
Protocole
1. Traitement des MP à partir de granulés de plastique par prétraitement cryogénique et broyage
NOTE: Cette méthodologie est basée sur une procédure décrite ailleurs, utilisant un film PBAT composé du même matériau utilisé pour cette étudeprésentée 29.
- Peser les échantillons de granulés de polymère de ~1 g et les transférer dans un bocal en verre de 50 mL.
- Placez le tube de « livraison rectangulaire » avec un tamis de 20 mailles (840 μm) dans la fente devant le train de coupe rotatif et soulevez le tube de refoulement jusqu’à ce qu’il atteigne la goupille d’arrêt.
- Placez la plaque de verre sur la face de la chambre de fraisage et fixez-la avec la pince réglable. Ensuite, placez un bocal en verre de 50 ml sous la sortie du broyeur (figure 2).
- Placez le support du bras latéral coulissant sur le moulin (situé sur le côté supérieur droit) au milieu de la vitre avant et serrez avec le boulon moleté. Assurez-vous que la vitre avant du laminoir est bien positionnée (figure 2a).
- Insérez l’entonnoir de trémie au-dessus du broyeur dans l’ouverture de la chambre de broyage supérieure.
- Branchez un cordon de ligne sur une prise de courant et sur l’interrupteur du cordon de pression pour démarrer le fonctionnement du fraisage.
REMARQUE: Pour éviter le bourrage, n’alimentez que le matériau après la mise sous tension et la rotation du broyeur. Portez également une protection oculaire et auditive pendant toute la procédure de fraisage. - Introduire lentement l’échantillon dans la trémie (environ 10 granulés/min) pour éviter de ralentir ou de se coincer. Une fois le bruit audible réduit, ajoutez le lot suivant de granulés (~10 pièces). Après avoir traité les granulés (1 g), appuyez sur l’interrupteur du cordon pour arrêter le fonctionnement du broyeur pendant ~20 min pour refroidir. Utilisez un piston en bois pour alimenter l’échantillon et empêcher l’éjection et l’agglomération des particules à l’intérieur de la trémie d’alimentation.
ATTENTION : Le taux d’alimentation optimal varie selon le type de matière de transformation. Éteignez immédiatement le broyeur si la vitesse de traitement diminue en raison du frottement des particules dans la chambre de coupe, ou si la formation de polymère fondu est observée sur la plaque de verre, afin d’éviter la surchauffe et la fusion ultérieure des particules de polymère. - Retirez le tube de distribution de 20 mailles (840 μm) et remplacez-le par le tube de distribution de 60 mailles (250 μm) à la fin du premier lot (figure 2b).
- Réintroduisez le matériau collecté dans la trémie du moulin. Suivez les étapes 1.1 et 1.7 pour la fraction de fraisage de 250 μm.
- Réalimentez les fractions de 250 μm collectées jusqu’à trois fois.
- Récupérez les particules restantes dans la chambre et ajoutez-les à la fraction principale collectée.
2. Traitement des films plastiques par prétraitement cryogénique et broyage
- Récupérez un échantillon de film du rouleau et coupez l’échantillon en bandes de ~120 mm (sens transversal) x 20 mm (direction de la machine) avec un coupe-papier.
- Prétremper les fragments (~1 g) dans 800 mL d’eau désionisée (DI) pendant 10 min dans un bécher en verre de 1000 mL. Cette étape améliore la fragilisation pour la procédure de refroidissement cryogénique ultérieure en prétrempant le polymère.
ATTENTION : Manipulez l’azote liquide avec de l’équipement de sécurité en portant des gants cryogéniques et des lunettes de sécurité. - Ajouter lentement 200 mL d’azote liquide (N2) dans un contenant cryogénique.
- Transférer soigneusement les particules de film prétrempées dans le récipient cryogénique avec une pince à épiler en acier. Prétremper pendant 3 min dans le liquideN2.
- Transférez les fragments de film congelés dans un mélangeur de 200 W à 14 vitesses.
- Traiter le matériau congelé à la vitesse 3 pendant 10 s pour briser la structure du film de verre gelé. Pour favoriser une réduction supplémentaire de la taille, ajouter 400 ml d’eau DI et mélanger la suspension film-eau pendant 5 minutes.
- Transférer la boue dans un entonnoir Büchner avec filtre (maille de 1 μm) et appliquer le vide pendant au moins 1 h.
- Sécher sous vide les particules solides à 30 °C pendant au moins 48 h dans un plat en aluminium.
- Introduire des particules sèches dans le moulin avec une pince à épiler. Pour le fraisage, suivez les étapes 1.1 à 1.11.
3. Traitement des films plastiques prétraités par altération environnementale et broyage
- Disposer les fragments de film plastique récupérés sur le terrain sur une surface lisse (paillasse de laboratoire). Enlevez soigneusement les particules de sol absorbées et les restes de plantes avec la brosse à poils souples.
- Couper le film avec des ciseaux en ~4 cm2 échantillons de ~1,0 g.
- Ajouter des fragments de film dans un bécher de 1000 ml rempli de 500 ml d’eau DI. Remuer à raison de 300 min-1 avec une barre d’agitation de 20 mm pendant 1 h.
- Enlevez les particules de sol dissoutes en décantant et en réintroduisant de l’eau DI sous une légère agitation du bécher dans un évier ou un seau en plastique. Répétez cette étape trois fois. L’agitation continue maintient les particules de sol dispersées dans l’eau et peut être plus facilement décantée.
- Transférer les échantillons du bécher dans un plat en aluminium. Sécher à l’air libre les échantillons de plastique pendant 12 h, puis transférer et sécher dans une étuve à vide pendant 24 h à 30 °C. Pour le fraisage, suivez les étapes 1.1 à 1.11.
4. Procédure de tamisage à travers des tamis en cascade
- Empilez les tamis (3 pouces de diamètre) en commençant par le tamis en bas, suivi du tamis le plus fin (#325; 45 μm), puis des tamis de plus en plus grossiers (tels que #140; 106 μm et #60; 250 μm, où le tamis #20; 840 μm est le plus grossier), et placez le couvercle sur le dessus.
- Montez les quatre tamis sur l’agitateur en insérant quatre broches dans les ouvertures du shaker à tamis.
- Transférer les fractions individuelles collectées à l’étape 1, 2 ou 3 au-dessus des quatre tamis en cascade. Agiter pendant 10 min à 300 min-1.
- Récupérez séparément la plus grande fraction (supérieure), qui sera soumise à un broyage supplémentaire.
REMARQUE: Ajustez la vitesse de secousse sur le vibreur au besoin. Alternativement, secouer les tamis à la main est possible. Utilisez un seul tamis à la fois, en commençant par le tamis en maille #20 : tenez fermement le fond et le couvercle contre le tamis à la main, et secouez axialement et horizontalement pendant 5 min. - Réintroduire des particules tamisées de dp > 106 μm dans le laminoir de coupe rotatif comme décrit aux étapes 1.6-1.10.
- Récupérez les fractions inférieures de la casserole et réintroduisez les particules à la taille de tamis supérieure plus petite. Répétez la procédure jusqu’à ce que les particules de 106 μm représentent la fraction principale.
- Fusionner les fractions de 106 μm collectées et stocker les particules dans un endroit sec (dessiccateur ou sac plastique scellé à l’air).
NOTA : La fraction de 45 μm fait partie de la fraction de 106 μm; Cependant, la première fraction n’a pas été isolée et analysée séparément car le rendement est généralement très faible. Les taux de récupération et les fractions granulométriques des fractions individuelles peuvent être déterminés par des mesures gravimétriques en % en poids pour chaque fraction tamisée (maille #20 - maille #325) par rapport à la fraction d’alimentation initiale à l’aide d’une microbalance de haute précision.
5. Préparation d’une suspension aqueuse de NP pour broyage humide
- Préparer une boue de MP dispersée dans de l’eau DI en ajoutant 800 mL d’eau distillée dans le bécher en verre de 1000 mL et en insérant une barre d’agitation (diamètre = 8 mm, longueur = 50,8 mm).
- Introduire 8 g de la fraction plastique de 106 μm des étapes 1, 2, 3 ou 4 dans l’eau DI, produisant une suspension de 1 % en poids.
- Placer le bécher en verre sur une plaque d’agitation et agiter magnétiquement pendant 24 h à 400 min-1 pour faire tremper les particules dans l’eau afin de favoriser l’adoucissement des particules.
- Transférer les particules dans un contenant en plastique de 1000 mL.
- Remplissez deux contenants de plastique supplémentaires de 1000 ml avec de l’eau DI, qui sera utilisée pour rincer les particules adhérentes sur la trémie du broyeur pendant le processus de broyage.
6. Préparation de la rectifieuse humide pour la production de NP
- Placez les pierres d’une taille de 46 grains (grain d’une meule = 297-420 μm) dans la meuleuse à friction humide et fixez les écrous centraux hermétiquement à la main avec une clé de 17 mm.
- Ajouter la trémie sur le dessus et fixer les trois écrous et boulons avec la clé de 17 mm.
- Placez un pot de collecte en plastique de 1 L sous la sortie du collisionneur. Placez un deuxième seau vide de 1 L à côté de la prise, qui sera utilisé pour l’échange pendant le traitement.
- Réglez le jeu de la jauge à + 1,0, ce qui correspond à un décalage positif de 0,10 μm par rapport à la position zéro.
- Allumez l’appareil et tournez prudemment la roue de réglage dans le sens des aiguilles d’une montre jusqu’à ce que les meules se touchent. Ensuite, réglez la bague de mesure flexible à zéro et tournez immédiatement la roue dans le sens inverse des aiguilles d’une montre. Par défaut, la vitesse est réglée à 1500 min-1.
REMARQUE: Évitez le « broyage à sec » des pierres car cela crée une chaleur excessive sur les meules. - Tournez la roue de réglage dans le sens des aiguilles d’une montre jusqu’à ce que les pierres se touchent et remplissez doucement la boue d’eau NP dans la trémie. Réduire continuellement l’écart jusqu’à une jauge de dégagement de -2,0, ce qui correspond à un décalage négatif de 0,20 μm par rapport à la position zéro après l’introduction de la boue. Les boues de particules de plastique et d’eau entre les deux disques de pierre favorisent la transformation des MP en NP et évitent le frottement direct entre les meules.
- Recueillir le lisier en échangeant les seaux de collecte une fois que le niveau de remplissage dans le seau dépasse 0,5 L.
- Recueillir et réintroduire les particules dans le broyeur entre 30 et 60 fois; Des passages plus élevés (nombre de réintroductions) entraînent des particules plus petites.
- Lavez les particules adhérentes adsorbées sur la trémie avec la bouteille d’eau DI préparée pour permettre un mélange approprié de la boue pendant le traitement.
REMARQUE : Le prélèvement d’échantillons intermédiaires pendant le processus est possible en tenant des flacons en verre de 20 ml dans le flux de sortie. Les étapes individuelles évalueront les mécanismes de fragmentation des particules tandis que la gravité du processus (nombre de passages) augmente. Récupérer le lisier et agiter pendant 4 h à 400 min-1 à 25 °C pour un bon mélange; Laisser reposer le lisier pendant 48 h pour se stabiliser.
7. Récupération et séchage des NP du lisier
- Isoler la fraction inférieure (ou la phase ayant la concentration de NP la plus élevée) si plusieurs couches dans la boue sont observées en versant lentement la boue dans un bécher de verre supplémentaire de 1000 mL.
- Transférer les fractions dans des flacons de centrifugation (50 mL) et centrifuger pendant 10 min (force centrifuge relative [FCR] = 20 x 102 g). La FCR (également appelée force g) est la force radiale générée en fonction du rayon du rotor et de la vitesse du rotor, ce qui provoque la séparation des particules les plus lourdes et de l’eau de la boue.
- Retirez la couche supérieure transparente en la décantant dans une casserole en aluminium séparée.
- Transférer la couche inférieure restante (contenant une suspension de NP) dans une capsule en aluminium supplémentaire et la placer dans un four à vide à 30 °C pendant 48 h.
- Récupérez les matières séchées à l’aide d’une spatule sous une hotte ou une boîte à gants tout en portant un masque respiratoire. Transférer le contenu séché dans un récipient en verre de 100 ml et sceller avec un couvercle.
- Contenir des NP dans un flacon et les conserver dans un endroit hermétique, sec et frais (p. ex. un dessiccateur).
REMARQUE : Les PMN rejetées dans l’environnement pendant le processus de fabrication (ici, soit pendant le processus de broyage humide, soit sous forme de particules séchées) peuvent constituer une grave menace pour les écosystèmes aquatiques et terrestres. En particulier, les mesures réglementaires sont conçues pour minimiser les risques liés à leur production et à leur utilisation pour les nanomatériaux manufacturés30. Par conséquent, la formation de PMN nécessite des mesures de précaution spécifiques telles que la manutention des matériaux dans une hotte ou une boîte à gants. De plus, les solutions de déchets aqueux formées lors de l’isolement des NP (étapes 6.7 à 6.9) feront l’objet d’une procédure d’élimination en fin de vie effectuée par le Service de l’environnement, de la santé et de la sécurité.
8. Imagerie MP par microscopie stéréoscopique
- Disperser ~20 mg de particules (recueillies à l’étape 4) sur une surface de surface ~4cm2. Étalez les députés blancs ou translucides sur une surface sombre et étalez les députés noirs ou de couleur foncée sur un fond blanc (feuille de papier) pour maximiser le contraste de l’arrière-plan.
- Ajustez le microscope au grossissement le plus bas pour capturer la plus grande zone possible (milieu de la zone des particules). Ensuite, dirigez la lampe externe vers le centre de mise au point pour obtenir un éclairage sur les régions d’intérêt.
- Appliquer un grossissement qui permet la détection de particules >50 au milieu du champ de vision. Ce montant est recommandé pour obtenir des résultats d’évaluation statistique robustes.
- Concentrez-vous sur les zones sans chevauchement de particules ou avec un léger contraste de couleur.
- Capturez au moins cinq images représentatives en vous concentrant sur la forme des particules externes. L’ordinateur local utilisé pour l’imagerie enregistre les images haute résolution sous forme de bitmap dans le logiciel.
- Enregistrez les images enregistrées au stéréomicroscope dans un format de fichier reconnu par ImageJ (bitmap, tiff ou jpeg) pour l’analyse quantitative des données suivante.
REMARQUE: Prenez une image de référence aux paramètres d’agrandissement exacts pour lesquels l’image principale a été prise à l’aide d’une règle ou de tout autre objet de référence enregistré dans l’image. Cette procédure permettra un étalonnage facile des images lors de la préparation et de l’analyse via le logiciel ImageJ.
9. Analyse d’images via ImageJ
- Ouvrez le logiciel ImageJ31 et préparez l’importation de fichiers en entrant (CTRL + L) pour ouvrir l’outil de recherche de commandes. Entrez ensuite Bio-Formats dans le coin inférieur droit. Cette fonction active le chemin de menu Fichier > Importer > Bio formats (> fait référence aux étapes de navigation dans le logiciel). Recherchez le répertoire des fichiers image stockés.
Remarque : Si le package Bio-Formats n’apparaît pas dans l’outil de recherche, recherchez en ligne sous Bio-Formats ImageJ. Suivez les instructions pour télécharger et installer ImageJ. L’importateur Bio-Formats permet une gestion simple de l’importation/exportation de fichiers image dans ImageJ et la recherche de commandes. - Ouvrez l’image (ou importez les bioformats comme décrit à l’étape 9.1) en cliquant sur Fichier > Ouvrir > sélectionnez l’image de particules à l’emplacement du fichier collecté à l’étape 4.7 et l’image de référence de règle décrite à l’étape 1.6. Il est recommandé de créer une image dupliquée en cliquant sur Maj + Commande + D pour comparer avec l’image d’origine tout en ajustant les paramètres de seuil de l’image copiée.
Remarque : File > commande Open ouvre différents formats pris en charge en mode natif par ImageJ comme décrit à l’étape 8.7. Vous pouvez également sélectionner l’emplacement de l’image sur l’ordinateur et glisser-déposer le fichier dans la barre d’état principale de la fenêtre ImageJ. Le fichier image s’ouvrira automatiquement dans une fenêtre séparée. - Effectuez un zoom avant et arrière sur l’image à l’aide des touches CTRL + et CTRL -, respectivement.
- Définissez les mesures en cliquant sur Analyser > Définir les mesures, puis sélectionnez Descripteurs de zone et de forme comme valeurs par défaut.
- Définissez la barre d’échelle en traçant une ligne droite sur la longueur de la barre d’échelle à l’aide de l’image de référence de la règle, comme décrit à l’étape 8. Appuyez sur Analyser > Définir l’échelle, puis entrez la valeur numérique de la longueur de barre sous Distance connue et l’unité de la longueur correspondante.
- Visualisez la barre d’échelle de l’image en cliquant sur Outils d’analyse > > Barre d’échelle, puis ajustez les paramètres tels que l’affichage d’un contraste net sur l’image. Sélectionnez une position sur l’image où la barre d’échelle doit être placée pour les paramètres de la barre d’échelle. Sélectionnez Largeur pour ajuster la barre en unités calibrées, Hauteur de la barre en pixels et Taille de police de l’étiquette de la barre d’échelle. Sélectionnez l’arrière-plan pour ajuster la couleur de remplissage de la zone de texte de l’étiquette.
NOTE: Pour les micromètres, l’entrée de μm est suffisante; Le programme adapte automatiquement μm dans la sortie de données. - Transformez l’image en image 8 bits en sélectionnant Image > Type > 8 bits.
- Convertissez l’image copiée en 8 bits en sélectionnant Image > Type > 8 bits.
- Ajustez en sélectionnant Image > Ajuster > seuil > définir (comparer la taille à l’image d’origine).
- Déterminez les mesures à prendre en sélectionnant Analyser > Définir les mesures.
- Sélectionnez Analyser les particules > 0-infini, cliquez sur Afficher les résultats, puis afficher in situ.
- Stockez les résultats du retour sur investissement (.zip) sous Enregistrer les mesures et sélectionner un dossier.
- Enregistrer les résultats (*.csv) sous Fichier > Enregistrer sous > Sélectionner un dossier.
10. Calcul du diamètre des particules (dp) et du facteur de forme dans un tableur
NOTE: La connaissance du diamètre et des facteurs de forme des particules est essentielle pour le comportement des particules (devenir, transport) dans l’environnement et la détermination de la surface. Par conséquent, la géométrie est essentielle lorsque les MP sont utilisés pour des études environnementales. Par exemple, différents mécanismes d’interaction avec le sol ont été observés en fonction de la taille et de la forme des MP, tels que les agglomérations MP-MP et MP-sol, qui influencent le mouvement des particules dans le sol15,32. Par conséquent, les étapes suivantes sont suggérées pour déterminer la distribution granulométrique dp et le paramètre géométrique.
- Importez le fichier *.csv correspondant obtenu et enregistré à partir de l’analyse ImageJ (étape 9.13) dans le tableur.
NOTE: Les valeurs numériques de chaque ligne de colonne reflètent les calculs individuels pour chaque particule conformément aux équations 1 et 2. - Évaluez les valeurs moyennes des paramètres de forme telles que la circularité (CIR) et le rapport hauteur / largeur (AR) en entrant = moyenne (x,y) au bas de chaque colonne, où x représente la première ligne et y la dernière ligne de la colonne, puis appuyez sur Entrée. Les valeurs CIR décrivent la relation entre l’aire projetée et le cercle parfait avec le CIR d’une particule individuelle = 1 (équation 1). Le RA représente le rapport longueur/largeur des particules décrit par l’équation 2.
- Déterminez si le RA moyen < de 2,5, puis calculez lesvaleurs p dans une nouvelle colonne à l’aide de l’équation 3. Si le RA ≥ 2,5, calculez dp valeurs reflétant l’équation 4. Ajoutez une nouvelle colonne pour calculer dp en fonction de la colonne de surface reçue de la sortie ImageJ.
REMARQUE : La sélection des valeurs seuils de RA ≥ 2,5 représente davantage de particules de forme rectangulaire, tandis que la < 2,5 reflète davantage de particules de forme ronde. Cette sélection permet de minimiser l’erreur de calcul dp dérivée de la zone mesurée par microscopie et déterminée par ImageJ.
(1)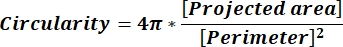
(2)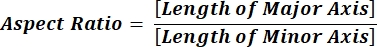
(3)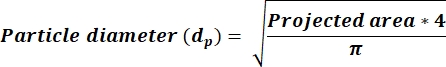
(4)
11. Analyse statistique pour les députés et les IP
- Ouvrez le fichier de données *.csv avec le logiciel statistique par Fichier > Ouvrir > Sélectionnez l’emplacement du fichier correspondant tel que créé à l’étape 9.13.
REMARQUE : Alternativement, le tableau peut être directement transféré via la fonction copier-coller dans le logiciel statistique. Reportez-vous au tableau des matériaux pour connaître la marque et la version du logiciel statistique Modifier > Coller avec les noms de colonne. - Évaluez les données dp en sélectionnant Analyser > distribution.
- Sélectionnez dp, qui reflète les données de la colonne, glissez-déposez dans les colonnes Y, puis appuyez sur le bouton OK. Cette fonctionnalité crée un histogramme avec une sortie statistique comprenant les valeurs Summary Statistics, Average et Std Dev dans une fenêtre distincte.
- Évaluez si l’histogramme suit une distribution normale (ou le meilleur ajustement pour d p) avec la courbe de meilleur ajustement en sélectionnant le triangle en regard de d p > ajustement continu, puis sélectionnez la courbe reçue comme meilleur ajustement (par exemple, ajuster la normale). Cette étape superpose l’histogramme avec un ajustement normalement distribué.
- Déterminez et rapportez les valeurs moyennes et d’écart-type à partir des statistiques récapitulatives des valeurs moyennes des paramètres de forme de circularité (Cir), de rapport d’aspect (AR), d’arrondi (arrondi) et de solidité (Sol).
REMARQUE : Un seuil de signification statistique de α = 0,05 est recommandé et a été utilisé pour toutes les évaluations. Le niveau de signification est la probabilité de rejeter l’hypothèse nulle lorsqu’elle est vraie lors de la comparaison des résultats numériques.
12. Meilleur ajustement de la distribution granulométrique dp et des facteurs de forme des particules
- Chargez l’ensemble de données dans un logiciel statistique et utilisez le même ensemble de données *.csv pour la distribution de dp telle que calculée à l’étape 10.
- Sélectionnez Analyser > Fiabilité et Survie > Distribution de la vie.
- Faites glisser la colonne dp vers le champ Y, Time to Event, puis sélectionnez OK. Cette fonction crée une sortie avec un diagramme de probabilité en fonction de dp.
- Déterminez la distribution optimale sous Comparer les distributions en cochant Non paramétrique, Lognormal, Weibull, Loglogistique et Normal.
- Évaluez la qualité du modèle en fonction des valeurs numériques les plus basses pour les critères d’information d’Akaike et de Bayésien (AIC et BIC, respectivement) dans le tableau de comparaison des modèles statistiques sous le graphique par les nombres BIC les plus bas. Le modèle le mieux ajusté est présenté par défaut dans la première ligne. Les champs de sortie de l’estimation paramétrique ou non paramétrique pour chaque évaluation de distribution se trouvent sous le graphique Comparer les distributions .
- Enregistrez le script de sortie dans la table de données en sélectionnant le triangle déroulant rouge dans le coin supérieur gauche par Save Script > To Data Table (Enregistrer le script dans la table de données). Ensuite, enregistrez la table de données d’origine dans l’emplacement de fichier souhaité en sélectionnant Fichier > Enregistrer sous > *.jmp.
13. Caractérisation dimensionnelle des NP par diffusion dynamique de la lumière
- Démarrez le logiciel de diffusion dynamique de la lumière (DLS) en double-cliquant sur l’icône du bureau. Sélectionnez Fichier > Nouvelle > SOP. Ajoutez le nom de l’échantillon et sélectionnez l’indice de réfraction du matériau à 1,33 pour l’eau distillée et à 1,59 pour les polymères33 dans le logiciel DLS sous Configuration de l’échantillon. Sélectionnez Matériau dans le menu déroulant, puis cliquez sur OK.
REMARQUE: Cliquez sur le menu déroulant pour ouvrir le Gestionnaire de matériaux, qui propose d’ajouter de nouveaux échantillons ou de modifier des échantillons existants en modifiant l’indice de réfraction et l’absorption. Sélectionnez comme dispersant Eau. - Sélectionnez la cellule appropriée sous Cellule > Type de cellule et sélectionnez Rapports pour déterminer quelle sortie sera présentée après chaque mesure.
- Démarrez l’instrument en fermant le couvercle de l’instrument et en allumant le système en fermant le couvercle (s’il est ouvert) et en appuyant sur le bouton ON . Attendez après le premier bip et attendez environ 30 minutes pour permettre la stabilisation du faisceau.
- Attendez que la routine d’initialisation soit terminée et attendez un deuxième bip sonore, indiquant que la température préréglée (généralement 25 °C) a été atteinte.
- Préparer un échantillon de boue de NP (tel que reçu à l’étape 7) et d’eau DI dans un flacon de 15 mL à une concentration de ~0,1 % en poids en agitant magnétiquement pendant ~1 h pour permettre de bien mélanger.
- Agiter la boue avant de transférer ~1,0 mL dans la cuvette de quartz de 4,5 mL et ouvrir le couvercle. Ensuite, insérez soigneusement la cellule d’échantillon dans le porte-échantillon de l’instrument DLS.
NOTA : Préparer trois échantillons du même lot de lisier à la même concentration que celle décrite à l’étape 13.5. - Effectuer trois mesures (sélection dans le logiciel DLS) pour chaque échantillon. Entre les mesures, retirer la cellule d’échantillon et agiter doucement les échantillons pendant 5 s pour permettre le mélange de l’échantillon.
- Extrayez et exportez des données au moyen du logiciel DLS, transférez l’ensemble de données dans le tableur et créez des histogrammes pour les députés et les IP comme décrit aux étapes 11.1 à 11.5 (Figure 1). Copiez à partir de l’onglet Vue des enregistrements un tableau ou un graphique en sélectionnant Modifier-copier, qui peut être collé dans une autre application telle que le tableur.
14. Analyse chimique des PMN à l’aide de la réflectance totale atténuée par spectrométrie infrarouge à transformée de Fourier (FTIR)
NOTE: Les analyses chimiques des MNP par spectroscopies infrarouges à transformation de Fourier (FTIR) et par résonance magnétique nucléaire (RMN) sont des outils bien adaptés pour évaluer l’impact du broyage humide sur les propriétés de liaison chimique, ainsi que les quantités relatives de composants majeurs et de constituants monomères des polymères, respectivement10. En outre, les propriétés thermiques et la stabilité des constituants polymères des MNP peuvent être évaluées par calorimétrie différentielle à balayage (DSC) et analyse thermogravimétrique (TGA), respectivement29.
- Nettoyez le système de détection (surface cristalline ATR) avec de l’éthanol et un chiffon non pelucheux.
- Démarrez le logiciel et appuyez sur le bouton d’arrière-plan dans la barre de commandes pour effectuer un balayage en arrière-plan dans les airs en effaçant le trajet du faisceau d’instruments. Le spectre d’arrière-plan est affiché peu de temps après la collecte.
- Entrez l’ID de l’échantillon et la Description de l’échantillon dans la barre d’outils des paramètres de l’instrument.
- Ajustez le nombre d’onde spectrale entre 4000 cm-1 et 600 cm-1 et sélectionnez une résolution de 2,0 cm-1 en mode absorbance. Sélectionnez 32 balayages par spectre et commencez.
- Placer un échantillon de plastique (~20 mg ou ~ 1-3 mm3) de MPs (106 μm) et de NP (~300 nm) à l’intérieur d’une rondelle en acier d’un diamètre intérieur de ~10 mm, ou équivalent, sur la surface du cristal.
REMARQUE: La rondelle empêche la dispersion sur le cristal lorsque le porte-échantillon comprime l’échantillon, ce qui entraîne des inhomogénéités matérielles et un biais de données en raison de mesures incohérentes. - Placez la rondelle au centre du cristal ATR et ajoutez l’échantillon de polymère au milieu de l’ouverture de la rondelle à l’aide d’une spatule.
- Faites pivoter le levier d’échantillon au-dessus au centre de l’échantillon et tournez le bouton dans le sens des aiguilles d’une montre en surveillant la force de jauge de force comprise entre 50 et 90. L’échantillon montre les spectres préliminaires. Appuyez une seconde fois sur le bouton Scan pour collecter le spectre.
- Prélevez entre 8 et 10 spectres en cliquant sur le bouton Scanner et mélangez soigneusement les échantillons après chaque mesure avec une spatule pour permettre la collecte de résultats représentatifs.
- Cliquez sur le dossier Sample View dans l’explorateur de données pour afficher tous les échantillons collectés superposés dans la zone de visualisation. Tout d’abord, supprimez les spectres significativement déviants représentant les valeurs aberrantes. Ensuite, sélectionnez le mode Absorbance ou Transmittance dans la barre d’outils.
- Enregistrez les spectres en sélectionnant le dossier Exemple de vue contenant les spectres et en sélectionnant Enregistrer sous dans le menu Fichier. La fenêtre de dialogue active le nom de fichier, le répertoire de destination et la modification de l’emplacement par défaut pour tous les spectres.
REMARQUE: Alternativement, les spectres peuvent être enregistrés en tant que fichier *.sp en sélectionnant un spectre et en cliquant avec le bouton droit de la souris pour afficher l’option binaire. Sélectionnez Enregistrer le fichier binaire et parcourez l’emplacement d’enregistrement final. - Effectuez la correction de la ligne de base et la normalisation moyenne en sélectionnant un seul spectre dans l’Explorateur de données en sélectionnant Processus > Normalisation dans le menu via le logiciel ou à l’étape suivante.
REMARQUE : La normalisation moyenne compense les erreurs spectrales dues à l’épaisseur ou à la variation du matériau dans l’échantillon. - Nettoyez la zone cristalline avec de l’éthanol et un chiffon non pelucheux à la fin de la collecte des données.
- Interpréter les différences entre les MP et les IP en fonction des bandes de vibrations FTIR assignées, attribuées et évaluées dans une publication précédente10.
Résultats
Pour valider la méthode et l’analyse de la procédure expérimentale, des MP et des NP ont été formés à partir de granulés et de matériaux de film et comparés par taille et forme à l’aide d’images microscopiques. La méthode décrite à la figure 1 a permis de former efficacement des MP et des NP à partir de granulés et de films plastiques biodégradables; Ceci a été réalisé grâce au refroidissement cryogénique, au broyage, au broyage humide et à la caractérisation. ...
Discussion
Cette méthode décrit un procédé efficace initialement décrit dans une publication précédente29, pour préparer des MNP provenant de granulés et de films de paillis pour des études environnementales. Le processus de réduction de la taille impliquait un refroidissement cryogénique (pour film seulement), un broyage à sec et des étapes de broyage humide, pour fabriquer des MNP modèles. Nous avons appliqué cette méthode pour préparer des MNP à partir d’une large gamme de matières p...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Cette recherche a été financée par le Herbert College of Agriculture, le Biosystems Engineering and Soil Department et la Science Alliance de l’Université du Tennessee, Knoxville. En outre, les auteurs remercient le soutien financier fourni par le biais de la subvention USDA 2020-67019-31167 pour cette recherche. Les matières premières initiales pour la préparation des PMN de film de paillis biodégradable à base de PBAT ont été aimablement fournies par BioBag Americas, Inc. (Dunevin, FL, États-Unis) et les granulés PBAT par Mobius, LLC (Lenoir City, TN).
matériels
| Name | Company | Catalog Number | Comments |
| Aluminum dish, 150 mL | Fisher Scientific, Waltham, MA, USA | 08-732-103 | Drying of collected NPs |
| Aluminum dish, 500 mL | VWR International, Radnor, PA, USA | 25433-018 | Collecting NPs after wet-grinding |
| Centrifuge | Fisher Scientific, Waltham, MA, USA | Centrific 228 | Container for centrifugation |
| Delivery tube, #20, 840 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M30 | Sieving of the first fraction during milling |
| Delivery tube, #60, 250 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M45 | Sieving of the second fraction (3x) during milling |
| Thermomixer, 5350 Mixer | Eppendorf North America, Enfield, CT, USA | 05-400-200 | Analysis of sieving experiments |
| FT-IR Spectrum Two, spectrometer with attenuated total reflectance (ATR) | Perkin Elmer, Waltham, MA, USA | L1050228 | Measuring FTIR spectra |
| Glass beaker, 1000 mL | DWK Life Sciences, Milville, NJ, USA | 02-555-113 | Stirring of MPs-water slurry before grinding |
| Glass front plate | Thomas Scientific, Swedesboro, NJ, USA | 3383N55 | Front cover plaste for Wiley Mini Mill |
| Glass jar, 50 mL | Uline, Pleasant Prairie, WI, USA | S-15846P | Collective MPs after milling |
| Glove Box, neoprene | Bel-Art-SP Scienceware, Wayne, NJ, USA | BEL-H500290000 | 22-Inch, Size 10 |
| Zetasizer Nano ZS 90 size analyzer | Malvern Panalytical, Worcestershire, UK | Zetasizer Nano ZS | Measuring nanoplastics dispersed in DI-water |
| Microscope camera | Nikon, Tokyo, 108-6290, Japan | Nikon Digital Sight 10 | Combined with Olympus microscope to receive digital images |
| Microscope | Olympus, Shinjuku, Tokyo, Japan | Model SZ 61 | Imaging of MPs |
| Nitrogen jar, low form dewar flasks | Cole-Palmer, Vernon Hills, IL, USA | UX-03771-23 | Storage of liquid nitrogen during cryogenic cooling |
| Accurate Blend 200, 12-speed blender | Oster, Boca Raton, FL, USA | 6684 | Initiating the size reduction of cryogenically treated plastic film |
| PBAT film, - BioAgri™ (Mater-Bi®) | BioBag Americas, Inc, Dunedin, FL, USA | 0.7 mm thick | Feedstock to form MPs and NPs, agricultural mulch film |
| PBAT pellets | Mobius, LLC, Lenoir City, TN, USA | Diameter 3 mm | Feedstock to form microplastics (MPs) and nanoplastics (NPs) trough milling and grinding |
| Plastic centrifuge tubes, 50 mL | Fisher Scientific, Waltham, MA, USA | 06-443-18 | Centrifugation of slurry after wet-grinding |
| Plastic jar, 1000 mL, pre-cleaned, straight sided | Fisher Scientific, Waltham, MA, USA | 05-719-733 | Collection of NPs during and after wet grinding |
| Polygon stir bars, diameterø=8 mm, length=50.8 mm | Fisher Scientific, Waltham, MA, USA | 14-512-127 | Stirring of MPs slurry prior to wet-grinding |
| Scissors, titanium bonded | Westcott, Shelton, CT, USA | 13901 | Cutting of initial PBAT film feedstocks |
| Square glass cell with square aperture and cap, 12 mm O.D. | Malvern Panalytical, Worcestershire, UK | PCS1115 | Measuring of NPs particle size |
| Stainless steel bottom, 3 inch, pan | Hogentogler & Co. Inc, Columbia, MD, USA | 8401 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 140 (106 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1308 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 20 (850 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1296 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 325 (45 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1313 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 60 (250 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1303 | Sieving of MPs after Wiley-milling |
| Stainless steel top cover, 3 inch | Hogentogler & Co. Inc, Columbia, MD, USA | 8406 | Sieving of MPs after Wiley-milling |
| Stainless steel tweezers | Global Industrial, Port Washington, NY, USA | T9FB2264892 | Transferring of frozen film particles from jar into blender |
| Vacuum oven, model 281A | Fisher Scientific, Waltham, MA, USA | 13-262-50 | Vacuum oven to dry NPs after wet-grinding |
| Friction grinding machine, Supermass Colloider | Masuko Sangyo, Tokyo, Japan | MKCA6-2J | Grinding machine to form NPs from MPs |
| Wet-grinding stone, grit size: 297 μm -420 μm | Masuko Sangyo, Tokyo, Japan | MKE6-46DD | Grinding stone to form NPs from MPs |
| Wiley Mini Mill, rotary cutting mill | Thomas Scientific, Swedesboro, NJ, USA | NC1346618 | Size reduction of pellets and film into MPs and NPs |
| Software | |||
| FTIR-Spectroscopy software | Perkin Elmer, Waltham, MA, USA | Spectrum 10 | Collection of spectra from the initial plastic, MPs and NPs |
| Image J, image processing program | National Institutes of Health, Bethesda, MD, USA | Version 1.53n | Analysis of digital images received from microscopy |
| Microscope software, ds-fi1 software | Malvern Panalytical , Malvern, UK | Firmware DS-U1 Ver3.10 | Recording of digital images |
| Microsoft, Windows, Excel 365, spreadsheet software | Microsoft, Redmond, WA, USA | Office 365 | Calculating the average particle size and creating FTIR spectra images |
| JMP software, statistical software | SAS Institute Inc., Cary, NC, 1989-2021 | Version 15 | Statistical analysis of particle size and perform best fit of data set |
| Unscrambler software | Camo Analytics, Oslo, Norway | Version 9.2 | Normalizing and converting FTIR spectra into .csv fromat |
Références
- Jin, Z., Dan, L. Review on the occurrence, analysis methods, toxicity and health effects of micro-and nano-plastics in the environment. Environmental Chemistry. (1), 28-40 (2021).
- Kumar, M., et al. Current research trends on micro-and nano-plastics as an emerging threat to global environment: a review. Journal of Hazardous Materials. 409, 124967 (2021).
- Alimba, C. G., Faggio, C., Sivanesan, S., Ogunkanmi, A. L., Krishnamurthi, K. Micro (nano)-plastics in the environment and risk of carcinogenesis: Insight into possible mechanisms. Journal of Hazardous Materials. 416, 126143 (2021).
- Serrano-Ruiz, H., Martin-Closas, L., Pelacho, A. M. Biodegradable plastic mulches: Impact on the agricultural biotic environment. Science of The Total Environment. 750, 141228 (2021).
- Hayes, D. G., et al. Biodegradable plastic mulch films for sustainable specialty crop production. Polymers for Agri-Food Applications. , 183-213 (2019).
- Viaroli, S., Lancia, M., Re, V. Microplastics contamination of groundwater: Current evidence and future perspectives. A review. Science of The Total Environment. , 153851 (2022).
- Rillig, M. C., Lehmann, A. Microplastic in terrestrial ecosystems. Science. 368 (6498), 1430-1431 (2020).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. Journal of Polymers and the Environment. 29 (9), 2916-2931 (2021).
- Yang, Y., et al. Kinetics of microplastic generation from different types of mulch films in agricultural soil. Science of The Total Environment. 814, 152572 (2022).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Schwaferts, C., Niessner, R., Elsner, M., Ivleva, N. P. Methods for the analysis of submicrometer-and nanoplastic particles in the environment. TrAC Trends in Analytical Chemistry. 112, 52-65 (2019).
- Gigault, J., et al. Current opinion: what is a nanoplastic. Environmental Pollution. 235, 1030-1034 (2018).
- Naqash, N., Prakash, S., Kapoor, D., Singh, R. Interaction of freshwater microplastics with biota and heavy metals: a review. Environmental Chemistry Letters. 18 (6), 1813-1824 (2020).
- Manzoor, S., Naqash, N., Rashid, G., Singh, R. Plastic material degradation and formation of microplastic in the environment: A review. Materials Today: Proceedings. , 3254-3260 (2022).
- de Souza Machado, A. A., et al. Impacts of microplastics on the soil biophysical environment. Environmental Science & Technology. 52 (17), 9656-9665 (2018).
- Jacques, O., Prosser, R. A probabilistic risk assessment of microplastics in soil ecosystems. Science of The Total Environment. 757, 143987 (2021).
- Kwak, J. I., An, Y. -. J. Microplastic digestion generates fragmented nanoplastics in soils and damages earthworm spermatogenesis and coelomocyte viability. Journal of Hazardous Materials. 402, 124034 (2021).
- Wahl, A., et al. Nanoplastic occurrence in a soil amended with plastic debris. Chemosphere. 262, 127784 (2021).
- Vighi, M., et al. Micro and nano-plastics in the environment: research priorities for the near future. Reviews of Environmental Contamination and Toxicology Volume 257. , 163-218 (2021).
- Pironti, C., et al. Microplastics in the environment: intake through the food web, human exposure and toxicological effects. Toxics. 9 (9), 224 (2021).
- Zurier, H. S., Goddard, J. M. Biodegradation of microplastics in food and agriculture. Current Opinion in Food Science. 37, 37-44 (2021).
- Horton, A. A., Dixon, S. J. Microplastics: An introduction to environmental transport processes. Wiley Interdisciplinary Reviews: Water. 5 (2), 1268 (2018).
- Panno, S. V., et al. Microplastic contamination in karst groundwater systems. Groundwater. 57 (2), 189-196 (2019).
- Su, Y., et al. Delivery, uptake, fate, an transport of engineered nanoparticles in plants: a critical review and data analysis. Environmental Science: Nano. 6 (8), 2311-2331 (2019).
- Yu, Y., Griffin-LaHue, D. E., Miles, C. A., Hayes, D. G., Flury, M. Are micro-and nanoplastics from soil-biodegradable plastic mulches an environmental concern. Journal of Hazardous Materials Advances. 4, 100024 (2021).
- Hayes, D. G. Enhanced end-of-life performance for biodegradable plastic mulch films through improving standards and addressing research gaps. Current Opinion in Chemical Engineering. 33, 100695 (2021).
- Qin, M., et al. A review of biodegradable plastics to biodegradable microplastics: Another ecological threat to soil environments. Journal of Cleaner Production. 312, 127816 (2021).
- Phuong, N. N., et al. Is there any consistency between the microplastics found in the field and those used in laboratory experiments. Environmental Pollution. 211, 111-123 (2016).
- Astner, A., et al. Mechanical formation of micro-and nano-plastic materials for environmental studies in agricultural ecosystems. Science of The Total Environment. 685, 1097-1106 (2019).
- Rist, S., Hartmann, N. B. Aquatic ecotoxicity of microplastics and nanoplastics: lessons learned from engineered nanomaterials. Freshwater Microplastics. , 25-49 (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Raju, S., et al. Improved methodology to determine the fate and transport of microplastics in a secondary wastewater treatment plant. Water Research. 173, 115549 (2020).
- Caputo, F., et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: addressing some analytical challenges in the sub-micron size range. Journal of Colloid and Interface Science. 588, 401-417 (2021).
- Xu, M., et al. Polystyrene microplastics alleviate the effects of sulfamethazine on soil microbial communities at different CO2 concentrations. Journal of Hazardous Materials. 413, 125286 (2021).
- Ding, L., et al. Insight into interactions of polystyrene microplastics with different types and compositions of dissolved organic matter. Science of The Total Environment. 824, 153883 (2022).
- Abbasimaedeh, P., Ghanbari, A., O'Kelly, B. C., Tavanafar, M., Irdmoosa, K. G. Geomechanical behaviour of uncemented expanded polystyrene (EPS) beads-clayey soil mixtures as lightweight fill. Geotechnics. 1 (1), 38-58 (2021).
- Li, Z., Li, Q., Li, R., Zhou, J., Wang, G. The distribution and impact of polystyrene nanoplastics on cucumber plants. Environmental Science and Pollution Research. 28 (13), 16042-16053 (2021).
- Sobhani, Z., Panneerselvan, L., Fang, C., Naidu, R., Megharaj, M. Chronic and transgenerational effects of polystyrene microplastics at environmentally relevant concentrations in earthworms (Eisenia fetida). Environmental Toxicology and Chemistry. 40 (8), 2240-2246 (2021).
- Lionetto, F., Esposito Corcione, C., Rizzo, A., Maffezzoli, A. Production and characterization of polyethylene terephthalate nanoparticles. Polymers. 13 (21), 3745 (2021).
- Dümichen, E., et al. Analysis of polyethylene microplastics in environmental samples, using a thermal decomposition method. Water Research. 85, 451-457 (2015).
- Robotti, M., et al. Attrition and cryogenic milling production for low pressure cold gas spray and composite coatings characterization. Advanced Powder Technology. 27 (4), 1257-1264 (2016).
- Ducoli, S., et al. A different protein corona cloaks "true-to-life" nanoplastics with respect to synthetic polystyrene nanobeads. Environmental Science: Nano. 9 (4), 1414-1426 (2022).
- El Hadri, H., Gigault, J., Maxit, B., Grassl, B., Reynaud, S. Nanoplastic from mechanically degraded primary and secondary microplastics for environmental assessments. NanoImpact. 17, 100206 (2020).
- Eitzen, L., et al. The challenge in preparing particle suspensions for aquatic microplastic research. Environmental research. 168, 490-495 (2019).
- Ekvall, M. T., et al. Nanoplastics formed during the mechanical breakdown of daily-use polystyrene products. Nanoscale advances. 1 (3), 1055-1061 (2019).
- Caldwell, J., et al. Fluorescent plastic nanoparticles to track their interaction and fate in physiological environments. Environmental Science: Nano. 8 (2), 502-513 (2021).
- Zeb, A., et al. Evaluating the knowledge structure of micro-and nanoplastics in terrestrial environment through scientometric assessment. Applied Soil Ecology. 177, 104507 (2022).
- Ji, Z., et al. Effects of pristine microplastics and nanoplastics on soil invertebrates: A systematic review and meta-analysis of available data. Science of The Total Environment. 788, 147784 (2021).
- de Alkimin, G. D., Gonçalves, J. M., Nathan, J., Bebianno, M. J. Impact of micro and nanoplastics in the marine environment. Assessing the Effects of Emerging Plastics on the Environment and Public Health. , 172-225 (2022).
- Pires, A., Cuccaro, A., Sole, M., Freitas, R. Micro (nano) plastics and plastic additives effects in marine annelids: A literature review. Environmental Research. , 113642 (2022).
- Hurley, R. R., Nizzetto, L. Fate and occurrence of micro (nano) plastics in soils: Knowledge gaps and possible risks. Current Opinion in Environmental Science & Health. 1, 6-11 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon