È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Formare micro e nanoplastiche da film plastici agricoli per l'impiego negli studi di ricerca fondamentale
In questo articolo
Riepilogo
Mostriamo la formazione e la caratterizzazione dimensionale di micro e nanoplastiche (MP e NP, rispettivamente) utilizzando un processo graduale di fresatura meccanica, rettifica e analisi di imaging.
Abstract
Le microplastiche (MP) e le nanoplastiche (NP) disperse negli ecosistemi agricoli possono rappresentare una grave minaccia per il biota nel suolo e nei corsi d'acqua vicini. Inoltre, sostanze chimiche come i pesticidi adsorbiti dalle NP possono danneggiare gli organismi del suolo e potenzialmente entrare nella catena alimentare. In questo contesto, le materie plastiche utilizzate in agricoltura come le pellicole di pacciamatura di plastica contribuiscono in modo significativo all'inquinamento da plastica negli ecosistemi agricoli. Tuttavia, la maggior parte degli studi fondamentali sul destino e l'ecotossicità impiegano materiali MP idealizzati e scarsamente rappresentativi, come le microsfere di polistirolo.
Pertanto, come descritto nel presente documento, abbiamo sviluppato una procedura multifase su scala di laboratorio per formare meccanicamente MP e NP rappresentativi per tali studi. Il materiale plastico è stato preparato da film di pacciamatura plastica disponibili in commercio di polibutirrato adipato-co-tereftalato (PBAT) che sono stati infragiliti attraverso un trattamento criogenico (CRYO) o atmosferico ambientale (W) e da pellet PBAT non trattati. I materiali plastici sono stati poi trattati mediante fresatura meccanica per formare MP con una dimensione di 46-840 μm, imitando l'abrasione dei frammenti plastici da parte di macchinari eolici e meccanici. I parlamentari sono stati quindi setacciati in diverse frazioni di dimensioni per consentire ulteriori analisi. Infine, la frazione di setaccio da 106 μm è stata sottoposta a macinazione a umido per generare NP di 20-900 nm, un processo che imita il lento processo di riduzione delle dimensioni per i MP terrestri. Le dimensioni e la forma per i MP sono state determinate attraverso l'analisi delle immagini di stereomicrografie ed è stata impiegata la diffusione dinamica della luce (DLS) per valutare la dimensione delle particelle per le NP. MP e NP formati attraverso questo processo possedevano forme irregolari, che è in linea con le proprietà geometriche dei MP recuperati dai campi agricoli. Nel complesso, questo metodo di riduzione delle dimensioni si è dimostrato efficace per formare MP e NP composti da plastiche biodegradabili come il polibutilene adipato-co-tereftalato (PBAT), che rappresenta materiali di pacciamatura utilizzati per la produzione di colture agricole speciali.
Introduzione
Negli ultimi decenni, il rapido aumento della produzione globale di plastica e lo smaltimento improprio e la mancanza di riciclaggio per i rifiuti di plastica hanno portato a un inquinamento ambientale che ha avuto un impatto sugli ecosistemi marini e terrestri 1,2,3. I materiali plastici sono essenziali per l'agricoltura contemporanea, in particolare per coltivare ortaggi, piccoli frutti e altre colture speciali. Il loro utilizzo come film per pacciamatura, coperture a tunnel alti e bassi, nastro antigoccia e altre applicazioni mirano a migliorare la resa e la qualità delle colture, ridurre i costi di produzione e promuovere metodi agricoli sostenibili 4,5. Tuttavia, l'espansione dell'impiego della "plasticoltura" ha sollevato preoccupazioni sulla formazione, la distribuzione e la ritenzione di pezzi di plastica negli ambienti agricoli. Dopo un processo di frammentazione continuo causato dall'infragilimento attraverso il degrado ambientale durante la vita di servizio, frammenti di plastica più grandi formano micro e nanoplastiche (MNP), che persistono nel suolo o migrano verso i corsi d'acqua adiacenti attraverso il deflusso dell'acqua e il vento 6,7,8. Fattori ambientali come la radiazione ultravioletta (UV) attraverso la luce solare, le forze meccaniche dell'acqua e i fattori biologici innescano l'infragilimento plastico di materie plastiche disperse nell'ambiente, con conseguente scomposizione di frammenti di plastica più grandi in particelle macro o meso-plastiche 9,10. Un'ulteriore deframmentazione forma microplastiche (MP) e nanoplastiche (NP), riflettendo particelle di dimensioni medie (diametro nominale; dp) di 1-5000 μm e 1-1000 nm, rispettivamente11. Tuttavia, il limite superiore dp per le NP (cioè un limite inferiore per i parlamentari) non è universalmente concordato e in diversi articoli, questo è elencato come 100 nm12.
Gli MNP provenienti dai rifiuti di plastica rappresentano una minaccia globale emergente per la salute del suolo e i servizi ecosistemici. L'adsorbimento di metalli pesanti dall'acqua dolce da parte dei parlamentari ha portato a una concentrazione di metalli pesanti 800 volte superiore rispetto all'ambiente circostante13. Inoltre, i parlamentari negli ecosistemi acquatici pongono molteplici fattori di stress e contaminanti alterando la penetrazione della luce, causando l'esaurimento dell'ossigeno e causando l'adesione a vari bioti, compresa la penetrazione e l'accumulo negli organismi acquatici14.
Studi recenti suggeriscono che i MNP possono avere un impatto sulla geochimica del suolo e sul biota, comprese le comunità microbiche e le piante15,16,17. Inoltre, le NP minacciano la rete alimentare17,18,19,20. Poiché gli MNP subiscono facilmente il trasporto verticale e orizzontale nel suolo, possono trasportare contaminanti assorbiti come pesticidi, plastificanti e microrganismi attraverso il suolo nelle acque sotterranee o negli ecosistemi acquatici come fiumi e torrenti21,22,23,24. Le materie plastiche agricole convenzionali come i film per pacciamatura sono realizzate in polietilene, che deve essere rimosso dal campo dopo l'uso e smaltito nelle discariche. Tuttavia, la rimozione incompleta porta ad un sostanziale accumulo di detriti plastici nei terreni 9,25,26. In alternativa, i pacciami di plastica biodegradabili del suolo (BDM) sono progettati per essere lavorati nel terreno dopo l'uso, dove si degraderanno nel tempo. Tuttavia, i BDM persistono temporaneamente nel suolo e gradualmente si degradano e si frammentano in MP e NP 9,27.
Molti attuali studi ecotossicologici ambientali e sul destino impiegano materiali modello di MP e NP idealizzati e non rappresentativi. I MNP surrogati più comunemente usati sono micro o nanosfere di polistirene monodisperse, che non riflettono gli MNP effettivi che risiedono nell'ambiente12,28. Di conseguenza, la selezione di parlamentari e NP non rappresentativi può comportare misurazioni e risultati imprecisi. Sulla base della mancanza di modelli ΜNP appropriati per gli studi ambientali terrestri, gli autori sono stati motivati a preparare tali modelli da materie plastiche agricole. Abbiamo precedentemente riferito sulla formazione di MNP da BDM e pellet di polietilene attraverso la fresatura meccanica e la macinazione di pellet plastici e materiali in film e le caratteristiche dimensionali e molecolari degli MNP29. Il presente documento fornisce un protocollo più dettagliato per la preparazione di MNP che può essere applicato in modo più ampio a tutte le materie plastiche agricole, come i film di pacciamatura o le loro materie prime pellettizzate (Figura 1). Qui, per servire da esempio, abbiamo scelto un film di pacciamatura e pellet sferici del polimero biodegradabile polibutilene adipato tereftalato (PBAT) per rappresentare le materie plastiche agricole.
Protocollo
1. Lavorazione di MP da pellet di plastica attraverso pretrattamento criogenico e fresatura
NOTA: Questa metodologia si basa su una procedura descritta altrove, impiegando un film PBAT composto dallo stesso materiale utilizzato per questo studio presentato29.
- Pesare campioni di pellet polimerico di ~ 1 g e trasferirli in un barattolo di vetro da 50 ml.
- Posizionare il tubo di "mandata rettangolare" con un setaccio da 20 maglie (840 μm) nella fessura davanti al laminatoio di taglio rotante e sollevare il tubo di mandata fino a quando non colpisce il perno di arresto.
- Posizionare la lastra di vetro sulla faccia della camera di fresatura e fissarla con il morsetto regolabile. Quindi, posizionare un barattolo di vetro da 50 ml sotto l'uscita del mulino (Figura 2).
- Posizionare il supporto del braccio laterale scorrevole sul mulino (situato sul lato superiore destro) al centro del vetro anteriore e stringere con il bullone zigrinato. Assicurarsi che il vetro anteriore del mulino sia posizionato saldamente (Figura 2a).
- Inserire l'imbuto della tramoggia sulla parte superiore del mulino nell'apertura della camera di fresatura superiore.
- Collegare un cavo di linea a una presa di corrente e all'interruttore del cavo di pressatura per avviare il funzionamento del mulino.
NOTA: per evitare inceppamenti, alimentare solo il materiale dopo che il mulino è stato acceso e ruotato. Inoltre, indossare protezioni per occhi e orecchie durante l'intera procedura di fresatura. - Alimentare lentamente il campione nella tramoggia (circa 10 pellet/min) per evitare rallentamenti o inceppamenti. Dopo che il rumore udibile si è ridotto, aggiungere il prossimo lotto di pellet (~ 10 pezzi). Dopo aver lavorato il pellet (1 g), premere l'interruttore del cavo per interrompere il funzionamento del mulino per ~ 20 minuti per raffreddarsi. Utilizzare uno stantuffo di legno per alimentare il campione e prevenire l'espulsione e l'agglomerazione delle particelle all'interno della tramoggia di alimentazione.
ATTENZIONE: La velocità di avanzamento ottimale varia a seconda del tipo di materiale di lavorazione. Spegnere immediatamente il mulino se la velocità di lavorazione diminuisce a causa dell'attrito delle particelle nella camera di taglio o se si osserva la formazione di polimero fuso sulla lastra di vetro, per evitare il surriscaldamento e l'ulteriore fusione delle particelle polimeriche. - Rimuovere il tubo di mandata da 20 mesh (840 μm) e sostituirlo con il tubo di mandata da 60 mesh (250 μm) al completamento del primo lotto (Figura 2b).
- Reintrodurre il materiale raccolto nella tramoggia del mulino. Seguire i passaggi 1.1 e 1.7 per la frazione di fresatura da 250 μm.
- Rialimentare le frazioni raccolte da 250 μm fino a tre volte.
- Recuperare le particelle rimanenti nella camera e aggiungerle alla frazione principale raccolta.
2. Lavorazione di film plastici mediante pretrattamento criogenico e fresatura
- Recuperare un campione di pellicola dal rotolo e tagliare il campione in strisce di ~ 120 mm (direzione trasversale) x 20 mm (direzione macchina) con un tagliacarte.
- Immergere i frammenti (~1 g) in 800 ml di acqua deionizzata (DI) per 10 minuti in un becher di vetro da 1000 ml. Questo passaggio migliora l'infragilimento per la successiva procedura di raffreddamento criogenico anticipando il polimero.
ATTENZIONE: Maneggiare azoto liquido con dispositivi di sicurezza indossando guanti criogenici e occhiali di sicurezza. - Aggiungere lentamente 200 ml di azoto liquido (N2) in un contenitore criogenico.
- Trasferire con cautela le particelle di film preimpregnate nel contenitore criogenico con pinzette in acciaio. Immergere per 3 minuti in liquido N2.
- Trasferire i frammenti di film congelati in un frullatore da 200 W a 14 velocità.
- Elaborare il materiale congelato al livello di velocità 3 per 10 s per rompere la struttura del film di vetro congelato. Per promuovere un'ulteriore riduzione delle dimensioni, aggiungere 400 ml di acqua DI e mescolare il liquame film-acqua per 5 minuti.
- Trasferire il liquame in un imbuto Büchner con filtro (maglia da 1 μm) e applicare il vuoto per almeno 1 ora.
- Particelle solide essiccate sottovuoto a 30 °C per almeno 48 ore in un piatto di alluminio.
- Alimentare le particelle secche nel mulino con una pinzetta. Per la fresatura, seguire i passaggi 1.1-1.11.
3. Lavorazione di film plastici pretrattati mediante agenti atmosferici ambientali e fresatura
- Disporre frammenti di film plastico recuperati dal campo su una superficie liscia (banco da laboratorio). Rimuovere con cura le particelle di terreno assorbite e i resti vegetali con la spazzola a setole morbide.
- Tagliare il film con le forbici in ~4 cm2 campioni di ~1,0 g.
- Aggiungere frammenti di pellicola in un becher da 1000 mL riempito con 500 mL di acqua DI. Mescolare ad una velocità di 300 min-1 con barra di agitazione da 20 mm per 1 ora.
- Rimuovere le particelle di terreno disciolte travasando e reintroducendo acqua DI sotto leggera agitazione del becher in un lavandino o in un secchio di plastica. Ripetere questo passaggio tre volte. L'agitazione continua mantiene le particelle del terreno disperse nell'acqua e può essere più facilmente decantata.
- Trasferire i campioni dal becher in un piatto di alluminio. Asciugare all'aria i campioni di plastica per 12 ore, quindi trasferire e asciugare in forno sottovuoto per 24 ore a 30 °C. Per la fresatura, seguire i passaggi 1.1-1.11.
4. Procedura di setacciatura attraverso setacci a cascata
- Impilare i setacci (3 pollici di diametro) iniziando con la padella in basso, seguita dal setaccio più fine (# 325; 45 μm), e poi da setacci sempre più grossolani (come # 140; 106 μm e # 60; 250 μm, dove il setaccio # 20; 840 μm è il più grossolano) e posizionare il coperchio sopra.
- Montare tutti e quattro i setacci sullo shaker inserendo quattro perni nelle aperture dello shaker del setaccio.
- Trasferire le singole frazioni raccolte nei passaggi 1, 2 o 3 sopra i quattro setacci a cascata. Agitare per 10 minuti a 300 min-1.
- Recuperare separatamente la frazione più grande (superiore), che sarà sottoposta a ulteriore macinazione.
NOTA: regolare la velocità di agitazione sull'agitatore in base alle esigenze. In alternativa, è possibile agitare i setacci a mano. Utilizzare un solo setaccio alla volta, iniziando con il setaccio a rete #20: tenere saldamente il fondo e il coperchio contro il setaccio a mano, e agitare assialmente e orizzontalmente per 5 minuti. - Reintrodurre particelle setacciate di dp > 106 μm nel laminatoio di taglio rotativo come descritto nei punti 1.6-1.10.
- Recuperare le frazioni inferiori dalla vaschetta e reintrodurre le particelle nella successiva dimensione del setaccio più piccola. Ripetere la procedura fino a quando particelle da 106 μm rappresentano la frazione principale.
- Unire le frazioni raccolte da 106 μm e conservare le particelle in un'area asciutta (essiccatore o sacchetto di plastica sigillato ad aria).
NOTA: La frazione di 45 μm fa parte della frazione di 106 μm; Tuttavia, la prima frazione non è stata isolata e analizzata separatamente poiché la resa è generalmente molto bassa. I recuperi di resa e le frazioni granulometriche delle singole frazioni possono essere determinati mediante misurazioni gravimetriche in wt% per ciascuna frazione di setacciatura (mesh #20 - mesh #325) in relazione alla frazione di alimentazione iniziale utilizzando una microbilancia ad alta precisione.
5. Preparazione di un impasto NP acquoso per la macinazione a umido
- Preparare un impasto di MP dispersi in acqua DI aggiungendo 800 mL di acqua distillata nel becher di vetro da 1000 mL e inserendo una barra di agitazione (diametro = 8 mm, lunghezza = 50,8 mm).
- Introdurre 8 g della frazione plastica da 106 μm dai passaggi 1, 2, 3 o 4 nell'acqua DI, producendo un liquame dell'1% in peso.
- Posizionare il becher di vetro su una piastra di agitazione e mescolare magneticamente per 24 ore a 400 min-1 per immergere le particelle in acqua per favorire l'ammorbidimento delle particelle.
- Trasferire le particelle in un contenitore di plastica da 1000 ml.
- Riempire altri due contenitori di plastica da 1000 ml con acqua DI, che verrà utilizzata per risciacquare le particelle aderenti sulla tramoggia del macinino durante il processo di macinazione.
6. Preparazione della rettificatrice a umido per la produzione di NP
- Posizionare le pietre con una granulometria di 46 grani (graniglia di una macina = 297-420 μm) nella smerigliatrice a frizione bagnata e fissare i dadi centrali a mano con una chiave da 17 mm.
- Aggiungere la tramoggia sulla parte superiore e fissare i tre dadi e bulloni con la chiave da 17 mm.
- Posizionare un barattolo di raccolta in plastica da 1 litro sotto l'uscita del collisore. Posizionare un secondo secchio vuoto da 1 L accanto all'uscita, che verrà utilizzato per lo scambio durante la lavorazione.
- Regolare il gioco del misuratore su + 1,0, corrispondente a uno spostamento positivo di 0,10 μm dalla posizione zero.
- Accendere l'alimentazione e ruotare con attenzione la rotella di regolazione in senso orario fino a quando non si sentono toccare le mace. Quindi, regolare l'anello di misurazione flessibile su zero e ruotare immediatamente la rotellina in senso antiorario. Per impostazione predefinita, la velocità è regolata su 1500 min-1.
NOTA: Evitare la "macinazione a secco" delle pietre in quanto ciò crea calore eccessivo sulle macerie. - Ruotare la ruota di regolazione in senso orario fino a quando le pietre non toccano e riempire delicatamente il liquame acqua-NP nella tramoggia. Ridurre continuamente il divario a un indicatore di gioco di -2,0, corrispondente a uno spostamento negativo di 0,20 μm dalla posizione zero dopo l'introduzione del liquame. I fanghi di acqua e particelle di plastica tra i due dischi di pietra promuovono la trasformazione da MP in NP ed evitano l'attrito diretto tra le pietre di macinazione.
- Raccogliere il liquame scambiando i secchi di raccolta una volta che il livello di riempimento nel secchio supera 0,5 L.
- Raccogliere e reintrodurre le particelle nel macinino tra 30-60 volte; Passaggi più elevati (numero di reintroduzioni) si traducono in dimensioni delle particelle più piccole.
- Lavare le particelle aderenti adsorbite alla tramoggia con la bottiglia d'acqua DI preparata per consentire un'adeguata miscelazione dei liquami durante la lavorazione.
NOTA: La raccolta di campioni intermedi durante il processo è possibile trattenendo 20 ml di flaconcini di vetro nel flusso di uscita. Le singole fasi valuteranno i meccanismi di frammentazione delle particelle mentre aumenta la gravità del processo (numero di passaggi). Recuperare la sospensione e mescolare per 4 ore a 400 min-1 a 25 °C per una buona miscelazione; Lasciare riposare il liquame per 48 ore per stabilizzarsi.
7. Recupero ed essiccazione delle NP dal liquame
- Isolare la frazione inferiore (o la fase con la più alta concentrazione di NP) se si osservano più strati nel liquame versando lentamente il liquame in un ulteriore becher di vetro da 1000 ml.
- Trasferire le frazioni in flaconcini di centrifugazione (50 ml) e centrifugare per 10 minuti (forza centrifuga relativa [RCF] = 20 x 102 g). L'RCF (chiamato anche forza g) è la forza radiale generata in funzione del raggio del rotore e della velocità del rotore, che causa la separazione delle particelle più pesanti e dell'acqua del liquame.
- Rimuovere lo strato superiore trasparente travasandolo in una vaschetta di alluminio separata.
- Trasferire lo strato inferiore rimanente (contenente un impasto NP) in una piastra di alluminio aggiuntiva e metterlo in forno sottovuoto a 30 °C per 48 ore.
- Recuperare il materiale essiccato con una spatola sotto una cappa aspirante o un vano portaoggetti indossando una maschera respiratoria. Trasferire il contenuto essiccato in un contenitore di vetro da 100 ml e sigillare con un coperchio.
- Contenere NP in un flaconcino e conservarle in un luogo ermetico, asciutto e fresco (ad esempio, un essiccatore).
NOTA: Gli MNP rilasciati nell'ambiente durante il processo di produzione (qui, durante il processo di macinazione a umido o come particelle essiccate) possono rappresentare una grave minaccia per gli ecosistemi acquatici e terrestri. In particolare, le misure normative sono intese a ridurre al minimo il rischio per la loro produzione e il loro utilizzo per i nanomateriali ingegnerizzati30. Pertanto, la formazione di MNP richiede misure precauzionali specifiche come la movimentazione del materiale in una cappa aspirante o in un vano portaoggetti. Inoltre, le soluzioni acquose di rifiuti formate durante l'isolamento delle NP (fasi 6.7-6.9) saranno soggette ad una procedura di smaltimento a fine vita eseguita dal Dipartimento di Salute e Sicurezza Ambientale.
8. Imaging MP tramite microscopia stereoscopica
- Disperdere ~20 mg di particelle (raccolte nella fase 4) su una superficie di ~4 cm2. Stendere MP bianchi o traslucidi su una superficie scura e distribuire MP neri o di colore scuro su uno sfondo bianco (foglio di carta) per massimizzare il contrasto dello sfondo.
- Regolare il microscopio al minimo ingrandimento per catturare l'area più ampia possibile (al centro dell'area delle particelle). Quindi, dirigere la lampada esterna verso il centro di messa a fuoco per ottenere l'illuminazione sulle regioni di interesse.
- Applicare un ingrandimento che consenta il rilevamento di >50 particelle al centro del campo visivo. Questa quantità è raccomandata per ottenere risultati di valutazione statistica affidabili.
- Concentrati su aree con nessuna o minore sovrapposizione di particelle e buon contrasto cromatico.
- Cattura almeno cinque immagini rappresentative concentrandoti sulle forme delle particelle esterne. Il computer locale utilizzato per l'imaging salva le immagini ad alta risoluzione come bitmap nel software.
- Salvare le immagini registrate con stereomicroscopio in un formato di file riconosciuto da ImageJ (bitmap, tiff o jpeg) per la seguente analisi quantitativa dei dati.
NOTA: scattate un'immagine di riferimento con le impostazioni di ingrandimento esatte per le quali è stata scattata l'immagine principale utilizzando un righello o qualsiasi altro oggetto di riferimento registrato nell'immagine. Questa procedura consentirà una facile calibrazione delle immagini durante la preparazione e l'analisi tramite il software ImageJ.
9. Analisi delle immagini tramite ImageJ
- Apri il software ImageJ31 e prepara l'importazione dei file immettendo (CTRL + L) per aprire Command finder. Quindi inserisci Bio-Formati nell'angolo in basso a destra. Questa funzione attiva il percorso di menu File > Import > Bio formati (> si riferisce ai passaggi di navigazione all'interno del software). Cercare la directory dei file di immagine memorizzati.
NOTA: se il pacchetto Bio-Formats non viene visualizzato nel Command finder, cercare online in Bio-Formats ImageJ. Seguire le istruzioni per il download e l'installazione di ImageJ. L'importatore Bio-Formats consente di gestire facilmente l'importazione/esportazione di file di immagine all'interno di ImageJ e la ricerca di comandi. - Aprire l'immagine (in alternativa importare i bioformati come descritto nel passaggio 9.1) facendo clic su File > Apri > selezionare l'immagine della particella nella posizione del file raccolta nel passaggio 4.7 e l'immagine di riferimento righello descritta nel passaggio 1.6. Si consiglia di creare un'immagine duplicata facendo clic su Maiusc + Comando + D per confrontarla con l'immagine originale mentre si regolano le impostazioni di soglia dell'immagine copiata.
NOTA: il comando Apri > file consente di aprire vari formati supportati in modo nativo da ImageJ, come descritto nel passaggio 8.7. In alternativa, selezionare la posizione dell'immagine sul computer e trascinare e rilasciare il file sulla barra di stato principale della finestra di ImageJ. Il file di immagine si aprirà automaticamente in una finestra separata. - Ingrandisci e rimpicciolisci l'immagine usando rispettivamente CTRL + e CTRL -.
- Impostate le misurazioni facendo clic su Analizza > Imposta misure, quindi selezionate Descrittori area e forma come valori predefiniti.
- Definite la barra della scala disegnando una linea retta sulla lunghezza della barra della scala utilizzando l'immagine di riferimento del righello come descritto nel passaggio 8. Premere Analizza > Imposta scala e immettere il valore numerico della lunghezza della barra in Distanza nota e l'unità della lunghezza corrispondente.
- Visualizza la barra della scala sull'immagine facendo clic su Analizza > Strumenti > Barra scala e regola le impostazioni come mostrare un contrasto nitido sull'immagine. Selezionare una posizione sull'immagine in cui posizionare la barra della scala per le impostazioni della barra della scala. Selezionare Larghezza per regolare la barra in unità calibrate, Altezza della barra in pixel e Dimensione carattere dell'etichetta della barra della scala. Selezionare lo sfondo per regolare il colore di riempimento della casella di testo dell'etichetta.
NOTA: Per i micrometri, l'ingresso di μm è sufficiente; Il programma adatta automaticamente μm nell'output dei dati. - Trasformare l'immagine in un'immagine a 8 bit selezionando Immagine > Digitare > 8 bit.
- Convertite l'immagine copiata in 8 bit selezionando Immagine > Tipo > 8 bit.
- Regolate selezionando Immagine > Regola > soglia > Imposta (confrontate le dimensioni con l'immagine originale).
- Determinare le misurazioni da eseguire selezionando Analizza > Imposta misurazioni.
- Selezionare Analizza particelle > 0-infinito, fare clic su Visualizza risultati e Mostra in situ.
- Memorizza i risultati del ROI (.zip) in Salva misurazioni e seleziona cartella.
- Salva risultati (*.csv) in File > Salva con nome > Seleziona cartella.
10. Diametro delle particelle (dp) e calcolo del fattore di forma nel software per fogli di calcolo
NOTA: La conoscenza del diametro delle particelle e dei fattori di forma è essenziale per il comportamento delle particelle (destino, trasporto) nell'ambiente e la determinazione dell'area superficiale. Pertanto, la geometria è essenziale quando i MP vengono utilizzati per studi ambientali. Ad esempio, sono stati osservati diversi meccanismi di interazione con il suolo a seconda delle dimensioni e delle forme dei MP, come gli agglomerati MP-MP e MP-suolo, che influenzano il movimento delle particelle nel suolo15,32. Pertanto, i seguenti passaggi sono suggeriti per determinare la distribuzione della dimensione delle particelle p d e il parametro geometrico.
- Importare il corrispondente file *.csv ottenuto e salvato dall'analisi ImageJ (passaggio 9.13) nel software del foglio di calcolo.
NOTA: I valori numerici in ogni riga di colonna riflettono i singoli calcoli per ciascuna particella in base all'equazione 1 e all'equazione 2. - Valutare i valori medi dei parametri di forma, ad esempio circolarità (CIR) e proporzioni (AR), immettendo = media (x,y) nella parte inferiore di ogni colonna, dove x rappresenta la prima riga e y l'ultima riga della colonna, quindi premere INVIO. I valori CIR descrivono la relazione tra l'area proiettata e il cerchio perfetto con CIR = 1 di una singola particella (equazione 1). L'AR rappresenta il rapporto lunghezza/larghezza delle particelle descritto dall'equazione 2.
- Determinare se l'AR media < 2,5, quindi calcolare i valori dp in una nuova colonna utilizzando l'equazione 3. Se AR ≥ 2,5, calcolare i valori dp che riflettono l'equazione 4. Aggiungere una nuova colonna per calcolare dp in base alla colonna di area ricevuta dall'output ImageJ.
NOTA: la selezione dei valori di soglia AR ≥ 2,5 rappresenta più particelle di forma rettangolare, mentre AR < 2,5 riflette particelle di forma più rotonda. Questa selezione consente di ridurre al minimo l'errore di calcolo dp derivato dall'area misurata al microscopio e determinata tramite ImageJ.
(1)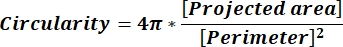
(2)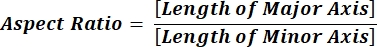
(3)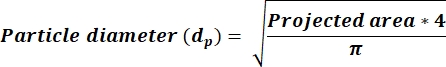
(4)
11. Analisi statistica per parlamentari e NP
- Aprire il file di dati *.csv con il software statistico per File > Apri > Selezionare il percorso del file corrispondente come creato nel passaggio 9.13.
NOTA: In alternativa, la tabella può essere trasferita direttamente tramite la funzione copia-incolla nel software statistico. Fare riferimento alla tabella dei materiali per la marca e la versione del software statistico Modifica > incolla con i nomi delle colonne. - Valutare i dati dp selezionando Analizza > distribuzione.
- Selezionare dp, che riflette i dati della colonna, trascinare e rilasciare nelle colonne Y e premere il pulsante OK. Questa funzionalità crea un istogramma con un output statistico che include i valori di sviluppo Statistiche di riepilogo, Media e Std in una finestra separata.
- Valutare se l'istogramma segue una distribuzione normale (o la migliore misura per d p) con la curva di adattamento migliore selezionando il triangolo accanto a d p > Adattamento continuo e quindi selezionare la curva ricevuta come migliore adattamento (ad esempio, Adatta normale). Questo passaggio sovrappone l'istogramma con un adattamento normalmente distribuito.
- Determinare e riportare i valori di deviazione media e standard dall'output statistico di riepilogo dei valori medi dei parametri di forma di circolarità (Cir), proporzioni (AR), rotondità (Arrotondamento) e solidità (Sol).
NOTA: Si raccomanda un livello di significatività statistica di α = 0,05 ed è stato utilizzato per tutte le valutazioni. Il livello di significatività è la probabilità di rifiutare l'ipotesi nulla quando è vera quando si confrontano i risultati numerici.
12. Migliore adattamento della distribuzione delle dimensioni dp e dei fattori di forma delle particelle
- Caricare il set di dati nel software statistico e utilizzare lo stesso set di dati *.csv per la distribuzione di dp come calcolato nel passaggio 10.
- Selezionare Analizza > affidabilità e sopravvivenza > distribuzione della vita.
- Trascinare la colonna dp nel campo Y, Tempo all'evento e selezionare OK. Questa feature crea un output con un grafico di probabilità in funzione di dp.
- Determinare la distribuzione ottimale in Confronta distribuzioni selezionando Non parametrico, Lognormale, Weibull, Loglogistico e Normale.
- Valutare la qualità del modello si adatta ai valori numerici più bassi per i criteri di informazione di Akaike e Bayesiani (AIC e BIC, rispettivamente) nella tabella di confronto del modello statistico sotto il grafico con i numeri BIC più bassi. Il modello più adatto è presentato nella prima riga per impostazione predefinita. I campi di output delle stime parametriche o non parametriche per ogni valutazione della distribuzione si trovano sotto il grafico Confronta distribuzioni .
- Salvare lo script di output nella tabella dati selezionando il triangolo rosso a discesa nell'angolo superiore sinistro da Salva script > nella tabella dati. Quindi, salvare la tabella dati originale nel percorso file desiderato selezionando File > Salva come > *.jmp.
13. Caratterizzazione dimensionale delle NP mediante diffusione dinamica della luce
- Avviare il software DLS (Dynamic Light Scattering) facendo doppio clic sull'icona del desktop. Selezionare File > Nuovo > SOP. Aggiungere il nome del campione e selezionare l'indice di rifrazione del materiale a 1,33 per l'acqua distillata e 1,59 per i polimeri33 nel software DLS in Configurazione campione. Selezionate Materiale (Material) nel menu a discesa (Pair-Down), quindi fate clic su OK.
NOTA: facendo clic sul menu a discesa si apre Gestione materiali, che consente di aggiungere nuovi campioni o modificare campioni esistenti modificando l'indice di rifrazione e l'assorbimento. Selezionare come disperdente l'acqua. - Selezionare la cella appropriata in Cella > Tipo di cella e selezionare Report per determinare quale output verrà presentato dopo ogni misurazione.
- Avviare lo strumento chiudendo il coperchio dello strumento e accendendo il sistema chiudendo il coperchio (se aperto) e premendo il pulsante ON . Attendere dopo il primo segnale acustico e attendere circa 30 minuti per consentire la stabilizzazione del raggio.
- Attendere il completamento della routine di inizializzazione e attendere un secondo segnale acustico, che indichi che la temperatura preimpostata (generalmente 25 °C) è stata raggiunta.
- Preparare un campione di sospensione di NP (come ricevuto nella fase 7) e acqua DI in un flaconcino da 15 mL a ~0,1% in peso agitando magneticamente per ~1 h per consentire di miscelare bene.
- Agitare il liquame prima di trasferire ~1,0 mL nella cuvetta al quarzo da 4,5 mL e aprire il coperchio. Quindi, inserire con cautela la cella del campione nel supporto del campione dello strumento DLS.
NOTA: Preparare tre campioni dello stesso lotto di liquami alla stessa concentrazione descritta al punto 13.5. - Eseguire tre misurazioni (selezione nel software DLS) per ogni campione. Tra una misurazione e l'altra, rimuovere la cella del campione e agitare delicatamente i campioni per 5 s per consentire la miscelazione del campione.
- Estrarre ed esportare i dati tramite il software DLS, trasferire il set di dati nel software del foglio di calcolo e creare istogrammi per MP e NP come descritto nei passaggi 11.1-11.5 (Figura 1). Copiare dalla scheda Visualizzazione record una tabella o un grafico selezionando Modifica-copia, che può essere incollato in un'altra applicazione, ad esempio il software per fogli di calcolo.
14. Analisi chimica di MNPs mediante spettrometria infrarossa a trasformazione di Fourier (FTIR) a riflettanza totale attenuata (ATR)
NOTA: Le analisi chimiche degli MNP mediante spettroscopia infrarossa a trasformazione di Fourier (FTIR) e di risonanza magnetica nucleare (NMR) sono strumenti adatti per valutare l'impatto della macinazione a umido sulle proprietà di legame chimico, nonché le quantità relative dei componenti principali e dei costituenti monomerici dei polimeri, rispettivamente10. Inoltre, le proprietà termiche e la stabilità dei costituenti polimerici degli MNP possono essere valutate rispettivamente attraverso la calorimetria differenziale a scansione (DSC) e l'analisi termogravimetrica (TGA),29.
- Pulire il sistema di rilevamento (superficie del cristallo ATR) con etanolo e un panno privo di lanugine.
- Avviare il software e premere il pulsante Background nella barra dei comandi per eseguire una scansione in background nell'aria cancellando il percorso del raggio dello strumento. Lo spettro di sfondo viene visualizzato poco dopo la raccolta.
- Immettere ID campione e Descrizione campione nella barra degli strumenti delle impostazioni dello strumento.
- Regolare il numero d'onda spettrale tra 4000 cm-1 e 600 cm-1 e selezionare una risoluzione di 2,0 cm-1 in modalità assorbanza. Selezionare 32 scansioni per spettro e iniziare.
- Posizionare un campione di plastica (~20 mg o ~ 1-3 mm3) di MP (106 μm) e NP (~300 nm) all'interno di una rondella di acciaio con un diametro interno di ~10 mm, o equivalente, sulla superficie del cristallo.
NOTA: La rondella impedisce la dispersione sul cristallo quando il portacampioni comprime il campione, con conseguenti disomogeneità del materiale e distorsioni dei dati dovute a misurazioni incoerenti. - Posizionare la rondella al centro del cristallo ATR e aggiungere il campione di polimero al centro dell'apertura della rondella con una spatola.
- Far ruotare la leva del campione sopra al centro del campione e ruotare la manopola in senso orario monitorando la forza del Force Gauge tra 50-90. Il campione mostra gli spettri preliminari. Premere il pulsante Scan una seconda volta per raccogliere lo spettro.
- Raccogliere tra 8-10 spettri facendo clic sul pulsante Scansione e mescolare accuratamente i campioni dopo ogni misurazione con una spatola per consentire la raccolta di risultati rappresentativi.
- Fare clic sulla cartella Visualizzazione esempi in Esplora dati per visualizzare tutti i campioni raccolti sovrapposti nell'area di visualizzazione. Innanzitutto, rimuovere gli spettri che rappresentano valori anomali significativamente deviati. Quindi, selezionare la modalità Assorbanza o Trasmittanza nella barra degli strumenti.
- Salva spettri selezionando la cartella Vista campione contenente gli spettri e selezionando Salva con nome dal menu file. La finestra di dialogo abilita il nome del file, la directory di destinazione e la modifica della posizione predefinita per tutti gli spettri.
NOTA: in alternativa, gli spettri possono essere salvati come file *.sp selezionando uno spettro e facendo clic con il pulsante destro del mouse per visualizzare l'opzione Binary. Selezionare Salva binario e sfogliare il percorso di salvataggio finale. - Eseguire la correzione della linea di base e la normalizzazione media selezionando un singolo spettro in Esplora dati selezionando Processo > normalizzazione nel menu tramite il software o nel passaggio successivo.
NOTA: la normalizzazione media compensa gli errori spettrali dovuti allo spessore o alla variazione del materiale nel campione. - Pulire l'area cristallina con etanolo e panno privo di lanugine al termine della raccolta dei dati.
- Interpretare le differenze tra MP e NP in base alle bande di vibrazione FTIR assegnate, assegnate e valutate in una precedente pubblicazione10.
Risultati
Per convalidare il metodo e l'analisi della procedura sperimentale, MP e NP sono stati formati da pellet e materiali di film e confrontati per dimensioni e forma utilizzando immagini microscopiche. Il metodo descritto nella Figura 1 ha formato in modo efficiente MP e NP da pellet e film di plastica biodegradabili; Ciò è stato ottenuto attraverso il raffreddamento criogenico, la fresatura, la macinazione a umido e la caratterizzazione. Il primo passo non era necessario per i film esposti al...
Discussione
Questo metodo descrive un processo efficace inizialmente descritto in una precedente pubblicazione29, per preparare MNP provenienti da pellet e pellicole di pacciamatura per studi ambientali. Il processo di riduzione delle dimensioni ha comportato il raffreddamento criogenico (solo per film), la fresatura a secco e le fasi di macinazione a umido, per produrre modelli MNP. Abbiamo applicato questo metodo per preparare MNP da una vasta gamma di materie prime polimeriche, tra cui polietilene a bassa ...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è stata finanziata dall'Herbert College of Agriculture, dal Dipartimento di ingegneria dei biosistemi e del suolo e dalla Science Alliance dell'Università del Tennessee, Knoxville. Inoltre, gli autori riconoscono con gratitudine il sostegno finanziario fornito attraverso l'USDA Grant 2020-67019-31167 per questa ricerca. Le materie prime iniziali per la preparazione di MNP di film di pacciamatura biodegradabile a base di PBAT sono state gentilmente fornite da BioBag Americas, Inc. (Dunevin, FL, USA) e i pellet PBAT da Mobius, LLC (Lenoir City, TN).
Materiali
| Name | Company | Catalog Number | Comments |
| Aluminum dish, 150 mL | Fisher Scientific, Waltham, MA, USA | 08-732-103 | Drying of collected NPs |
| Aluminum dish, 500 mL | VWR International, Radnor, PA, USA | 25433-018 | Collecting NPs after wet-grinding |
| Centrifuge | Fisher Scientific, Waltham, MA, USA | Centrific 228 | Container for centrifugation |
| Delivery tube, #20, 840 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M30 | Sieving of the first fraction during milling |
| Delivery tube, #60, 250 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M45 | Sieving of the second fraction (3x) during milling |
| Thermomixer, 5350 Mixer | Eppendorf North America, Enfield, CT, USA | 05-400-200 | Analysis of sieving experiments |
| FT-IR Spectrum Two, spectrometer with attenuated total reflectance (ATR) | Perkin Elmer, Waltham, MA, USA | L1050228 | Measuring FTIR spectra |
| Glass beaker, 1000 mL | DWK Life Sciences, Milville, NJ, USA | 02-555-113 | Stirring of MPs-water slurry before grinding |
| Glass front plate | Thomas Scientific, Swedesboro, NJ, USA | 3383N55 | Front cover plaste for Wiley Mini Mill |
| Glass jar, 50 mL | Uline, Pleasant Prairie, WI, USA | S-15846P | Collective MPs after milling |
| Glove Box, neoprene | Bel-Art-SP Scienceware, Wayne, NJ, USA | BEL-H500290000 | 22-Inch, Size 10 |
| Zetasizer Nano ZS 90 size analyzer | Malvern Panalytical, Worcestershire, UK | Zetasizer Nano ZS | Measuring nanoplastics dispersed in DI-water |
| Microscope camera | Nikon, Tokyo, 108-6290, Japan | Nikon Digital Sight 10 | Combined with Olympus microscope to receive digital images |
| Microscope | Olympus, Shinjuku, Tokyo, Japan | Model SZ 61 | Imaging of MPs |
| Nitrogen jar, low form dewar flasks | Cole-Palmer, Vernon Hills, IL, USA | UX-03771-23 | Storage of liquid nitrogen during cryogenic cooling |
| Accurate Blend 200, 12-speed blender | Oster, Boca Raton, FL, USA | 6684 | Initiating the size reduction of cryogenically treated plastic film |
| PBAT film, - BioAgri™ (Mater-Bi®) | BioBag Americas, Inc, Dunedin, FL, USA | 0.7 mm thick | Feedstock to form MPs and NPs, agricultural mulch film |
| PBAT pellets | Mobius, LLC, Lenoir City, TN, USA | Diameter 3 mm | Feedstock to form microplastics (MPs) and nanoplastics (NPs) trough milling and grinding |
| Plastic centrifuge tubes, 50 mL | Fisher Scientific, Waltham, MA, USA | 06-443-18 | Centrifugation of slurry after wet-grinding |
| Plastic jar, 1000 mL, pre-cleaned, straight sided | Fisher Scientific, Waltham, MA, USA | 05-719-733 | Collection of NPs during and after wet grinding |
| Polygon stir bars, diameterø=8 mm, length=50.8 mm | Fisher Scientific, Waltham, MA, USA | 14-512-127 | Stirring of MPs slurry prior to wet-grinding |
| Scissors, titanium bonded | Westcott, Shelton, CT, USA | 13901 | Cutting of initial PBAT film feedstocks |
| Square glass cell with square aperture and cap, 12 mm O.D. | Malvern Panalytical, Worcestershire, UK | PCS1115 | Measuring of NPs particle size |
| Stainless steel bottom, 3 inch, pan | Hogentogler & Co. Inc, Columbia, MD, USA | 8401 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 140 (106 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1308 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 20 (850 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1296 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 325 (45 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1313 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 60 (250 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1303 | Sieving of MPs after Wiley-milling |
| Stainless steel top cover, 3 inch | Hogentogler & Co. Inc, Columbia, MD, USA | 8406 | Sieving of MPs after Wiley-milling |
| Stainless steel tweezers | Global Industrial, Port Washington, NY, USA | T9FB2264892 | Transferring of frozen film particles from jar into blender |
| Vacuum oven, model 281A | Fisher Scientific, Waltham, MA, USA | 13-262-50 | Vacuum oven to dry NPs after wet-grinding |
| Friction grinding machine, Supermass Colloider | Masuko Sangyo, Tokyo, Japan | MKCA6-2J | Grinding machine to form NPs from MPs |
| Wet-grinding stone, grit size: 297 μm -420 μm | Masuko Sangyo, Tokyo, Japan | MKE6-46DD | Grinding stone to form NPs from MPs |
| Wiley Mini Mill, rotary cutting mill | Thomas Scientific, Swedesboro, NJ, USA | NC1346618 | Size reduction of pellets and film into MPs and NPs |
| Software | |||
| FTIR-Spectroscopy software | Perkin Elmer, Waltham, MA, USA | Spectrum 10 | Collection of spectra from the initial plastic, MPs and NPs |
| Image J, image processing program | National Institutes of Health, Bethesda, MD, USA | Version 1.53n | Analysis of digital images received from microscopy |
| Microscope software, ds-fi1 software | Malvern Panalytical , Malvern, UK | Firmware DS-U1 Ver3.10 | Recording of digital images |
| Microsoft, Windows, Excel 365, spreadsheet software | Microsoft, Redmond, WA, USA | Office 365 | Calculating the average particle size and creating FTIR spectra images |
| JMP software, statistical software | SAS Institute Inc., Cary, NC, 1989-2021 | Version 15 | Statistical analysis of particle size and perform best fit of data set |
| Unscrambler software | Camo Analytics, Oslo, Norway | Version 9.2 | Normalizing and converting FTIR spectra into .csv fromat |
Riferimenti
- Jin, Z., Dan, L. Review on the occurrence, analysis methods, toxicity and health effects of micro-and nano-plastics in the environment. Environmental Chemistry. (1), 28-40 (2021).
- Kumar, M., et al. Current research trends on micro-and nano-plastics as an emerging threat to global environment: a review. Journal of Hazardous Materials. 409, 124967 (2021).
- Alimba, C. G., Faggio, C., Sivanesan, S., Ogunkanmi, A. L., Krishnamurthi, K. Micro (nano)-plastics in the environment and risk of carcinogenesis: Insight into possible mechanisms. Journal of Hazardous Materials. 416, 126143 (2021).
- Serrano-Ruiz, H., Martin-Closas, L., Pelacho, A. M. Biodegradable plastic mulches: Impact on the agricultural biotic environment. Science of The Total Environment. 750, 141228 (2021).
- Hayes, D. G., et al. Biodegradable plastic mulch films for sustainable specialty crop production. Polymers for Agri-Food Applications. , 183-213 (2019).
- Viaroli, S., Lancia, M., Re, V. Microplastics contamination of groundwater: Current evidence and future perspectives. A review. Science of The Total Environment. , 153851 (2022).
- Rillig, M. C., Lehmann, A. Microplastic in terrestrial ecosystems. Science. 368 (6498), 1430-1431 (2020).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. Journal of Polymers and the Environment. 29 (9), 2916-2931 (2021).
- Yang, Y., et al. Kinetics of microplastic generation from different types of mulch films in agricultural soil. Science of The Total Environment. 814, 152572 (2022).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Schwaferts, C., Niessner, R., Elsner, M., Ivleva, N. P. Methods for the analysis of submicrometer-and nanoplastic particles in the environment. TrAC Trends in Analytical Chemistry. 112, 52-65 (2019).
- Gigault, J., et al. Current opinion: what is a nanoplastic. Environmental Pollution. 235, 1030-1034 (2018).
- Naqash, N., Prakash, S., Kapoor, D., Singh, R. Interaction of freshwater microplastics with biota and heavy metals: a review. Environmental Chemistry Letters. 18 (6), 1813-1824 (2020).
- Manzoor, S., Naqash, N., Rashid, G., Singh, R. Plastic material degradation and formation of microplastic in the environment: A review. Materials Today: Proceedings. , 3254-3260 (2022).
- de Souza Machado, A. A., et al. Impacts of microplastics on the soil biophysical environment. Environmental Science & Technology. 52 (17), 9656-9665 (2018).
- Jacques, O., Prosser, R. A probabilistic risk assessment of microplastics in soil ecosystems. Science of The Total Environment. 757, 143987 (2021).
- Kwak, J. I., An, Y. -. J. Microplastic digestion generates fragmented nanoplastics in soils and damages earthworm spermatogenesis and coelomocyte viability. Journal of Hazardous Materials. 402, 124034 (2021).
- Wahl, A., et al. Nanoplastic occurrence in a soil amended with plastic debris. Chemosphere. 262, 127784 (2021).
- Vighi, M., et al. Micro and nano-plastics in the environment: research priorities for the near future. Reviews of Environmental Contamination and Toxicology Volume 257. , 163-218 (2021).
- Pironti, C., et al. Microplastics in the environment: intake through the food web, human exposure and toxicological effects. Toxics. 9 (9), 224 (2021).
- Zurier, H. S., Goddard, J. M. Biodegradation of microplastics in food and agriculture. Current Opinion in Food Science. 37, 37-44 (2021).
- Horton, A. A., Dixon, S. J. Microplastics: An introduction to environmental transport processes. Wiley Interdisciplinary Reviews: Water. 5 (2), 1268 (2018).
- Panno, S. V., et al. Microplastic contamination in karst groundwater systems. Groundwater. 57 (2), 189-196 (2019).
- Su, Y., et al. Delivery, uptake, fate, an transport of engineered nanoparticles in plants: a critical review and data analysis. Environmental Science: Nano. 6 (8), 2311-2331 (2019).
- Yu, Y., Griffin-LaHue, D. E., Miles, C. A., Hayes, D. G., Flury, M. Are micro-and nanoplastics from soil-biodegradable plastic mulches an environmental concern. Journal of Hazardous Materials Advances. 4, 100024 (2021).
- Hayes, D. G. Enhanced end-of-life performance for biodegradable plastic mulch films through improving standards and addressing research gaps. Current Opinion in Chemical Engineering. 33, 100695 (2021).
- Qin, M., et al. A review of biodegradable plastics to biodegradable microplastics: Another ecological threat to soil environments. Journal of Cleaner Production. 312, 127816 (2021).
- Phuong, N. N., et al. Is there any consistency between the microplastics found in the field and those used in laboratory experiments. Environmental Pollution. 211, 111-123 (2016).
- Astner, A., et al. Mechanical formation of micro-and nano-plastic materials for environmental studies in agricultural ecosystems. Science of The Total Environment. 685, 1097-1106 (2019).
- Rist, S., Hartmann, N. B. Aquatic ecotoxicity of microplastics and nanoplastics: lessons learned from engineered nanomaterials. Freshwater Microplastics. , 25-49 (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Raju, S., et al. Improved methodology to determine the fate and transport of microplastics in a secondary wastewater treatment plant. Water Research. 173, 115549 (2020).
- Caputo, F., et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: addressing some analytical challenges in the sub-micron size range. Journal of Colloid and Interface Science. 588, 401-417 (2021).
- Xu, M., et al. Polystyrene microplastics alleviate the effects of sulfamethazine on soil microbial communities at different CO2 concentrations. Journal of Hazardous Materials. 413, 125286 (2021).
- Ding, L., et al. Insight into interactions of polystyrene microplastics with different types and compositions of dissolved organic matter. Science of The Total Environment. 824, 153883 (2022).
- Abbasimaedeh, P., Ghanbari, A., O'Kelly, B. C., Tavanafar, M., Irdmoosa, K. G. Geomechanical behaviour of uncemented expanded polystyrene (EPS) beads-clayey soil mixtures as lightweight fill. Geotechnics. 1 (1), 38-58 (2021).
- Li, Z., Li, Q., Li, R., Zhou, J., Wang, G. The distribution and impact of polystyrene nanoplastics on cucumber plants. Environmental Science and Pollution Research. 28 (13), 16042-16053 (2021).
- Sobhani, Z., Panneerselvan, L., Fang, C., Naidu, R., Megharaj, M. Chronic and transgenerational effects of polystyrene microplastics at environmentally relevant concentrations in earthworms (Eisenia fetida). Environmental Toxicology and Chemistry. 40 (8), 2240-2246 (2021).
- Lionetto, F., Esposito Corcione, C., Rizzo, A., Maffezzoli, A. Production and characterization of polyethylene terephthalate nanoparticles. Polymers. 13 (21), 3745 (2021).
- Dümichen, E., et al. Analysis of polyethylene microplastics in environmental samples, using a thermal decomposition method. Water Research. 85, 451-457 (2015).
- Robotti, M., et al. Attrition and cryogenic milling production for low pressure cold gas spray and composite coatings characterization. Advanced Powder Technology. 27 (4), 1257-1264 (2016).
- Ducoli, S., et al. A different protein corona cloaks "true-to-life" nanoplastics with respect to synthetic polystyrene nanobeads. Environmental Science: Nano. 9 (4), 1414-1426 (2022).
- El Hadri, H., Gigault, J., Maxit, B., Grassl, B., Reynaud, S. Nanoplastic from mechanically degraded primary and secondary microplastics for environmental assessments. NanoImpact. 17, 100206 (2020).
- Eitzen, L., et al. The challenge in preparing particle suspensions for aquatic microplastic research. Environmental research. 168, 490-495 (2019).
- Ekvall, M. T., et al. Nanoplastics formed during the mechanical breakdown of daily-use polystyrene products. Nanoscale advances. 1 (3), 1055-1061 (2019).
- Caldwell, J., et al. Fluorescent plastic nanoparticles to track their interaction and fate in physiological environments. Environmental Science: Nano. 8 (2), 502-513 (2021).
- Zeb, A., et al. Evaluating the knowledge structure of micro-and nanoplastics in terrestrial environment through scientometric assessment. Applied Soil Ecology. 177, 104507 (2022).
- Ji, Z., et al. Effects of pristine microplastics and nanoplastics on soil invertebrates: A systematic review and meta-analysis of available data. Science of The Total Environment. 788, 147784 (2021).
- de Alkimin, G. D., Gonçalves, J. M., Nathan, J., Bebianno, M. J. Impact of micro and nanoplastics in the marine environment. Assessing the Effects of Emerging Plastics on the Environment and Public Health. , 172-225 (2022).
- Pires, A., Cuccaro, A., Sole, M., Freitas, R. Micro (nano) plastics and plastic additives effects in marine annelids: A literature review. Environmental Research. , 113642 (2022).
- Hurley, R. R., Nizzetto, L. Fate and occurrence of micro (nano) plastics in soils: Knowledge gaps and possible risks. Current Opinion in Environmental Science & Health. 1, 6-11 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon