A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
יצירת מיקרו-וננו-פלסטיק מסרטי פלסטיק חקלאיים לתעסוקה במחקרי יסוד
In This Article
Summary
אנו מראים את ההיווצרות והאפיון הממדי של מיקרו וננו-פלסטיקים (MPs ו-NPs, בהתאמה) באמצעות תהליך מדורג של כרסום מכני, השחזה וניתוח הדמיה.
Abstract
מיקרופלסטיק (MPs) וננו-פלסטיק (NPs) המפוזרים במערכות אקולוגיות חקלאיות עלולים להוות איום חמור על הביוטה בקרקע ובנתיבי מים סמוכים. בנוסף, כימיקלים כמו חומרי הדברה שנספגים על ידי NPs יכולים לפגוע באורגניזמים בקרקע ועלולים להיכנס לשרשרת המזון. בהקשר זה, שימוש חקלאי בפלסטיק כגון יריעות חיפוי מפלסטיק תורם באופן משמעותי לזיהום הפלסטיק במערכות אקולוגיות חקלאיות. עם זאת, רוב המחקרים הבסיסיים על גורל ורעילות אקולוגית משתמשים בחומרי MP אידיאליים ומייצגים בצורה גרועה, כגון מיקרוספרות פוליסטירן.
לכן, כפי שמתואר כאן, פיתחנו הליך רב-שלבי בקנה מידה מעבדתי כדי ליצור באופן מכני חברי פרלמנט ו-NPs מייצגים למחקרים כאלה. החומר הפלסטי הוכן מסרטי חיפוי פלסטיק מסחריים של פוליבוטיראט אדיפט-קו-טרפתלט (PBAT) שהוטבעו באמצעות טיפול קריוגני (CRYO) או בליה סביבתית (W), ומכדורי PBAT שלא טופלו. החומרים הפלסטיים טופלו לאחר מכן על ידי כרסום מכני ליצירת חברי פרלמנט בגודל של 46-840 מיקרומטר, המחקים את השחיקה של שברי פלסטיק על ידי רוח ומכונות מכניות. לאחר מכן סוננו חברי הפרלמנט למספר שברים בגודל כדי לאפשר ניתוח נוסף. לבסוף, חלק המסננת של 106 מיקרומטר היה נתון לטחינה רטובה כדי ליצור NPs של 20-900 ננומטר, תהליך המחקה את תהליך הפחתת הגודל האיטי עבור חברי פרלמנט יבשתיים. הממדים והצורה של MPs נקבעו באמצעות ניתוח תמונה של סטריאומיקרוגרפים, ופיזור אור דינמי (DLS) שימש להערכת גודל החלקיקים עבור NPs. חברי פרלמנט ו- NPs שנוצרו בתהליך זה היו בעלי צורות לא סדירות, אשר עולה בקנה אחד עם התכונות הגיאומטריות של חברי פרלמנט שהתאוששו משדות חקלאיים. בסך הכל, שיטת הקטנת גודל זו הוכחה כיעילה ליצירת חברי פרלמנט ו-NPs המורכבים מפלסטיק מתכלה כגון פוליבוטילן אדיפט-קו-טרפתלט (PBAT), המייצג חומרי חיפוי המשמשים לייצור גידולים חקלאיים מיוחדים.
Introduction
בעשורים האחרונים, הייצור העולמי הגובר במהירות של פלסטיק וסילוק לא תקין והיעדר מיחזור של פסולת פלסטיק הובילו לזיהום סביבתי שהשפיע על מערכות אקולוגיות ימיות ויבשתיות 1,2,3. חומרים פלסטיים חיוניים לחקלאות בת זמננו, במיוחד לגידול ירקות, פירות קטנים וגידולים מיוחדים אחרים. השימוש בהם כסרטי חיפוי, כיסויי מנהרות גבוהים ונמוכים, סרט טפטוף ויישומים אחרים נועד לשפר את היבול ואת איכותו, להפחית את עלויות הייצור ולקדם שיטות חקלאות בנות קיימא 4,5. עם זאת, התעסוקה המתרחבת של "פלסטיקולטורה" העלתה חששות לגבי היווצרות, הפצה ושימור של חתיכות פלסטיק בסביבות חקלאיות. לאחר תהליך פיצול מתמשך הנגרם על ידי התפכחות סביבתית במהלך חיי השירות, שברי פלסטיק גדולים יותר יוצרים מיקרו וננו-פלסטיק (MNPs), אשר נשארים בקרקע או נודדים לנתיבי מים סמוכים באמצעות נגר מים ורוח 6,7,8. גורמים סביבתיים כגון קרינה אולטרה סגולה (UV) דרך אור השמש, כוחות מכניים של מים וגורמים ביולוגיים מפעילים התפשטות פלסטיק של פלסטיק המפוזר בסביבה, וכתוצאה מכך פירוק של שברי פלסטיק גדולים יותר לחלקיקי פלסטיק מאקרו או מזו 9,10. איחוי נוסף יוצר מיקרופלסטיק (MPs) וננו-פלסטיק (NPs), המשקף חלקיקים בגודל ממוצע (קוטר נומינלי; דפ) של 1-5000 מיקרומטר ו 1-1000 ננומטר, בהתאמה11. עם זאת, מגבלת d p העליונה עבור NPs (כלומר, גבול תחתון עבור חברי פרלמנט) אינה מוסכמת באופן אוניברסלי ובמספר מאמרים, זה מופיע כ- 100 ננומטר12.
MNPs מפסולת פלסטיק מהווים איום גלובלי מתפתח על בריאות הקרקע ושירותי המערכת האקולוגית. ספיחה של מתכות כבדות ממים מתוקים על ידי חברי פרלמנט הובילה לריכוז גבוה פי 800 של מתכות כבדות בהשוואה לסביבה13. יתר על כן, חברי פרלמנט במערכות אקולוגיות ימיות מציבים גורמי עקה ומזהמים מרובים על ידי שינוי חדירת האור, גרימת דלדול חמצן וגרימת הידבקות לבוטה שונים, כולל חדירה והצטברות באורגניזמים ימיים14.
מחקרים אחרונים מצביעים על כך ש-MNPs יכולים להשפיע על הגיאוכימיה של הקרקע ועל הביוטה, כולל קהילות מיקרוביאליות וצמחים15,16,17. יתר על כן, NPs מאיימים על מארג המזון17,18,19,20. מאחר ש-MNPs עוברים בקלות הובלה אנכית ואופקית בקרקע, הם יכולים לשאת מזהמים נספגים כגון חומרי הדברה, פלסטייזרים ומיקרואורגניזמים דרך האדמה אל מי תהום או מערכות אקולוגיות ימיות כגון נהרות ונחלים21,22,23,24. פלסטיק חקלאי קונבנציונלי כגון יריעות חיפוי עשוי מפוליאתילן, אשר יש להסיר מהשדה לאחר השימוש ולהשליך במזבלות. עם זאת, הסרה לא שלמה מובילה להצטברות משמעותית של פסולת פלסטיק בקרקעות 9,25,26. לחלופין, בולי פלסטיק מתכלים בקרקע (BDMs) מיועדים להיות מעובדים בקרקע לאחר השימוש, שם הם יתפרקו עם הזמן. עם זאת, BDMs נמשכים באופן זמני באדמה ובהדרגה מתפרקים ומתפרקים לחברי פרלמנטו-NPs 9,27.
מחקרים אקוטוקסיקולוגיים סביבתיים וגורליים רבים משתמשים בחומרי מודל אידיאליים ולא מייצגים של חברי פרלמנט ו-NPs. ה- MNPs הפונדקאיים הנפוצים ביותר הם מיקרו או ננו-כדורים פוליסטירן חד-ממדיים, שאינם משקפים את ה- MNPs בפועל המתגוררים בסביבה12,28. כתוצאה מכך, הבחירה של חברי פרלמנט ו-NPs לא מייצגים עלולה לגרום למדידות ותוצאות לא מדויקות. בהתבסס על היעדר מודלים מתאימים של ΜNPs למחקרים סביבתיים יבשתיים, המחברים היו מוטיבציה להכין מודלים כאלה מפלסטיק חקלאי. בעבר דיווחנו על היווצרות של MNPs מ BDMs וכדורי פוליאתילן באמצעות כרסום מכני והשחזה של כדורי פלסטיק וחומרי סרט ואת המאפיינים הממדיים והמולקולריים של MNPs29. המאמר הנוכחי מספק פרוטוקול מפורט יותר להכנת MNPs שניתן ליישם באופן רחב יותר על כל סוגי הפלסטיק החקלאיים, כגון יריעות חיפוי או חומרי ההזנה הכדוריים שלהם (איור 1). כאן, כדי לשמש דוגמה, בחרנו בסרט חיפוי ובכדורים כדוריים של הפולימר המתכלה פוליבוטילן אדיפט טרפתלט (PBAT) כדי לייצג את הפלסטיק החקלאי.
Protocol
1. עיבוד חברי פרלמנט מכדורי פלסטיק באמצעות טיפול מקדים קריוגני וכרסום
הערה: מתודולוגיה זו מבוססת על הליך שתואר במקום אחר, תוך שימוש בסרט PBAT המורכב מאותו חומר ששימש למחקר זה29.
- שוקלים דגימות כדורי פולימר של ~ 1 גרם ומעבירים לצנצנת זכוכית של 50 מ"ל.
- מניחים את צינור "המסירה המלבנית" עם מסננת רשת 20 (840 מיקרומטר) בחריץ שלפני טחנת החיתוך הסיבובית ומרימים את צינור המסירה עד שהוא פוגע בפין העצירה.
- מקמו את לוחית הזכוכית על פני תא הכרסום והדקו אותה באמצעות המהדק המתכוונן. לאחר מכן, הניחו צנצנת זכוכית בגודל 50 מ"ל מתחת לשקע הטחנה (איור 2).
- מקמו את תמיכת הזרוע הצדדית המחליקה על הטחנה (הממוקמת בצד ימין עליון) באמצע הזכוכית הקדמית והדקו עם הבריח המחורץ. ודאו שהזכוכית הקדמית של הטחנה ממוקמת היטב (איור 2a).
- הכנס את משפך הופר על גבי הטחנה לתוך הפתח של תא הטחינה העליון.
- חבר כבל קו לשקע חשמל ואת מתג כבל העיתונות כדי להתחיל את פעולת הטחנה.
הערה: כדי למנוע חסימה, יש להזין חומר רק לאחר הפעלת הטחנה וסיבובה. כמו כן, יש ללבוש הגנה על העיניים והאוזניים במהלך כל הליך הכרסום. - הזינו את הדגימה באיטיות לתוך ההופר (כ-10 כדורים לדקה) כדי למנוע האטה או חסימה. לאחר שהרעש הנשמע פוחת, הוסף את האצווה הבאה של גלולות (~ 10 חתיכות). לאחר עיבוד הכדורים (1 גרם), לחץ על מתג הכבל כדי לעצור את פעולת הטחנה למשך ~ 20 דקות כדי להתקרר. השתמש בבוכנה מעץ כדי להזין את הדגימה ולמנוע פליטה וצבירה של חלקיקים בתוך ההופר ההאכלה.
התראה: קצב ההזנה האופטימלי משתנה בהתאם לסוג חומר העיבוד. מיד לכבות את הטחנה אם מהירות העיבוד פוחתת עקב חיכוך חלקיקים בתא החיתוך, או אם היווצרות של פולימר מותך הוא ציין על צלחת זכוכית, כדי למנוע התחממות יתר והתכה נוספת של חלקיקי פולימר. - הסר את צינור המסירה של 20 רשת (840 מיקרומטר) והחלף אותו בצינור המסירה של 60 רשת (250 מיקרומטר) עם השלמת האצווה הראשונה (איור 2b).
- החזירו את החומר שנאסף לתוך הופר הטחנה. בצע את השלבים 1.1 ו- 1.7 עבור שבר הטחינה של 250 מיקרומטר.
- הזן מחדש את השברים שנאספו של 250 מיקרומטר עד שלוש פעמים.
- לשחזר את החלקיקים הנותרים בתא ולהוסיף אותם לחלק העיקרי שנאסף.
2. עיבוד יריעות פלסטיק על ידי טיפול מקדים קריוגני וכרסום
- שלוף דגימת סרט מהגליל וחתוך את הדגימה לרצועות של ~ 120 מ"מ (כיוון צולב) x 20 מ"מ (כיוון מכונה) עם חותך נייר.
- שברי Presoak (~ 1 גרם) ב 800 מ"ל של מים deionized (DI) במשך 10 דקות בכוס זכוכית 1000 מ"ל. שלב זה משפר את ההפרשה להליך הקירור הקריוגני הבא על ידי השריית הפולימר.
התראה: טפל בחנקן נוזלי עם ציוד בטיחות על ידי לבישת כפפות קריוגניות ומשקפי בטיחות. - הוסיפו באיטיות 200 מ"ל של חנקן נוזלי (N2) למיכל קריוגני.
- מעבירים את חלקיקי הסרט הספוגים בזהירות לתוך המיכל הקריוגני עם פינצטה מפלדה. משרים במשך 3 דקות בנוזל N2.
- העבירו את שברי הסרט הקפוא לבלנדר של 200 וואט, 14 הילוכים.
- מעבדים את החומר הקפוא ברמת מהירות 3 במשך 10 שניות כדי לשבור את מבנה סרט הזכוכית הקפוא. כדי לקדם הקטנת גודל נוספת, הוסיפו 400 מ"ל של מי DI וערבבו את המרקם של מי הסרט למשך 5 דקות.
- מעבירים את ה-slurry למשפך Büchner עם מסנן (רשת של 1 מיקרומטר) ומפעילים ואקום למשך שעה אחת לפחות.
- חלקיקים מוצקים יבשים בוואקום בטמפרטורה של 30°C למשך 48 שעות לפחות בכלי אלומיניום.
- להאכיל חלקיקים יבשים לתוך הטחנה עם פינצטה. עבור כרסום, בצע את השלבים 1.1-1.11.
3. עיבוד יריעות פלסטיק שטופלו מראש באמצעות בליה וכרסום סביבתיים
- הניחו שברי סרט פלסטיק שהתאוששו מהשדה על משטח חלק (ספסל מעבדה). הסירו בזהירות חלקיקי אדמה נספגים ושרידי צמחים בעזרת המברשת בעלת הזיפים הרכים.
- חותכים את הסרט עם מספריים לתוך ~ 4 ס"מ2 דוגמאות של ~ 1.0 גרם.
- הוסף שברי סרט לתוך 1000 מ"ל מלא 500 מ"ל של מים DI. מערבבים בקצב של 300 דקות-1 עם מוט ערבוב של 20 מ"מ למשך שעה אחת.
- הסר חלקיקי אדמה מומסים על ידי ניקוי והכנסה מחדש של מי DI תחת תסיסה קלה של הכוס לתוך כיור או דלי פלסטיק. חזור על שלב זה שלוש פעמים. תסיסה מתמשכת שומרת על חלקיקי קרקע מפוזרים במים וניתן לנטרל אותה בקלות רבה יותר.
- מעבירים דגימות מהכוס לצלחת אלומיניום. מייבשים באוויר את דגימות הפלסטיק במשך 12 שעות, ולאחר מכן מעבירים ומייבשים בתנור ואקום במשך 24 שעות בטמפרטורה של 30 מעלות צלזיוס. עבור כרסום, בצע את השלבים 1.1-1.11.
4. הליך סינון באמצעות מסננות מדורגות
- ערמו את המסננות (בקוטר 3 אינץ') החל מהמחבת בתחתית, לאחר מכן את המסננת המשובחת ביותר (#325; 45 מיקרומטר), ולאחר מכן על ידי מסננות גסות יותר ויותר (כגון #140; 106 מיקרומטר, ו #60; 250 מיקרומטר, כאשר מסננת #20; 840 מיקרומטר היא הגסה ביותר), ומניחים את המכסה על גבי.
- הרכב את כל ארבע המסננות על השייקר על ידי הכנסת ארבעה פינים בפתחי מסננת השייקר.
- העבר שברים בודדים שנאספו בשלב 1, 2 או 3 על גבי ארבע המסננות מדורגות. יש לנער במשך 10 דקות ב-300 דקות עד 1.
- לשחזר את החלק הגדול יותר (העליון) בנפרד, אשר יהיה נתון כרסום נוסף.
הערה: כוונן את מהירות הטלטול בשייקר לפי הצורך. לחלופין, ניתן ללחוץ מסננות ביד. השתמש רק במסננת אחת בכל פעם, החל ממסננת #20 של הרשת: החזק את החלק התחתון ואת המכסה בחוזקה כנגד המסננת ביד, ונער באופן אקסיאלי ואופקי במשך 5 דקות. - החזירו חלקיקים מנופים של dp > 106 מיקרומטר לטחנת החיתוך הסיבובית כמתואר בשלבים 1.6-1.10.
- שחזרו את השברים התחתונים מהתבנית והחזירו את החלקיקים לגודל המסננת הקטן הבא. חזור על ההליך עד שחלקיקי 106 מיקרומטר ייצגו את השבר הראשי.
- מזגו את שברי ה-106 מיקרומטר שנאספו ואחסנו את החלקיקים באזור יבש (ייבוש או שקית ניילון אטומה לאוויר).
הערה: השבר של 45 מיקרומטר הוא חלק מהשבר של 106 מיקרומטר; עם זאת, החלק הקודם לא היה מבודד ונותח בנפרד שכן התשואה היא בדרך כלל נמוכה מאוד. ניתן לקבוע שברי תפוקה ושברים בגודל חלקיקים של שברים בודדים על ידי מדידות גרבימטריות ב- wt% עבור כל שבר ניפוי (MeSH #20 - MeSH #325) ביחס לשבר ההזנה הראשוני באמצעות מיקרו-איזון ברמת דיוק גבוהה.
5. הכנת תבשיל NP מימי לטחינה רטובה
- הכינו תבשיל של חברי פרלמנט המפוזרים במי DI על ידי הוספת 800 מ"ל מים מזוקקים לכוס הזכוכית של 1000 מ"ל והכנסת מוט ערבוב (קוטר = 8 מ"מ, אורך = 50.8 מ"מ).
- הכנס 8 גרם של חלק פלסטיק 106 מיקרומטר משלבים 1, 2, 3, או 4 לתוך מים DI, לייצר 1 wt% slurry.
- מניחים את הזכוכית על צלחת ערבוב ומערבבים מגנטית במשך 24 שעות ב-400 דקות-1 כדי להשרות את החלקיקים במים כדי לקדם ריכוך חלקיקים.
- מעבירים את החלקיקים למיכל פלסטיק של 1000 מ"ל.
- מלאו שני מיכלי פלסטיק נוספים של 1000 מ"ל במי DI, שישמשו לשטיפת חלקיקים דבוקים על הופר המטחנה במהלך תהליך הטחינה.
6. הכנת מכונת הטחינה הרטובה לייצור NP
- מניחים אבנים בגודל 46 גרגרים (חצץ של אבן טחינה = 297-420 מיקרומטר) במטחנת החיכוך הרטובה ומהדקים את האגוזים המרכזיים ביד עם מפתח ברגים של 17 מ"מ.
- מוסיפים את ההופר למעלה ומהדקים את שלושת האומים והברגים עם מפתח ברגים 17 מ"מ.
- הניחו צנצנת איסוף פלסטיק בנפח 1 ליטר מתחת לשקע של המתנגש. מניחים דלי ריק שני של 1 ליטר ליד השקע, שישמש להחלפה בזמן העיבוד.
- התאם את מרווח המד ל- + 1.0, המתאים לתזוזה חיובית של 0.10 מיקרומטר ממיקום האפס.
- הפעילו את החשמל וסובבו בזהירות את גלגל הכוונון בכיוון השעון עד לשמיעת השחיקת אבני הטחינה נוגעות. לאחר מכן, כוונן את טבעת המדידה הגמישה לאפס וסובב את הגלגל נגד כיוון השעון באופן מיידי. כברירת מחדל, המהירות מותאמת ל-1500 דקות-1.
הערה: הימנעו מ"טחינה יבשה" של האבנים מכיוון שהדבר יוצר חום מוגזם על אבני הטחינה. - סובבו את גלגל הכוונון בכיוון השעון עד שהאבנים נוגעות וממלאות בעדינות את גלגל המים-NP לתוך ההופר. להקטין את הפער ללא הרף למד מרווח של -2.0, המתאים לתזוזה שלילית של 0.20 מיקרומטר ממיקום האפס לאחר הצגת ה-slurry. חלקיקי פלסטיק-מים בין שני דיסקי האבן מקדמים טרנספורמציה מ-MPs ל-NPs ומונעים חיכוך ישיר בין אבני הטחינה.
- אספו את הדליים על ידי החלפת דליי האיסוף ברגע שרמת המילוי בדלי עולה על 0.5 ליטר.
- לאסוף ולהחזיר את החלקיקים לתוך המטחנה בין 30-60 פעמים; מעברים גבוהים יותר (מספר החזרות) גורמים לגדלים קטנים יותר של חלקיקים.
- יש לשטוף חלקיקים נצמדים שנספחו להופר עם בקבוק המים DI המוכן כדי לאפשר ערבוב מתאים בזמן העיבוד.
הערה: איסוף דגימות ביניים במהלך התהליך אפשרי על ידי החזקת בקבוקוני זכוכית של 20 מ"ל לתוך זרם היציאה. הצעדים הבודדים יעריכו את מנגנוני פיצול החלקיקים בעוד חומרת התהליך (מספר המעברים) עולה. משחזרים את המרקם ומערבבים במשך 4 שעות ב-400 דקות-1 ב-25 מעלות צלזיוס לערבוב טוב; תן את slurry לעמוד במשך 48 שעות כדי להתייצב.
7. התאוששות וייבוש של NPs מן slurry
- בודדו את החלק התחתון (או הפאזה עם ריכוז ה-NP הגבוה ביותר) אם נצפו מספר שכבות ב-slurry על ידי שפיכה איטית של ה-slurry לתוך זכוכית נוספת של 1000 מ"ל.
- מעבירים את השברים לבקבוקוני צנטריפוגה (50 מ"ל) ולצנטריפוגה למשך 10 דקות (כוח צנטריפוגלי יחסי [RCF] = 20 x 102 גרם). כוח ה-RCF (נקרא גם כוח g) הוא הכוח הרדיאלי שנוצר כפונקציה של רדיוס הרוטור ומהירות הרוטור, מה שגורם להפרדה בין החלקיקים הכבדים יותר לבין המים של הרוטור.
- הסירו את השכבה העליונה השקופה על ידי פירוקה לתבנית אלומיניום נפרדת.
- מעבירים את השכבה התחתונה הנותרת (המכילה תבשיל NP) לצלחת אלומיניום נוספת ומניחים אותה בתנור ואקום בטמפרטורה של 30 מעלות צלזיוס למשך 48 שעות.
- יש לשקם חומר יבש בעזרת מרית מתחת למכסה אדים או תא כפפות תוך לבישת מסכת נשימה. מעבירים את התוכן המיובש למיכל זכוכית של 100 מ"ל ואוטמים באמצעות מכסה.
- מכילים NPs בבקבוקון ומאחסנים אותם במקום אטום, יבש וקריר (למשל, חומר ייבוש).
הערה: MNPs המשתחררים לסביבה במהלך תהליך הייצור (כאן, במהלך תהליך הטחינה הרטובה או כחלקיקים מיובשים) עלולים להוות איום חמור על מערכות אקולוגיות ימיות ויבשתיות. בפרט, אמצעים רגולטוריים נועדו למזער את הסיכון לייצורם ולשימוש בננו-חומרים מהונדסים30. לכן, היווצרות של MNPs דורשת צעדי זהירות ספציפיים כגון טיפול בחומרים במכסה אדים או בתא כפפות. יתר על כן, תמיסות פסולת מימיות שנוצרו במהלך בידוד NPs (שלבים 6.7-6.9) יהיו כפופות להליך סילוק בסוף החיים המבוצע על ידי המחלקה לבריאות ובטיחות הסביבה.
8. הדמיית MP באמצעות מיקרוסקופיית סטריאו
- פזרו ~ 20 מ"ג של חלקיקים (שנאספו בשלב 4) על פני שטח ~ 4 ס"מ2. פזרו קבצי MP לבנים או שקופים על משטח כהה ופזר קבצי MP שחורים או כהים על רקע לבן (גיליון נייר) כדי למקסם את ניגודיות הרקע.
- התאם את המיקרוסקופ להגדלה הנמוכה ביותר כדי ללכוד את השטח הגדול ביותר האפשרי (אמצע שטח החלקיקים). לאחר מכן, כוון את המנורה החיצונית למרכז המיקוד כדי להשיג הארה על אזורי העניין.
- החל הגדלה המאפשרת זיהוי של >50 חלקיקים במרכז שדה הראייה. סכום זה מומלץ כדי לקבל תוצאות הערכה סטטיסטיות חזקות.
- התמקדו באזורים ללא חפיפה או חפיפה מינורית של חלקיקים וניגודיות צבעים טובה.
- צלם לפחות חמש תמונות מייצגות על-ידי התמקדות בצורות החלקיקים החיצוניים. המחשב המקומי המשמש להדמיה שומר תמונות ברזולוציה גבוהה כמפת סיביות בתוכנה.
- שמור את התמונות המוקלטות של הסטריאומיקרוסקופ בתבנית קובץ המזוהה על-ידי ImageJ (מפת סיביות, tiff או jpeg) לצורך ניתוח הנתונים הכמותיים הבאים.
הערה: צלם תמונת ייחוס אחת בהגדרות ההגדלה המדויקות שעבורן התמונה הראשית צולמה באמצעות סרגל או כל אובייקט ייחוס אחר שהוקלט בתמונה. הליך זה יאפשר כיול קל של התמונות בעת הכנה וניתוח באמצעות תוכנת ImageJ.
9. ניתוח תמונות באמצעות ImageJ
- פתח את תוכנת ImageJ31 והכן ייבוא קבצים על ידי הזנת (CTRL + L) כדי לפתוח את מאתר הפקודות. לאחר מכן הזן ביו-פורמטים בפינה הימנית התחתונה. פונקציה זו מפעילה את נתיב התפריט File > Import > Bio formats (> מתייחס לשלבי ניווט בתוך התוכנה). חפש את הספרייה של קבצי תמונה מאוחסנים.
הערה: אם חבילת התבניות הביולוגיות אינה מופיעה במאתר הפקודות, חפש באינטרנט תחת Bio-Formats ImageJ. בצע את ההוראות להורדה והתקנה של ImageJ. יבואן הביו-פורמטים מאפשר טיפול פשוט בייבוא/ייצוא קבצי תמונה בתוך ImageJ וחיפוש פקודות. - פתח את התמונה (לחלופין, ייבוא ביו-פורמטים כמתואר בשלב 9.1) על-ידי לחיצה על קובץ > פתח > בחר תמונת חלקיקים במיקום הקובץ שנאסף בשלב 4.7 ובתמונת ההפניה לסרגל המתוארת בשלב 1.6. מומלץ ליצור תמונה משוכפלת על-ידי לחיצה על Shift + Command + D כדי להשוות לתמונה המקורית תוך התאמת הגדרות הסף של תמונת ההעתקה.
הערה: הפקודה File > Open פותחת תבניות שונות הנתמכות במקור על-ידי ImageJ כמתואר בשלב 8.7. לחלופין, בחר את מיקום התמונה במחשב וגרור ושחרר את הקובץ בשורת המצב הראשית של חלון ImageJ. קובץ התמונה ייפתח באופן אוטומטי בחלון נפרד. - הגדל והקטן את התצוגה של התמונה באמצעות CTRL + ו- CTRL -, בהתאמה.
- קבעו את המדידות בלחיצה על ' נתח > קבע מדידות', ולאחר מכן בחרו ' שטח ' ו'מתארי צורה' כערכי ברירת המחדל.
- הגדר את סרגל קנה המידה על-ידי ציור קו ישר לאורך סרגל קנה המידה באמצעות תמונת ההפניה לסרגל, כמתואר בשלב 8. הקש Analyze > Set Scale והזן את הערך המספרי של אורך הסרגל תחת מרחק ידוע ואת יחידת האורך המתאימה.
- הצג באופן חזותי את סרגל קנה המידה בתמונה על-ידי לחיצה על נתח כלים > > סרגל קנה המידה, והתאם הגדרות כגון הצגת ניגודיות חדה בתמונה. בחרו מיקום בתמונה שבו יש למקם את סרגל קנה המידה להגדרות סרגל קנה המידה. בחר רוחב כדי להתאים את הסרגל ביחידות מכוילות, גובה הסרגל בפיקסלים וגודל הגופן של תווית סרגל קנה המידה. בחר רקע כדי להתאים את צבע המילוי של תיבת הטקסט של התווית.
הערה: עבור מיקרומטרים, הכניסה של μm מספיקה; התוכנית מתאימה μm באופן אוטומטי בפלט הנתונים. - הפוך את התמונה לתמונה של 8 סיביות על-ידי בחירה באפשרות תמונה > הקלד > 8 סיביות.
- המר את התמונה שהועתקה ל- 8 סיביות על-ידי בחירה באפשרות תמונה > הקלד > 8 סיביות.
- התאם על-ידי בחירה באפשרות תמונה > התאם > סף > הגדר (השווה גודל לתמונה המקורית).
- קבע אילו מדידות לבצע על-ידי בחירה באפשרות נתח > הגדר מדידות.
- בחר נתח חלקיקים >-0-אינסוף, לחץ על הצג תוצאות והצג באתרו.
- אחסן את תוצאות החזר ההשקעה (.zip) תחת שמור מדידות ובחר תיקייה.
- שמור תוצאות (*.csv) תחת קובץ > שמירה בשם > בחר תיקיה.
10. קוטר חלקיקים (dp) וחישוב גורם צורה בתוכנת גיליון אלקטרוני
הערה: הכרת קוטר החלקיקים וגורמי הצורה חיוניים להתנהגות החלקיקים (גורל, הובלה) בסביבה ולקביעת שטח הפנים. לכן, גיאומטריה חיונית כאשר חברי פרלמנט משמשים למחקרים סביבתיים. לדוגמה, נצפו מנגנוני אינטראקציה שונים עם הקרקע בהתאם לגדלים ולצורות של חברי פרלמנט, כגון אגרגציות של MP-MP ו-MP, המשפיעות על תנועת החלקיקים בקרקע15,32. לכן, מוצעים השלבים הבאים כדי לקבוע את התפלגות גודל החלקיקים d p ואת הפרמטר הגיאומטרי.
- יבא את קובץ *.csv המתאים שהתקבל ונשמר מניתוח ImageJ (שלב 9.13) לתוכנת הגיליון האלקטרוני.
הערה: הערכים המספריים בכל שורת עמודה משקפים חישובים נפרדים עבור כל חלקיק בהתאם למשוואה 1 ולמשוואה 2. - הערך את ערכי פרמטרי הצורה הממוצעים, כגון מעגליות (CIR) ויחס גובה-רוחב (AR) על-ידי הזנת = ממוצע (x,y) בתחתית כל עמודה, כאשר x מייצג את השורה הראשונה ו- y השורה האחרונה של העמודה, ולאחר מכן הקש Enter. ערכי CIR מתארים את הקשר בין האזור המוקרן למעגל המושלם עם CIR = 1 של חלקיק בודד (משוואה 1). ה-AR מייצג את יחס אורך/רוחב החלקיקים המתואר במשוואה 2.
- קבע אם ה-AR הממוצע < 2.5, ולאחר מכן חשב ערכי d p בעמודה חדשה באמצעות משוואה 3. אם AR ≥ 2.5, חשב d p ערכים המשקפים משוואה 4. הוסף עמודה חדשה כדי לחשב dp בהתבסס על עמודת השטח שהתקבלה מהפלט ImageJ.
הערה: בחירה של ערכי סף AR ≥ 2.5 מייצגת חלקיקים בעלי צורה מלבנית יותר, ואילו AR < 2.5 משקפת חלקיקים בעלי צורה עגולה יותר. בחירה זו מאפשרת למזער את שגיאת החישוב dp הנגזרת מהשטח שנמדד על ידי מיקרוסקופיה ונקבע באמצעות ImageJ.
(1)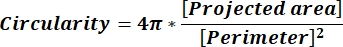
(2)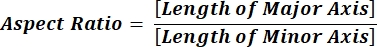
(3)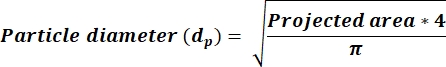
(4)
11. ניתוח סטטיסטי עבור חברי פרלמנט ו- NPs
- פתח את קובץ הנתונים *.csv עם התוכנה הסטטיסטית על ידי File > פתח > בחר את מיקום הקובץ של הקובץ המתאים כפי שנוצר בשלב 9.13.
הערה: לחלופין, ניתן להעביר את הטבלה ישירות באמצעות תכונת העתק-הדבק לתוכנה הסטטיסטית. עיין בטבלת החומרים של המותג והגרסה של התוכנה הסטטיסטית ערוך > הדבק עם שמות עמודות. - הערך את נתוני dp על-ידי בחירה באפשרות נתח התפלגות >.
- בחר dp, המשקף את נתוני העמודה, גרור ושחרר לתוך Y עמודות ולחץ על הלחצן אישור. תכונה זו יוצרת היסטוגרמה עם פלט סטטיסטי הכולל סטטיסטיקות סיכום, ממוצע וערכי Std Dev בחלון נפרד.
- הערך אם ההיסטוגרמה עוקבת אחר התפלגות נורמלית (או ההתאמה הטובה ביותר עבור d p) עם עקומת ההתאמה הטובה ביותר על-ידי בחירת המשולש שליד dp > Continuous Fit, ולאחר מכן בחר את העקומה שהתקבלה כהתאמה הטובה ביותר (לדוגמה, Fit Normal). שלב זה מחליף את ההיסטוגרמה בהתאמה המפוזרת באופן נורמלי.
- קבע ודווח על ערכי הממוצע וסטיית התקן מהפלט הסטטיסטי המסכם של ערכי פרמטרי הצורה הממוצעת של מעגליות (Cir), יחס גובה-רוחב (AR), מעוגלות (עגול) ומוצקות (Sol).
הערה: רמת מובהקות סטטיסטית של α = 0.05 מומלצת והועסקה בכל ההערכות. רמת המובהקות היא ההסתברות לדחיית השערת האפס כאשר היא נכונה בעת השוואת תוצאות מספריות.
12. ההתאמה הטובה ביותר של התפלגות גודל d p וגורמי צורת חלקיקים
- טען את ערכת הנתונים לתוכנה סטטיסטית והשתמש באותה ערכת נתונים *.csv להתפלגות dp כפי שחושב בשלב 10.
- בחר נתח > אמינות והישרדות > התפלגות החיים.
- גרור את העמודה dp לשדה Y, שעה לאירוע ובחר אישור. תכונה זו יוצרת פלט עם עלילת הסתברות כפונקציה של dp.
- קבע את ההתפלגות האופטימלית תחת השווה התפלגויות על-ידי בדיקת התפלגויות לא-פאראמטריות, לוג-נורמליות, ווייבול, לוגיות ונורמליות.
- הערך את איכות התאמת המודל לפי הערכים המספריים הנמוכים ביותר עבור קריטריוני המידע של Akaike ו- Bayesian (AIC ו- BIC, בהתאמה) בטבלת השוואת מודל הסטטיסטיקה מתחת לגרף לפי מספרי ה- BIC הנמוכים ביותר. מודל ההתאמה הטובה ביותר מוצג בשורה הראשונה כברירת מחדל. שדות פלט של אומדן פרמטרי או לא-פאראמטרי עבור כל הערכת התפלגות ממוקמים מתחת לגרף השוואת התפלגויות .
- שמור את סקריפט הפלט בטבלת הנתונים על-ידי בחירת המשולש הנפתח האדום בפינה השמאלית העליונה על-ידי שמירת סקריפט > לטבלת נתונים. לאחר מכן, שמור את טבלת הנתונים המקורית במיקום הקובץ הרצוי על-ידי בחירה באפשרות קובץ > שמירה בשם > *.jmp.
13. אפיון ממדי של NPs באמצעות פיזור אור דינמי
- הפעל את תוכנת פיזור האור הדינמי (DLS) על ידי לחיצה כפולה על סמל שולחן העבודה. בחר קובץ > > חדש SOP. הוסף שם לדוגמה ומדד שבירה של חומרים נבחרים ל- 1.33 עבור מים מזוקקים ו- 1.59 עבור פולימרים33 בתוכנת DLS תחת הגדרת דגימה. בחר חומר בתפריט הנפתח ולאחר מכן לחץ על אישור.
הערה: לחיצה על התפריט הנפתח פותחת את מנהל החומרים, המציע להוסיף דוגמאות חדשות או לשנות דוגמאות קיימות על-ידי שינוי מקדם השבירה והקליטה. בחר כמים מפזרים. - בחר את התא המתאים תחת סוג תא > תא ובחר דוחות כדי לקבוע איזה פלט יוצג לאחר כל מדידה.
- הפעל את המכשיר על-ידי סגירת מכסה המכשיר והפעלת המערכת על-ידי סגירת המכסה (אם פתוח) ולחיצה על לחצן ON . המתן לאחר הצפצוף הראשון והמתן כ-30 דקות כדי לאפשר ייצוב של הקורה.
- המתן עד להשלמת שגרת האתחול והמתן לצליל צפצוף שני, המציין כי הטמפרטורה שנקבעה מראש (בדרך כלל 25 מעלות צלזיוס) הגיעה.
- הכינו דגימה של NPs (כפי שהתקבל בשלב 7) ומי DI בבקבוקון של 15 מ"ל בריכוז של ~0.1 wt% על ידי ערבוב מגנטי במשך ~1 שעות כדי לאפשר לערבב היטב.
- לנער את slurry לפני העברת ~ 1.0 מ"ל לתוך קוורץ 4.5 מ"ל cuvette ולפתוח את המכסה. לאחר מכן, הכנס בזהירות את תא הדגימה למחזיק הדגימה של מכשיר ה- DLS.
הערה: הכן שלוש דגימות מאותה אצווה של slurry באותו ריכוז כמתואר בשלב 13.5. - בצע שלוש מדידות (בחירה בתוכנת DLS) עבור כל דגימה. בין המדידות, הסר את תא הדגימה ונער בעדינות את הדגימות במשך 5 שניות כדי לאפשר ערבוב של הדגימה.
- חלץ וייצא נתונים באמצעות תוכנת DLS, העבר את ערכת הנתונים לתוכנת הגיליון האלקטרוני וצור היסטוגרמות עבור MPs ו- NPs כמתואר בשלבים 11.1-11.5 (איור 1). העתק מהכרטיסיה תצוגת רשומות טבלה או גרף על-ידי בחירה באפשרות ערוך-העתק, שניתן להדביק ביישום אחר, כגון תוכנת הגיליון האלקטרוני.
14. אנליזה כימית של MNPs באמצעות טרנספורמציית פורייה אינפרא אדום (FTIR) ספקטרומטריה מוחלשת סה"כ (ATR)
הערה: ניתוחים כימיים של MNPs על ידי ספקטרוסקופיות אינפרה-אדום של התמרת פורייה (FTIR) ותהודה מגנטית גרעינית (NMR) הם כלים מתאימים היטב להערכת ההשפעה של שחיקה רטובה על תכונות הקשר הכימי, כמו גם על הכמויות היחסיות של רכיבים עיקריים והמרכיבים המונומריים של הפולימרים, בהתאמה10. בנוסף, ניתן להעריך את התכונות התרמיות ואת היציבות של המרכיבים הפולימריים של MNPs באמצעות קלורימטריה סריקה דיפרנציאלית (DSC) ואנליזה תרמוגרווימטרית (TGA),בהתאמה 29.
- נקו את מערכת הגילוי (משטח גבישי ATR) עם אתנול ומטלית נטולת מוך.
- הפעל את התוכנה ולחץ על לחצן רקע בסרגל הפקודות כדי לבצע סריקת רקע באוויר על-ידי ניקוי נתיב קרן המכשיר. ספקטרום הרקע מוצג זמן קצר לאחר האיסוף.
- הזן מזהה לדוגמה ותיאור לדוגמה בסרגל הכלים של הגדרות המכשיר.
- כוונן את מספר הגל הספקטרלי בין 4000 ס"מ-1 ל- 600 ס"מ-1 ובחר רזולוציה של 2.0 ס"מ-1 במצב ספיגה. בחר 32 סריקות לכל ספקטרום והתחל.
- הנח דגימת פלסטיק (~ 20 מ"ג או ~ 1-3 מ"מ3) של חברי פרלמנט (106 מיקרומטר) ו- NPs (~ 300 ננומטר) בתוך מכונת כביסה מפלדה בקוטר פנימי של ~ 10 מ"מ, או שווה ערך, על משטח הגביש.
הערה: מכונת הכביסה מונעת פיזור על גביש כאשר בעל הדגימה דוחס את הדגימה, וכתוצאה מכך אי-הומוגניות של חומר והטיית נתונים עקב מדידות לא עקביות. - מניחים את מכונת הכביסה במרכז גביש ה-ATR ומוסיפים את דגימת הפולימר לאמצע פתח מכונת הכביסה בעזרת מרית.
- הניפו את ידית הדגימה למעלה למרכז הדגימה וסובבו את הידית בכיוון השעון על ידי ניטור כוח מד הכוח בין 50-90. המדגם מציג את הספקטרום הראשוני. לחץ על לחצן סרוק פעם נוספת כדי לאסוף את הספקטרום.
- אסוף בין 8-10 ספקטרום על ידי לחיצה על כפתור הסריקה וערבב את הדגימות בקפידה לאחר כל מדידה עם מרית כדי לאפשר איסוף של תוצאות מייצגות.
- לחץ על התיקיה תצוגת דוגמה בסייר הנתונים כדי להציג את כל הדגימות שנאספו על גבי אזור התצוגה. ראשית, הסר ספקטרום סוטה משמעותית המייצג חריגים. לאחר מכן, בחר במצב ספיגה או העברה בסרגל הכלים.
- שמור את הספקטרום על-ידי בחירת התיקייה Sample View המכילה את הספקטרום ובחירה באפשרות Save As מתפריט הקובץ. חלון הדו-שיח מאפשר את שם הקובץ, ספריית היעד ושינוי מיקום ברירת המחדל עבור כל הספקטרום.
הערה: לחלופין, ניתן לשמור את הספקטרום כקובץ *.sp על-ידי בחירת ספקטרום ולחיצה באמצעות לחצן העכבר הימני כדי להציג את האפשרות הבינארית. בחר שמור בינארי ועיין במיקום השמירה הסופי. - בצע תיקון בסיסי ונורמליזציה ממוצעת על-ידי בחירת ספקטרום יחיד בסייר הנתונים על-ידי בחירת תהליך > נורמליזציה בתפריט באמצעות התוכנה או בשלב הבא.
הערה: נורמליזציה ממוצעת מפצה על שגיאות ספקטרליות עקב עובי או שונות החומר בדגימה. - נקו את אזור הגביש עם אתנול ומטלית נטולת מוך עם השלמת איסוף הנתונים.
- לפרש הבדלים בין חברי פרלמנט ו- NPs על פי רצועות רטט FTIR שהוקצו, שהוקצו והוערכו בפרסום קודם10.
תוצאות
כדי לאמת את שיטת הפרוצדורה הניסויית ואת הניתוח, חברי פרלמנט ו- NPs נוצרו מכדורים וחומרי פילם והושוו לפי גודל וצורה באמצעות תמונות מיקרוסקופיות. השיטה המתוארת באיור 1 יצרה ביעילות חברי פרלמנט ו-NPs מכדורי פלסטיק מתכלים ומסרטים; זה הושג באמצעות קירור קריוגני, כרסום, טחינה רטובה ...
Discussion
שיטה זו מתארת תהליך יעיל שתואר לראשונה בפרסום קודם29, להכנת MNPs שמקורם בכופתיות ויריעות חיפוי למחקרים סביבתיים. תהליך הקטנת הגודל כלל קירור קריוגני (לסרט בלבד), כרסום יבש ושלבי השחזה רטובים, לייצור MNPs מודל. יישמנו שיטה זו כדי להכין MNPs ממגוון רחב של חומרי הזנה פולימריים, כולל פולי...
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
מחקר זה מומן על ידי מכללת הרברט לחקלאות, המחלקה להנדסת ביו-מערכות וקרקע, והברית המדעית באוניברסיטת טנסי, נוקסוויל. יתר על כן, המחברים מודים על התמיכה הכספית הניתנת באמצעות מענק USDA 2020-67019-31167 עבור מחקר זה. חומרי ההזנה הראשוניים להכנת MNPs של סרט חיפוי מתכלה מבוסס PBAT סופקו בחביבות על ידי BioBag Americas, Inc. (Dunevin, FL, ארה"ב), וכדורי PBAT על ידי Mobius, LLC (לנואר סיטי, טנסי).
Materials
| Name | Company | Catalog Number | Comments |
| Aluminum dish, 150 mL | Fisher Scientific, Waltham, MA, USA | 08-732-103 | Drying of collected NPs |
| Aluminum dish, 500 mL | VWR International, Radnor, PA, USA | 25433-018 | Collecting NPs after wet-grinding |
| Centrifuge | Fisher Scientific, Waltham, MA, USA | Centrific 228 | Container for centrifugation |
| Delivery tube, #20, 840 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M30 | Sieving of the first fraction during milling |
| Delivery tube, #60, 250 µm | Thomas Scientific, Swedesboro, NJ, USA | 3383M45 | Sieving of the second fraction (3x) during milling |
| Thermomixer, 5350 Mixer | Eppendorf North America, Enfield, CT, USA | 05-400-200 | Analysis of sieving experiments |
| FT-IR Spectrum Two, spectrometer with attenuated total reflectance (ATR) | Perkin Elmer, Waltham, MA, USA | L1050228 | Measuring FTIR spectra |
| Glass beaker, 1000 mL | DWK Life Sciences, Milville, NJ, USA | 02-555-113 | Stirring of MPs-water slurry before grinding |
| Glass front plate | Thomas Scientific, Swedesboro, NJ, USA | 3383N55 | Front cover plaste for Wiley Mini Mill |
| Glass jar, 50 mL | Uline, Pleasant Prairie, WI, USA | S-15846P | Collective MPs after milling |
| Glove Box, neoprene | Bel-Art-SP Scienceware, Wayne, NJ, USA | BEL-H500290000 | 22-Inch, Size 10 |
| Zetasizer Nano ZS 90 size analyzer | Malvern Panalytical, Worcestershire, UK | Zetasizer Nano ZS | Measuring nanoplastics dispersed in DI-water |
| Microscope camera | Nikon, Tokyo, 108-6290, Japan | Nikon Digital Sight 10 | Combined with Olympus microscope to receive digital images |
| Microscope | Olympus, Shinjuku, Tokyo, Japan | Model SZ 61 | Imaging of MPs |
| Nitrogen jar, low form dewar flasks | Cole-Palmer, Vernon Hills, IL, USA | UX-03771-23 | Storage of liquid nitrogen during cryogenic cooling |
| Accurate Blend 200, 12-speed blender | Oster, Boca Raton, FL, USA | 6684 | Initiating the size reduction of cryogenically treated plastic film |
| PBAT film, - BioAgri™ (Mater-Bi®) | BioBag Americas, Inc, Dunedin, FL, USA | 0.7 mm thick | Feedstock to form MPs and NPs, agricultural mulch film |
| PBAT pellets | Mobius, LLC, Lenoir City, TN, USA | Diameter 3 mm | Feedstock to form microplastics (MPs) and nanoplastics (NPs) trough milling and grinding |
| Plastic centrifuge tubes, 50 mL | Fisher Scientific, Waltham, MA, USA | 06-443-18 | Centrifugation of slurry after wet-grinding |
| Plastic jar, 1000 mL, pre-cleaned, straight sided | Fisher Scientific, Waltham, MA, USA | 05-719-733 | Collection of NPs during and after wet grinding |
| Polygon stir bars, diameterø=8 mm, length=50.8 mm | Fisher Scientific, Waltham, MA, USA | 14-512-127 | Stirring of MPs slurry prior to wet-grinding |
| Scissors, titanium bonded | Westcott, Shelton, CT, USA | 13901 | Cutting of initial PBAT film feedstocks |
| Square glass cell with square aperture and cap, 12 mm O.D. | Malvern Panalytical, Worcestershire, UK | PCS1115 | Measuring of NPs particle size |
| Stainless steel bottom, 3 inch, pan | Hogentogler & Co. Inc, Columbia, MD, USA | 8401 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 140 (106 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1308 | For sieving after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 20 (850 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1296 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 325 (45 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1313 | Sieving of MPs after Wiley-milling |
| Stainless steel sieve, 3 inch, No. 60 (250 µm) | Hogentogler & Co. Inc, Columbia, MD, USA | 1303 | Sieving of MPs after Wiley-milling |
| Stainless steel top cover, 3 inch | Hogentogler & Co. Inc, Columbia, MD, USA | 8406 | Sieving of MPs after Wiley-milling |
| Stainless steel tweezers | Global Industrial, Port Washington, NY, USA | T9FB2264892 | Transferring of frozen film particles from jar into blender |
| Vacuum oven, model 281A | Fisher Scientific, Waltham, MA, USA | 13-262-50 | Vacuum oven to dry NPs after wet-grinding |
| Friction grinding machine, Supermass Colloider | Masuko Sangyo, Tokyo, Japan | MKCA6-2J | Grinding machine to form NPs from MPs |
| Wet-grinding stone, grit size: 297 μm -420 μm | Masuko Sangyo, Tokyo, Japan | MKE6-46DD | Grinding stone to form NPs from MPs |
| Wiley Mini Mill, rotary cutting mill | Thomas Scientific, Swedesboro, NJ, USA | NC1346618 | Size reduction of pellets and film into MPs and NPs |
| Software | |||
| FTIR-Spectroscopy software | Perkin Elmer, Waltham, MA, USA | Spectrum 10 | Collection of spectra from the initial plastic, MPs and NPs |
| Image J, image processing program | National Institutes of Health, Bethesda, MD, USA | Version 1.53n | Analysis of digital images received from microscopy |
| Microscope software, ds-fi1 software | Malvern Panalytical , Malvern, UK | Firmware DS-U1 Ver3.10 | Recording of digital images |
| Microsoft, Windows, Excel 365, spreadsheet software | Microsoft, Redmond, WA, USA | Office 365 | Calculating the average particle size and creating FTIR spectra images |
| JMP software, statistical software | SAS Institute Inc., Cary, NC, 1989-2021 | Version 15 | Statistical analysis of particle size and perform best fit of data set |
| Unscrambler software | Camo Analytics, Oslo, Norway | Version 9.2 | Normalizing and converting FTIR spectra into .csv fromat |
References
- Jin, Z., Dan, L. Review on the occurrence, analysis methods, toxicity and health effects of micro-and nano-plastics in the environment. Environmental Chemistry. (1), 28-40 (2021).
- Kumar, M., et al. Current research trends on micro-and nano-plastics as an emerging threat to global environment: a review. Journal of Hazardous Materials. 409, 124967 (2021).
- Alimba, C. G., Faggio, C., Sivanesan, S., Ogunkanmi, A. L., Krishnamurthi, K. Micro (nano)-plastics in the environment and risk of carcinogenesis: Insight into possible mechanisms. Journal of Hazardous Materials. 416, 126143 (2021).
- Serrano-Ruiz, H., Martin-Closas, L., Pelacho, A. M. Biodegradable plastic mulches: Impact on the agricultural biotic environment. Science of The Total Environment. 750, 141228 (2021).
- Hayes, D. G., et al. Biodegradable plastic mulch films for sustainable specialty crop production. Polymers for Agri-Food Applications. , 183-213 (2019).
- Viaroli, S., Lancia, M., Re, V. Microplastics contamination of groundwater: Current evidence and future perspectives. A review. Science of The Total Environment. , 153851 (2022).
- Rillig, M. C., Lehmann, A. Microplastic in terrestrial ecosystems. Science. 368 (6498), 1430-1431 (2020).
- Anunciado, M. B., et al. Effect of environmental weathering on biodegradation of biodegradable plastic mulch films under ambient soil and composting conditions. Journal of Polymers and the Environment. 29 (9), 2916-2931 (2021).
- Yang, Y., et al. Kinetics of microplastic generation from different types of mulch films in agricultural soil. Science of The Total Environment. 814, 152572 (2022).
- Hayes, D. G., et al. Effect of diverse weathering conditions on the physicochemical properties of biodegradable plastic mulches. Polymer Testing. 62, 454-467 (2017).
- Schwaferts, C., Niessner, R., Elsner, M., Ivleva, N. P. Methods for the analysis of submicrometer-and nanoplastic particles in the environment. TrAC Trends in Analytical Chemistry. 112, 52-65 (2019).
- Gigault, J., et al. Current opinion: what is a nanoplastic. Environmental Pollution. 235, 1030-1034 (2018).
- Naqash, N., Prakash, S., Kapoor, D., Singh, R. Interaction of freshwater microplastics with biota and heavy metals: a review. Environmental Chemistry Letters. 18 (6), 1813-1824 (2020).
- Manzoor, S., Naqash, N., Rashid, G., Singh, R. Plastic material degradation and formation of microplastic in the environment: A review. Materials Today: Proceedings. , 3254-3260 (2022).
- de Souza Machado, A. A., et al. Impacts of microplastics on the soil biophysical environment. Environmental Science & Technology. 52 (17), 9656-9665 (2018).
- Jacques, O., Prosser, R. A probabilistic risk assessment of microplastics in soil ecosystems. Science of The Total Environment. 757, 143987 (2021).
- Kwak, J. I., An, Y. -. J. Microplastic digestion generates fragmented nanoplastics in soils and damages earthworm spermatogenesis and coelomocyte viability. Journal of Hazardous Materials. 402, 124034 (2021).
- Wahl, A., et al. Nanoplastic occurrence in a soil amended with plastic debris. Chemosphere. 262, 127784 (2021).
- Vighi, M., et al. Micro and nano-plastics in the environment: research priorities for the near future. Reviews of Environmental Contamination and Toxicology Volume 257. , 163-218 (2021).
- Pironti, C., et al. Microplastics in the environment: intake through the food web, human exposure and toxicological effects. Toxics. 9 (9), 224 (2021).
- Zurier, H. S., Goddard, J. M. Biodegradation of microplastics in food and agriculture. Current Opinion in Food Science. 37, 37-44 (2021).
- Horton, A. A., Dixon, S. J. Microplastics: An introduction to environmental transport processes. Wiley Interdisciplinary Reviews: Water. 5 (2), 1268 (2018).
- Panno, S. V., et al. Microplastic contamination in karst groundwater systems. Groundwater. 57 (2), 189-196 (2019).
- Su, Y., et al. Delivery, uptake, fate, an transport of engineered nanoparticles in plants: a critical review and data analysis. Environmental Science: Nano. 6 (8), 2311-2331 (2019).
- Yu, Y., Griffin-LaHue, D. E., Miles, C. A., Hayes, D. G., Flury, M. Are micro-and nanoplastics from soil-biodegradable plastic mulches an environmental concern. Journal of Hazardous Materials Advances. 4, 100024 (2021).
- Hayes, D. G. Enhanced end-of-life performance for biodegradable plastic mulch films through improving standards and addressing research gaps. Current Opinion in Chemical Engineering. 33, 100695 (2021).
- Qin, M., et al. A review of biodegradable plastics to biodegradable microplastics: Another ecological threat to soil environments. Journal of Cleaner Production. 312, 127816 (2021).
- Phuong, N. N., et al. Is there any consistency between the microplastics found in the field and those used in laboratory experiments. Environmental Pollution. 211, 111-123 (2016).
- Astner, A., et al. Mechanical formation of micro-and nano-plastic materials for environmental studies in agricultural ecosystems. Science of The Total Environment. 685, 1097-1106 (2019).
- Rist, S., Hartmann, N. B. Aquatic ecotoxicity of microplastics and nanoplastics: lessons learned from engineered nanomaterials. Freshwater Microplastics. , 25-49 (2018).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nature Methods. 9 (7), 671-675 (2012).
- Raju, S., et al. Improved methodology to determine the fate and transport of microplastics in a secondary wastewater treatment plant. Water Research. 173, 115549 (2020).
- Caputo, F., et al. Measuring particle size distribution and mass concentration of nanoplastics and microplastics: addressing some analytical challenges in the sub-micron size range. Journal of Colloid and Interface Science. 588, 401-417 (2021).
- Xu, M., et al. Polystyrene microplastics alleviate the effects of sulfamethazine on soil microbial communities at different CO2 concentrations. Journal of Hazardous Materials. 413, 125286 (2021).
- Ding, L., et al. Insight into interactions of polystyrene microplastics with different types and compositions of dissolved organic matter. Science of The Total Environment. 824, 153883 (2022).
- Abbasimaedeh, P., Ghanbari, A., O'Kelly, B. C., Tavanafar, M., Irdmoosa, K. G. Geomechanical behaviour of uncemented expanded polystyrene (EPS) beads-clayey soil mixtures as lightweight fill. Geotechnics. 1 (1), 38-58 (2021).
- Li, Z., Li, Q., Li, R., Zhou, J., Wang, G. The distribution and impact of polystyrene nanoplastics on cucumber plants. Environmental Science and Pollution Research. 28 (13), 16042-16053 (2021).
- Sobhani, Z., Panneerselvan, L., Fang, C., Naidu, R., Megharaj, M. Chronic and transgenerational effects of polystyrene microplastics at environmentally relevant concentrations in earthworms (Eisenia fetida). Environmental Toxicology and Chemistry. 40 (8), 2240-2246 (2021).
- Lionetto, F., Esposito Corcione, C., Rizzo, A., Maffezzoli, A. Production and characterization of polyethylene terephthalate nanoparticles. Polymers. 13 (21), 3745 (2021).
- Dümichen, E., et al. Analysis of polyethylene microplastics in environmental samples, using a thermal decomposition method. Water Research. 85, 451-457 (2015).
- Robotti, M., et al. Attrition and cryogenic milling production for low pressure cold gas spray and composite coatings characterization. Advanced Powder Technology. 27 (4), 1257-1264 (2016).
- Ducoli, S., et al. A different protein corona cloaks "true-to-life" nanoplastics with respect to synthetic polystyrene nanobeads. Environmental Science: Nano. 9 (4), 1414-1426 (2022).
- El Hadri, H., Gigault, J., Maxit, B., Grassl, B., Reynaud, S. Nanoplastic from mechanically degraded primary and secondary microplastics for environmental assessments. NanoImpact. 17, 100206 (2020).
- Eitzen, L., et al. The challenge in preparing particle suspensions for aquatic microplastic research. Environmental research. 168, 490-495 (2019).
- Ekvall, M. T., et al. Nanoplastics formed during the mechanical breakdown of daily-use polystyrene products. Nanoscale advances. 1 (3), 1055-1061 (2019).
- Caldwell, J., et al. Fluorescent plastic nanoparticles to track their interaction and fate in physiological environments. Environmental Science: Nano. 8 (2), 502-513 (2021).
- Zeb, A., et al. Evaluating the knowledge structure of micro-and nanoplastics in terrestrial environment through scientometric assessment. Applied Soil Ecology. 177, 104507 (2022).
- Ji, Z., et al. Effects of pristine microplastics and nanoplastics on soil invertebrates: A systematic review and meta-analysis of available data. Science of The Total Environment. 788, 147784 (2021).
- de Alkimin, G. D., Gonçalves, J. M., Nathan, J., Bebianno, M. J. Impact of micro and nanoplastics in the marine environment. Assessing the Effects of Emerging Plastics on the Environment and Public Health. , 172-225 (2022).
- Pires, A., Cuccaro, A., Sole, M., Freitas, R. Micro (nano) plastics and plastic additives effects in marine annelids: A literature review. Environmental Research. , 113642 (2022).
- Hurley, R. R., Nizzetto, L. Fate and occurrence of micro (nano) plastics in soils: Knowledge gaps and possible risks. Current Opinion in Environmental Science & Health. 1, 6-11 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved