Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Conceptos básicos de histología y detección de muerte celular en tejido de abeja melífera
En este artículo
Resumen
Los métodos inmunohistoquímicos son útiles en la investigación de abejas melíferas para detectar y evaluar el nivel de apoptosis y necrosis en el intestino medio y las glándulas hipofaríngeas de las abejas adultas.
Resumen
Las abejas melíferas (Apis mellifera L.) dentro de la colmena (obreras nodrizas y otras abejas de la colmena) y fuera de la colmena (recolectoras) están expuestas a cambios climáticos y climáticos, diversos pesticidas, patógenos y desnutrición, que ingresan principalmente por la boca y afectan principalmente el tracto digestivo de las abejas adultas. Para comprender y prevenir los efectos de tales factores estresantes externos e internos en las abejas, un método de investigación útil es el método inmunohistoquímico. Se describe un protocolo básico para preparar el intestino medio (ventrículo) y las glándulas hipofaríngeas (HPG) de las abejas adultas para el análisis histológico. Se describe una metodología detallada para evaluar el nivel de daño celular y distinguir la necrosis de la muerte celular programada (apoptosis) como un proceso natural de regeneración tisular. Se presentan los resultados del tratamiento de abejas adultas con ácido oxálico y pesticidas (insecticida y acaricida) y la determinación de la muerte celular en el ventrículo y HPG. También se discuten los pros y los contras de la metodología.
Introducción
Las abejas melíferas (Apis mellifera L.) son, entre otros polinizadores silvestres, los polinizadores más importantes de las plantas agrícolas. Durante miles de años, el entorno cambiante ha influido en las abejas para adaptar su morfología, fisiología, comportamiento y tolerancia a varios patógenos y parásitos. Por lo tanto, las abejas han desarrollado una gama muy diversa de especies y subespecies en todo el mundo1. Estos resultados son consistentes con hallazgos previos, que existe variación genética en la estructura del tracto digestivo de la abeja, pero también sugieren que las alteraciones del intestino medio se deben a factores ambientales 2,3.
El tracto digestivo de la abeja melífera tiene tres partes principales: intestino anterior, intestino medio (ventrículo) e intestino posterior4. El ventrículo es un órgano esencial para la digestión del polen y el néctar/miel; En el intestino posterior, el control osmótico tiene lugar a través de la absorción de agua e iones2. Las glándulas hipofaríngeas (HPG) de las obreras de las abejas melíferas se encuentran en la cabeza y sintetizan y secretan componentes de jalea real para alimentar a la cría, la reina y los miembros de la colonia. Su tamaño cambia con la edad y las tareas y depende de una nutrición adecuada (polen de calidad). Las enfermeras trabajadoras de 6 a 18 días realizan la cría de crías, y el tamaño de las HPG aumenta 5,6. En las abejas forrajeras, las HPG degeneran y sólo secretan enzimas que son importantes para convertir los azúcares complejos en simples (α-glucosidasas, leucina arilamidasa, invertasa) en la miel7.
Las abejas están expuestas a varios factores estresantes bióticos y abióticos8, y el tracto digestivo puede verse afectado por varios estimulantes negativos. La primera barrera que protege al organismo de los patógenos es la membrana peritrófica en el intestino medio, que consiste en mucosa intestinal para proteger contra patógenos4. El desarrollo y la función de los HPG dependen de la dieta, la edad y la condición de la colonia9, y se ven afectados por insecticidas, acaricidas 10 y patógenos11,12,13. Los residuos acaricidas en la colmena debido al tratamiento de control de varroa y pesticidas del medio ambiente afectan a las abejas recolectoras y a las abejas nodrizas14,15. La mayor amenaza para las colonias de abejas melíferas es el ácaro Varroa destructor, tanto como vector de virus que contribuyen a la pérdida de colonias16 como consumidor del cuerpo graso del huésped (un órgano vital importante en las abejas), que consecuentemente afecta el cuerpo del individuo y las funciones de la colonia17.
Sin embargo, los hábitats intensivos de tierras de cultivo pueden proporcionar un suministro de alimentos a corto plazo para las abejas. Por lo tanto, los regímenes agroambientales deben mejorar la disponibilidad de flores de miel en los paisajes agrícolas18. Para evaluar la morfología de diferentes subespecies 6,19,20,21 o los efectos subletales de estos factores a nivel celular o tisular, especialmente el intestino medio y las HPG, los métodos histológicos e inmunohistoquímicos son prácticos y suficientemente precisos para ser utilizados en la investigación histológica en abejas.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Histología básica para la investigación de las abejas melíferas
- Disección de tejido de abeja melífera
NOTA: Para la disección de abejas obreras, use un microscopio de disección con una fuente de luz LED. El aumento más útil es ~20x.- Manipulación y disección
- Tome con cuidado una abeja obrera con fórceps y póngala en hielo (o en el congelador a -20 ° C) durante 2 minutos para inmovilizarla22. Fije la abeja en la placa de Petri diagonalmente a través de la parte posterior superior del tórax dos veces, de izquierda a derecha y de derecha a izquierda.
- Vierta solución salina de insectos para cubrir el cuerpo. Coloque la placa de Petri bajo el microscopio, enfoque y ajuste.
- Prepare los instrumentos (consulte la Tabla de materiales).
- Disección del intestino medio
- Comience con el abdomen insertando un punto de las tijeras debajo de la tergita A5 (Figura 1) en el centro del lado derecho del cuerpo de la abeja. Corte a la tergita A2.
- Mantenga la hoja interna de las tijeras paralela al costado del cuerpo para evitar dañar los órganos internos. Gire las tijeras a la izquierda y haga un corte; Gire a la derecha y haga otro corte. Abra suavemente la parte izquierda del abdomen y fíjelo. Repita en el otro lado.
- Usando fórceps con una mano, tire suavemente del estómago de la abeja hacia arriba, y con tijeras en la otra mano, corte al final del esófago. Tire del estómago y el intestino medio lejos del abdomen y corte en el recto. Use una pipeta con solución salina de insectos y retire cualquier heces o partes del tejido.
- Disección de HPG
- Inmovilizar una abeja obrera en hielo como se describe en el paso 1.1.1. Corte la cabeza y colóquela en la placa más pequeña con las antenas hacia arriba. Asegure la cabeza con dos clavos: uno a través del ojo compuesto izquierdo y el segundo a través del ojo compuesto derecho.
- Haga un corte a través del primer ojo compuesto en el lado interno de los alfileres, continúe hasta el labrum y luego haga otro corte en el otro lado a través del segundo ojo compuesto (Figura 2).
- Corte las antenas. Quítese la máscara y córtela donde aún esté sujeta. Tome los fórceps y retire cuidadosamente las glándulas junto con el cerebro y parte de los ojos compuestos.
- Manipulación y disección
- Fijación, deshidratación e incrustación de parafina
NOTA: Use guantes protectores.- Coloque el pañuelo en frascos de penicilina, llenos 3/4 con 10% de formalina. Conservar en nevera a 4 °C.
- Después de 24 h, deshidratar el tejido en una serie de alcoholes: 70%, 80%, 90%, 100%, durante 1 h cada uno, 100% 2-propanol durante 1 h, 100% 2-propanol durante 12 h, y finalmente 100% 2-propanol durante 1 h.
- Coloque el tejido en histocasetes; márquelos y colóquelos en las cámaras de vidrio con 2-propanol y parafina (1:1) en una incubadora a 60 °C durante 24 h.
- Mover los histocasetes a otra cámara con parafina (I.) durante otras 24 h. Repetir el procedimiento con parafina fresca dos veces más (II. y III.), ambas durante 24 h.
- Finalmente, prepare la estación de montaje y comience a incrustar el tejido en cera.
- Abra cada histocasete y retire la cubierta. Llene el molde con cera y coloque cuidadosamente el pañuelo con pinzas tibias en el centro del molde.
- Coloque el histocasete en el molde y cúbralo ligeramente con cera. Coloque inmediatamente el molde en la superficie fría de la estación de montaje durante unos segundos, luego colóquelo en la placa fría durante unos minutos hasta que la cera se endurezca y se separe del molde y del histocasete.
- Guarde las muestras terminadas en una caja, lejos del polvo y el calor.
- Corte secciones delgadas de 4 μm en un micrótomo: primero, dos secciones unidas entre sí y luego una por separado. Transfiera las secciones con pinzas y déjelas flotar en agua destilada (42 ° C), luego recójalas en toboganes limpios colocando dos secciones juntas en el lado izquierdo del vidrio objetivo y la tercera en el lado derecho, permaneciendo claramente separadas. Deje los portaobjetos marcados durante la noche en el dispositivo de calentamiento y finalmente guárdelos en una caja dedicada a muestras histológicas.
- Desparafinado y rehidratación
NOTA: Use guantes protectores.- Prepare nueve frascos de Coplin y coloque las secciones en una serie de agentes de limpieza (I., II., III.) durante 5 minutos cada uno.
- Poner en 2-propanol, etanol 96% (I., II.), alcohol 90% y 80%, y agua destilada durante 3 min cada uno.
- Teñido con hematoxilina y eosina
NOTA: Use guantes protectores.- Prepara seis frascos de Coplin.
- Para la tinción de hematoxilina y eosina (H&E), coloque las secciones desparafinadas y rehidratadas en hematoxilina durante 5 minutos, luego colóquelas cuidadosamente debajo del agua corriente del grifo durante 2 minutos. Luego póngalos en agua destilada durante 1 minuto y eosina durante 4 minutos (para la eosina, el frasco de Coplin no es necesario).
- Coloque los portaobjetos en etanol al 96% durante 1 minuto, luego 2-propanol durante 2 minutos y finalmente en el agente de limpieza durante 2 minutos.
- Agregue el medio de montaje y un vidrio de cubierta y déjelos secar. Observe bajo un microscopio de luz.
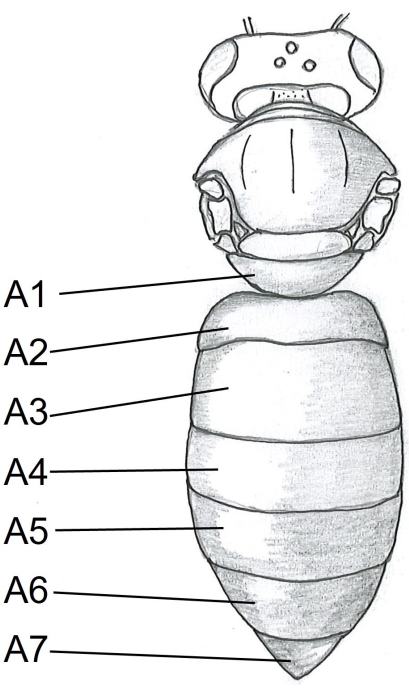
Figura 1: Vista dorsal del cuerpo de la abeja. Tergitas A1-A7. Las instrucciones detalladas sobre la disección de abejas melíferas se pueden encontrar en Carreck et al.24. Haga clic aquí para ver una versión más grande de esta figura.
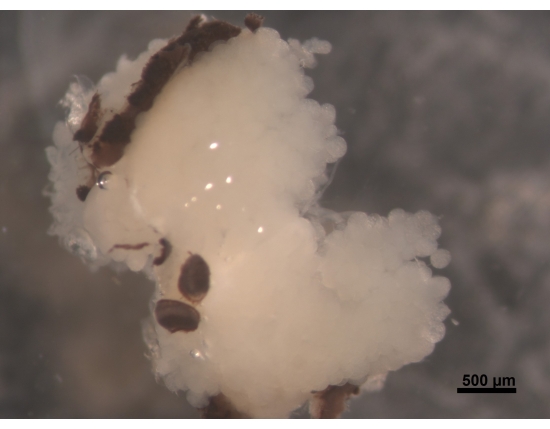
Figura 2: Vista dorsal de HPG, partes de ojos compuestos unidos al cerebro (no visibles). Una abeja obrera joven de 5 a 6 días tiene HPG blancos regordetes y cremosos. Los acinos se encuentran en el cerebro y llenan el área de la cabeza con ramas que llegan a la parte posterior del cerebro. En las abejas forrajeras, estas glándulas se encogen mucho y dejan solo restos delgados en forma de hilo. Por esta razón, es mejor extirpar las glándulas junto con el cerebro para facilitar los procedimientos adicionales para evitar perder el tejido. Barra de escala = 500 μm. Haga clic aquí para ver una versión más grande de esta figura.
2. Detección de muerte celular en secciones de tejido
- Kit de detección de apoptosis (Ensayo A)
NOTA: Siga el protocolo del fabricante (consulte la Tabla de materiales).- Prepare los frascos de Coplin.
- Después de desparafinar y rehidratar (ver paso 1.3), sumergir los portaobjetos en una solución de NaCl al 0,85% y, a continuación, en solución salina tamponada con fosfato (PBS) (5 min).
- Poner los portaobjetos en paraformaldehído al 4% 2 x 15 min.
- Coloque los portaobjetos planos en el recipiente y agregue 100 μL de una solución de proteinasa K (20 μg / ml), luego déjelos durante 10-30 minutos.
- Coloque las diapositivas en PBS (5 min).
- Coloque los portaobjetos en paraformaldehído al 4% en PBS (5 min).
- Sumergir las diapositivas en PBS (2 x 5 min).
- Coloque los portaobjetos planos en el recipiente, agregue 100 μL de tampón de equilibrio y déjelos durante 5-10 minutos.
- Añadir 100 μL de mezcla de reacción TdT. Coloque toallas de papel dentro del recipiente, alrededor de los toboganes, humedezca las toallas con agua y luego cúbralas con una envoltura de plástico. Incubar los portaobjetos durante 60 min a 37 °C.
- Vuelva a colocar los portaobjetos en la rejilla de tinción y sumérjalos en 2x citrato de sodio salino (SSC) durante 15 min.
- Sumerja las diapositivas 3 x 5 min en PBS, luego en peróxido de hidrógeno al 0,3% durante 3-5 min, y luego en PBS nuevamente, 3 x 5 min.
- Nuevamente, coloque los portaobjetos planos en el recipiente, agregue 100 μL de Streptavidin HRP (peroxidasa de rábano picante) y déjelos actuar durante 30 minutos (cubra con una envoltura de plástico).
- Sumerge las diapositivas 3 x 5 min en PBS.
- Colocar los portaobjetos planos en el recipiente y añadir 100 μL de solución de 3,3'-diaminobencidina (DAB). Busca un fondo marrón claro.
- Devuelva los portaobjetos a la rejilla y lávelos varias veces en agua (doble destilación).
- Monte las guías bajo cubreobjetos de vidrio en medio de montaje y déjelas secar.
- Observe bajo un microscopio de luz.
- Kit de detección de apoptosis (Ensayo B)
NOTA: Siga el protocolo del fabricante (consulte la Tabla de materiales).- Prepare frascos de Coplin.
- Preparar proteinasa K (20 μg/ml diluidos en PBS).
- Después de desparafinar y rehidratar las secciones (paso 1.3), coloque los portaobjetos en PBS durante 5 min.
- Coloque los portaobjetos planos en el recipiente y agregue proteinasa K (20 μg/ml, 60 μl por muestra de 5 cm²).
- Lave los toboganes 2 x 2 min en agua destilada.
- Enfriamiento en peroxidasa endógena (en peroxidasa de hidrógeno al 3%) a temperatura ambiente.
- Enjuague los toboganes 2 x 5 min con PBS o agua.
- Coloque los portaobjetos planos en el recipiente y aplique un tampón de equilibrio (75 μL/5 cm2) durante 10 s a temperatura ambiente.
- Limpie cuidadosamente alrededor del pañuelo.
- Añadir la enzima TdT (desoxinucleotidiltransferasa terminal) a cada sección e incubar en una cámara humidificada durante 1 h a 37 °C. Coloque toallas de papel dentro de la bandeja, alrededor de los toboganes, humedezca las toallas con agua y cúbralas con una envoltura de plástico.
- Después de la incubación, coloque las muestras en la rejilla y déjelas en un tampón de parada / lavado (10 min).
- Caliente el conjugado antidigoxigenina a temperatura ambiente.
- Lave las diapositivas en PBS (3 x 1 min).
- Limpie cuidadosamente alrededor del pañuelo.
- Añadir dos gotas de antidigoxigenina-peroxidasa conjugada (65 μL/5 cm²) a las secciones e incubar durante 30 min en un recipiente humidificado.
- Después de lavar en PBS 4 x 2 min, prepare el sustrato de peroxidasa de fuerza de trabajo y golpee suavemente el exceso de líquido y aspire alrededor de la sección.
- Cubrir las secciones con sustrato de peroxidasa (75 μL/5 cm²) y teñir durante 5 min. Coloque un portaobjetos bajo el microscopio y determine el tiempo óptimo de tinción.
- Lave los portaobjetos en una rejilla de tinción en agua destilada (3 x 1 min).
- Incubar los toboganes en agua destilada durante 5 min.
- Contrarrestar la tinción con hematoxilina durante 2 min.
- Coloque el tobogán bajo agua corriente del grifo durante 3 minutos.
- Lave el tobogán con agua destilada.
- Monte las guías bajo cubreobjetos de vidrio en medio de montaje y déjelas secar.
- Observe bajo un microscopio de luz.
- Kit de detección de apoptosis (Ensayo C)
NOTA: Siga el protocolo del fabricante (consulte la Tabla de materiales).- Prepare los frascos de Coplin.
- Desparafinar y rehidratar las secciones de tejido (ver paso 1.3).
- Incubar el tejido con proteinasa K (15-30 min a 37 °C).
- Vuelva a colocar las guías en la rejilla y enjuague 2x en PBS.
- Cubrir con 50 μL de «mezcla de reacción TUNEL». Coloque las toallas de papel húmedas dentro del recipiente, cúbralas con una envoltura de plástico y déjelas durante 60 minutos a 37 ° C.
- Enjuague 3x con PBS.
- Coloque los portaobjetos en el recipiente y seque el área alrededor de la muestra de tejido.
- Añadir 50 μL de Converter-AP a la muestra e incubar en un recipiente humidificado durante 30 min a 37 °C.
- Enjuague 3x en PBS.
- Añadir 50-100 μL de solución de sustrato y dejar actuar durante 10 minutos en la oscuridad.
NOTA: Observe la tinción bajo un microscopio óptico. - Enjuague las diapositivas 3 veces con PBS.
- Contrarresta la tinción transfiriendo secciones a hematoxilina durante 2 minutos y luego enjuague cuidadosamente con agua corriente del grifo durante 5 minutos.
- Monte las guías bajo cubreobjetos de vidrio en un medio de montaje acuoso y déjelas planas para que se sequen.
- Observe bajo un microscopio de luz. Evalúe las células afectadas (positivas) contando de 70 a 100 células en cada muestra del intestino medio o HPG bajo un microscopio óptico.
Access restricted. Please log in or start a trial to view this content.
Resultados
Detección de muerte celular en el intestino medio
Las abejas obreras recién emergidas (Apis mellifera carnica) del colmenar experimental en el Instituto Agrícola de Eslovenia en Liubliana fueron tratadas individualmente con ácido oxálico (OA) al 3%23. OA se utiliza con frecuencia en la apicultura para el control del destructor Varroa . Después del tratamiento, las abejas obreras (tres de cada grupo) fueron inmovilizadas en hielo. Se diseccionó el intest...
Access restricted. Please log in or start a trial to view this content.
Discusión
En los organismos vivos, la muerte celular se define como apoptosis o necrosis25 y puede ir acompañada de autofagia26. La diferencia entre las células apoptóticas y necróticas es que la apoptosis es una forma de muerte celular programada y aparece en células normales, mientras que la necrosis ocurre debido a condiciones letales (por ejemplo, accidente, enfermedad)27,28. La apoptosis se puede detectar utilizando...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
El autor no tiene conflictos de intereses.
Agradecimientos
Agradezco el apoyo de la Agencia de Investigación de Eslovenia, subvención nº P4-133.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 2-Propanol | |||
| ApopTag Peroxidase kit (ApopTag Peroxidase In Situ Apoptosis Detection) | Sigma-Aldrich | S7100 | Assay B, https://www.sigmaaldrich.com/SI/en/product/mm/s7100?gclid=CjwKCA jw7vuUBhBUEiwAEdu2pPanI9SE j81ZTl-nLHEoxXAv7ViKwPA_QRx H7fciMRNcYwR7lbPQbhoCqcQQA vD_BwE; Positive controls included in S7101 |
| Covers | |||
| DeadEnd Colorimetric TUNEL system | Promega | G7360 | Assay A, https://worldwide.promega.com/products/cell-health-assays/apoptosis-assays/deadend-colorimetric-tunel-system/?catNum=G7360 |
| Dissecting microscope (for bee dissection) | Zeiss | ||
| Distilled water | |||
| Embedding cassette | |||
| EnVision System alkaline phosphatase kit | Dako | ||
| Eosin Y Solution | Sigma-Aldrich | alcoholic | |
| Ethanol | 95% (or less pure), 90%, 80% | ||
| Faramount mounting medium, aqueous | Dako | mounting medium | |
| Flattening table | Leica | HI1220 | |
| Forceps (for bee dissection) | Fine science tools | 11294-00 | Standard #4 |
| Formalin 10% | Formaldehyde | ||
| Hematoxylin | Sigma-Aldrich | ||
| HistoChoice Clearing Agent | Sigma-Aldrich | clearing agent | |
| Hydrogen peroxidase 3% | |||
| Incubator | BioRad | ||
| Insect pins (for bee dissection) | Entosphinx | 44594 | Insect pins stainless steel – white, size 2 |
| ISCDDK, AP (In Situ Cell Death Detecteion Kit, Alkaline Phosphatase) | Roche | 11684809910 | Assay C, https://www.sigmaaldrich.com/deepweb/assets/sigmaaldrich/product/documents/362/737/11684809910b ul.pdf |
| KH2PO4 | |||
| Lab clock | |||
| Light microscope | Leica | ||
| Microscope slides | Box with the slides must be preserved in a plastic wrap to prevent dust | ||
| Microtome | Leica | ||
| Modular tissue embedding station | Leica | ||
| Na2HPO4 | |||
| NaCl | |||
| Paraformaldehyde 4% | |||
| Paraplast | Leica | ||
| Pasteur pipettes | 1.5 mL; 3 mL | ||
| PBS | |||
| Petri dish (for bee dissection) | Filled with condensation silicon (Xantoprene L blue and Universal liquid plus activator) | ||
| Proteinase K | Merck | 21627 | |
| Ringers' solution (for bee dissection) | 7.5 g NaCL, 2.38 g Na2HPO4, 2.72 g KH2PO4, 1 L distilled water | ||
| Scissors (for bee dissection) | Fine science tools | 1406-09, 14061-09 | Straight and curved, 9 cm |
| Universal liquid plus activator (for bee dissection) | Kulzer | ||
| Watchmaker’s forceps (for bee dissection) | Fine science tools | 91100-12 | |
| Water bath | Leica | ||
| Watercolor brush | 2x | ||
| Xantoprene L blue (for bee dissection) | Kulzer |
Referencias
- Ruttner, F. Naturgeschichte der Honigbienen. , Ehrenwirth. München. (1992).
- Jordan, R. Kleine Bienenkunde. Österreichischer Agrarverlag Wien München. , 41-45 (1964).
- Snodgrass, R. E. The Anatomy of the Honey Bee. The Hive and the Honey Bee. , Dadant and Sons. 111-113 (1975).
- Snodgrass, R. E. The Anatomy of the Honey Bee. , Cornell University Press. (2004).
- Hrassnigg, N., Crailsheim, K. Adaptation of hypopharyngeal gland development to the brood status of honeybee (Apis mellifera L.) colonies. Journal of Insect Physiology. 44 (10), 929-939 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Characteristics of hypopharyngeal glands in honeybees (Apis mellifera carnica) from a nurse colony. Slovenian Veterinary Research. 52 (2), 67-74 (2015).
- Kubo, T. Change in the expression of hypopharyngeal-gland proteins of the worker honeybees (Apis mellifera L.) with age and/or role. Journal of Biochemistry. 119 (2), 291-295 (1996).
- Sammataro, D., Yoder, J. A. Honey bee colony health: Challenges and sustainable solutions. , Taylor & Francis Group. 302(2012).
- Crailsheim, K., Stolberg, E. Influence of diet, age and colony condition upon intestinal proteolytic activity and size of the hypopharyngeal glands in the honeybee (Apis mellifera L.). Journal of Insect Physiology. 35 (8), 595-602 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Heat shock proteins and cell death in situ localisation in hypopharyngeal glands of honeybee (Apis mellifera carnica) workers after imidacloprid or coumaphos treatment. Apidologie. 41 (1), 73-86 (2010).
- Gregorc, A., Bowen, I. D. The histochemical characterisation of cell death in honeybee larvae midgut after treatment with Paenibacillus larvae, Amitraz and Oxytetracycline. Cell Biology International. 24 (5), 319-324 (2000).
- Higes, M., et al. Apoptosis in the pathogenesis of Nosema ceranae (Microsporidia: Nosematidae) in honey bees (Apis mellifera). Environmental Microbiology Reports. 5 (4), 530-536 (2013).
- Kurze, C., et al. Infection dynamics of Nosema ceranae in honey bee midgut and host cell apoptosis. Journal of Invertebrate Pathology. 154, 1-4 (2018).
- Johnson, R. M. Honey bee toxicology. Annual Review of Entomology. 60 (1), 415-434 (2005).
- Gashout, H. A., Guzman-Novoa, E., Goodwin, P. H. Synthetic and natural acaricides impair hygienic and foraging behaviors of honey bees. Apidologie. 51 (6), 1155-1165 (2020).
- McMenamin, A. J., Genersch, E. Honey bee colony losses and associated viruses. Current Opinion in Insect Science. 8, 121-129 (2015).
- Ramsey, S. D., et al. Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. Proceedings of the National Academy of Sciences USA. 116 (5), 1792-1801 (2019).
- Requier, F., et al. Honey bee diet in intensive farmland habitats reveals an unexpectedly high flower richness and a major role of weeds. Ecological Applications. 25 (4), 881-890 (2015).
- Santos, C., Serrão, J. Histology of the ileum in bees (Hymenoptera, Apoidea). Brazilian Journal of Morphological Sciences. 23 (3), 405-413 (2006).
- Suwannapong, G., Saichon, C., Benbow, M. Histochemical comparison of the hypopharyngeal gland in Apis cerana Fabricius, 1793 workers and Apis mellifera Linnaeus, 1758 workers. Psyche: A Journal of Entomology. , (2010).
- Ceylan, A., Sevin, S., Özgenç, Ö Histomorphological and histochemical structure of the midgut and hindgut of the Caucasian honey bee (Apis mellifera caucasia). Turkish Journal of Veterinary and Animal Sciences. 43 (6), 747-753 (2019).
- Human, H., et al. Miscellaneous standard methods for Apis mellifera research. Journal of Apicultural Research. 52 (4), 1-53 (2013).
- Gregorc, A., Smodiš Škerl, M. I. Toxicological and immunohistochemical testing of honeybees after oxalic and rotenone treatments. Apidologie. 38 (3), 296-305 (2007).
- Carreck, N. L., et al. Standard methods for Apis mellifera anatomy and dissection. Journal of Apicultural Research. 52 (4), 1-40 (2013).
- Bowen, I. D., Bowen, S. M., Jones, A. H. Mitosis and apoptosis: Matters of Life and Death. , Chapman & Hall. London. (1998).
- Eisenberg-Lerner, A., et al. Life and death partners: apoptosis, autophagy and the cross-talk between them. Cell Death and Differentiation. 16 (7), 966-975 (2009).
- Bowen, I. D., Mullarkey, K., Morgan, S. M. Programmed cell death in the salivary gland of the blow fly Calliphora vomitoria. Microscopy Research Techniques. 34, 202-207 (1996).
- D'Arcy, M. S. Cell death: a review of the major forms of apoptosis, necrosis and autophagy. Cell Biology International. 43 (6), 582-592 (2019).
- Matylevitch, N. P., et al. Apoptosis and accidental cell death in cultured human keratinocytes after thermal injury. American Journal of Pathology. 153 (2), 567-577 (1998).
- Perry, S. W., Epstein, L. G., Gelbard, H. A. Simultaneous in situ detection of apoptosis and necrosis in monolayer cultures by TUNEL and trypan blue staining. BioTechniques. 22 (6), 1102-1106 (1997).
- Cuello-Carrion, F. D., Ciocca, D. Improved detection of apoptotic cells using a modified in situ TUNEL technique. Journal of Histochemistry and Cytochemistry. 47 (6), 837-839 (1999).
- Gregorc, A., Bowen, I. D. Programmed cell death in the honeybee (Apis mellifera L.) larvae midgut. Cell Biology International. 21 (3), 151-158 (1997).
- Gregorc, A., Pogačnik, A., Bowen, I. D. Cell death in honey bee (Apis mellifera) larvae treated with oxalic or formic acid. Apidologie. 35 (5), 453-460 (2004).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados