Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Principes de base de l’histologie et détection de la mort cellulaire dans les tissus d’abeilles mellifères
Dans cet article
Résumé
Les méthodes immunohistochimiques sont utiles dans la recherche sur les abeilles mellifères pour détecter et évaluer le niveau d’apoptose et de nécrose dans l’intestin moyen et les glandes hypopharyngées des abeilles adultes.
Résumé
Les abeilles mellifères (Apis mellifera L.) à l’intérieur de la ruche (ouvrières nourricières et autres abeilles de la ruche) et à l’extérieur de la ruche (butineuses) sont exposées aux changements climatiques et météorologiques, à divers pesticides, agents pathogènes et à la malnutrition, pénétrant principalement par la bouche et affectant principalement le tube digestif des abeilles adultes. Pour comprendre et prévenir les effets de ces facteurs de stress externes et internes sur les abeilles, une méthode de recherche utile est la méthode immunohistochimique. Un protocole de base est décrit pour préparer l’intestin moyen (ventriculus) et les glandes hypopharyngées (HPG) des abeilles adultes pour l’analyse histologique. Une méthodologie détaillée est décrite pour évaluer le niveau de dommages cellulaires et distinguer la nécrose de la mort cellulaire programmée (apoptose) en tant que processus naturel de régénération tissulaire. Les résultats du traitement des abeilles adultes avec de l’acide oxalique et des pesticides (insecticide et acaricide) et la détermination de la mort cellulaire dans le ventriculus et les HPG sont présentés. Les avantages et les inconvénients de la méthodologie sont également discutés.
Introduction
Les abeilles mellifères (Apis mellifera L.) sont, entre autres pollinisateurs sauvages, les pollinisateurs les plus importants des plantes agricoles. Pendant des milliers d’années, l’environnement changeant a incité les abeilles à adapter leur morphologie, leur physiologie, leur comportement et leur tolérance à plusieurs agents pathogènes et parasites. Par conséquent, les abeilles mellifères ont développé une gamme très diversifiée d’espèces et de sous-espèces dans le mondeentier 1. Ces résultats sont cohérents avec les résultats précédents, qu’il existe une variation génétique dans la structure du tube digestif de l’abeille, mais suggèrent également que les altérations de l’intestin moyen sont dues à des facteurs environnementaux 2,3.
Le tube digestif de l’abeille a trois parties principales: l’intestin antérieur, l’intestin moyen (ventriculus) et l’intestin postérieur4. Le ventriculus est un organe essentiel pour la digestion du pollen et du nectar/miel ; Dans l’intestin postérieur, le contrôle osmotique a lieu par absorption d’eau et d’ions2. Les glandes hypopharyngées (HPG) des ouvrières apicoles sont situées dans la tête et synthétisent et sécrètent des composants de gelée royale pour nourrir la couvée, la reine et les membres de la colonie. Leur taille change avec l’âge et les tâches et dépend d’une bonne nutrition (pollen de qualité). Les infirmières et infirmiers âgés de 6 à 18 jours effectuent l’élevage des couvées, et la taille des HPG augmentede 5,6. Chez les abeilles butineuses, les HPG dégénèrent et ne sécrètent que les enzymes importantes pour convertir les sucres complexes en sucres simples (α-glucosidases, leucine arylamidase, invertase) dans le miel7.
Les abeilles mellifères sont exposées à plusieurs facteurs de stress biotiques et abiotiques8, et le tube digestif peut être affecté par plusieurs stimulants négatifs. La première barrière qui protège l’organisme contre les agents pathogènes est la membrane péritrophique de l’intestin moyen, constituée de muqueuse intestinale pour protéger contre les agents pathogènes4. Le développement et la fonction des HPG dépendent de l’alimentation, de l’âge et de l’état de la colonie9, et sont affectés par les insecticides, les acaricides 10 et les agents pathogènes11,12,13. Les résidus d’acaricides dans la ruche dus au traitement de lutte contre le varroa et aux pesticides de l’environnement affectent les abeilles butineuses et les abeilles nourrices14,15. La plus grande menace pour les colonies d’abeilles mellifères est l’acarien Varroa destructor, à la fois en tant que vecteur de virus contribuant aux pertes de colonies16 et en tant que consommateur du corps adipeux de l’hôte (un organe vital important chez les abeilles mellifères), ce qui affecte par conséquent le corps de l’individu et les fonctions de la colonie17.
Cependant, les habitats agricoles intensifs peuvent fournir un approvisionnement alimentaire à court terme pour les abeilles mellifères. Par conséquent, les programmes agroenvironnementaux devraient améliorer la disponibilité des fleurs mellifères dans les paysages agricoles18. Pour évaluer la morphologie de différentes sous-espèces 6,19,20,21 ou les effets sublétaux de ces facteurs au niveau des cellules ou des tissus, en particulier l’intestin moyen et les HPG, les méthodes histologiques et immunohistochimiques sont pratiques et suffisamment précises pour être utilisées dans la recherche histologique sur les abeilles.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Histologie de base pour la recherche sur les abeilles mellifères
- Dissection de tissus d’abeilles mellifères
REMARQUE : Pour la dissection des abeilles ouvrières, utilisez un microscope à dissection muni d’une source lumineuse DEL. Le grossissement le plus utile est ~20x.- Manipulation et dissection
- Prendre soigneusement une abeille ouvrière avec une pince et la mettre sur de la glace (ou au congélateur à -20 °C) pendant 2 min pour l’immobiliser22. Épinglez l’abeille sur la boîte de Petri en diagonale à travers la partie supérieure arrière du thorax deux fois, de gauche à droite et de droite à gauche.
- Versez une solution saline d’insecte pour couvrir le corps. Placez la boîte de Petri sous le microscope, faites la mise au point et ajustez.
- Préparez les instruments (voir le tableau des matériaux).
- Dissection de l’intestin moyen
- Commencez par l’abdomen en insérant un point des ciseaux sous le tergite A5 (Figure 1) au centre du côté droit du corps de l’abeille. Couper au tergite A2.
- Gardez la lame interne des ciseaux parallèle au côté du corps pour éviter d’endommager les organes internes. Tournez les ciseaux vers la gauche et faites une coupe; Tournez à droite et faites une autre coupe. Ouvrez doucement la partie gauche de l’abdomen et épinglez-la. Répétez de l’autre côté.
- À l’aide d’une pince, tirez doucement l’estomac de l’abeille vers le haut et, avec des ciseaux dans l’autre main, coupez à la toute extrémité de l’œsophage. Retirez l’estomac et l’intestin moyen de l’abdomen et coupez le rectum. Utilisez une pipette avec une solution saline d’insectes et retirez les matières fécales ou les parties du tissu.
- Dissection des HPG
- Immobiliser une abeille ouvrière sur la glace comme décrit à l’étape 1.1.1. Coupez la tête et placez-la sur la plus petite assiette avec les antennes tournées vers le haut. Fixez la tête avec deux broches: une à travers l’œil composé gauche et la seconde à travers l’œil composé droit.
- Faites une incision sur le premier œil composé sur la face interne des broches, continuez jusqu’au labrum, puis faites une autre coupe de l’autre côté à travers le deuxième œil composé (Figure 2).
- Coupez les antennes. Soulevez le masque et coupez là où il est encore attaché. Prenez les forceps et retirez soigneusement les glandes ainsi que le cerveau et une partie des yeux composés.
- Manipulation et dissection
- Fixation, déshydratation et encastrement de paraffine
REMARQUE : Portez des gants de protection.- Placez le mouchoir dans des flacons de pénicilline, remplis aux 3/4 avec 10% de formol. Conserver au réfrigérateur à 4 °C.
- Après 24 h, déshydrater le tissu dans une série d’alcools: 70%, 80%, 90%, 100%, pendant 1 h chacun, 100% 2-propanol pendant 1 h, 100% 2-propanol pendant 12 h, et enfin 100% 2-propanol pendant 1 h.
- Placer le tissu dans des histocassettes; marquez-les et placez-les dans les chambres vitrées avec du 2-propanol et de la paraffine (1:1) dans un incubateur à 60 °C pendant 24 h.
- Déplacer les histocassettes dans une autre chambre avec de la paraffine (I.) pendant encore 24 h. Répétez la procédure avec de la paraffine fraîche deux fois de plus (II. et III.), les deux pendant 24 h.
- Enfin, préparez la station de montage et commencez à incorporer le tissu dans de la cire.
- Ouvrez chaque histocassette et retirez le couvercle. Remplissez le moule avec de la cire et placez soigneusement le mouchoir avec une pince chaude au milieu du moule.
- Placez l’histocassette sur le moule et recouvrez-la légèrement de cire. Placez immédiatement le moule sur la surface froide de la station de montage pendant quelques secondes, puis placez-le sur la plaque froide pendant quelques minutes jusqu’à ce que la cire durcisse et se sépare du moule et de l’histocassette.
- Conservez les échantillons finis dans une boîte, à l’abri de la poussière et de la chaleur.
- Couper des sections minces de 4 μm sur un microtome: d’abord, deux sections attachées l’une à l’autre, puis une séparément. Transférer les sections à l’aide d’une pince et les laisser flotter sur de l’eau distillée (42 °C), puis les recueillir sur des lames propres en plaçant deux sections ensemble sur le côté gauche du verre de l’objectif et la troisième sur le côté droit, en restant nettement séparées. Laissez les lames marquées pendant la nuit sur l’appareil de chauffage et enfin rangez-les dans une boîte dédiée aux échantillons d’histologie.
- Déparaffinage et réhydratation
REMARQUE : Portez des gants de protection.- Préparer neuf pots Coplin et placer les sections dans une série d’agents de compensation (I., II., III.) pendant 5 minutes chacun.
- Mettre dans le 2-propanol, l’éthanol 96% (I., II.), l’alcool 90% et 80%, et l’eau distillée pendant 3 min chacun.
- Teinture à l’hématoxyline et à l’éosine
REMARQUE : Portez des gants de protection.- Préparez six pots Colin.
- Pour la coloration à l’hématoxyline et à l’éosine (H & E), mettez les sections déparaffinées et réhydratées dans de l’hématoxyline pendant 5 minutes, puis placez-les soigneusement sous l’eau courante du robinet pendant 2 minutes. Ensuite, mettez-les dans de l’eau distillée pendant 1 min et de l’éosine pendant 4 min (pour l’éosine, le pot Coplin n’est pas nécessaire).
- Placer les lames dans de l’éthanol à 96% pendant 1 min, puis 2-propanol pendant 2 min, et enfin dans l’agent de nettoyage pendant 2 min.
- Ajoutez un support de montage et un verre de couverture et laissez-les sécher. Observez au microscope optique.
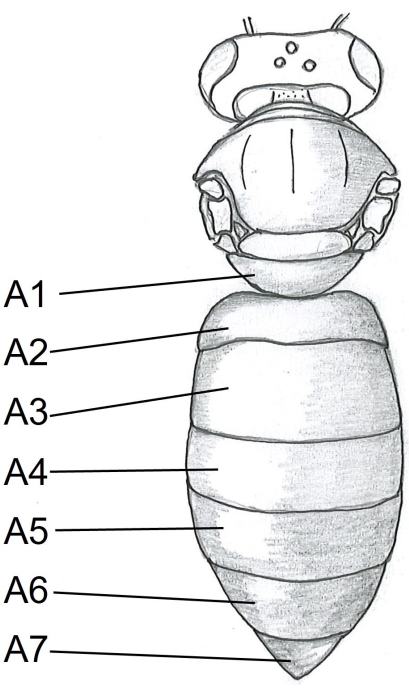
Figure 1 : Vue dorsale du corps de l’abeille. A1-A7 tergites. Les instructions détaillées sur la dissection des abeilles mellifères se trouvent dans Carreck et coll.24. Veuillez cliquer ici pour voir une version agrandie de cette figure.
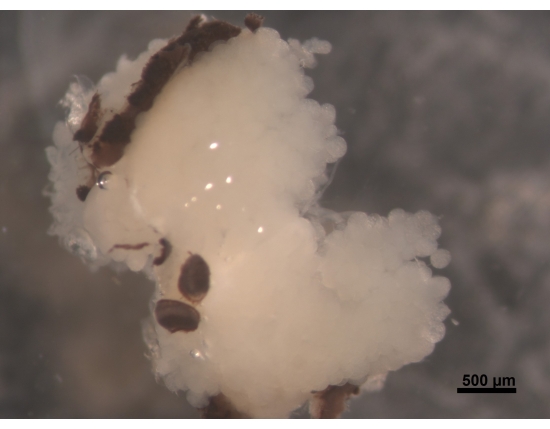
Figure 2 : Vue dorsale des HPG, parties des yeux composés attachées au cerveau (non visible). Une jeune abeille ouvrière âgée de 5 à 6 jours a des HPG dodus et blanc crème. Les acini sont situés sur le cerveau et remplissent la zone de la tête avec des branches atteignant l’arrière du cerveau. Chez les abeilles butineuses, ces glandes sont considérablement rétrécies et ne laissent que de minces restes filiformes. Pour cette raison, il est préférable d’enlever les glandes avec le cerveau pour faciliter les procédures ultérieures afin d’éviter de perdre le tissu. Barre d’échelle = 500 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Détection de la mort cellulaire dans les coupes tissulaires
- Kit de détection de l’apoptose (Dosage A)
REMARQUE : Suivez le protocole du fabricant (voir le tableau des matériaux).- Préparez les pots de Coplin.
- Après déparaffinage et réhydratation (voir étape 1.3), immerger les lames dans une solution de NaCl à 0,85 %, puis dans une solution saline tamponnée au phosphate (PBS) (5 min).
- Mettre les lames dans 4% de paraformaldéhyde 2 x 15 min.
- Placez les lames à plat dans le récipient et ajoutez 100 μL d’une solution de protéinase K (20 μg/mL), puis laissez-les pendant 10 à 30 minutes.
- Placez les diapositives dans PBS (5 min).
- Placer les lames dans du paraformaldéhyde à 4% dans du PBS (5 min).
- Immergez les diapositives dans PBS (2 x 5 min).
- Placez les lames à plat dans le récipient, ajoutez 100 μL de tampon d’équilibrage et laissez-les pendant 5-10 min.
- Ajouter 100 μL de mélange réactionnel TdT. Mettez des serviettes en papier à l’intérieur du récipient, autour des lames, humidifiez les serviettes avec de l’eau, puis recouvrez-les d’une pellicule de plastique. Incuber les toboggans pendant 60 min à 37 °C.
- Replacez les lames dans la grille de coloration et plongez dans 2x citrate de sodium salin (SSC) pendant 15 min.
- Immergez les diapositives 3 x 5 min dans du PBS, puis dans du peroxyde d’hydrogène à 0,3 % pendant 3 à 5 min, puis à nouveau dans du PBS, 3 x 5 min.
- Encore une fois, placez les lames à plat dans le récipient, ajoutez 100 μL de streptavidine HRP (peroxydase de raifort) et laissez reposer 30 minutes (couvrir d’une pellicule de plastique).
- Immergez les diapositives 3 x 5 min dans PBS.
- Placer les lames à plat dans le récipient et ajouter 100 μL de solution de 3,3'-diaminobenzidine (DAB). Recherchez un fond brun clair.
- Remettez les lames sur la grille et lavez-les plusieurs fois à l’eau (double distillation).
- Montez les glissières sous des lamelles de verre dans un support de montage et laissez sécher à plat.
- Observez au microscope optique.
- Kit de détection de l’apoptose (Dosage B)
REMARQUE : Suivez le protocole du fabricant (voir le tableau des matériaux).- Préparez les pots Colin.
- Préparer la protéinase K (20 μg/mL dilués dans du PBS).
- Après avoir déciré et réhydraté les sections (étape 1.3), placez les lames dans PBS pendant 5 min.
- Placer les lames à plat dans le récipient et ajouter la protéinase K (20 μg/mL, 60 μL par échantillon de 5 cm²).
- Laver les lames 2 x 2 min à l’eau distillée.
- Tremper dans la peroxydase endogène (dans 3% d’hydrogène peroxydase) à température ambiante.
- Rincer les lames 2 x 5 min avec du PBS ou de l’eau.
- Placer les lames à plat dans le récipient et appliquer un tampon d’équilibrage (75 μL/5 cm2) pendant 10 s à température ambiante.
- Essuyez soigneusement autour du tissu.
- Ajouter l’enzyme TdT (désoxynucléotidyl transférase terminale) à chaque section et incuber dans une chambre humidifiée pendant 1 h à 37 °C. Mettez des serviettes en papier à l’intérieur du plateau, autour des diapositives, humidifiez les serviettes avec de l’eau et recouvrez-les d’une pellicule de plastique.
- Après l’incubation, mettre les échantillons dans la grille et les laisser dans un tampon d’arrêt/lavage (10 min).
- Réchauffer le conjugué anti-digoxigénine à température ambiante.
- Lavez les lames dans PBS (3 x 1 min).
- Essuyez soigneusement autour du mouchoir.
- Ajouter deux gouttes de conjugué anti-digoxigénine-peroxydase (65 μL/5 cm²) aux sections et incuber pendant 30 min dans un récipient humidifié.
- Après le lavage dans PBS 4 x 2 min, préparer le substrat de peroxydase de résistance au travail, puis tapoter doucement l’excès de liquide et aspirer autour de la section.
- Couvrir les sections avec un substrat de peroxydase (75 μL/5 cm²) et colorer pendant 5 min. Placez une lame sous le microscope et déterminez le temps de coloration optimal.
- Laver les lames dans une grille de coloration dans de l’eau distillée (3 x 1 min).
- Incuber les lames dans de l’eau distillée pendant 5 min.
- Contre-coloration à l’aide d’hématoxyline pendant 2 min.
- Placez la toboggan sous l’eau courante du robinet pendant 3 min.
- Lavez la lame à l’eau distillée.
- Montez les glissières sous des lamelles de verre dans un support de montage et laissez sécher à plat.
- Observez au microscope optique.
- Kit de détection de l’apoptose (Dosage C)
REMARQUE : Suivez le protocole du fabricant (voir le tableau des matériaux).- Préparez les pots de Coplin.
- Décirer et réhydrater les sections de tissu (voir étape 1.3).
- Incuber le tissu avec la protéinase K (15-30 min à 37 °C).
- Replacez les lames sur la grille et rincez 2x dans PBS.
- Couvrir de 50 μL de « mélange réactionnel TUNEL ». Placez les serviettes en papier humides à l’intérieur du récipient, recouvrez-les d’une pellicule plastique et laissez-les pendant 60 min à 37 °C.
- Rincer 3x avec du PBS.
- Placez les lames dans le récipient et séchez la zone autour de l’échantillon de tissu.
- Ajouter 50 μL de Converter-AP à l’échantillon et incuber dans un récipient humidifié pendant 30 min à 37 °C.
- Rincer 3x dans PBS.
- Ajouter 50-100 μL de solution de substrat et laisser reposer 10 min dans l’obscurité.
REMARQUE: Observez la coloration au microscope optique. - Rincez les lames 3x avec du PBS.
- Contre-colorer en transférant les sections dans l’hématoxyline pendant 2 min, puis rincer soigneusement à l’eau courante du robinet pendant 5 min.
- Montez les glissières sous des lamelles de verre dans un support de montage aqueux et laissez-les à plat pour sécher.
- Observez au microscope optique. Évaluer les cellules affectées (positives) en comptant 70 à 100 cellules dans chaque échantillon de l’intestin moyen ou HPG au microscope optique.
Access restricted. Please log in or start a trial to view this content.
Résultats
Détection de la mort cellulaire dans l’intestin moyen
Les abeilles ouvrières (Apis mellifera carnica) nouvellement issues du rucher expérimental de l’Institut agricole de Slovénie à Ljubljana ont été traitées individuellement avec de l’acide oxalique (OA) à 3 %23. L’arthrose est fréquemment utilisée en apiculture pour lutter contre Varroa destructor . Après le traitement, les abeilles ouvrières (trois de chaque groupe) ont été immobilis?...
Access restricted. Please log in or start a trial to view this content.
Discussion
Dans les organismes vivants, la mort cellulaire est définie comme l’apoptose ou la nécrose25 et peut être accompagnée d’autophagie26. La différence entre les cellules apoptotiques et nécrotiques est que l’apoptose est une forme de mort cellulaire programmée et apparaît dans les cellules normales, alors que la nécrose se produit en raison de conditions mortelles (p. ex. accident, maladie)27,28. L’apo...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
L’auteur n’a pas de conflits d’intérêts.
Remerciements
Je remercie l’Agence slovène de recherche, subvention n° P4-133, pour son soutien.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 2-Propanol | |||
| ApopTag Peroxidase kit (ApopTag Peroxidase In Situ Apoptosis Detection) | Sigma-Aldrich | S7100 | Assay B, https://www.sigmaaldrich.com/SI/en/product/mm/s7100?gclid=CjwKCA jw7vuUBhBUEiwAEdu2pPanI9SE j81ZTl-nLHEoxXAv7ViKwPA_QRx H7fciMRNcYwR7lbPQbhoCqcQQA vD_BwE; Positive controls included in S7101 |
| Covers | |||
| DeadEnd Colorimetric TUNEL system | Promega | G7360 | Assay A, https://worldwide.promega.com/products/cell-health-assays/apoptosis-assays/deadend-colorimetric-tunel-system/?catNum=G7360 |
| Dissecting microscope (for bee dissection) | Zeiss | ||
| Distilled water | |||
| Embedding cassette | |||
| EnVision System alkaline phosphatase kit | Dako | ||
| Eosin Y Solution | Sigma-Aldrich | alcoholic | |
| Ethanol | 95% (or less pure), 90%, 80% | ||
| Faramount mounting medium, aqueous | Dako | mounting medium | |
| Flattening table | Leica | HI1220 | |
| Forceps (for bee dissection) | Fine science tools | 11294-00 | Standard #4 |
| Formalin 10% | Formaldehyde | ||
| Hematoxylin | Sigma-Aldrich | ||
| HistoChoice Clearing Agent | Sigma-Aldrich | clearing agent | |
| Hydrogen peroxidase 3% | |||
| Incubator | BioRad | ||
| Insect pins (for bee dissection) | Entosphinx | 44594 | Insect pins stainless steel – white, size 2 |
| ISCDDK, AP (In Situ Cell Death Detecteion Kit, Alkaline Phosphatase) | Roche | 11684809910 | Assay C, https://www.sigmaaldrich.com/deepweb/assets/sigmaaldrich/product/documents/362/737/11684809910b ul.pdf |
| KH2PO4 | |||
| Lab clock | |||
| Light microscope | Leica | ||
| Microscope slides | Box with the slides must be preserved in a plastic wrap to prevent dust | ||
| Microtome | Leica | ||
| Modular tissue embedding station | Leica | ||
| Na2HPO4 | |||
| NaCl | |||
| Paraformaldehyde 4% | |||
| Paraplast | Leica | ||
| Pasteur pipettes | 1.5 mL; 3 mL | ||
| PBS | |||
| Petri dish (for bee dissection) | Filled with condensation silicon (Xantoprene L blue and Universal liquid plus activator) | ||
| Proteinase K | Merck | 21627 | |
| Ringers' solution (for bee dissection) | 7.5 g NaCL, 2.38 g Na2HPO4, 2.72 g KH2PO4, 1 L distilled water | ||
| Scissors (for bee dissection) | Fine science tools | 1406-09, 14061-09 | Straight and curved, 9 cm |
| Universal liquid plus activator (for bee dissection) | Kulzer | ||
| Watchmaker’s forceps (for bee dissection) | Fine science tools | 91100-12 | |
| Water bath | Leica | ||
| Watercolor brush | 2x | ||
| Xantoprene L blue (for bee dissection) | Kulzer |
Références
- Ruttner, F. Naturgeschichte der Honigbienen. , Ehrenwirth. München. (1992).
- Jordan, R. Kleine Bienenkunde. Österreichischer Agrarverlag Wien München. , 41-45 (1964).
- Snodgrass, R. E. The Anatomy of the Honey Bee. The Hive and the Honey Bee. , Dadant and Sons. 111-113 (1975).
- Snodgrass, R. E. The Anatomy of the Honey Bee. , Cornell University Press. (2004).
- Hrassnigg, N., Crailsheim, K. Adaptation of hypopharyngeal gland development to the brood status of honeybee (Apis mellifera L.) colonies. Journal of Insect Physiology. 44 (10), 929-939 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Characteristics of hypopharyngeal glands in honeybees (Apis mellifera carnica) from a nurse colony. Slovenian Veterinary Research. 52 (2), 67-74 (2015).
- Kubo, T. Change in the expression of hypopharyngeal-gland proteins of the worker honeybees (Apis mellifera L.) with age and/or role. Journal of Biochemistry. 119 (2), 291-295 (1996).
- Sammataro, D., Yoder, J. A. Honey bee colony health: Challenges and sustainable solutions. , Taylor & Francis Group. 302(2012).
- Crailsheim, K., Stolberg, E. Influence of diet, age and colony condition upon intestinal proteolytic activity and size of the hypopharyngeal glands in the honeybee (Apis mellifera L.). Journal of Insect Physiology. 35 (8), 595-602 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Heat shock proteins and cell death in situ localisation in hypopharyngeal glands of honeybee (Apis mellifera carnica) workers after imidacloprid or coumaphos treatment. Apidologie. 41 (1), 73-86 (2010).
- Gregorc, A., Bowen, I. D. The histochemical characterisation of cell death in honeybee larvae midgut after treatment with Paenibacillus larvae, Amitraz and Oxytetracycline. Cell Biology International. 24 (5), 319-324 (2000).
- Higes, M., et al. Apoptosis in the pathogenesis of Nosema ceranae (Microsporidia: Nosematidae) in honey bees (Apis mellifera). Environmental Microbiology Reports. 5 (4), 530-536 (2013).
- Kurze, C., et al. Infection dynamics of Nosema ceranae in honey bee midgut and host cell apoptosis. Journal of Invertebrate Pathology. 154, 1-4 (2018).
- Johnson, R. M. Honey bee toxicology. Annual Review of Entomology. 60 (1), 415-434 (2005).
- Gashout, H. A., Guzman-Novoa, E., Goodwin, P. H. Synthetic and natural acaricides impair hygienic and foraging behaviors of honey bees. Apidologie. 51 (6), 1155-1165 (2020).
- McMenamin, A. J., Genersch, E. Honey bee colony losses and associated viruses. Current Opinion in Insect Science. 8, 121-129 (2015).
- Ramsey, S. D., et al. Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. Proceedings of the National Academy of Sciences USA. 116 (5), 1792-1801 (2019).
- Requier, F., et al. Honey bee diet in intensive farmland habitats reveals an unexpectedly high flower richness and a major role of weeds. Ecological Applications. 25 (4), 881-890 (2015).
- Santos, C., Serrão, J. Histology of the ileum in bees (Hymenoptera, Apoidea). Brazilian Journal of Morphological Sciences. 23 (3), 405-413 (2006).
- Suwannapong, G., Saichon, C., Benbow, M. Histochemical comparison of the hypopharyngeal gland in Apis cerana Fabricius, 1793 workers and Apis mellifera Linnaeus, 1758 workers. Psyche: A Journal of Entomology. , (2010).
- Ceylan, A., Sevin, S., Özgenç, Ö Histomorphological and histochemical structure of the midgut and hindgut of the Caucasian honey bee (Apis mellifera caucasia). Turkish Journal of Veterinary and Animal Sciences. 43 (6), 747-753 (2019).
- Human, H., et al. Miscellaneous standard methods for Apis mellifera research. Journal of Apicultural Research. 52 (4), 1-53 (2013).
- Gregorc, A., Smodiš Škerl, M. I. Toxicological and immunohistochemical testing of honeybees after oxalic and rotenone treatments. Apidologie. 38 (3), 296-305 (2007).
- Carreck, N. L., et al. Standard methods for Apis mellifera anatomy and dissection. Journal of Apicultural Research. 52 (4), 1-40 (2013).
- Bowen, I. D., Bowen, S. M., Jones, A. H. Mitosis and apoptosis: Matters of Life and Death. , Chapman & Hall. London. (1998).
- Eisenberg-Lerner, A., et al. Life and death partners: apoptosis, autophagy and the cross-talk between them. Cell Death and Differentiation. 16 (7), 966-975 (2009).
- Bowen, I. D., Mullarkey, K., Morgan, S. M. Programmed cell death in the salivary gland of the blow fly Calliphora vomitoria. Microscopy Research Techniques. 34, 202-207 (1996).
- D'Arcy, M. S. Cell death: a review of the major forms of apoptosis, necrosis and autophagy. Cell Biology International. 43 (6), 582-592 (2019).
- Matylevitch, N. P., et al. Apoptosis and accidental cell death in cultured human keratinocytes after thermal injury. American Journal of Pathology. 153 (2), 567-577 (1998).
- Perry, S. W., Epstein, L. G., Gelbard, H. A. Simultaneous in situ detection of apoptosis and necrosis in monolayer cultures by TUNEL and trypan blue staining. BioTechniques. 22 (6), 1102-1106 (1997).
- Cuello-Carrion, F. D., Ciocca, D. Improved detection of apoptotic cells using a modified in situ TUNEL technique. Journal of Histochemistry and Cytochemistry. 47 (6), 837-839 (1999).
- Gregorc, A., Bowen, I. D. Programmed cell death in the honeybee (Apis mellifera L.) larvae midgut. Cell Biology International. 21 (3), 151-158 (1997).
- Gregorc, A., Pogačnik, A., Bowen, I. D. Cell death in honey bee (Apis mellifera) larvae treated with oxalic or formic acid. Apidologie. 35 (5), 453-460 (2004).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon