JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
꿀벌 조직의 조직학 기초 및 세포 사멸 검출
요약
면역 조직 화학적 방법은 꿀벌 연구에서 성인 꿀벌의 중추 및 하인두 땀샘에서 세포 사멸 및 괴사 수준을 감지하고 평가하는 데 유용합니다.
초록
꿀벌 (Apis mellifera L.) 벌집 내부 (간호사 및 기타 벌집 꿀벌)와 벌집 외부 (채집자)는 기후 및 날씨 변화, 다양한 살충제, 병원균 및 영양 실조에 노출되며 주로 입을 통해 들어가고 주로 성인 꿀벌의 소화관에 영향을 미칩니다. 꿀벌에 대한 이러한 외부 및 내부 스트레스 요인의 영향을 이해하고 예방하기 위해 유용한 연구 방법 중 하나는 면역 조직 화학적 방법입니다. 조직 학적 분석을 위해 성인 꿀벌의 중추 (심실) 및 하인두 땀샘 (HPG)을 준비하기위한 기본 프로토콜이 설명됩니다. 세포 손상 수준을 평가하고 조직 재생의 자연적인 과정으로서 괴사를 프로그램 된 세포 사멸 (세포 사멸)과 구별하기위한 상세한 방법론이 설명됩니다. 옥살산과 살충제 (살충제 및 살비제)로 성인 꿀벌을 치료하고 심실 및 HPG에서 세포 사멸을 측정 한 결과가 제시됩니다. 방법론의 장단점도 논의됩니다.
서문
꿀벌 (Apis mellifera L.)은 다른 야생 수분 매개자 중에서도 농업 식물의 가장 중요한 수분 매개자입니다. 수천 년에 걸쳐 변화하는 환경은 꿀벌이 형태, 생리학, 행동 및 여러 병원체와 기생충에 대한 내성을 적응시키는 데 영향을 미쳤습니다. 따라서 꿀벌은 전 세계적으로 매우 다양한 종과 아종을 개발했습니다1. 이러한 결과는 꿀벌의 소화관 구조에 유전 적 변이가 있다는 이전 발견과 일치하지만 중추의 변화가 환경 요인 2,3에 기인 한 것임을 시사합니다.
꿀벌의 소화관에는 앞장, 중추 (심실) 및 뒷부4의 세 가지 주요 부분이 있습니다. 심실은 꽃가루와 꿀/꿀의 소화에 필수적인 기관입니다. 뒷다리에서 삼투압 조절은 물과 이온의 흡수를 통해 발생합니다2. 꿀벌 작업자의 하인두 땀샘 (HPG)은 머리에 위치하며 로열 젤리 성분을 합성하고 분비하여 무리, 여왕 및 식민지 구성원에게 먹이를줍니다. 그들의 크기는 나이와 작업에 따라 변하고 적절한 영양 (품질 꽃가루)에 달려 있습니다. 6 일에서 18 일 사이의 간호사는 양육을 수행하며 HPG의 크기는 5,6 증가합니다. 채집 꿀벌에서 HPG는 퇴화되어 꿀7에서 복잡한 당을 단순한 설탕 (α- 글루코시다 아제, 류신 아릴 아미다 제, 인버 타제)으로 전환하는 데 중요한 효소 만 분비합니다.
꿀벌은 여러 생물학적 및 비생물적스트레스 요인8에 노출되며 소화관은 여러 가지 부정적인 자극제의 영향을 받을 수 있습니다. 병원체로부터 유기체를 보호하는 첫 번째 장벽은 병원균으로부터 보호하기 위해 장 점막으로 구성된 중추의 주변 영양 막입니다4. HPG의 발달과 기능은 식단, 연령 및 집락 상태9에 따라 달라지며 살충제, 살비제10 및 병원균11,12,13의 영향을 받습니다. varroa 방제 처리 및 환경의 살충제로 인한 벌통의 살비제 잔류 물은 수렵 꿀벌과 간호사 꿀벌14,15에 영향을 미칩니다. 꿀벌 식민지에 대한 가장 큰 위협은 진드기 Varroa 소멸자로, 식민지 손실에 기여하는 바이러스 벡터16 및 숙주의 지방 신체 (꿀벌의 중요한 중요한 기관)의 소비자로서 결과적으로 개인의 신체와 식민지 기능에 영향을 미칩니다17.
그러나 집약적 인 농지 서식지는 꿀벌에게 단기적인 식량 공급을 제공 할 수 있습니다. 따라서 농업 환경 계획은 농업 경관에서 꿀 꽃의 가용성을 향상시켜야합니다18. 세포 또는 조직 수준, 특히 중추 및 HPG에서 다른 아종 6,19,20,21 또는 이러한 요인의 치명적인 영향을 평가하기 위해 조직 학적 및 면역 조직 화학적 방법은 꿀벌의 조직학 연구에 사용하기에 실용적이고 충분히 정확합니다.
프로토콜
1. 꿀벌 연구를위한 기본 조직학
- 꿀벌 조직의 해부
알림: 일벌을 해부하려면 LED 광원이 있는 해부 현미경을 사용하십시오. 가장 유용한 배율은 ~ 20x입니다.- 조작 및 해부
- 조심스럽게 집게로 일벌을 가져 와서 얼음 (또는 -20 ° C의 냉동실)에 2 분 동안 넣어고정시킵니다 22. 페트리 접시에 꿀벌을 왼쪽에서 오른쪽으로, 오른쪽에서 왼쪽으로 두 번 흉부의 맨 위 뒤쪽 부분을 통해 대각선으로 고정합니다.
- 곤충 식염수를 부어 몸을 덮으십시오. 페트리 접시를 현미경 아래에 놓고 초점을 맞추고 조정합니다.
- 기기를 준비하십시오 ( 재료 표 참조).
- 중추의 해부
- 꿀벌 몸의 오른쪽 중앙에있는 tergite A5 (그림 1) 아래에 가위의 한 지점을 삽입하여 복부부터 시작하십시오. 테르 기트 A2로 자릅니다.
- 내부 장기가 손상되지 않도록 가위의 안쪽 날을 몸의 측면과 평행하게 유지하십시오. 가위를 왼쪽으로 돌려 한 번 자릅니다. 우회전하여 다시 자릅니다. 복부의 왼쪽 부분을 부드럽게 열고 고정하십시오. 반대쪽에서도 반복하십시오.
- 한 손으로 집게를 사용하여 꿀벌 위를 부드럽게 위로 당기고 다른 손에는 가위로 식도 끝에서 자릅니다. 복부에서 위와 중추를 당겨 직장을 자릅니다. 곤충 식염수가 든 피펫을 사용하여 대변이나 조직의 일부를 제거하십시오.
- HPG의 해부
- 1.1.1 단계에서 설명한대로 일벌을 얼음 위에 고정시킵니다. 머리를 잘라 안테나가 위를 향하도록 작은 접시에 놓습니다. 두 개의 핀으로 머리를 고정합니다 : 하나는 왼쪽 겹눈을 통과하고 다른 하나는 오른쪽 겹눈을 관통합니다.
- 핀 안쪽의 첫 번째 겹안을 가로질러 절단하고 음순으로 계속 이동한 다음 두 번째 겹눈을 가로질러 다른 쪽을 다시 절단합니다(그림 2).
- 안테나를 잘라냅니다. 마스크를 벗고 아직 부착된 부분을 자릅니다. 집게를 가지고 뇌와 겉눈의 일부와 함께 땀샘을 조심스럽게 제거하십시오.
- 조작 및 해부
- 고정, 탈수 및 파라핀 삽입
알림: 보호 장갑을 착용하십시오.- 조직을 페니실린 병에 넣고 10 % 포르말린으로 3/4을 채 웁니다. 4 ° C의 냉장고에 보관하십시오.
- 24 시간 후, 일련의 알코올로 조직을 탈수하십시오 : 70 %, 80 %, 90 %, 100 %, 각각 1 시간, 100 % 2- 프로판올 12 시간, 마지막으로 100 % 2- 프로판올 1 시간.
- 조직을 히스토카세트에 넣습니다. 표시하고 2- 프로판올과 파라핀 (1 : 1)으로 60 ° C의 인큐베이터에서 24 시간 동안 유리 챔버에 넣습니다.
- 히스토카세트를 파라핀(I.)이 있는 다른 챔버로 24시간 더 옮깁니다. 신선한 파라핀으로 24 시간 동안 두 번 더 (II. 및 III.) 절차를 반복하십시오.
- 마지막으로 장착 스테이션을 준비하고 티슈를 왁스에 매립하기 시작합니다.
- 각 히스토카세트를 열고 덮개를 제거합니다. 금형을 왁스로 채우고 금형 중앙에 따뜻한 집게로 티슈를 조심스럽게 넣으십시오.
- 히스토카세트를 몰드에 놓고 왁스로 약간 덮으십시오. 즉시 장착 스테이션의 차가운 표면에 금형을 몇 초 동안 놓은 다음 왁스가 경화되어 금형과 히스토카세트에서 함께 분리될 때까지 몇 분 동안 냉각판에 놓습니다.
- 완성 된 샘플을 먼지와 열이없는 상자에 보관하십시오.
- 마이크로톰에서 4μm의 얇은 섹션을 자릅니다: 먼저 두 개의 섹션이 서로 부착된 다음 하나씩 별도로 부착됩니다. 집게로 섹션을 옮기고 증류수(42°C)에 띄운 다음 대물 유리의 왼쪽에 두 섹션을 함께 배치하고 오른쪽에 세 번째 섹션을 함께 배치하여 깨끗한 슬라이드에 수집합니다. 표시된 슬라이드를 가열 장치에 밤새 방치하고 마지막으로 조직학 샘플 전용 상자에 보관하십시오.
- 탈랍 및 재수화
알림: 보호 장갑을 착용하십시오.- 9 개의 코플린 병을 준비하고 섹션을 일련의 제거제 (I., II., III.)에 각각 5 분 동안 넣습니다.
- 2-프로판올, 에탄올 96%(I., II.), 알코올 90% 및 80%, 증류수를 각각 3분 동안 투입하였다.
- 헤마톡실린과 에오신으로 염색
알림: 보호 장갑을 착용하십시오.- 6 개의 코플린 항아리를 준비하십시오.
- 헤마톡실린 및 에오신 (H&E) 염색의 경우, 탈랍되고 재수화된 부분을 헤마톡실린에 5분 동안 넣은 다음 흐르는 수돗물 아래에 2분 동안 조심스럽게 두십시오. 그런 다음 증류수에 1 분, 에오신 4 분 동안 넣으십시오 (에오신의 경우 코플린 병은 필요하지 않습니다).
- 슬라이드를 에탄올 96 %에 1 분 동안 넣은 다음 2- 프로판올에 2 분, 마지막으로 투명화제에 2 분 동안 넣습니다.
- 장착 매체와 커버 유리를 추가하고 건조시킵니다. 광학 현미경으로 관찰하십시오.
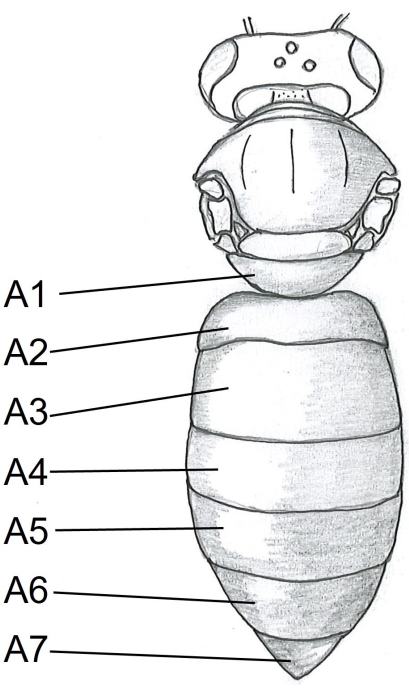
그림 1: 꿀벌 몸의 등쪽 모습. A1-A7 테르 자이트. 꿀벌 해부에 대한 자세한 지침은 Carreck et al.24에서 찾을 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
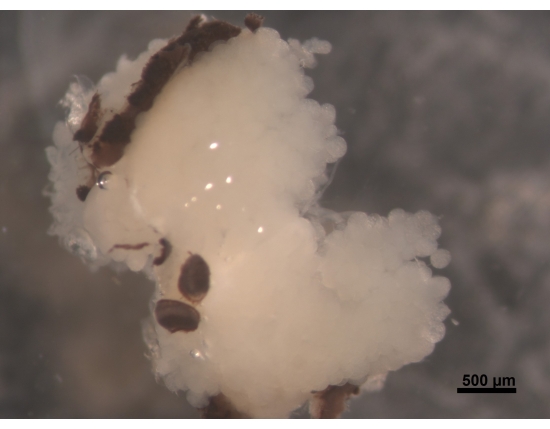
그림 2: 뇌에 부착된 겹눈의 일부인 HPG의 등쪽 보기(보이지 않음). 5-6 일 된 어린 일벌은 통통하고 크림색의 흰색 HPG를 가지고 있습니다. acini는 뇌에 위치하고 뇌 뒤쪽에 도달하는 가지로 머리 부분을 채 웁니다. 꿀벌을 채집 할 때,이 땀샘은 크게 줄어들고 얇은 실 모양의 잔해 만 남습니다. 이러한 이유로 조직 손실을 피하기 위해 추가 절차를 더 쉽게 수행 할 수 있도록 뇌와 함께 땀샘을 제거하는 것이 좋습니다. 스케일 바 = 500 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 조직 절편에서 세포 사멸 검출
- 세포자멸사 검출 키트(분석 A)
알림: 제조업체의 프로토콜을 따르십시오( 재료 표 참조).- 코플린 항아리를 준비하십시오.
- 탈랍 및 재수화 후(1.3단계 참조) 슬라이드를 0.85% NaCl 용액에 담근 다음 인산염 완충 식염수(PBS)에 담근다(5분).
- 슬라이드를 4% 파라포름알데히드 2 x 15분에 넣습니다.
- 슬라이드를 용기에 평평하게 놓고 100μL의 프로테이나제 K(20μg/mL) 용액을 추가한 다음 10-30분 동안 그대로 두십시오.
- 슬라이드를 PBS에 넣습니다(5분).
- 슬라이드를 PBS의 4% 파라포름알데히드에 넣습니다(5분).
- 슬라이드를 PBS에 담그십시오(2 x 5분).
- 슬라이드를 용기에 평평하게 놓고 100μL의 평형 버퍼를 추가하고 5-10분 동안 그대로 둡니다.
- 100 μL의 TdT 반응 혼합물을 추가합니다. 종이 타월을 용기 안, 슬라이드 주위에 넣고 수건에 물을 적신 다음 플라스틱 랩으로 덮으십시오. 슬라이드를 37°C에서 60분 동안 배양합니다.
- 슬라이드를 염색 랙에 다시 놓고 2x 식염수-시트르산 나트륨(SSC)에 15분 동안 담그십시오.
- 슬라이드를 PBS에 3 x 5분 동안 담근 다음 0.3% 과산화수소에 3-5분 동안 담근 다음 다시 PBS에 3 x 5분 동안 담그십시오.
- 다시 슬라이드를 용기에 평평하게 놓고 스트렙타비딘 HRP(양 고추냉이 과산화효소) 100μL를 넣고 30분 동안 그대로 둡니다(플라스틱 랩으로 덮음).
- 슬라이드를 PBS에 3 x 5분 동안 담그십시오.
- 슬라이드를 용기에 평평하게 놓고 100μL의 3,3'-디아미노벤지딘(DAB) 용액을 추가합니다. 밝은 갈색 배경을 찾으십시오.
- 슬라이드를 랙에 다시 넣고 물로 여러 번 씻으십시오 (이중 증류).
- 장착 매체의 유리 커버슬립 아래에 슬라이드를 장착하고 평평하게 두어 건조시킵니다.
- 광학 현미경으로 관찰하십시오.
- 세포자멸사 검출 키트(분석 B)
알림: 제조업체의 프로토콜을 따르십시오( 재료 표 참조).- 코플린 항아리를 준비하십시오.
- 프로테이나제 K(PBS에 희석한 20μg/mL)를 준비합니다.
- 섹션을 탈랍하고 재수화한 후(1.3단계) 슬라이드를 PBS에 5분 동안 놓습니다.
- 슬라이드를 용기에 평평하게 놓고 프로테이나제 K(20μg/mL, 5cm² 표본당 60μL)를 추가합니다.
- 슬라이드를 증류수로 2 x 2 분 동안 씻으십시오.
- 실온에서 내인성 과산화 효소 (3 % 과산화 수소 효소)에서 담금질합니다.
- 슬라이드를 PBS 또는 물로 2 x 5분 동안 헹굽니다.
- 슬라이드를 용기에 평평하게 놓고 실온에서 10초 동안 평형 버퍼(75μL/5cm2)를 적용합니다.
- 티슈 주위를 조심스럽게 닦으십시오.
- TdT 효소 (말단 데 옥시 뉴클레오티딜 트랜스퍼 라제)를 각 섹션에 첨가하고 37 ° C에서 1 시간 동안 가습 챔버에서 배양합니다. 종이 타월을 트레이 내부, 슬라이드 주위에 놓고 수건에 물을 적신 다음 플라스틱 랩으로 덮으십시오.
- 배양 후 표본을 랙에 넣고 정지/세척 버퍼(10분)에 그대로 둡니다.
- 항-디곡시제닌 접합체를 실온으로 따뜻하게 합니다.
- 슬라이드를 PBS로 세척합니다(3 x 1분).
- 조직 주위를 조심스럽게 닦아냅니다.
- 항-디곡시제닌-퍼옥시다제 접합체(65μL/5cm²) 2방울을 섹션에 추가하고 가습 용기에서 30분 동안 배양합니다.
- PBS 4 x 2 분으로 세척 한 후 작동 강도의 퍼 옥시 다제 기질을 준비하고 여분의 액체를 부드럽게 두드리고 섹션 주위를 흡인합니다.
- 과산화효소 기질(75μL/5cm²)로 섹션을 덮고 5분 동안 염색합니다. 현미경 아래에 슬라이드를 놓고 최적의 염색 시간을 결정합니다.
- 슬라이드를 증류수(3 x 1분)의 염색 선반으로 세척합니다.
- 슬라이드를 증류수에 5분 동안 배양합니다.
- 헤마톡실린을 사용하여 2분 동안 카운터염색합니다.
- 흐르는 수돗물에 슬라이드를 3분 동안 두십시오.
- 증류수로 슬라이드를 씻으십시오.
- 장착 매체의 유리 커버슬립 아래에 슬라이드를 장착하고 평평하게 두어 건조시킵니다.
- 광학 현미경으로 관찰하십시오.
- 세포자멸사 검출 키트(분석 C)
알림: 제조업체의 프로토콜을 따르십시오( 재료 표 참조).- 코플린 항아리를 준비하십시오.
- 조직 절편을 탈랍하고 재수화합니다(1.3단계 참조).
- 조직을 프로테이나제 K로 배양합니다(37°C에서 15-30분).
- 슬라이드를 랙에 다시 놓고 PBS로 2번 헹굽니다.
- 50 μL의 'TUNEL 반응 혼합물'로 덮습니다. 젖은 종이 타월을 용기 안에 넣고 플라스틱 랩으로 덮고 37 ° C에서 60 분 동안 그대로 두십시오.
- PBS로 3 번 헹굽니다.
- 슬라이드를 용기에 넣고 조직 샘플 주위를 건조시킵니다.
- 50μL의 변환기-AP를 샘플에 추가하고 37°C에서 30분 동안 가습 용기에서 배양합니다.
- PBS로 3 번 헹굽니다.
- 50-100 μL의 기질 용액을 첨가하고 어둠 속에서 10 분 동안 그대로 두십시오.
참고: 광학 현미경으로 염색을 관찰하십시오. - PBS로 슬라이드를 3배 헹굽니다.
- 섹션을 헤마톡실린에 2분 동안 옮겨 염색을 한 다음 흐르는 수돗물로 5분 동안 조심스럽게 헹굽니다.
- 수성 장착 매체의 유리 커버슬립 아래에 슬라이드를 장착하고 평평하게 두어 건조시킵니다.
- 광학 현미경으로 관찰하십시오. 광학 현미경으로 중추 또는 HPG의 각 샘플에서 70-100 개의 세포를 세어 영향을받은 (양성) 세포를 평가하십시오.
결과
중추의 세포 사멸 감지
류블 랴나에있는 슬로베니아 농업 연구소의 실험 양봉장에서 새로 출현 한 일벌 (Apis mellifera carnica)은 3 % 옥살산 (OA)으로 개별적으로 처리되었습니다.23. OA는 Varroa 소멸자 제어를 위해 양봉에 자주 사용됩니다. 처리 후, 일벌 (각 그룹에서 3 명)을 얼음 위에 고정시켰다. 중추를 해부하여 10 % 포르말린으로 고정시켰다. 그런 다음 ?...
토론
살아있는 유기체에서, 세포 사멸은 아폽토시스 또는 괴사(25)로서 정의되고, 자가포식(autophagy)26을 동반할 수 있다. 세포 사멸과 괴사 세포의 차이점은 세포 사멸은 프로그램 된 세포 사멸의 한 형태이며 정상 세포에서 나타나는 반면 괴사는 치명적인 상태 (예 : 사고, 질병)로 인해 발생한다는 것입니다 27,28. 아폽토시?...
공개
저자는 이해 상충이 없습니다.
감사의 말
슬로베니아 연구 기관, 보조금 번호 P4-133의 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| 2-Propanol | |||
| ApopTag Peroxidase kit (ApopTag Peroxidase In Situ Apoptosis Detection) | Sigma-Aldrich | S7100 | Assay B, https://www.sigmaaldrich.com/SI/en/product/mm/s7100?gclid=CjwKCA jw7vuUBhBUEiwAEdu2pPanI9SE j81ZTl-nLHEoxXAv7ViKwPA_QRx H7fciMRNcYwR7lbPQbhoCqcQQA vD_BwE; Positive controls included in S7101 |
| Covers | |||
| DeadEnd Colorimetric TUNEL system | Promega | G7360 | Assay A, https://worldwide.promega.com/products/cell-health-assays/apoptosis-assays/deadend-colorimetric-tunel-system/?catNum=G7360 |
| Dissecting microscope (for bee dissection) | Zeiss | ||
| Distilled water | |||
| Embedding cassette | |||
| EnVision System alkaline phosphatase kit | Dako | ||
| Eosin Y Solution | Sigma-Aldrich | alcoholic | |
| Ethanol | 95% (or less pure), 90%, 80% | ||
| Faramount mounting medium, aqueous | Dako | mounting medium | |
| Flattening table | Leica | HI1220 | |
| Forceps (for bee dissection) | Fine science tools | 11294-00 | Standard #4 |
| Formalin 10% | Formaldehyde | ||
| Hematoxylin | Sigma-Aldrich | ||
| HistoChoice Clearing Agent | Sigma-Aldrich | clearing agent | |
| Hydrogen peroxidase 3% | |||
| Incubator | BioRad | ||
| Insect pins (for bee dissection) | Entosphinx | 44594 | Insect pins stainless steel – white, size 2 |
| ISCDDK, AP (In Situ Cell Death Detecteion Kit, Alkaline Phosphatase) | Roche | 11684809910 | Assay C, https://www.sigmaaldrich.com/deepweb/assets/sigmaaldrich/product/documents/362/737/11684809910b ul.pdf |
| KH2PO4 | |||
| Lab clock | |||
| Light microscope | Leica | ||
| Microscope slides | Box with the slides must be preserved in a plastic wrap to prevent dust | ||
| Microtome | Leica | ||
| Modular tissue embedding station | Leica | ||
| Na2HPO4 | |||
| NaCl | |||
| Paraformaldehyde 4% | |||
| Paraplast | Leica | ||
| Pasteur pipettes | 1.5 mL; 3 mL | ||
| PBS | |||
| Petri dish (for bee dissection) | Filled with condensation silicon (Xantoprene L blue and Universal liquid plus activator) | ||
| Proteinase K | Merck | 21627 | |
| Ringers' solution (for bee dissection) | 7.5 g NaCL, 2.38 g Na2HPO4, 2.72 g KH2PO4, 1 L distilled water | ||
| Scissors (for bee dissection) | Fine science tools | 1406-09, 14061-09 | Straight and curved, 9 cm |
| Universal liquid plus activator (for bee dissection) | Kulzer | ||
| Watchmaker’s forceps (for bee dissection) | Fine science tools | 91100-12 | |
| Water bath | Leica | ||
| Watercolor brush | 2x | ||
| Xantoprene L blue (for bee dissection) | Kulzer |
참고문헌
- Ruttner, F. . Naturgeschichte der Honigbienen. , (1992).
- Jordan, R. Kleine Bienenkunde. Österreichischer Agrarverlag Wien München. , 41-45 (1964).
- Snodgrass, R. E. The Anatomy of the Honey Bee. The Hive and the Honey Bee. , 111-113 (1975).
- Snodgrass, R. E. . The Anatomy of the Honey Bee. , (2004).
- Hrassnigg, N., Crailsheim, K. Adaptation of hypopharyngeal gland development to the brood status of honeybee (Apis mellifera L.) colonies. Journal of Insect Physiology. 44 (10), 929-939 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Characteristics of hypopharyngeal glands in honeybees (Apis mellifera carnica) from a nurse colony. Slovenian Veterinary Research. 52 (2), 67-74 (2015).
- Kubo, T. Change in the expression of hypopharyngeal-gland proteins of the worker honeybees (Apis mellifera L.) with age and/or role. Journal of Biochemistry. 119 (2), 291-295 (1996).
- Sammataro, D., Yoder, J. A. . Honey bee colony health: Challenges and sustainable solutions. , 302 (2012).
- Crailsheim, K., Stolberg, E. Influence of diet, age and colony condition upon intestinal proteolytic activity and size of the hypopharyngeal glands in the honeybee (Apis mellifera L.). Journal of Insect Physiology. 35 (8), 595-602 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Heat shock proteins and cell death in situ localisation in hypopharyngeal glands of honeybee (Apis mellifera carnica) workers after imidacloprid or coumaphos treatment. Apidologie. 41 (1), 73-86 (2010).
- Gregorc, A., Bowen, I. D. The histochemical characterisation of cell death in honeybee larvae midgut after treatment with Paenibacillus larvae, Amitraz and Oxytetracycline. Cell Biology International. 24 (5), 319-324 (2000).
- Higes, M., et al. Apoptosis in the pathogenesis of Nosema ceranae (Microsporidia: Nosematidae) in honey bees (Apis mellifera). Environmental Microbiology Reports. 5 (4), 530-536 (2013).
- Kurze, C., et al. Infection dynamics of Nosema ceranae in honey bee midgut and host cell apoptosis. Journal of Invertebrate Pathology. 154, 1-4 (2018).
- Johnson, R. M. Honey bee toxicology. Annual Review of Entomology. 60 (1), 415-434 (2005).
- Gashout, H. A., Guzman-Novoa, E., Goodwin, P. H. Synthetic and natural acaricides impair hygienic and foraging behaviors of honey bees. Apidologie. 51 (6), 1155-1165 (2020).
- McMenamin, A. J., Genersch, E. Honey bee colony losses and associated viruses. Current Opinion in Insect Science. 8, 121-129 (2015).
- Ramsey, S. D., et al. Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. Proceedings of the National Academy of Sciences USA. 116 (5), 1792-1801 (2019).
- Requier, F., et al. Honey bee diet in intensive farmland habitats reveals an unexpectedly high flower richness and a major role of weeds. Ecological Applications. 25 (4), 881-890 (2015).
- Santos, C., Serrão, J. Histology of the ileum in bees (Hymenoptera, Apoidea). Brazilian Journal of Morphological Sciences. 23 (3), 405-413 (2006).
- Suwannapong, G., Saichon, C., Benbow, M. Histochemical comparison of the hypopharyngeal gland in Apis cerana Fabricius, 1793 workers and Apis mellifera Linnaeus, 1758 workers. Psyche: A Journal of Entomology. , (2010).
- Ceylan, A., Sevin, S., Özgenç, &. #. 2. 1. 4. ;. Histomorphological and histochemical structure of the midgut and hindgut of the Caucasian honey bee (Apis mellifera caucasia). Turkish Journal of Veterinary and Animal Sciences. 43 (6), 747-753 (2019).
- Human, H., et al. Miscellaneous standard methods for Apis mellifera research. Journal of Apicultural Research. 52 (4), 1-53 (2013).
- Gregorc, A., Smodiš Škerl, M. I. Toxicological and immunohistochemical testing of honeybees after oxalic and rotenone treatments. Apidologie. 38 (3), 296-305 (2007).
- Carreck, N. L., et al. Standard methods for Apis mellifera anatomy and dissection. Journal of Apicultural Research. 52 (4), 1-40 (2013).
- Bowen, I. D., Bowen, S. M., Jones, A. H. . Mitosis and apoptosis: Matters of Life and Death. , (1998).
- Eisenberg-Lerner, A., et al. Life and death partners: apoptosis, autophagy and the cross-talk between them. Cell Death and Differentiation. 16 (7), 966-975 (2009).
- Bowen, I. D., Mullarkey, K., Morgan, S. M. Programmed cell death in the salivary gland of the blow fly Calliphora vomitoria. Microscopy Research Techniques. 34, 202-207 (1996).
- D'Arcy, M. S. Cell death: a review of the major forms of apoptosis, necrosis and autophagy. Cell Biology International. 43 (6), 582-592 (2019).
- Matylevitch, N. P., et al. Apoptosis and accidental cell death in cultured human keratinocytes after thermal injury. American Journal of Pathology. 153 (2), 567-577 (1998).
- Perry, S. W., Epstein, L. G., Gelbard, H. A. Simultaneous in situ detection of apoptosis and necrosis in monolayer cultures by TUNEL and trypan blue staining. BioTechniques. 22 (6), 1102-1106 (1997).
- Cuello-Carrion, F. D., Ciocca, D. Improved detection of apoptotic cells using a modified in situ TUNEL technique. Journal of Histochemistry and Cytochemistry. 47 (6), 837-839 (1999).
- Gregorc, A., Bowen, I. D. Programmed cell death in the honeybee (Apis mellifera L.) larvae midgut. Cell Biology International. 21 (3), 151-158 (1997).
- Gregorc, A., Pogačnik, A., Bowen, I. D. Cell death in honey bee (Apis mellifera) larvae treated with oxalic or formic acid. Apidologie. 35 (5), 453-460 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유