このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ミツバチ組織における組織学の基礎と細胞死検出
要約
免疫組織化学的方法は、成虫のミツバチの中腸および下咽頭腺におけるアポトーシスおよび壊死のレベルを検出および評価するためのミツバチの研究において有用である。
要約
ミツバチ(Apis mellifera L.)ハイブ内(ナースワーカーや他のハイブミツバチ)とハイブ外(採餌者)は、気候や天候の変化、さまざまな農薬、病原体、栄養失調にさらされ、主に口から侵入し、主に成虫の消化管に影響を与えます。このような外部および内部のストレッサーがミツバチに及ぼす影響を理解し、予防するために、有用な研究方法の1つが免疫組織化学的方法です。組織学的分析のために成体ミツバチの中腸(心室)および下咽頭腺(HPG)を準備するための基本的なプロトコルが説明されています。細胞損傷のレベルを評価し、組織再生の自然なプロセスとして壊死とプログラム細胞死(アポトーシス)を区別するための詳細な方法論が説明されています。シュウ酸と農薬(殺虫剤と殺ダニ剤)による成虫ミツバチの治療結果と、心室とHPGの細胞死の測定が提示されています。方法論の長所と短所についても説明します。
概要
ミツバチ(Apis mellifera L.)は、他の野生の花粉媒介者の中でも、農業用植物の最も重要な花粉媒介者です。何千年もの間、変化する環境は、ミツバチが形態、生理学、行動、およびいくつかの病原体や寄生虫に対する耐性を適応させるように影響を与えてきました。したがって、ミツバチは世界中で非常に多様な種と亜種を開発しました1。これらの結果は、ミツバチの消化管構造に遺伝的変異があるという以前の発見と一致していますが、中腸の変化は環境要因によるものであることも示唆しています2,3。
ミツバチの消化管には、前腸、中腸(心室)、後腸4の3つの主要部分があります。心室は花粉と蜜/蜂蜜の消化に不可欠な器官です。後腸では、浸透圧制御は水とイオンの吸収によって行われます2。ミツバチ労働者の下咽頭腺(HPG)は頭にあり、ローヤルゼリー成分を合成して分泌し、ひな、女王、およびコロニーのメンバーに餌を与えます。それらのサイズは年齢や課題によって変化し、適切な栄養(高品質の花粉)に依存します。6〜18日齢の看護師がひなの飼育を行い、HPGのサイズは5,6増加します。採餌ミツバチでは、HPGは変性し、蜂蜜中の複雑な糖を単純な糖(α-グルコシダーゼ、ロイシンアリールアミダーゼ、インベルターゼ)に変換するのに重要な酵素のみを分泌します7。
ミツバチはいくつかの生物的および非生物的ストレッサーにさらされており8、消化管はいくつかの負の覚醒剤の影響を受ける可能性があります。病原体から生物を保護する最初の障壁は、病原体から保護するための腸粘膜からなる中腸の周栄養膜です4。HPGの発生と機能は、食事、年齢、コロニーの状態9に依存し、殺虫剤、殺ダニ剤10、および病原体11、12、13の影響を受けます。バロア防除処理および環境からの農薬による巣箱内の殺ダニ剤残留物は、採餌蜂およびナースミツバチに影響を及ぼす14,15。ミツバチのコロニーに対する最大の脅威は、コロニーの損失に寄与するウイルスのベクターとして、また宿主の脂肪体(ミツバチの重要な重要な器官)の消費者として、ダニVarroaデストラクタであり、その結果、個体の体とコロニーの機能に影響を与えます17。
しかし、集中的な農地の生息地は、ミツバチに短期的な食料供給を提供することができます。したがって、農業環境計画は、農業景観における蜂蜜の花の利用可能性を高めるはずです18。異なる亜種6,19,20,21の形態、または細胞または組織レベル、特に中腸およびHPGでのこれらの因子の亜致死的影響を評価するために、組織学的および免疫組織化学的方法は実用的であり、ミツバチの組織学研究に使用するのに十分正確です。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. ミツバチ研究のための基礎組織学
- ミツバチ組織の解剖
注意: 働きバチの解剖には、LED光源を備えた解剖顕微鏡を使用してください。最も有用な倍率は~20倍です。- 操作と解剖
- 働きバチを鉗子で慎重に取り、氷の上(または-20°Cの冷凍庫)に2分間入れて固定します22。ペトリ皿に蜂を胸部の背中の上部から左から右、右から左に2回斜めに固定します。
- 体を覆うために昆虫食塩水を注ぐ。ペトリ皿を顕微鏡下に置き、焦点を合わせて調整します。
- 機器を準備します( 材料の表を参照)。
- 中腸の解剖
- ミツバチの体の右側の中央にあるテルガイトA5(図1)の下にハサミの一点を挿入して、腹部から始めます。テルガイトA2にカットします。
- 内臓を傷つけないように、はさみの内刃を体の側面と平行に保ちます。はさみを左に回して1カットします。右に曲がって別のカットを行います。腹部の左側をそっと開いて固定します。反対側で繰り返します。
- 片手で鉗子を使用して、ミツバチの胃をそっと上に引き上げ、もう一方の手でハサミで食道の端を切ります。胃と中腸を腹部から引き離し、直腸を切ります。昆虫食塩水を入れたピペットを使用し、糞便や組織の一部を取り除きます。
- HPGの解剖
- ステップ1.1.1で説明されているように、働きバチを氷の上に固定します。頭を切り取り、アンテナを上に向けて小さなプレートに置きます。左複眼と右複眼の2本のピンで頭を固定します。
- ピンの内側にある最初の複眼を横切って切り込みを入れ、唇まで続けてから、反対側に2番目の複眼を横切って別の切り込みを入れます(図2)。
- アンテナを切り取ります。マスクを持ち上げて、まだ取り付けられている場所で切ります。鉗子を取り、脳と複眼の一部と一緒に腺を慎重に取り除きます。
- 操作と解剖
- 固定、脱水、パラフィン包埋
注意: 保護手袋を着用してください。- 組織をペニシリンボトルに入れ、3/4を10%ホルマリンで満たします。4°Cの冷蔵庫に保管してください。
- 24時間後、一連のアルコールで組織を脱水します:70%、80%、90%、100%、それぞれ1時間、100%2-プロパノールを1時間、100%2-プロパノールを12時間、最後に100%2-プロパノールを1時間。
- 組織をヒストカセットに入れる。印を付け、2-プロパノールとパラフィン(1:1)を入れたガラスチャンバーに入れ、60°Cのインキュベーターで24時間放置します。
- ヒストカセットをパラフィン(I.)を含む別のチャンバーにさらに24時間移動します。新鮮なパラフィンでさらに2回(IIとIII)、両方とも24時間手順を繰り返します。
- 最後に、取り付けステーションを準備し、ティッシュをワックスに埋め込み始めます。
- 各ヒストカセットを開き、カバーを取り外します。型をワックスで満たし、型の中央に温かい鉗子で組織を慎重に置きます。
- ヒストカセットを型の上に置き、ワックスで少し覆います。すぐに金型を取り付けステーションの冷たい面に数秒間置き、ワックスが硬化して金型とヒストカセットから分離するまで数分間コールドプレートに置きます。
- 完成したサンプルは、ほこりや熱から離れた箱に保管してください。
- ミクロトームで4 μmの薄い切片を切断します:最初に2つの切片を互いに取り付け、次に1つを別々に取り付けます。切片を鉗子で移し、蒸留水(42°C)に浮かせてから、対物レンズガラスの左側に2つの切片を一緒に、右側に3番目の切片を別々に配置して、きれいなスライドに集めます。マークされたスライドを加熱装置に一晩置いておき、最後に組織学サンプル専用の箱に保管します。
- 脱ろうと水分補給
注意: 保護手袋を着用してください。- 9つのコプリンジャーを準備し、セクションを一連の清澄剤(I.、II.、III.)にそれぞれ5分間入れます。
- 2-プロパノール、エタノール96%(I.、II)、アルコール90%および80%、蒸留水にそれぞれ3分間入れます。
- ヘマトキシリンとエオシンによる染色
注意: 保護手袋を着用してください。- 6つのコプリンジャーを準備します。
- ヘマトキシリンおよびエオジン(H&E)染色の場合は、脱ワックス、再水和した切片をヘマトキシリンに5分間入れてから、水道水の下に2分間注意深く置きます。次に、それらを蒸留水に1分間、エオシンに4分間入れます(エオシンの場合、コプリンジャーは必要ありません)。
- スライドをエタノール96%に1分間入れ、次に2-プロパノールに2分間入れ、最後に透明化剤に2分間入れます。
- 封入剤とカバーガラスを加え、乾燥させます。光学顕微鏡で観察する。
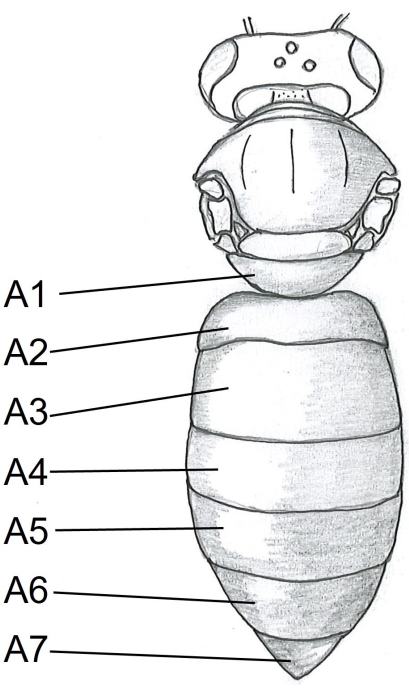
図1:ミツバチの体の背側図。A1-A7テルガイト。ミツバチの解剖に関する詳細な手順は、Carreckら24にあります。この図の拡大版を表示するには、ここをクリックしてください。
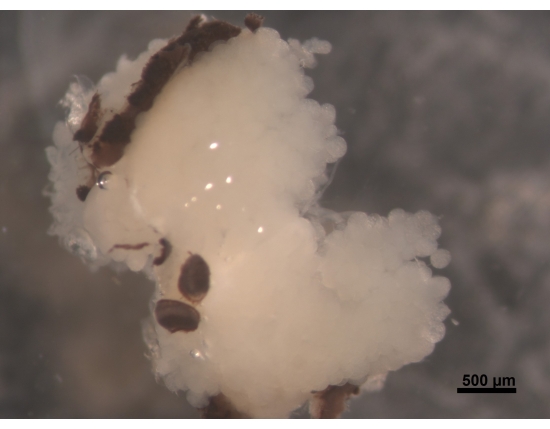
図2:HPGの背側図、脳に付着した複眼の一部(見えない)。5〜6日齢の若い働き蜂は、ふっくらとしたクリーミーな白いHPGを持っています。腺房は脳上にあり、脳の後ろに達する枝で頭の領域を埋めます。採餌中のミツバチでは、これらの腺は非常に縮小し、細い糸のような残骸だけを残します。このため、組織を失うことを避けるために、さらなる手順でそれを容易にするために、脳と一緒に腺を取り除くことをお勧めします。スケールバー= 500μm。 この図の拡大版を表示するには、ここをクリックしてください。
2.組織切片における細胞死の検出
- アポトーシス検出キット(アッセイA)
注意: 製造元のプロトコルに従ってください( 材料表を参照)。- コプリンジャーを準備します。
- 脱ろうと再水和(ステップ1.3を参照)の後、スライドを0.85%NaCl溶液に浸し、次にリン酸緩衝生理食塩水(PBS)に浸します(5分間)。
- スライドを4%パラホルムアルデヒド2 x 15分に入れます。
- スライドを容器に平らに置き、100 μLのプロテイナーゼK(20 μg / mL)溶液を加えてから、10〜30分間放置します。
- スライドをPBSに入れます(5分)。
- スライドをPBS中の4%パラホルムアルデヒドに入れます(5分)。
- スライドをPBSに浸します(2 x 5分)。
- スライドを容器に平らに置き、100 μLの平衡化バッファーを加えて、5〜10分間放置します。
- 100 μLのTdT反応ミックスを加えます。スライドの周りにペーパータオルを容器の中に入れ、タオルを水で湿らせてから、ラップで覆います。スライドを37°Cで60分間インキュベートします。
- スライドを染色ラックに戻し、2x生理食塩水-クエン酸ナトリウム(SSC)に15分間浸します。
- スライドをPBSに3 x 5分浸し、次に0.3%過酸化水素に3〜5分間浸し、次に再びPBSに3 x 5分浸します。
- 再度、スライドを容器に平らに置き、100 μLのストレプトアビジンHRP(西洋ワサビペルオキシダーゼ)を加え、30分間放置します(ラップで覆います)。
- スライドをPBSに3 x 5分浸します。
- スライドを容器に平らに置き、100 μLの3,3'-ジアミノベンジジン(DAB)溶液を加えます。明るい茶色の背景を探します。
- スライドをラックに戻し、水で数回洗います(二重蒸留)。
- スライドを封入剤のガラスカバースリップの下に取り付け、平らにして乾かします。
- 光学顕微鏡で観察する。
- アポトーシス検出キット(アッセイB)
注意: 製造元のプロトコルに従ってください( 材料表を参照)。- コプリンジャーを準備します。
- プロテイナーゼK(PBSで希釈した20 μg/mL)を調製します。
- 切片を脱ワックスして再水和した後(ステップ1.3)、スライドをPBSに5分間入れます。
- スライドを容器に平らに置き、プロテイナーゼK(20 μg/mL、5 cm²検体あたり60 μL)を加えます。
- スライドを蒸留水で2 x 2分洗浄します。
- 室温で内因性ペルオキシダーゼ(3%水素ペルオキシダーゼ中)でクエンチします。
- スライドをPBSまたは水で2 x 5分すすぎます。
- スライドを容器に平らに置き、平衡化バッファー(75 μL/5 cm2)を室温で10秒間適用します。
- ティッシュの周りを慎重に拭きます。
- TdT酵素(末端デオキシヌクレオチジルトランスフェラーゼ)を各切片に加え、加湿チャンバー内で37°Cで1時間インキュベートします。 ペーパータオルをトレイの中、スライドの周りに置き、タオルを水で湿らせ、ラップで覆います。
- インキュベーション後、検体をラックに入れ、ストップ/ウォッシュバッファー(10分)に入れます。
- 抗ジゴキシゲニンコンジュゲートを室温に温めます。
- スライドをPBSで洗います(3 x 1分)。
- ティッシュの周りを慎重に拭き取ります。
- 抗ジゴキシゲニン-ペルオキシダーゼコンジュゲート(65 μL/5 cm²)を切片に2滴加え、加湿容器で30分間インキュベートします。
- PBS 4 x 2分で洗浄した後、作業強度のペルオキシダーゼ基質を準備し、余分な液体を静かにたたき取り、セクションの周りを吸引します。
- 切片をペルオキシダーゼ基質(75 μL/5 cm²)で覆い、5分間染色します。顕微鏡の下にスライドを置き、最適な染色時間を決定します。
- 蒸留水(3 x 1分)の染色ラックでスライドを洗います。
- スライドを蒸留水で5分間インキュベートします。
- ヘマトキシリンを2分間対比染色する。
- スライドを水道水の下に3分間置きます。
- スライドを蒸留水で洗います。
- スライドを封入剤のガラスカバースリップの下に取り付け、平らにして乾かします。
- 光学顕微鏡で観察する。
- アポトーシス検出キット(アッセイC)
注意: 製造元のプロトコルに従ってください( 材料表を参照)。- コプリンジャーを準備します。
- 組織切片を脱ろうして再水和します(手順1.3を参照)。
- 組織をプロテイナーゼK(37°Cで15〜30分)でインキュベートします。
- スライドをラックに戻し、PBSで2回すすぎます。
- 50 μLの「TUNEL反応混合物」で覆います。濡れたペーパータオルを容器に入れ、ラップで覆い、37°Cで60分間放置します。
- PBSで3回すすぎます。
- スライドを容器に入れ、組織サンプルの周囲を乾燥させます。
- 50 μLのコンバーター-APをサンプルに加え、加湿容器中で37°Cで30分間インキュベートします。
- PBSで3回すすぎます。
- 50〜100μLの基質溶液を加え、暗所に10分間放置する。
注:光学顕微鏡で染色を観察します。 - スライドをPBSで3回すすぎます。
- 切片をヘマトキシリンに2分間移して対比染色し、水道水で5分間注意深くすすいでください。
- スライドを水性封入剤のガラスカバースリップの下に取り付け、平らにして乾かします。
- 光学顕微鏡で観察する。光学顕微鏡下で中腸またはHPGの各サンプル中の70〜100個の細胞を数えることにより、影響を受けた(陽性)細胞を評価します。
Access restricted. Please log in or start a trial to view this content.
結果
中腸における細胞死の検出
リュブリャナのスロベニア農業研究所の実験養蜂場から新たに出現した働きバチ(Apis mellifera carnica)を、3%シュウ酸(OA)23で個別に処理しました。OAは、 Varroaデストラクタ 制御のための養蜂に頻繁に使用されます。処理後、働きバチ(各群から3匹)を氷上に固定した。中腸を解剖し、10%ホルマリンで固定した。次に、組織を?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
生体では、細胞死はアポトーシスまたは壊死25として定義され、オートファジー26を伴うことがあります。アポトーシス細胞と壊死細胞の違いは、アポトーシスはプログラムされた細胞死の一形態であり、正常細胞に現れるのに対し、壊死は致命的な状態(事故、病気など)によって起こることです27,28。アポトーシ...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者には利益相反はありません。
謝辞
スロベニア研究庁、助成金番号P4-133の支援に感謝します。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 2-Propanol | |||
| ApopTag Peroxidase kit (ApopTag Peroxidase In Situ Apoptosis Detection) | Sigma-Aldrich | S7100 | Assay B, https://www.sigmaaldrich.com/SI/en/product/mm/s7100?gclid=CjwKCA jw7vuUBhBUEiwAEdu2pPanI9SE j81ZTl-nLHEoxXAv7ViKwPA_QRx H7fciMRNcYwR7lbPQbhoCqcQQA vD_BwE; Positive controls included in S7101 |
| Covers | |||
| DeadEnd Colorimetric TUNEL system | Promega | G7360 | Assay A, https://worldwide.promega.com/products/cell-health-assays/apoptosis-assays/deadend-colorimetric-tunel-system/?catNum=G7360 |
| Dissecting microscope (for bee dissection) | Zeiss | ||
| Distilled water | |||
| Embedding cassette | |||
| EnVision System alkaline phosphatase kit | Dako | ||
| Eosin Y Solution | Sigma-Aldrich | alcoholic | |
| Ethanol | 95% (or less pure), 90%, 80% | ||
| Faramount mounting medium, aqueous | Dako | mounting medium | |
| Flattening table | Leica | HI1220 | |
| Forceps (for bee dissection) | Fine science tools | 11294-00 | Standard #4 |
| Formalin 10% | Formaldehyde | ||
| Hematoxylin | Sigma-Aldrich | ||
| HistoChoice Clearing Agent | Sigma-Aldrich | clearing agent | |
| Hydrogen peroxidase 3% | |||
| Incubator | BioRad | ||
| Insect pins (for bee dissection) | Entosphinx | 44594 | Insect pins stainless steel – white, size 2 |
| ISCDDK, AP (In Situ Cell Death Detecteion Kit, Alkaline Phosphatase) | Roche | 11684809910 | Assay C, https://www.sigmaaldrich.com/deepweb/assets/sigmaaldrich/product/documents/362/737/11684809910b ul.pdf |
| KH2PO4 | |||
| Lab clock | |||
| Light microscope | Leica | ||
| Microscope slides | Box with the slides must be preserved in a plastic wrap to prevent dust | ||
| Microtome | Leica | ||
| Modular tissue embedding station | Leica | ||
| Na2HPO4 | |||
| NaCl | |||
| Paraformaldehyde 4% | |||
| Paraplast | Leica | ||
| Pasteur pipettes | 1.5 mL; 3 mL | ||
| PBS | |||
| Petri dish (for bee dissection) | Filled with condensation silicon (Xantoprene L blue and Universal liquid plus activator) | ||
| Proteinase K | Merck | 21627 | |
| Ringers' solution (for bee dissection) | 7.5 g NaCL, 2.38 g Na2HPO4, 2.72 g KH2PO4, 1 L distilled water | ||
| Scissors (for bee dissection) | Fine science tools | 1406-09, 14061-09 | Straight and curved, 9 cm |
| Universal liquid plus activator (for bee dissection) | Kulzer | ||
| Watchmaker’s forceps (for bee dissection) | Fine science tools | 91100-12 | |
| Water bath | Leica | ||
| Watercolor brush | 2x | ||
| Xantoprene L blue (for bee dissection) | Kulzer |
参考文献
- Ruttner, F. Naturgeschichte der Honigbienen. , Ehrenwirth. München. (1992).
- Jordan, R. Kleine Bienenkunde. Österreichischer Agrarverlag Wien München. , 41-45 (1964).
- Snodgrass, R. E. The Anatomy of the Honey Bee. The Hive and the Honey Bee. , Dadant and Sons. 111-113 (1975).
- Snodgrass, R. E. The Anatomy of the Honey Bee. , Cornell University Press. (2004).
- Hrassnigg, N., Crailsheim, K. Adaptation of hypopharyngeal gland development to the brood status of honeybee (Apis mellifera L.) colonies. Journal of Insect Physiology. 44 (10), 929-939 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Characteristics of hypopharyngeal glands in honeybees (Apis mellifera carnica) from a nurse colony. Slovenian Veterinary Research. 52 (2), 67-74 (2015).
- Kubo, T. Change in the expression of hypopharyngeal-gland proteins of the worker honeybees (Apis mellifera L.) with age and/or role. Journal of Biochemistry. 119 (2), 291-295 (1996).
- Sammataro, D., Yoder, J. A. Honey bee colony health: Challenges and sustainable solutions. , Taylor & Francis Group. 302(2012).
- Crailsheim, K., Stolberg, E. Influence of diet, age and colony condition upon intestinal proteolytic activity and size of the hypopharyngeal glands in the honeybee (Apis mellifera L.). Journal of Insect Physiology. 35 (8), 595-602 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Heat shock proteins and cell death in situ localisation in hypopharyngeal glands of honeybee (Apis mellifera carnica) workers after imidacloprid or coumaphos treatment. Apidologie. 41 (1), 73-86 (2010).
- Gregorc, A., Bowen, I. D. The histochemical characterisation of cell death in honeybee larvae midgut after treatment with Paenibacillus larvae, Amitraz and Oxytetracycline. Cell Biology International. 24 (5), 319-324 (2000).
- Higes, M., et al. Apoptosis in the pathogenesis of Nosema ceranae (Microsporidia: Nosematidae) in honey bees (Apis mellifera). Environmental Microbiology Reports. 5 (4), 530-536 (2013).
- Kurze, C., et al. Infection dynamics of Nosema ceranae in honey bee midgut and host cell apoptosis. Journal of Invertebrate Pathology. 154, 1-4 (2018).
- Johnson, R. M. Honey bee toxicology. Annual Review of Entomology. 60 (1), 415-434 (2005).
- Gashout, H. A., Guzman-Novoa, E., Goodwin, P. H. Synthetic and natural acaricides impair hygienic and foraging behaviors of honey bees. Apidologie. 51 (6), 1155-1165 (2020).
- McMenamin, A. J., Genersch, E. Honey bee colony losses and associated viruses. Current Opinion in Insect Science. 8, 121-129 (2015).
- Ramsey, S. D., et al. Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. Proceedings of the National Academy of Sciences USA. 116 (5), 1792-1801 (2019).
- Requier, F., et al. Honey bee diet in intensive farmland habitats reveals an unexpectedly high flower richness and a major role of weeds. Ecological Applications. 25 (4), 881-890 (2015).
- Santos, C., Serrão, J. Histology of the ileum in bees (Hymenoptera, Apoidea). Brazilian Journal of Morphological Sciences. 23 (3), 405-413 (2006).
- Suwannapong, G., Saichon, C., Benbow, M. Histochemical comparison of the hypopharyngeal gland in Apis cerana Fabricius, 1793 workers and Apis mellifera Linnaeus, 1758 workers. Psyche: A Journal of Entomology. , (2010).
- Ceylan, A., Sevin, S., Özgenç, Ö Histomorphological and histochemical structure of the midgut and hindgut of the Caucasian honey bee (Apis mellifera caucasia). Turkish Journal of Veterinary and Animal Sciences. 43 (6), 747-753 (2019).
- Human, H., et al. Miscellaneous standard methods for Apis mellifera research. Journal of Apicultural Research. 52 (4), 1-53 (2013).
- Gregorc, A., Smodiš Škerl, M. I. Toxicological and immunohistochemical testing of honeybees after oxalic and rotenone treatments. Apidologie. 38 (3), 296-305 (2007).
- Carreck, N. L., et al. Standard methods for Apis mellifera anatomy and dissection. Journal of Apicultural Research. 52 (4), 1-40 (2013).
- Bowen, I. D., Bowen, S. M., Jones, A. H. Mitosis and apoptosis: Matters of Life and Death. , Chapman & Hall. London. (1998).
- Eisenberg-Lerner, A., et al. Life and death partners: apoptosis, autophagy and the cross-talk between them. Cell Death and Differentiation. 16 (7), 966-975 (2009).
- Bowen, I. D., Mullarkey, K., Morgan, S. M. Programmed cell death in the salivary gland of the blow fly Calliphora vomitoria. Microscopy Research Techniques. 34, 202-207 (1996).
- D'Arcy, M. S. Cell death: a review of the major forms of apoptosis, necrosis and autophagy. Cell Biology International. 43 (6), 582-592 (2019).
- Matylevitch, N. P., et al. Apoptosis and accidental cell death in cultured human keratinocytes after thermal injury. American Journal of Pathology. 153 (2), 567-577 (1998).
- Perry, S. W., Epstein, L. G., Gelbard, H. A. Simultaneous in situ detection of apoptosis and necrosis in monolayer cultures by TUNEL and trypan blue staining. BioTechniques. 22 (6), 1102-1106 (1997).
- Cuello-Carrion, F. D., Ciocca, D. Improved detection of apoptotic cells using a modified in situ TUNEL technique. Journal of Histochemistry and Cytochemistry. 47 (6), 837-839 (1999).
- Gregorc, A., Bowen, I. D. Programmed cell death in the honeybee (Apis mellifera L.) larvae midgut. Cell Biology International. 21 (3), 151-158 (1997).
- Gregorc, A., Pogačnik, A., Bowen, I. D. Cell death in honey bee (Apis mellifera) larvae treated with oxalic or formic acid. Apidologie. 35 (5), 453-460 (2004).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved