Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Histologische Grundlagen und Zelltodnachweis in Honigbienengewebe
In diesem Artikel
Zusammenfassung
Immunhistochemische Methoden sind in der Honigbienenforschung nützlich, um den Grad der Apoptose und Nekrose in den Mitteldarm- und Hypopharynxdrüsen erwachsener Bienen zu erkennen und zu beurteilen.
Zusammenfassung
Honigbienen (Apis mellifera L.) innerhalb des Bienenstocks (Ammenarbeiter und andere Bienenstöcke) und außerhalb des Bienenstocks (Sammler) sind Klima- und Wetteränderungen, verschiedenen Pestiziden, Krankheitserregern und Unterernährung ausgesetzt, die hauptsächlich durch den Mund gelangen und hauptsächlich den Verdauungstrakt erwachsener Bienen betreffen. Um die Auswirkungen solcher externen und inneren Stressoren auf Honigbienen zu verstehen und zu verhindern, ist eine nützliche Forschungsmethode die immunhistochemische Methode. Es wird ein grundlegendes Protokoll beschrieben, um den Mitteldarm (Ventriculus) und die hypopharyngealen Drüsen (HPGs) erwachsener Bienen für die histologische Analyse vorzubereiten. Eine detaillierte Methodik wird beschrieben, um den Grad der Zellschädigung zu beurteilen und die Nekrose vom programmierten Zelltod (Apoptose) als natürlichen Prozess der Geweberegeneration zu unterscheiden. Die Ergebnisse der adulten Honigbienenbehandlung mit Oxalsäure und Pestiziden (Insektizid und Akarizid) und die Bestimmung des Zelltods im Ventriculus und HPGs werden vorgestellt. Die Vor- und Nachteile der Methodik werden ebenfalls diskutiert.
Einleitung
Honigbienen (Apis mellifera L.) sind neben anderen Wildbestäubern die wichtigsten Bestäuber landwirtschaftlicher Pflanzen. Über Tausende von Jahren hat die sich verändernde Umwelt Bienen beeinflusst, ihre Morphologie, Physiologie, ihr Verhalten und ihre Toleranz an verschiedene Krankheitserreger und Parasiten anzupassen. Daher haben Honigbienen rund um den Globus ein sehr vielfältiges Arten- und Unterartenspektrum entwickelt1. Diese Ergebnisse stimmen mit früheren Befunden überein, dass es genetische Variationen in der Verdauungstraktstruktur der Honigbiene gibt, deuten aber auch darauf hin, dass Veränderungen des Mitteldarms auf Umweltfaktoren zurückzuführen sind 2,3.
Der Verdauungstrakt der Honigbiene besteht aus drei Hauptteilen: Vorderdarm, Mitteldarm (Ventriculus) und Hinterdarm4. Der Ventriculus ist ein essentielles Organ für die Verdauung von Pollen und Nektar/Honig; Im Hinterdarm erfolgt die osmotische Kontrolle durch Aufnahme von Wasser und Ionen2. Die hypopharyngealen Drüsen (HPGs) von Honigbienenarbeitern befinden sich im Kopf und synthetisieren und sezernieren Gelée Royale-Komponenten, um die Brut, die Königin und Mitglieder der Kolonie zu füttern. Ihre Größe ändert sich mit Alter und Aufgaben und hängt von der richtigen Ernährung (Qualitätspollen) ab. Krankenschwestern im Alter von 6 bis 18 Tagen führen Brutaufzucht durch, und die Größe der HPGs nimmtum 5,6 zu. Bei Sammelbienen degenerieren die HPGs und sezernieren nur Enzyme, die wichtig sind, um die komplexen Zucker in einfache umzuwandeln (α-Glucosidasen, Leucin-Arylamidase, Invertase) in Honig7.
Honigbienen sind mehreren biotischen und abiotischen Stressoren ausgesetzt8, und der Verdauungstrakt kann durch mehrere negative Stimulanzien beeinträchtigt werden. Die erste Barriere, die den Organismus vor Krankheitserregern schützt, ist die peritrophe Membran im Mitteldarm, die zum Schutz vor Krankheitserregern aus Darmschleimhaut besteht4. Die Entwicklung und Funktion von HPGs hängen von Ernährung, Alter und Koloniezustandab 9 und werden durch Insektizide, Akarizide 10 und Krankheitserreger11,12,13 beeinflusst. Akarizidrückstände im Bienenstock aufgrund der Varroabekämpfung und Pestizide aus der Umwelt beeinträchtigen Sammlerbienen und Ammenbienen14,15. Die größte Bedrohung für Honigbienenvölker ist die Milbe Varroa destructor, sowohl als Vektor von Viren, die zu Völkerverlusten beitragen16 als auch als Konsument des Fettkörpers des Wirts (ein wichtiges lebenswichtiges Organ bei Honigbienen), der folglich den Körper und die Koloniefunktionen des Individuums beeinträchtigt17.
Intensive landwirtschaftliche Lebensräume können jedoch eine kurzfristige Nahrungsversorgung für Honigbienen darstellen. Daher sollten Agrarumweltmaßnahmen die Verfügbarkeit von Honigblumen in Agrarlandschaften verbessern18. Um die Morphologie verschiedener Unterarten 6,19,20,21 oder subletale Effekte dieser Faktoren auf Zell- oder Gewebeebene, insbesondere Mitteldarm und HPGs, zu beurteilen, sind histologische und immunhistochemische Methoden praktisch und ausreichend genau, um in der histologischen Forschung an Honigbienen eingesetzt zu werden.
Protokoll
1. Grundlagenhistologie für die Honigbienenforschung
- Dissektion von Honigbienengewebe
HINWEIS: Verwenden Sie für die Sektion von Arbeiterbienen ein Seziermikroskop mit einer LED-Lichtquelle. Die nützlichste Vergrößerung ist ~ 20x.- Manipulation und Sezieren
- Eine Arbeitsbiene vorsichtig mit einer Pinzette nehmen und für 2 min auf Eis (oder in den Gefrierschrank bei -20 °C) legen, um sie zu immobilisieren22. Stecken Sie die Biene auf die Petrischale schräg durch den obersten hinteren Teil des Thorax zweimal, von links nach rechts und von rechts nach links.
- Gießen Sie Insektenkochsalzlösung, um den Körper zu bedecken. Legen Sie die Petrischale unter das Mikroskop, fokussieren Sie und stellen Sie sie ein.
- Bereiten Sie die Instrumente vor (siehe Materialtabelle).
- Dissektion des Mitteldarms
- Beginnen Sie mit dem Bauch, indem Sie einen Punkt der Schere unter dem Tergit A5 (Abbildung 1) in der Mitte der rechten Seite des Bienenkörpers einführen. Auf den Tergit A2 schneiden.
- Halten Sie die innere Klinge der Schere parallel zur Körperseite, um eine Beschädigung der inneren Organe zu vermeiden. Drehen Sie die Schere nach links und machen Sie einen Schnitt; Biegen Sie rechts ab und machen Sie einen weiteren Schnitt. Öffnen Sie vorsichtig den linken Teil des Bauches und stecken Sie ihn fest. Wiederholen auf der anderen Seite.
- Ziehen Sie mit einer Hand die Honigbiene vorsichtig nach oben und schneiden Sie mit einer Schere in der anderen Hand ganz am Ende der Speiseröhre. Ziehen Sie den Magen und den Mitteldarm vom Bauch weg und schneiden Sie am Rektum ab. Verwenden Sie eine Pipette mit Insektenkochsalzlösung und entfernen Sie Kot oder Teile des Gewebes.
- Dissektion von HPGs
- Immobilisieren Sie eine Arbeitsbiene auf Eis, wie in Schritt 1.1.1 beschrieben. Schneiden Sie den Kopf ab und legen Sie ihn mit den Antennen nach oben auf die kleinere Platte. Sichern Sie den Kopf mit zwei Stiften: einen durch das linke Facettenauge und den zweiten durch das rechte Facettenauge.
- Machen Sie einen Schnitt über das erste Facettenauge auf der Innenseite der Stifte, fahren Sie weiter zum Labrum und machen Sie dann einen weiteren Schnitt auf der anderen Seite über das zweite Facettenauge (Abbildung 2).
- Schneiden Sie die Antennen ab. Heben Sie die Maske ab und schneiden Sie sie dort ab, wo sie noch befestigt ist. Nehmen Sie die Pinzette und entfernen Sie vorsichtig die Drüsen zusammen mit dem Gehirn und einem Teil der Facettenaugen.
- Manipulation und Sezieren
- Fixierung, Dehydratation und Paraffineinbettung
HINWEIS: Tragen Sie Schutzhandschuhe.- Legen Sie das Gewebe in Penicillinflaschen, gefüllt zu 3/4 mit 10% Formalin. Im Kühlschrank bei 4 °C aufbewahren.
- Nach 24 h dehydrieren Sie das Gewebe in einer Reihe von Alkoholen: 70%, 80%, 90%, 100%, für jeweils 1 h, 100% 2-Propanol für 1 h, 100% 2-Propanol für 12 h und schließlich 100% 2-Propanol für 1 h.
- Legen Sie das Gewebe in Histokassetten; markieren und in die Glaskammern mit 2-Propanol und Paraffin (1:1) in einen Inkubator bei 60 °C für 24 h legen.
- Die Histokassetten für weitere 24 h in eine andere Kammer mit Paraffin (I.) bringen. Wiederholen Sie den Vorgang mit frischem Paraffin noch zweimal (II. und III.), beide für 24 h.
- Bereiten Sie abschließend die Montagestation vor und beginnen Sie mit der Einbettung des Gewebes in Wachs.
- Öffnen Sie jede histokassette und entfernen Sie die Abdeckung. Füllen Sie die Form mit Wachs und legen Sie das Gewebe vorsichtig mit einer warmen Pinzette in die Mitte der Form.
- Legen Sie die histokassette auf die Form und bedecken Sie sie leicht mit Wachs. Legen Sie die Form sofort für einige Sekunden auf die kalte Oberfläche der Montagestation, dann legen Sie sie für einige Minuten auf die kalte Platte, bis das Wachs aushärtet und sich von der Form und der histokassette trennt.
- Lagern Sie die fertigen Proben in einer Box, weg von Staub und Hitze.
- Schneiden Sie 4 μm dünne Schnitte auf einem Mikrotom: zuerst zwei Abschnitte, die aneinander befestigt sind, und dann einen separat. Übertragen Sie die Abschnitte mit einer Pinzette und lassen Sie sie auf destilliertem Wasser (42 °C) schwimmen, sammeln Sie sie dann auf sauberen Objektträgern, indem Sie zwei Abschnitte auf der linken Seite des Objektivglases und den dritten auf der rechten Seite zusammenlegen, wobei sie deutlich getrennt bleiben. Lassen Sie die markierten Objektträger über Nacht auf dem Heizgerät und bewahren Sie sie schließlich in einer Box für histologische Proben auf.
- Entwachsung und Rehydratation
HINWEIS: Tragen Sie Schutzhandschuhe.- Bereiten Sie neun Coplin-Gläser vor und legen Sie die Abschnitte für jeweils 5 min in eine Reihe von Clearingmitteln (I., II., III.).
- In 2-Propanol, Ethanol 96% (I., II.), Alkohol 90% und 80% und destilliertes Wasser für jeweils 3 min gegeben.
- Färben mit Hämatoxylin und Eosin
HINWEIS: Tragen Sie Schutzhandschuhe.- Bereiten Sie sechs Coplin-Gläser vor.
- Für die Hämatoxylin- und Eosinfärbung (H & E) legen Sie die entwachsten, rehydrierten Abschnitte für 5 min in Hämatoxylin und legen Sie sie dann vorsichtig für 2 min unter das fließende Leitungswasser. Dann legen Sie sie für 1 min in destilliertes Wasser und Eosin für 4 min (für Eosin ist das Coplin-Glas nicht notwendig).
- Die Objektträger in Ethanol 96% für 1 min, dann 2-Propanol für 2 min und schließlich für 2 min in das Clearingmittel geben.
- Fügen Sie ein Montagemedium und ein Deckglas hinzu und lassen Sie sie trocknen. Unter einem Lichtmikroskop beobachten.
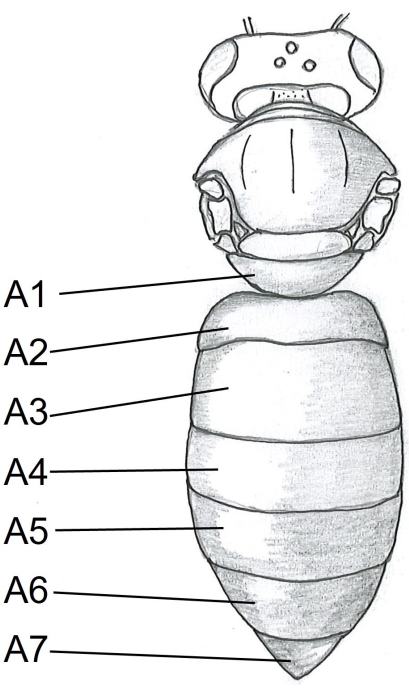
Abbildung 1: Dorsale Ansicht des Honigbienenkörpers. A1-A7 Tergite. Die detaillierte Anleitung zur Sektion von Honigbienen findet sich in Carreck et al.24. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
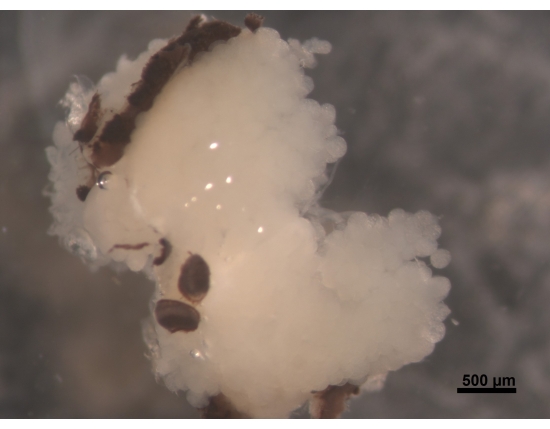
Abbildung 2: Dorsale Ansicht von HPGs, Teile von Facettenaugen, die am Gehirn befestigt sind (nicht sichtbar). Eine junge Arbeiterbiene im Alter von 5 bis 6 Tagen hat pralle und cremeweiße HPGs. Die Acini befinden sich im Gehirn und füllen den Kopfbereich mit Ästen, die den hinteren Teil des Gehirns erreichen. Bei Futterbienen sind diese Drüsen stark geschrumpft und hinterlassen nur dünne fadenförmige Überreste. Aus diesem Grund ist es besser, Drüsen zusammen mit dem Gehirn zu entfernen, um es bei weiteren Verfahren zu erleichtern, um den Verlust des Gewebes zu vermeiden. Maßstabsbalken = 500 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
2. Zelltodnachweis in Gewebeschnitten
- Apoptose-Detektionskit (Assay A)
HINWEIS: Befolgen Sie das Protokoll des Herstellers (siehe Materialtabelle).- Bereiten Sie die Coplin-Gläser vor.
- Nach der Entwachsung und Rehydratation (siehe Schritt 1.3) tauchen Sie die Objektträger in 0,85%ige NaCl-Lösung und dann in phosphatgepufferte Kochsalzlösung (PBS) (5 min).
- Legen Sie die Objektträger in 4% Paraformaldehyd 2 x 15 min.
- Legen Sie die Objektträger flach in den Behälter und fügen Sie 100 μL einer Proteinase K (20 μg / ml) Lösung hinzu und lassen Sie sie dann für 10-30 min.
- Legen Sie die Dias in PBS (5 min).
- Legen Sie die Objektträger in 4% Paraformaldehyd in PBS (5 min).
- Tauchen Sie die Dias in PBS (2 x 5 min).
- Legen Sie die Objektträger flach in den Behälter, fügen Sie 100 μL Gleichgewichtspuffer hinzu und lassen Sie sie für 5-10 min.
- Fügen Sie 100 μL TdT-Reaktionsmischung hinzu. Legen Sie Papierhandtücher in den Behälter, um die Objektträger herum, befeuchten Sie die Handtücher mit Wasser und bedecken Sie sie dann mit Plastikfolie. Objektträger 60 min bei 37 °C inkubieren.
- Legen Sie die Objektträger zurück in das Färbegestell und tauchen Sie 15 min in 2x Kochsalzlösungs-Natriumcitrat (SSC) ein.
- Tauchen Sie die Objektträger 3 x 5 min in PBS, dann 3-5 min in 0,3% Wasserstoffperoxid und dann wieder in PBS, 3 x 5 min.
- Legen Sie die Objektträger erneut flach in den Behälter, fügen Sie 100 μL Streptavidin HRP (Meerrettichperoxidase) hinzu und lassen Sie sie 30 Minuten einwirken (mit Plastikfolie abdecken).
- Tauchen Sie die Dias 3 x 5 min in PBS.
- Legen Sie die Objektträger flach in den Behälter und fügen Sie 100 μL 3,3'-Diaminobenzidin (DAB)-Lösung hinzu. Suchen Sie nach einem hellbraunen Hintergrund.
- Bringen Sie die Objektträger wieder in das Gestell und waschen Sie sie mehrmals in Wasser (doppelt destilliert).
- Montieren Sie die Dias unter Glasdeckgläsern in Montagemedium und lassen Sie sie flach trocknen.
- Unter einem Lichtmikroskop beobachten.
- Apoptose-Detektionskit (Assay B)
HINWEIS: Befolgen Sie das Protokoll des Herstellers (siehe Materialtabelle).- Coplin-Gläser vorbereiten.
- Proteinase K (20 μg/ml verdünnt in PBS) herstellen.
- Nach dem Entwachsen und Rehydrieren der Abschnitte (Schritt 1.3) legen Sie die Objektträger für 5 min in PBS.
- Die Objektträger flach in den Behälter geben und Proteinase K (20 μg/ml, 60 μL pro 5 cm² Probe) hinzufügen.
- Die Objektträger 2 x 2 min in destilliertem Wasser waschen.
- Quench in endogener Peroxidase (in 3% Wasserstoffperoxidase) bei Raumtemperatur.
- Spülen Sie die Objektträger 2 x 5 min mit PBS oder Wasser ab.
- Legen Sie die Objektträger flach in den Behälter und tragen Sie einen Gleichgewichtspuffer (75 μL/5 cm2) für 10 s bei Raumtemperatur auf.
- Wischen Sie vorsichtig um das Gewebe herum.
- Zu jedem Abschnitt wird das Enzym TdT (terminale Desoxynukleotidyltransferase) hinzugefügt und in einer befeuchteten Kammer für 1 h bei 37 °C inkubiert. Legen Sie Papiertücher in das Tablett, um die Rutschen herum, befeuchten Sie die Handtücher mit Wasser und bedecken Sie sie mit Plastikfolie.
- Nach der Inkubation legen Sie die Proben in das Gestell und lassen Sie sie im Stop/Wash-Puffer (10 min).
- Erwärmen Sie das Anti-Digoxigenin-Konjugat auf Raumtemperatur.
- Die Objektträger in PBS waschen (3 x 1 min).
- Vorsichtig um das Gewebe herum abwischen.
- Zwei Tropfen Anti-Digoxigenin-Peroxidase-Konjugat (65 μL/5 cm²) zu den Abschnitten geben und 30 min in einem befeuchteten Behälter inkubieren.
- Nach dem Waschen in PBS 4 x 2 min das Peroxidasesubstrat in Arbeitsstärke vorbereiten und überschüssige Flüssigkeit vorsichtig abklopfen und um den Abschnitt herum aspirieren.
- Die Abschnitte mit Peroxidasesubstrat (75 μL/5 cm²) abdecken und 5 min einfärben. Legen Sie einen Objektträger unter das Mikroskop und bestimmen Sie den optimalen Färbezeitpunkt.
- Die Objektträger in einem Fleckengestell in destilliertem Wasser waschen (3 x 1 min).
- Die Objektträger in destilliertem Wasser 5 min inkubieren.
- Gegenfärbung mit Hämatoxylin für 2 min.
- Legen Sie die Folie für 3 min unter fließendes Leitungswasser.
- Waschen Sie den Objektträger in destilliertem Wasser.
- Montieren Sie die Dias unter Glasdeckgläsern in Montagemedium und lassen Sie sie flach trocknen.
- Unter einem Lichtmikroskop beobachten.
- Apoptose-Detektionskit (Assay C)
HINWEIS: Befolgen Sie das Protokoll des Herstellers (siehe Materialtabelle).- Bereiten Sie die Coplin-Gläser vor.
- Entwachsen und rehydrieren Sie die Gewebeabschnitte (siehe Schritt 1.3).
- Inkubieren Sie das Gewebe mit Proteinase K (15-30 min bei 37 °C).
- Legen Sie die Dias wieder auf das Rack und spülen Sie sie 2x in PBS ab.
- Mit 50 μL "TUNEL-Reaktionsgemisch" abdecken. Legen Sie nasse Papierhandtücher in den Behälter, bedecken Sie sie mit Frischhaltefolie und lassen Sie sie 60 Minuten bei 37 °C.
- 3x mit PBS abspülen.
- Legen Sie die Objektträger in den Behälter und trocknen Sie den Bereich um die Gewebeprobe ab.
- 50 μL Converter-AP in die Probe geben und 30 min bei 37 °C in einem befeuchteten Behälter inkubieren.
- Spülen Sie 3x in PBS.
- 50-100 μL Substratlösung zugeben und 10 min im Dunkeln stehen lassen.
HINWEIS: Beobachten Sie die Färbung unter einem Lichtmikroskop. - Spülen Sie die Objektträger 3x mit PBS ab.
- Gegenfärbung durch Übertragen von Abschnitten in Hämatoxylin für 2 min und dann vorsichtig in fließendem Leitungswasser für 5 min abspülen.
- Montieren Sie die Dias unter Glasdeckgläsern in einem wässrigen Montagemedium und lassen Sie sie flach trocknen.
- Unter einem Lichtmikroskop beobachten. Beurteilen Sie die betroffenen (positiven) Zellen, indem Sie 70 bis 100 Zellen in jeder Probe des Mitteldarms oder HPGs unter einem Lichtmikroskop zählen.
Ergebnisse
Zelltodnachweis im Mitteldarm
Neu geschlüpfte Arbeiterbienen (Apis mellifera carnica) aus dem Versuchsimkerei des Landwirtschaftsinstituts Sloweniens in Ljubljana wurden einzeln mit 3% Oxalsäure (OA)23 behandelt. OA wird häufig in der Imkerei zur Varroa-Destruktorkontrolle eingesetzt. Nach der Behandlung wurden die Arbeiterbienen (drei aus jeder Gruppe) auf Eis immobilisiert. Der Mitteldarm wurde seziert und in 10% Formalin fixiert. Das Gewebe wurde dann in...
Diskussion
In lebenden Organismen wird der Zelltod als Apoptose oder Nekrose25 definiert und kann von Autophagie26 begleitet werden. Der Unterschied zwischen apoptotischen und nekrotischen Zellen besteht darin, dass Apoptose eine Form des programmierten Zelltods ist und in normalen Zellen auftritt, während Nekrose aufgrund tödlicher Bedingungen (z. B. Unfall, Krankheit) auftritt27,28. Apoptose kann mit Assay-Kits nachgewiese...
Offenlegungen
Der Autor hat keine Interessenkonflikte.
Danksagungen
Ich bedanke mich für die Unterstützung der slowenischen Forschungsagentur, Zuschuss Nr. P4-133.
Materialien
| Name | Company | Catalog Number | Comments |
| 2-Propanol | |||
| ApopTag Peroxidase kit (ApopTag Peroxidase In Situ Apoptosis Detection) | Sigma-Aldrich | S7100 | Assay B, https://www.sigmaaldrich.com/SI/en/product/mm/s7100?gclid=CjwKCA jw7vuUBhBUEiwAEdu2pPanI9SE j81ZTl-nLHEoxXAv7ViKwPA_QRx H7fciMRNcYwR7lbPQbhoCqcQQA vD_BwE; Positive controls included in S7101 |
| Covers | |||
| DeadEnd Colorimetric TUNEL system | Promega | G7360 | Assay A, https://worldwide.promega.com/products/cell-health-assays/apoptosis-assays/deadend-colorimetric-tunel-system/?catNum=G7360 |
| Dissecting microscope (for bee dissection) | Zeiss | ||
| Distilled water | |||
| Embedding cassette | |||
| EnVision System alkaline phosphatase kit | Dako | ||
| Eosin Y Solution | Sigma-Aldrich | alcoholic | |
| Ethanol | 95% (or less pure), 90%, 80% | ||
| Faramount mounting medium, aqueous | Dako | mounting medium | |
| Flattening table | Leica | HI1220 | |
| Forceps (for bee dissection) | Fine science tools | 11294-00 | Standard #4 |
| Formalin 10% | Formaldehyde | ||
| Hematoxylin | Sigma-Aldrich | ||
| HistoChoice Clearing Agent | Sigma-Aldrich | clearing agent | |
| Hydrogen peroxidase 3% | |||
| Incubator | BioRad | ||
| Insect pins (for bee dissection) | Entosphinx | 44594 | Insect pins stainless steel – white, size 2 |
| ISCDDK, AP (In Situ Cell Death Detecteion Kit, Alkaline Phosphatase) | Roche | 11684809910 | Assay C, https://www.sigmaaldrich.com/deepweb/assets/sigmaaldrich/product/documents/362/737/11684809910b ul.pdf |
| KH2PO4 | |||
| Lab clock | |||
| Light microscope | Leica | ||
| Microscope slides | Box with the slides must be preserved in a plastic wrap to prevent dust | ||
| Microtome | Leica | ||
| Modular tissue embedding station | Leica | ||
| Na2HPO4 | |||
| NaCl | |||
| Paraformaldehyde 4% | |||
| Paraplast | Leica | ||
| Pasteur pipettes | 1.5 mL; 3 mL | ||
| PBS | |||
| Petri dish (for bee dissection) | Filled with condensation silicon (Xantoprene L blue and Universal liquid plus activator) | ||
| Proteinase K | Merck | 21627 | |
| Ringers' solution (for bee dissection) | 7.5 g NaCL, 2.38 g Na2HPO4, 2.72 g KH2PO4, 1 L distilled water | ||
| Scissors (for bee dissection) | Fine science tools | 1406-09, 14061-09 | Straight and curved, 9 cm |
| Universal liquid plus activator (for bee dissection) | Kulzer | ||
| Watchmaker’s forceps (for bee dissection) | Fine science tools | 91100-12 | |
| Water bath | Leica | ||
| Watercolor brush | 2x | ||
| Xantoprene L blue (for bee dissection) | Kulzer |
Referenzen
- Ruttner, F. . Naturgeschichte der Honigbienen. , (1992).
- Jordan, R. Kleine Bienenkunde. Österreichischer Agrarverlag Wien München. , 41-45 (1964).
- Snodgrass, R. E. The Anatomy of the Honey Bee. The Hive and the Honey Bee. , 111-113 (1975).
- Snodgrass, R. E. . The Anatomy of the Honey Bee. , (2004).
- Hrassnigg, N., Crailsheim, K. Adaptation of hypopharyngeal gland development to the brood status of honeybee (Apis mellifera L.) colonies. Journal of Insect Physiology. 44 (10), 929-939 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Characteristics of hypopharyngeal glands in honeybees (Apis mellifera carnica) from a nurse colony. Slovenian Veterinary Research. 52 (2), 67-74 (2015).
- Kubo, T. Change in the expression of hypopharyngeal-gland proteins of the worker honeybees (Apis mellifera L.) with age and/or role. Journal of Biochemistry. 119 (2), 291-295 (1996).
- Sammataro, D., Yoder, J. A. . Honey bee colony health: Challenges and sustainable solutions. , 302 (2012).
- Crailsheim, K., Stolberg, E. Influence of diet, age and colony condition upon intestinal proteolytic activity and size of the hypopharyngeal glands in the honeybee (Apis mellifera L.). Journal of Insect Physiology. 35 (8), 595-602 (1998).
- Smodiš Škerl, M. I., Gregorc, A. Heat shock proteins and cell death in situ localisation in hypopharyngeal glands of honeybee (Apis mellifera carnica) workers after imidacloprid or coumaphos treatment. Apidologie. 41 (1), 73-86 (2010).
- Gregorc, A., Bowen, I. D. The histochemical characterisation of cell death in honeybee larvae midgut after treatment with Paenibacillus larvae, Amitraz and Oxytetracycline. Cell Biology International. 24 (5), 319-324 (2000).
- Higes, M., et al. Apoptosis in the pathogenesis of Nosema ceranae (Microsporidia: Nosematidae) in honey bees (Apis mellifera). Environmental Microbiology Reports. 5 (4), 530-536 (2013).
- Kurze, C., et al. Infection dynamics of Nosema ceranae in honey bee midgut and host cell apoptosis. Journal of Invertebrate Pathology. 154, 1-4 (2018).
- Johnson, R. M. Honey bee toxicology. Annual Review of Entomology. 60 (1), 415-434 (2005).
- Gashout, H. A., Guzman-Novoa, E., Goodwin, P. H. Synthetic and natural acaricides impair hygienic and foraging behaviors of honey bees. Apidologie. 51 (6), 1155-1165 (2020).
- McMenamin, A. J., Genersch, E. Honey bee colony losses and associated viruses. Current Opinion in Insect Science. 8, 121-129 (2015).
- Ramsey, S. D., et al. Varroa destructor feeds primarily on honey bee fat body tissue and not hemolymph. Proceedings of the National Academy of Sciences USA. 116 (5), 1792-1801 (2019).
- Requier, F., et al. Honey bee diet in intensive farmland habitats reveals an unexpectedly high flower richness and a major role of weeds. Ecological Applications. 25 (4), 881-890 (2015).
- Santos, C., Serrão, J. Histology of the ileum in bees (Hymenoptera, Apoidea). Brazilian Journal of Morphological Sciences. 23 (3), 405-413 (2006).
- Suwannapong, G., Saichon, C., Benbow, M. Histochemical comparison of the hypopharyngeal gland in Apis cerana Fabricius, 1793 workers and Apis mellifera Linnaeus, 1758 workers. Psyche: A Journal of Entomology. , (2010).
- Ceylan, A., Sevin, S., Özgenç, &. #. 2. 1. 4. ;. Histomorphological and histochemical structure of the midgut and hindgut of the Caucasian honey bee (Apis mellifera caucasia). Turkish Journal of Veterinary and Animal Sciences. 43 (6), 747-753 (2019).
- Human, H., et al. Miscellaneous standard methods for Apis mellifera research. Journal of Apicultural Research. 52 (4), 1-53 (2013).
- Gregorc, A., Smodiš Škerl, M. I. Toxicological and immunohistochemical testing of honeybees after oxalic and rotenone treatments. Apidologie. 38 (3), 296-305 (2007).
- Carreck, N. L., et al. Standard methods for Apis mellifera anatomy and dissection. Journal of Apicultural Research. 52 (4), 1-40 (2013).
- Bowen, I. D., Bowen, S. M., Jones, A. H. . Mitosis and apoptosis: Matters of Life and Death. , (1998).
- Eisenberg-Lerner, A., et al. Life and death partners: apoptosis, autophagy and the cross-talk between them. Cell Death and Differentiation. 16 (7), 966-975 (2009).
- Bowen, I. D., Mullarkey, K., Morgan, S. M. Programmed cell death in the salivary gland of the blow fly Calliphora vomitoria. Microscopy Research Techniques. 34, 202-207 (1996).
- D'Arcy, M. S. Cell death: a review of the major forms of apoptosis, necrosis and autophagy. Cell Biology International. 43 (6), 582-592 (2019).
- Matylevitch, N. P., et al. Apoptosis and accidental cell death in cultured human keratinocytes after thermal injury. American Journal of Pathology. 153 (2), 567-577 (1998).
- Perry, S. W., Epstein, L. G., Gelbard, H. A. Simultaneous in situ detection of apoptosis and necrosis in monolayer cultures by TUNEL and trypan blue staining. BioTechniques. 22 (6), 1102-1106 (1997).
- Cuello-Carrion, F. D., Ciocca, D. Improved detection of apoptotic cells using a modified in situ TUNEL technique. Journal of Histochemistry and Cytochemistry. 47 (6), 837-839 (1999).
- Gregorc, A., Bowen, I. D. Programmed cell death in the honeybee (Apis mellifera L.) larvae midgut. Cell Biology International. 21 (3), 151-158 (1997).
- Gregorc, A., Pogačnik, A., Bowen, I. D. Cell death in honey bee (Apis mellifera) larvae treated with oxalic or formic acid. Apidologie. 35 (5), 453-460 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten