Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Monitoreo continuo simple de glucosa en ratones que se mueven libremente
En este artículo
Resumen
Aquí, describimos un método simple para implantar un monitor comercial continuo de glucosa diseñado para pacientes en ratones y proporcionamos los guiones para analizar los resultados.
Resumen
Los ratones son un organismo modelo común utilizado para estudiar enfermedades metabólicas como la diabetes mellitus. Los niveles de glucosa se miden típicamente por sangrado de cola, que requiere manipular a los ratones, causa estrés y no proporciona datos sobre el comportamiento libre de los ratones durante el ciclo oscuro. La medición continua de glucosa de última generación en ratones requiere la inserción de una sonda en el arco aórtico del ratón, así como un sistema de telemetría especializado. Este método desafiante y costoso no ha sido adoptado por la mayoría de los laboratorios. Aquí, presentamos un protocolo simple que implica la utilización de monitores continuos de glucosa disponibles comercialmente utilizados por millones de pacientes para medir la glucosa continuamente en ratones como parte de la investigación básica. La sonda sensible a la glucosa se inserta en el espacio subcutáneo en la parte posterior del ratón a través de una pequeña incisión en la piel y se mantiene en su lugar firmemente con un par de suturas. El dispositivo se sutura a la piel del ratón para garantizar que permanezca en su lugar. El dispositivo puede medir los niveles de glucosa durante un máximo de 2 semanas y envía los datos a un receptor cercano sin necesidad de manipular los ratones. Se proporcionan scripts para el análisis de datos básicos de los niveles de glucosa registrados. Este método, desde la cirugía hasta el análisis computacional, es rentable y potencialmente muy útil en la investigación metabólica.
Introducción
La diabetes mellitus (DM) es una enfermedad devastadora caracterizada por niveles altos de glucosa en sangre. La DM tipo 1 puede ser el resultado de un ataque autoinmune a las células beta productoras de insulina en el páncreas. La DM tipo 2 y la DM gestacional, por otro lado, se caracterizan por una falla de las células beta para secretar suficiente insulina en respuesta a un aumento en los niveles de glucosa1. El ratón es un organismo modelo común utilizado para estudiar la DM, ya que tiene una fisiología similar y sus niveles normales de glucosa son cercanos a los de los humanos. Además, cepas específicas de ratón pueden desarrollar DM debido a mutaciones en vías de señalización clave o después de la exposición a dietas específicas, lo que permite modelar la enfermedad 2,3,4.
La glucosa en sangre se mide comúnmente en ratones usando glucómetros diseñados para pacientes extrayendo una pequeña gota de sangre (1-2 μL) de la punta de la cola del ratón. Este método causa estrés y requiere el manejo del ratón, lo que afecta los niveles de glucosa y prohíbe la medición de los niveles de glucosa en sangre en ratones que se comportan libremente o cuando el investigador no está cerca de5. El sangrado de los ratones puede causar estrés a los ratones cercanos, particularmente a los ratones de la misma jaula cuya glucemia aún no se ha medido, lo que afecta los resultados. Los ratones responden de manera diferente dependiendo del manejador, y la persona que mide la glucosa puede afectar los niveles de glucosa de los ratones. Estos escollos requieren un diseño experimental cuidadoso y subyacen a algunas inconsistencias entre los experimentos.
Es posible medir la glucosa en ratones que se mueven libremente sin sangrado mediante la implantación de sensores de glucosa en el arco aórtico de los ratones utilizando la telemetría de última generación6. Las mediciones resultantes son muy buenas y pueden mantenerse durante un largo período, pero es difícil implantar estos sensores, y el sistema de telemetría es costoso, lo que lleva a una adopción moderada de esta metodología y a ninguna adopción en laboratorios no especializados. En los últimos años se han desarrollado sensores subcutáneos u otros sensores de glucosa adaptados a las dimensiones de los ratones y su fisiología, pero también requieren expertos altamente calificados y, en algunos casos, son costosos 6,7,8,9,10.
Los monitores continuos de glucosa (MCG) comerciales que se desarrollaron originalmente para monitorear los niveles de glucosa de los pacientes con DM ofrecen otra opción para medir la glucosa en ratones que se mueven libremente, con requisitos de menor costo y experiencia técnica que las sondas implantadas. Tales sondas han sido utilizadas en investigación básica por unos pocos laboratorios 5,11,12,13,14,15 incluyendo nuestros colegas que utilizaron este protocolo 16. Estos dispositivos suelen incluir un sensor, un dispositivo de montaje, un receptor y una aplicación de software. El sensor tiene una cánula que guía el glucosensor enzimático, cinta adhesiva, una fuente de energía, memoria a corto plazo y un módulo de comunicación inalámbrica que almacena y envía los datos al receptor. El receptor puede mostrar los niveles actuales de glucosa y envía los datos a un servidor; Este receptor puede ser un teléfono celular. La aplicación de software proporciona datos para el paciente y el equipo de atención médica sobre la glucemia del paciente. En los pacientes, el sensor se conecta fácilmente utilizando el dispositivo de montaje. La cánula se inserta por vía subcutánea presionando el dispositivo de montaje contra la piel, y el sensor permanece en su lugar con la ayuda de cinta adhesiva.
Este es un protocolo detallado para adaptar un dispositivo comercial de MCG para medir los niveles de glucosa en ratones. Este protocolo describe cómo insertar quirúrgicamente el sensor de glucosa y conectarlo al ratón. Se proporcionan scripts para el análisis básico de datos y la visualización de datos. Se proporcionan los posibles escollos, la solución de problemas y ejemplos de resultados estándar. El siguiente protocolo es específico para un determinado MCG, pero se puede adaptar fácilmente a otros tipos de MCG comerciales a medida que estén disponibles.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Los experimentos fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad Hebrea.
NOTA: Todas las herramientas deben ser esterilizadas, y el manejo de la cánula debe realizarse utilizando una técnica estéril. El siguiente protocolo está ajustado a un CGM específico. El protocolo se puede adaptar a otros MCG.
1. Administración de analgésicos antes del procedimiento
- Administrar dextrosa al 5% y solución salina al 0,45% con meloxicam a 5 mg/kg de peso corporal por vía subcutánea.
2. Administración de anestesia
- Coloque el ratón en la cámara de inducción, cerrando la tapa herméticamente. Ajuste la inducción de la anestesia en la cámara de inducción a isoflurano al 3% a un caudal de 500 mL/min.
- Una vez que el mouse no responda, retire el mouse de la cámara y ajuste el cono de la nariz al mouse. Confirme el nivel de anestesia con un pellizco interdigital. Ajuste la concentración a 1% -1.5% isoflurano y el caudal a 100 ml / min en un ratón que pesa 30 g.
- Aplique ungüento oftálmico en los ojos para prevenir la sequedad durante la anestesia.
3. Preparación del sensor
- Monte el sensor en el dispositivo de montaje del sensor para exponer la cinta y el lado de la cánula del sensor (Figura 1A). Tenga cuidado ya que la aguja se inserta en la cánula y se expone.
- Suture dos suturas de punto cónico 5-0 a la cinta en ambos lados de la cánula (Figura 1A).
4. Depilación y desinfección
- Afeite un área de aproximadamente 4 cm x 4 cm en la línea media de la parte posterior del ratón.
- Administrar una crema depilatoria en la zona afeitada para asegurar la depilación completa.
- Limpie la piel y desintéctela con una solución antiséptica que contenga 2% de gluconato de clorhexidina y 70% de alcohol isopropílico.
5. Preparación de la piel dorsal
- Haga una incisión de 2 mm en el centro del área afeitada por encima de la columna vertebral con tijeras afiladas (Figura 1B).
- Brevemente, inserte fórceps pequeños con un borde romo debajo de la piel para formar un pequeño bolsillo subcutáneo para que la cánula se pueda insertar fácilmente en el bolsillo subcutáneo (Figura 1B).
- Pasar una sutura del paso 3.2 a través de la piel a cada lado de la incisión (Figura 1C).
6. Inserción del sensor
- Retire el sensor completamente del dispositivo de montaje del sensor (la cánula está vacía de la aguja) y sostenga el sensor con pinzas para evitar que la cinta circundante se pegue a sí misma.
- Inserte cuidadosamente la cánula en el bolsillo subcutáneo.
- Tire de las suturas de cada lado, y apriételas y átelas para fijar el sensor firmemente en su lugar, evitando así que la cánula se salga del bolsillo subcutáneo una vez que la cinta adhesiva se afloje con el tiempo.
7. Fijación y sutura del sensor
- Fije el sensor a la parte posterior firmemente atando las suturas internas y utilizando la cinta adhesiva que rodea el sensor.
- Haga ocho suturas discontinuas alrededor del sensor, fijando el borde de la cinta del sensor a la piel (Figura 1D).
8. Activación del lector
- Una vez insertado el sensor, active el lector encendiéndolo, presionando Iniciar nuevo sensor y deslizando el sensor de acuerdo con las instrucciones del fabricante.
- La primera lectura solo se puede tomar unos minutos después de instalar el CGM. En el caso de este MCG, la primera lectura se puede tomar después de 60 minutos.
9. Lectura de resultados
- Coloque el lector cerca del ratón (no es necesario tocarlo). Todos los datos almacenados en el sensor se transmiten al lector.
NOTA: Los diferentes dispositivos CGM pueden diferir en el período de capacidad histórica de ahorro de datos. En el caso de este MCG, se puede almacenar un máximo de 8 h entre dos lecturas.
10. Extracción del sensor
- Anestesiar el ratón (ver sección 2).
- Corte las suturas que conectan el sensor a la parte posterior del ratón con unas tijeras afiladas.
- Retire y corte las suturas en la incisión retirando suavemente el sensor.
- Si es necesario, use una sola sutura para cerrar la incisión en la parte posterior del ratón.
11. Análisis de datos
- Descarga de datos: descargue los datos según las instrucciones proporcionadas por el fabricante de CGM.
NOTA: Cada CGM tiene un formato diferente, que puede o no ser fácilmente accesible para el usuario. Esta es una consideración importante en la elección del MCG. - Para el análisis con el software proporcionado, formatee los datos de acuerdo con las instrucciones del archivo léame en Github (https://github.com/mika-littor/CGM-in-Mice-Analysis.git).
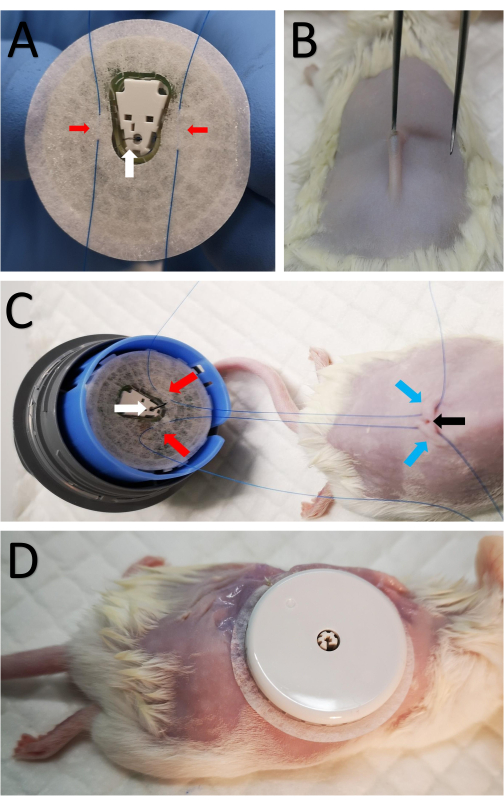
Figura 1: Fijación del sensor al ratón . (A) Dos suturas marcadas con flechas rojas se pasan a través de la cinta del sensor a ambos lados de la cánula en la parte inferior del sensor CGM, marcado por una flecha blanca. (B) Se realiza una pequeña incisión de 2 mm en el centro del área afeitada a lo largo de la columna vertebral con tijeras afiladas. Pequeños fórceps con un borde romo se insertan brevemente debajo de la piel para formar un pequeño bolsillo subcutáneo para que la cánula se pueda insertar por vía subcutánea. (C) Las mismas suturas de A se pasan por vía subcutánea a cada lado de la incisión. Las flechas rojas marcan las suturas unidas al sensor como en A, las flechas azules marcan la ubicación a través de la cual las suturas pasaron a la piel en la parte posterior del ratón, y la flecha negra muestra la incisión. (D) Después de insertar la cánula, las suturas internas se aprietan y se atan cerca de la incisión para asegurar el MCG. A continuación, el sensor se sutura a la piel. Haga clic aquí para ver una versión más grande de esta figura.
Access restricted. Please log in or start a trial to view this content.
Resultados
Resultado quirúrgico
Se muestran los resultados de ocho ratones HSD: ICR (de 8 semanas) alimentados con una dieta alta en grasas y alta en sacarosa (HFHS) durante 18 semanas y cinco ratones HSD: ICR magros (de 12 semanas). El dispositivo que utilizamos almacena datos durante un máximo de 8 h. El acceso a la instalación local de animales estaba restringido a las 07:00-19:00, prohibiendo así la recopilación de datos durante las últimas horas de la tarde, cuando los ratones están activos. Por lo t...
Access restricted. Please log in or start a trial to view this content.
Discusión
Este protocolo ofrece un método simple y económico para monitorear los niveles de glucosa en ratones que no requiere microcirugía desafiante y no implica sangrado o manipulación de ratones. El método es fácil de implementar en todas las instalaciones y no causa mortalidad, dolor o molestias excesivas a los ratones. El paso más crítico en el protocolo es insertar la cánula del sensor de glucosa debajo de la piel del ratón. La adición de algunas suturas permite que la cánula permanezca en su lugar durante más ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Agradecemos a Dvir Mintz DVM y al personal veterinario y ganadero de la instalación para animales, así como a los miembros de nuestro grupo, por las fructíferas discusiones. Este estudio fue apoyado por una subvención 1541/21 de la Fundación de Ciencias de Israel otorgada a D.B.Z. D.B.Z. es una facultad de Zuckerman STEM.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| 2% Chlorhexidine Gluconate and 70% Isopropyl Alcohol | 3M | ID 7000136290 | |
| 5% Dextrose and 0.45% Sodium Chloride Injection, USP | Braun | L6120 | |
| Castroviejo needle holder | FST | 12061-02 | |
| Extra Fine Bonn scissors | FST | 14084-08 | |
| FreeStyle Libre 1 reader | Abbott | ART27543 | |
| FreeStyle Libre sensor | Abbott | ART36687 | |
| FreeStyle Libre sensor applicator | Abbott | ART36787 | |
| Gauze pads | Sion medical | PC912017 | |
| Graefe Forceps | FST | 11052-10 | |
| Hair Removal Cream | Veet | 3116523 | |
| High-fat high-sucrose diet | Envigo Teklad diets | TD.08811 | |
| Isoflurane, USP Terrell | Piramal | 26675-46-7 | |
| Meloxicam 5 mg/mL | Chanelle Pharma | 08749/5024 | |
| MiniARCO Clipper kit | Moser | CL8787-KIT | |
| PROLENE Polypropylene Suture 5-0 | Ethicon | 8725H | |
| Puralube Opthalmic Ointment | Perrigo | 574402511 | |
| Q-tips | B.H.W | 271676 | |
| SomnoSuite Low-Flow Anesthesia System | Kent Scientific | SOMNO |
Referencias
- Polonsky, K. S. The past 200 years in diabetes. New England Journal of Medicine. 367 (14), 1332-1340 (2012).
- Rees, D. A., Alcolado, J. C. Animal models of diabetes mellitus. Diabetic Medicine. 22 (4), 359-370 (2005).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the non-obese diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Heydemann, A. An overview of murine high fat diet as a model for Type 2 diabetes mellitus. Journal of Diabetes Research. 2016, 2902351(2016).
- Kennard, M. R., et al. The use of mice in diabetes research: The impact of experimental protocols. Diabetic Medicine. 38 (12), 14705(2021).
- Klueh, U., et al. Continuous glucose monitoring in normal mice and mice with prediabetes and diabetes. Diabetes Technology and Therapeutics. 8 (3), 402-412 (2006).
- Wuyts, C., Simoens, C., Pinto, S., Philippaert, K., Vennekens, R. Continuous glucose monitoring during pregnancy in healthy mice. Scientific Reports. 11, 4450(2021).
- Korstanje, R., et al. Continuous glucose monitoring in female NOD mice reveals daily rhythms and a negative correlation with body temperature. Endocrinology. 158 (9), 2707-2712 (2017).
- Han, B. G., et al. Markers of glycemic control in the mouse: Comparisons of 6-h-and overnight-fasted blood glucoses to Hb A1c. American Journal of Physiology - Endocrinology and Metabolism. 295 (4), 981-986 (2008).
- Xie, X., et al. Reduction of measurement noise in a continuous glucose monitor by coating the sensor with a zwitterionic polymer. Nature Biomedical Engineering. 2 (12), 894-906 (2018).
- Van Der Meulen, T., et al. Urocortin3 mediates somatostatin-dependent negative feedback control of insulin secretion. Nature Medicine. 21 (7), 769-776 (2015).
- Peterson, Q. P., et al. A method for the generation of human stem cell-derived alpha cells. Nature Communications. 11, 2241(2020).
- Klueh, U., Liu, Z., Feldman, B., Kreutzer, D. Interstitial fluid physiology as it relates to glucose monitoring technologies: Importance of Interleukin-1 and Interleukin-1 receptor antagonist in short-term glucose sensor function in vivo. Journal of Diabetes Science and Technology. 4 (5), 1073(2010).
- Klueh, U., Antar, O., Qiao, Y., Kreutzer, D. L. Role of interleukin-1/interleukin-1 receptor antagonist family of cytokines in long-term continuous glucose monitoring in vivo. Journal of Diabetes Science and Technology. 7 (6), 1538(2013).
- Klueh, U., Kaur, M., Qiao, Y., Kreutzer, D. L. Critical role of tissue mast cells in controlling long-term glucose sensor function in vivo. Biomaterials. 31 (16), 4540-4551 (2010).
- Kogot-Levin, A., et al. Mapping the metabolic reprogramming induced by sodium-glucose cotransporter 2 inhibition. JCI Insight. , 164296(2023).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados