Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Serbestçe hareket eden farelerde basit sürekli glikoz izleme
Bu Makalede
Özet
Burada, hastalar için tasarlanmış ticari bir sürekli glikoz monitörünü farelere implante etmek ve sonuçları analiz etmek için komut dosyaları sağlamak için basit bir yöntem açıklıyoruz.
Özet
Fareler, diabetes mellitus gibi metabolik hastalıkları incelemek için kullanılan yaygın bir model organizmadır. Glikoz seviyeleri tipik olarak farelerin ele alınmasını gerektiren, strese neden olan ve karanlık döngü sırasında serbestçe davranan fareler hakkında veri sağlamayan kuyruk kanaması ile ölçülür. Farelerde son teknoloji ürünü sürekli glikoz ölçümü, farenin aort kemerine bir probun yanı sıra özel bir telemetri sistemi yerleştirilmesini gerektirir. Bu zorlu ve pahalı yöntem çoğu laboratuvar tarafından benimsenmemiştir. Burada, temel araştırmanın bir parçası olarak farelerde glikozu sürekli ölçmek için milyonlarca hasta tarafından kullanılan ticari olarak temin edilebilen sürekli glikoz monitörlerinin kullanımını içeren basit bir protokol sunuyoruz. Glikoz algılayıcı prob, farenin arkasındaki deri altı boşluğuna, cilde küçük bir kesi yoluyla yerleştirilir ve birkaç dikiş kullanılarak sıkıca yerinde tutulur. Cihaz, yerinde kalmasını sağlamak için fare derisine dikilir. Cihaz, glikoz seviyelerini 2 haftaya kadar ölçebilir ve fareleri tutmaya gerek kalmadan verileri yakındaki bir alıcıya gönderir. Kaydedilen glikoz seviyelerinin temel veri analizi için komut dosyaları sağlanmıştır. Ameliyattan hesaplamalı analize kadar bu yöntem, uygun maliyetlidir ve metabolik araştırmalarda potansiyel olarak çok yararlıdır.
Giriş
Diabetes mellitus (DM), yüksek kan şekeri düzeyleri ile karakterize yıkıcı bir hastalıktır. Tip 1 DM, pankreastaki insülin üreten beta hücrelerine otoimmün bir saldırının bir sonucu olabilir. Öte yandan, Tip 2 DM ve gestasyonel DM, beta hücrelerinin glukozseviyelerindeki 1 artışa yanıt olarak yeterli insülin salgılamaması ile karakterizedir. Fare, benzer fizyolojiye sahip olduğu için DM'yi incelemek için kullanılan yaygın bir model organizmadır ve normal glikoz seviyeleri insanlarınkine yakındır. Ayrıca, spesifik fare suşları, anahtar sinyal yolaklarındaki mutasyonlar nedeniyle veya hastalık modellemesini mümkün kılan spesifik diyetlere maruz kaldıktan sonra DM geliştirebilir 2,3,4.
Kan şekeri genellikle farelerde, fare kuyruğunun ucundan küçük bir damla kan (1-2 μL) çıkarılarak hastalar için tasarlanmış glukometreler kullanılarak ölçülür. Bu yöntem strese neden olur ve glikoz seviyelerini etkileyen ve serbestçe davranan farelerde veya araştırmacı5'e yakın olmadığında kan şekeri seviyelerinin ölçülmesini yasaklayan farenin kullanılmasını gerektirir. Farelerin kanaması, yakındaki farelerde, özellikle de glisemisi henüz ölçülmemiş aynı kafesteki farelerde strese neden olabilir ve böylece sonuçları etkileyebilir. Fareler, işleyiciye bağlı olarak farklı tepki verir ve glikozu ölçen kişi, farelerin glikoz seviyelerini etkileyebilir. Bu tuzaklar dikkatli deneysel tasarım gerektirir ve deneyler arasındaki bazı tutarsızlıkların altında yatmaktadır.
Kanama olmadan serbestçe hareket eden farelerde glikozu, son teknoloji ürünü telemetri6 kullanarak farelerin aort arkına glikoz sensörleri implante ederek ölçmek mümkündür. Elde edilen ölçümler çok iyidir ve uzun bir süre boyunca sürdürülebilir, ancak bu sensörleri implante etmek zordur ve telemetri sistemi pahalıdır, bu da bu metodolojinin ılımlı bir şekilde benimsenmesine ve uzman olmayan laboratuvarlarda benimsenmemesine neden olur. Farelerin boyutlarına ve fizyolojilerine göre uyarlanmış deri altı veya diğer glikoz sensörleri son yıllarda geliştirilmiştir, ancak bunlar yine çok yetenekli uzmanlar gerektirir ve bazı durumlardamaliyetli 6,7,8,9,10'dur.
Başlangıçta DM hastalarının glikoz seviyelerini izlemek için geliştirilen ticari sürekli glikoz monitörleri (CGM'ler), implante edilmiş problardan daha düşük maliyet ve teknik uzmanlık gereksinimleri ile serbestçe hareket eden farelerde glikozu ölçmek için başka bir seçenek sunar. Bu tür sondalar, bu protokolü kullanan meslektaşlarımız da dahil olmak üzere 5,11,12,13,14,15 numaralı birkaç laboratuvar tarafından temel araştırmalarda kullanılmıştır 16. Bu cihazlar tipik olarak bir sensör, bir montaj cihazı, bir alıcı ve bir yazılım uygulaması içerir. Sensör, enzimatik glukosensörü yönlendiren bir kanüle, yapışkan banda, bir enerji kaynağına, kısa süreli belleğe ve verileri depolayan ve alıcıya gönderen bir kablosuz iletişim modülüne sahiptir. Alıcı mevcut glikoz seviyelerini gösterebilir ve verileri bir sunucuya gönderebilir; Bu alıcı bir cep telefonu olabilir. Yazılım uygulaması, hasta ve tıbbi bakım ekibi için hastanın glisemisi hakkında veri sağlar. Hastalarda, sensör montaj cihazı kullanılarak kolayca takılır. Kanül, montaj cihazı cilde bastırılarak deri altına yerleştirilir ve sensör yapışkan bant yardımıyla yerinde kalır.
Bu, farelerde glikoz seviyelerini ölçmek için ticari bir CGM cihazını uyarlamak için ayrıntılı bir protokoldür. Bu protokol, glikoz sensörünün cerrahi olarak nasıl yerleştirileceğini ve fareye nasıl takılacağını açıklar. Temel veri analizi ve veri görselleştirme için komut dosyaları sağlanır. Olası tuzaklar, sorun giderme ve standart sonuç örnekleri verilmiştir. Aşağıdaki protokol belirli bir CGM için spesifiktir, ancak kullanıma sunuldukça diğer ticari CGM türlerine kolayca uyarlanabilir.
Access restricted. Please log in or start a trial to view this content.
Protokol
Deneyler, İbrani Üniversitesi Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) tarafından onaylandı.
NOT: Tüm aletler sterilize edilmeli ve kanülün taşınması steril bir teknik kullanılarak yapılmalıdır. Aşağıdaki protokol belirli bir CGM'ye göre ince ayarlıdır. Protokol diğer CGM'lere uyarlanabilir.
1. İşlemden önce analjezik uygulama
- Deri altından 5 mg / kg vücut ağırlığında meloksikam ile% 5 dekstroz ve% 0.45 salin uygulayın.
2. Anestezi uygulaması
- Fareyi indüksiyon odasına yerleştirin ve kapağı sıkıca kapatın. İndüksiyon odasındaki anestezi indüksiyonunu 500 mL/dak akış hızında %3 izofluran olarak ayarlayın.
- Fare yanıt vermediğinde, fareyi odadan çıkarın ve burun konisini fareye takın. Anestezi seviyesini interdigital bir tutam ile onaylayın. 30 g ağırlığındaki bir farede konsantrasyonu %1-%1,5 izofluran ve akış hızını 100 mL/dak olarak ayarlayın.
- Anestezi sırasında kuruluğu önlemek için gözlere oftalmik merhem uygulayın.
3. Sensör hazırlama
- Sensörün bandını ve kanül tarafını ortaya çıkarmak için sensörü sensör montaj cihazına monte edin (Şekil 1A). İğne kanülün içine sokulduğundan ve açığa çıktığından dikkatli olun.
- Kanülün her iki tarafındaki banda iki adet 5-0 konik nokta dikiş dikin (Şekil 1A).
4. Epilasyon ve dezenfeksiyon
- Farenin arka kısmının orta çizgisinde yaklaşık 4 cm x 4 cm'lik bir alanı tıraş edin.
- Tamamen epilasyon sağlamak için tıraş edilen bölgeye tüy dökücü bir krem uygulayın.
- Cildi silin ve% 2 klorheksidin glukonat ve% 70 izopropil alkol içeren antiseptik bir çözelti kullanarak dezenfekte edin.
5. Dorsal cilt hazırlığı
- Tıraş edilen bölgenin ortasında, omurganın üstünde, keskin makas kullanarak 2 mm'lik bir kesi yapın (Şekil 1B).
- Kısaca, küçük bir deri altı cebi oluşturmak için derinin altına künt kenarlı küçük forseps yerleştirin, böylece kanül deri altı cebe kolayca yerleştirilebilir (Şekil 1B).
- Adım 3.2'den itibaren bir sütürü insizyonun her iki tarafındaki deriden geçirin (Şekil 1C).
6. Sensör yerleştirme
- Sensörü sensör montaj cihazından tamamen çıkarın (kanül iğneden boştur) ve çevreleyen bandın kendisine yapışmasını önlemek için sensörü forseps ile tutun.
- Kanülü dikkatlice deri altı cebine yerleştirin.
- Dikişleri her iki tarafa da çekin ve sensörü sıkıca yerine oturtmak için sıkın ve bağlayın, böylece yapışkan bant zamanla gevşediğinde kanülün deri altı cebinden kaymasını önleyin.
7. Sensör bağlantısı ve dikiş
- İç dikişleri bağlayarak ve sensörü çevreleyen yapışkan bandı kullanarak sensörü arkaya sıkıca takın.
- Sensörün etrafında sekiz adet süreksiz dikiş yaparak sensör bandının kenarlığını cilde yapıştırın (Şekil 1D).
8. Okuyucunun etkinleştirilmesi
- Sensör takıldıktan sonra, okuyucuyu açarak, Yeni Sensör Başlat'a basarak ve sensörü üreticinin talimatlarına göre kaydırarak okuyucuyu etkinleştirin.
- İlk okuma, CGM'yi kurduktan sonra sadece birkaç dakika alınabilir. Bu CGM durumunda, ilk okuma 60 dakika sonra alınabilir.
9. Sonuçları okuma
- Okuyucuyu farenin yakınına yerleştirin (dokunmaya gerek yoktur). Sensörde depolanan tüm veriler okuyucuya iletilir.
NOT: Farklı CGM cihazları, geçmiş veri tasarrufu kapasitesi döneminde farklılık gösterebilir. Bu CGM durumunda, iki okuma arasında maksimum 8 saat saklanabilir.
10. Sensörün çıkarılması
- Fareyi uyuşturun (bkz. bölüm 2).
- Sensörü farenin arkasına bağlayan dikişleri keskin makas kullanarak kesin.
- Sensörü nazikçe çıkararak kesideki dikişleri çıkarın ve kesin.
- Gerekirse, farenin arkasındaki kesiyi kapatmak için tek bir dikiş kullanın.
11. Veri analizi
- Veri indirme: CGM üreticisi tarafından sağlanan talimatlara göre verileri indirin.
NOT: Her CGM'nin, kullanıcı tarafından kolayca erişilebilen veya erişilemeyen farklı bir biçimi vardır. Bu, CGM'nin seçiminde önemli bir husustur. - Sağlanan yazılımla analiz için, verileri Github'daki (https://github.com/mika-littor/CGM-in-Mice-Analysis.git) benioku dosyasındaki talimatlara göre biçimlendirin.
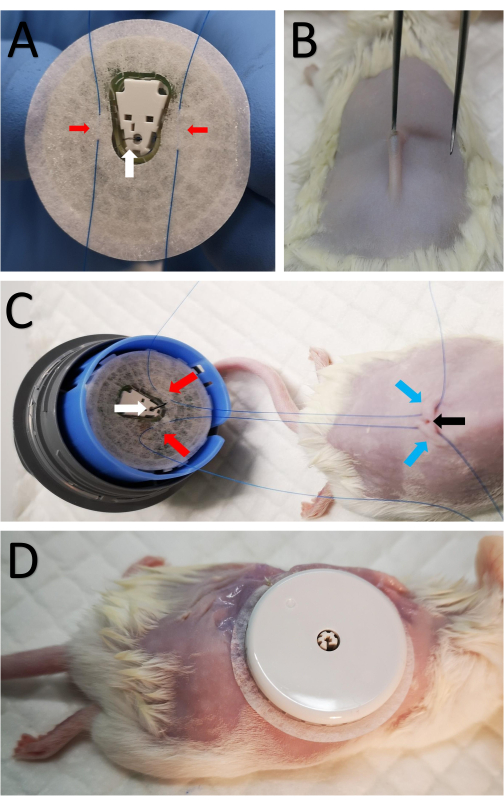
Şekil 1: Sensörün fareye bağlanması . (A) Kırmızı oklarla işaretlenmiş iki dikiş, CGM sensörünün alt tarafındaki kanülün her iki tarafındaki sensör bandından beyaz bir okla işaretlenmiş olarak geçirilir. (B) Omurga boyunca tıraş edilen alanın merkezinde keskin makas kullanılarak 2 mm'lik küçük bir kesi yapılır. Künt kenarlı küçük forsepsler, küçük bir deri altı cep oluşturmak için cildin altına kısaca yerleştirilir, böylece kanül deri altına yerleştirilebilir. (C) A'dan aynı dikişler insizyonun her iki tarafında deri altından geçirilir. Kırmızı oklar sensöre tutturulmuş dikişleri A'da olduğu gibi işaretler, mavi oklar dikişlerin farenin arkasındaki cilde geçtiği yeri işaretler ve siyah ok kesiyi gösterir. (D) Kanül yerleştirildikten sonra, iç dikişler sıkılır ve CGM'yi sabitlemek için insizyona yakın bir yere bağlanır. Sensör daha sonra cilde dikilir. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
Cerrahi sonuç
18 hafta boyunca yüksek yağlı yüksek sakkaroz diyeti (HFHS) ile beslenen sekiz HSD: ICR faresinden (8 haftalık) ve beş yağsız HSD: ICR faresinden (12 haftalık) elde edilen sonuçlar gösterilmiştir. Kullandığımız cihaz 8 saate kadar veri saklıyor. Yerel hayvan tesisine erişim 07:00-19:00 ile sınırlandırıldı, böylece farelerin aktif olduğu geç saatlerde veri toplanması yasaklandı. Bu nedenle fareler, cerrahi işlemden 7 gün önce, 8: 30 ile 20: 30 arasında kar...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Bu protokol, zorlu mikrocerrahi gerektirmeyen ve kanamayı veya fareleri tutmayı içermeyen farelerde glikoz seviyelerini izlemek için basit, ucuz bir yöntem sunar. Yöntemin her tesiste uygulanması kolaydır ve farelerde ölüm, ağrı veya aşırı rahatsızlığa neden olmaz. Protokoldeki en kritik adım, glikoz sensörünün kanülünü fare derisinin altına yerleştirmektir. Birkaç dikişin eklenmesi, kanülün daha uzun süre yerinde kalmasını sağlar. Sensörler küçüktür ve fare hareket ettikçe tıkan...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarların açıklayacak çıkar çatışmaları yoktur.
Teşekkürler
Dvir Mintz DVM'ye, hayvan tesisindeki veterinerlik ve hayvancılık personeline ve grubumuzun üyelerine verimli tartışmalar için teşekkür ederiz. Bu çalışma, D.B.Z.'ye verilen 1541/21 sayılı İsrail Bilim Vakfı hibesi ile desteklenmiştir.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 2% Chlorhexidine Gluconate and 70% Isopropyl Alcohol | 3M | ID 7000136290 | |
| 5% Dextrose and 0.45% Sodium Chloride Injection, USP | Braun | L6120 | |
| Castroviejo needle holder | FST | 12061-02 | |
| Extra Fine Bonn scissors | FST | 14084-08 | |
| FreeStyle Libre 1 reader | Abbott | ART27543 | |
| FreeStyle Libre sensor | Abbott | ART36687 | |
| FreeStyle Libre sensor applicator | Abbott | ART36787 | |
| Gauze pads | Sion medical | PC912017 | |
| Graefe Forceps | FST | 11052-10 | |
| Hair Removal Cream | Veet | 3116523 | |
| High-fat high-sucrose diet | Envigo Teklad diets | TD.08811 | |
| Isoflurane, USP Terrell | Piramal | 26675-46-7 | |
| Meloxicam 5 mg/mL | Chanelle Pharma | 08749/5024 | |
| MiniARCO Clipper kit | Moser | CL8787-KIT | |
| PROLENE Polypropylene Suture 5-0 | Ethicon | 8725H | |
| Puralube Opthalmic Ointment | Perrigo | 574402511 | |
| Q-tips | B.H.W | 271676 | |
| SomnoSuite Low-Flow Anesthesia System | Kent Scientific | SOMNO |
Referanslar
- Polonsky, K. S. The past 200 years in diabetes. New England Journal of Medicine. 367 (14), 1332-1340 (2012).
- Rees, D. A., Alcolado, J. C. Animal models of diabetes mellitus. Diabetic Medicine. 22 (4), 359-370 (2005).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the non-obese diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Heydemann, A. An overview of murine high fat diet as a model for Type 2 diabetes mellitus. Journal of Diabetes Research. 2016, 2902351(2016).
- Kennard, M. R., et al. The use of mice in diabetes research: The impact of experimental protocols. Diabetic Medicine. 38 (12), 14705(2021).
- Klueh, U., et al. Continuous glucose monitoring in normal mice and mice with prediabetes and diabetes. Diabetes Technology and Therapeutics. 8 (3), 402-412 (2006).
- Wuyts, C., Simoens, C., Pinto, S., Philippaert, K., Vennekens, R. Continuous glucose monitoring during pregnancy in healthy mice. Scientific Reports. 11, 4450(2021).
- Korstanje, R., et al. Continuous glucose monitoring in female NOD mice reveals daily rhythms and a negative correlation with body temperature. Endocrinology. 158 (9), 2707-2712 (2017).
- Han, B. G., et al. Markers of glycemic control in the mouse: Comparisons of 6-h-and overnight-fasted blood glucoses to Hb A1c. American Journal of Physiology - Endocrinology and Metabolism. 295 (4), 981-986 (2008).
- Xie, X., et al. Reduction of measurement noise in a continuous glucose monitor by coating the sensor with a zwitterionic polymer. Nature Biomedical Engineering. 2 (12), 894-906 (2018).
- Van Der Meulen, T., et al. Urocortin3 mediates somatostatin-dependent negative feedback control of insulin secretion. Nature Medicine. 21 (7), 769-776 (2015).
- Peterson, Q. P., et al. A method for the generation of human stem cell-derived alpha cells. Nature Communications. 11, 2241(2020).
- Klueh, U., Liu, Z., Feldman, B., Kreutzer, D. Interstitial fluid physiology as it relates to glucose monitoring technologies: Importance of Interleukin-1 and Interleukin-1 receptor antagonist in short-term glucose sensor function in vivo. Journal of Diabetes Science and Technology. 4 (5), 1073(2010).
- Klueh, U., Antar, O., Qiao, Y., Kreutzer, D. L. Role of interleukin-1/interleukin-1 receptor antagonist family of cytokines in long-term continuous glucose monitoring in vivo. Journal of Diabetes Science and Technology. 7 (6), 1538(2013).
- Klueh, U., Kaur, M., Qiao, Y., Kreutzer, D. L. Critical role of tissue mast cells in controlling long-term glucose sensor function in vivo. Biomaterials. 31 (16), 4540-4551 (2010).
- Kogot-Levin, A., et al. Mapping the metabolic reprogramming induced by sodium-glucose cotransporter 2 inhibition. JCI Insight. , 164296(2023).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır