Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Surveillance continue simple de la glycémie chez des souris en mouvement libre
Dans cet article
Résumé
Ici, nous décrivons une méthode simple pour implanter un glucomètre continu commercial conçu pour les patients sur des souris et fournir les scripts pour analyser les résultats.
Résumé
Les souris sont un organisme modèle commun utilisé pour étudier les maladies métaboliques telles que le diabète sucré. Les niveaux de glucose sont généralement mesurés par saignement de la queue, ce qui nécessite la manipulation des souris, provoque du stress et ne fournit pas de données sur le comportement libre des souris pendant le cycle sombre. La mesure continue de pointe de la glycémie chez la souris nécessite l’insertion d’une sonde dans l’arc aortique de la souris, ainsi que d’un système de télémétrie spécialisé. Cette méthode difficile et coûteuse n’a pas été adoptée par la plupart des laboratoires. Ici, nous présentons un protocole simple impliquant l’utilisation de glucomètres continus disponibles dans le commerce utilisés par des millions de patients pour mesurer le glucose en continu chez la souris dans le cadre de la recherche fondamentale. La sonde de détection de glucose est insérée dans l’espace sous-cutané à l’arrière de la souris à travers une petite incision sur la peau et est maintenue fermement en place à l’aide de quelques sutures. L’appareil est suturé à la peau de la souris pour s’assurer qu’elle reste en place. L’appareil peut mesurer les niveaux de glucose jusqu’à 2 semaines et envoie les données à un récepteur à proximité sans avoir besoin de manipuler les souris. Des scripts pour l’analyse des données de base des niveaux de glucose enregistrés sont fournis. Cette méthode, de la chirurgie à l’analyse informatique, est rentable et potentiellement très utile dans la recherche métabolique.
Introduction
Le diabète sucré (DM) est une maladie dévastatrice caractérisée par une glycémie élevée. Le diabète de type 1 peut être le résultat d’une attaque auto-immune sur les cellules bêta productrices d’insuline dans le pancréas. Le DM de type 2 et le DM gestationnel, en revanche, sont caractérisés par une incapacité des cellules bêta à sécréter suffisamment d’insuline en réponse à une augmentation du taux de glucose1. La souris est un organisme modèle commun utilisé pour étudier le DM car elle a une physiologie similaire et ses niveaux normaux de glucose sont proches de ceux des humains. De plus, des souches de souris spécifiques peuvent développer un DM en raison de mutations dans les principales voies de signalisation ou à la suite d’une exposition à des régimes spécifiques, ce qui permet la modélisation de la maladie 2,3,4.
La glycémie est couramment mesurée chez la souris à l’aide de glucomètres conçus pour les patients en extrayant une petite goutte de sang (1-2 μL) du bout de la queue de la souris. Cette méthode provoque un stress et nécessite la manipulation de la souris, ce qui affecte les niveaux de glucose et interdit la mesure de la glycémie chez les souris se comportant librement ou lorsque le chercheur n’est pas à proximitéde 5. Le saignement des souris peut causer du stress aux souris voisines, en particulier aux souris de la même cage dont la glycémie n’a pas encore été mesurée, affectant ainsi les résultats. Les souris réagissent différemment selon le manipulateur, et la personne qui mesure le glucose peut affecter les niveaux de glucose des souris. Ces pièges exigent une conception expérimentale minutieuse et sous-tendent certaines incohérences entre les expériences.
Il est possible de mesurer le glucose chez des souris en mouvement libre sans saignement en implantant des capteurs de glucose dans l’arc aortique des souris à l’aide de la télémétriede pointe 6. Les mesures résultantes sont très bonnes et peuvent être maintenues sur une longue période, mais il est difficile d’implanter ces capteurs, et le système de télémétrie est coûteux, ce qui conduit à une adoption modérée de cette méthodologie et à aucune adoption dans les laboratoires non spécialisés. Des capteurs de glucose sous-cutanés ou autres adaptés aux dimensions des souris et à leur physiologie ont été développés ces dernières années, mais ceux-ci nécessitent à nouveau des experts hautement qualifiés et sont dans certains cas coûteux 6,7,8,9,10.
Les glucomètres continus (CGM) commerciaux qui ont été développés à l’origine pour surveiller les niveaux de glucose des patients atteints de DM offrent une autre option pour mesurer le glucose chez les souris en mouvement libre, avec des exigences de coût et d’expertise technique inférieures à celles des sondes implantées. De telles sondes ont été utilisées en recherche fondamentale par quelques laboratoires 5,11,12,13,14,15 y compris nos collègues qui ont utilisé ce protocole 16. Ces périphériques comprennent généralement un capteur, un dispositif de montage, un récepteur et une application logicielle. Le capteur dispose d’une canule guidant le glucocapteur enzymatique, d’un ruban adhésif, d’une source d’énergie, d’une mémoire à court terme et d’un module de communication sans fil qui stocke et envoie les données au récepteur. Le récepteur peut afficher les niveaux de glucose actuels et envoyer les données à un serveur; Ce récepteur peut être un téléphone portable. L’application logicielle fournit des données au patient et à l’équipe médicale sur la glycémie du patient. Chez les patients, le capteur se fixe facilement à l’aide du dispositif de montage. La canule est insérée par voie sous-cutanée en pressant le dispositif de montage contre la peau, et le capteur reste en place à l’aide de ruban adhésif.
Il s’agit d’un protocole détaillé pour adapter un dispositif CGM commercial pour mesurer les niveaux de glucose chez la souris. Ce protocole décrit comment insérer chirurgicalement le capteur de glucose et le fixer à la souris. Des scripts pour l’analyse et la visualisation des données de base sont fournis. Les pièges potentiels, le dépannage et des exemples de résultats standard sont fournis. Le protocole ci-dessous est spécifique à un certain CGM, mais peut être facilement adapté à d’autres types de CGM commerciaux dès qu’ils deviennent disponibles.
Access restricted. Please log in or start a trial to view this content.
Protocole
Les expériences ont été approuvées par le Comité institutionnel de soin et d’utilisation des animaux (IACUC) de l’Université hébraïque.
NOTE: Tous les outils doivent être stérilisés et la manipulation de la canule doit être effectuée à l’aide d’une technique stérile. Le protocole ci-dessous est adapté à un CGM spécifique. Le protocole peut être adapté à d’autres CGM.
1. Administration d’analgésique avant la procédure
- Administrer 5% de dextrose et 0,45% de solution saline avec du méloxicam à 5 mg / kg de poids corporel par voie sous-cutanée.
2. Administration de l’anesthésie
- Placez la souris dans la chambre à induction en fermant hermétiquement le couvercle. Régler l’induction de l’anesthésie dans la chambre d’induction à 3 % d’isoflurane à un débit de 500 mL/min.
- Une fois que la souris ne répond plus, retirez-la de la chambre et ajustez le cône de nez à la souris. Confirmez le niveau d’anesthésie avec une pincement interdigitale. Régler la concentration à 1 %-1,5 % d’isoflurane et le débit à 100 mL/min chez une souris pesant 30 g.
- Appliquez une pommade ophtalmique sur les yeux pour prévenir la sécheresse pendant l’anesthésie.
3. Préparation du capteur
- Montez le capteur sur le dispositif de montage du capteur pour exposer la bande et la canule du capteur (Figure 1A). Soyez prudent car l’aiguille est insérée dans la canule et exposée.
- Suturer deux points de suture coniques 5-0 à la bande des deux côtés de la canule (Figure 1A).
4. Épilation et désinfection
- Rasez une zone d’environ 4 cm x 4 cm sur la ligne médiane du dos de la souris.
- Administrer une crème dépilatoire sur la zone rasée pour assurer une épilation complète.
- Essuyez la peau et désinfectez-la à l’aide d’une solution antiseptique contenant 2% de gluconate de chlorhexidine et 70% d’alcool isopropylique.
5. Préparation dorsale de la peau
- Faites une incision de 2 mm au centre de la zone rasée au-dessus de la colonne vertébrale à l’aide de ciseaux tranchants (Figure 1B).
- En bref, insérez de petites pinces avec un bord émoussé sous la peau pour former une petite poche sous-cutanée afin que la canule puisse être insérée facilement dans la poche sous-cutanée (Figure 1B).
- Passez une suture de l’étape 3.2 à travers la peau de chaque côté de l’incision (Figure 1C).
6. Insertion du capteur
- Retirez complètement le capteur du dispositif de montage du capteur (la canule est vide de l’aiguille) et maintenez le capteur avec une pince pour empêcher le ruban environnant de coller à lui-même.
- Insérez délicatement la canule dans la poche sous-cutanée.
- Tirez les sutures de chaque côté, serrez-les et attachez-les pour fixer le capteur fermement en place, empêchant ainsi la canule de glisser hors de la poche sous-cutanée une fois que le ruban adhésif se desserre avec le temps.
7. Fixation et suture du capteur
- Fixez fermement le capteur à l’arrière en attachant les sutures internes et en utilisant le ruban adhésif entourant le capteur.
- Effectuez huit sutures discontinues autour du capteur, en fixant le bord du ruban adhésif du capteur à la peau (Figure 1D).
8. Activation du lecteur
- Une fois le capteur inséré, activez-le en allumant le lecteur, en appuyant sur Démarrer un nouveau capteur et en faisant glisser le capteur conformément aux instructions du fabricant.
- La première lecture ne peut être effectuée que quelques minutes après l’installation du CGM. Dans le cas de ce CGM, la première lecture peut être effectuée après 60 min.
9. Résultats de lecture
- Placez le lecteur près de la souris (il n’est pas nécessaire de le toucher). Toutes les données stockées dans le capteur sont transmises au lecteur.
REMARQUE: Différents appareils CGM peuvent différer dans la période de capacité historique d’économie de données. Dans le cas de ce CGM, un maximum de 8 h peut être stocké entre deux lectures.
10. Retrait du capteur
- Anesthésiez la souris (voir rubrique 2).
- Coupez les sutures reliant le capteur à l’arrière de la souris à l’aide de ciseaux tranchants.
- Retirez et coupez les sutures à l’incision en retirant doucement le capteur.
- Si nécessaire, utilisez une seule suture pour fermer l’incision à l’arrière de la souris.
11. Analyse des données
- Téléchargement des données : Téléchargez les données conformément aux instructions fournies par le fabricant du CGM.
REMARQUE: Chaque CGM a un format différent, qui peut ou non être facilement accessible à l’utilisateur. Il s’agit d’une considération importante dans le choix du CGM. - Pour l’analyse avec le logiciel fourni, formatez les données selon les instructions du fichier readme sur Github (https://github.com/mika-littor/CGM-in-Mice-Analysis.git).
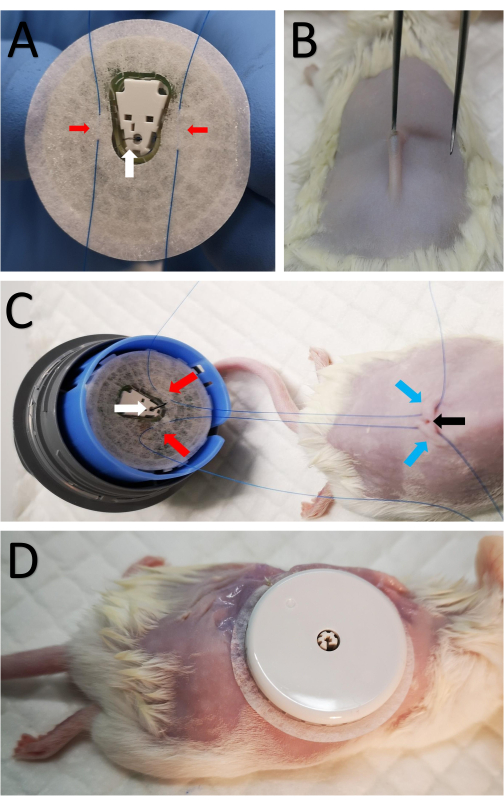
Figure 1 : Fixation du capteur à la souris. (A) Deux sutures marquées par des flèches rouges sont passées à travers le ruban de capteur des deux côtés de la canule sur la face inférieure du capteur CGM, marquées par une flèche blanche. (B) Une petite incision de 2 mm est pratiquée au centre de la zone rasée le long de la colonne vertébrale à l’aide de ciseaux tranchants. De petites pinces avec un bord émoussé sont brièvement insérées sous la peau pour former une petite poche sous-cutanée afin que la canule puisse être insérée par voie sous-cutanée. (C) Les mêmes sutures de A sont passées par voie sous-cutanée de chaque côté de l’incision. Les flèches rouges marquent les sutures attachées au capteur comme dans A, les flèches bleues marquent l’emplacement des sutures passées à la peau à l’arrière de la souris et la flèche noire montre l’incision. (D) Après l’insertion de la canule, les sutures internes sont serrées et attachées près de l’incision pour fixer le CGM. Le capteur est ensuite suturé à la peau. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Résultats
Résultat chirurgical
Les résultats de huit souris HSD: ICR (âgées de 8 semaines) nourries avec un régime riche en graisses et en saccharose (HFHS) pendant 18 semaines et cinq souris HSD: ICR maigres (âgées de 12 semaines) sont présentés. L’appareil que nous avons utilisé stocke les données jusqu’à 8 heures. L’accès à l’animalerie locale a été limité de 7h00 à 19h00, interdisant ainsi la collecte de données pendant les heures tardives de l’après-midi, lorsque les souris so...
Access restricted. Please log in or start a trial to view this content.
Discussion
Ce protocole offre une méthode simple et peu coûteuse pour surveiller les niveaux de glucose chez la souris qui ne nécessite pas de microchirurgie difficile et n’implique pas de saignement ou de manipulation des souris. La méthode est facile à mettre en œuvre dans tous les établissements et ne cause pas de mortalité, de douleur ou d’inconfort excessif aux souris. L’étape la plus critique du protocole consiste à insérer la canule du capteur de glucose sous la peau de la souris. L’ajout de quelques sutur...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous remercions Dvir Mintz DVM et le personnel vétérinaire et d’élevage de l’animalerie, ainsi que les membres de notre groupe, pour leurs discussions fructueuses. Cette étude a été soutenue par une subvention 1541/21 de la Fondation israélienne des sciences accordée à D.B.Z. D.B.Z. est une faculté Zuckerman STEM.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 2% Chlorhexidine Gluconate and 70% Isopropyl Alcohol | 3M | ID 7000136290 | |
| 5% Dextrose and 0.45% Sodium Chloride Injection, USP | Braun | L6120 | |
| Castroviejo needle holder | FST | 12061-02 | |
| Extra Fine Bonn scissors | FST | 14084-08 | |
| FreeStyle Libre 1 reader | Abbott | ART27543 | |
| FreeStyle Libre sensor | Abbott | ART36687 | |
| FreeStyle Libre sensor applicator | Abbott | ART36787 | |
| Gauze pads | Sion medical | PC912017 | |
| Graefe Forceps | FST | 11052-10 | |
| Hair Removal Cream | Veet | 3116523 | |
| High-fat high-sucrose diet | Envigo Teklad diets | TD.08811 | |
| Isoflurane, USP Terrell | Piramal | 26675-46-7 | |
| Meloxicam 5 mg/mL | Chanelle Pharma | 08749/5024 | |
| MiniARCO Clipper kit | Moser | CL8787-KIT | |
| PROLENE Polypropylene Suture 5-0 | Ethicon | 8725H | |
| Puralube Opthalmic Ointment | Perrigo | 574402511 | |
| Q-tips | B.H.W | 271676 | |
| SomnoSuite Low-Flow Anesthesia System | Kent Scientific | SOMNO |
Références
- Polonsky, K. S. The past 200 years in diabetes. New England Journal of Medicine. 367 (14), 1332-1340 (2012).
- Rees, D. A., Alcolado, J. C. Animal models of diabetes mellitus. Diabetic Medicine. 22 (4), 359-370 (2005).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the non-obese diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Heydemann, A. An overview of murine high fat diet as a model for Type 2 diabetes mellitus. Journal of Diabetes Research. 2016, 2902351(2016).
- Kennard, M. R., et al. The use of mice in diabetes research: The impact of experimental protocols. Diabetic Medicine. 38 (12), 14705(2021).
- Klueh, U., et al. Continuous glucose monitoring in normal mice and mice with prediabetes and diabetes. Diabetes Technology and Therapeutics. 8 (3), 402-412 (2006).
- Wuyts, C., Simoens, C., Pinto, S., Philippaert, K., Vennekens, R. Continuous glucose monitoring during pregnancy in healthy mice. Scientific Reports. 11, 4450(2021).
- Korstanje, R., et al. Continuous glucose monitoring in female NOD mice reveals daily rhythms and a negative correlation with body temperature. Endocrinology. 158 (9), 2707-2712 (2017).
- Han, B. G., et al. Markers of glycemic control in the mouse: Comparisons of 6-h-and overnight-fasted blood glucoses to Hb A1c. American Journal of Physiology - Endocrinology and Metabolism. 295 (4), 981-986 (2008).
- Xie, X., et al. Reduction of measurement noise in a continuous glucose monitor by coating the sensor with a zwitterionic polymer. Nature Biomedical Engineering. 2 (12), 894-906 (2018).
- Van Der Meulen, T., et al. Urocortin3 mediates somatostatin-dependent negative feedback control of insulin secretion. Nature Medicine. 21 (7), 769-776 (2015).
- Peterson, Q. P., et al. A method for the generation of human stem cell-derived alpha cells. Nature Communications. 11, 2241(2020).
- Klueh, U., Liu, Z., Feldman, B., Kreutzer, D. Interstitial fluid physiology as it relates to glucose monitoring technologies: Importance of Interleukin-1 and Interleukin-1 receptor antagonist in short-term glucose sensor function in vivo. Journal of Diabetes Science and Technology. 4 (5), 1073(2010).
- Klueh, U., Antar, O., Qiao, Y., Kreutzer, D. L. Role of interleukin-1/interleukin-1 receptor antagonist family of cytokines in long-term continuous glucose monitoring in vivo. Journal of Diabetes Science and Technology. 7 (6), 1538(2013).
- Klueh, U., Kaur, M., Qiao, Y., Kreutzer, D. L. Critical role of tissue mast cells in controlling long-term glucose sensor function in vivo. Biomaterials. 31 (16), 4540-4551 (2010).
- Kogot-Levin, A., et al. Mapping the metabolic reprogramming induced by sodium-glucose cotransporter 2 inhibition. JCI Insight. , 164296(2023).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon