Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Простой непрерывный мониторинг уровня глюкозы у свободно движущихся мышей
В этой статье
Резюме
Здесь мы описываем простой метод имплантации мышам коммерческого непрерывного монитора глюкозы, предназначенного для пациентов, и предоставляем сценарии для анализа результатов.
Аннотация
Мыши являются распространенным модельным организмом, используемым для изучения метаболических заболеваний, таких как сахарный диабет. Уровни глюкозы обычно измеряются с помощью кровотечения из хвоста, которое требует обращения с мышами, вызывает стресс и не дает данных о свободно ведущих себя мышах во время темного цикла. Современное непрерывное измерение уровня глюкозы у мышей требует введения зонда в дугу аорты мыши, а также специализированной системы телеметрии. Этот сложный и дорогостоящий метод не был принят большинством лабораторий. Здесь мы представляем простой протокол, включающий использование коммерчески доступных непрерывных мониторов глюкозы, используемых миллионами пациентов для непрерывного измерения глюкозы у мышей в рамках фундаментальных исследований. Зонд, чувствительный к глюкозе, вводится в подкожное пространство в задней части мыши через небольшой разрез на коже и плотно удерживается на месте с помощью пары швов. Устройство пришивается к коже мыши, чтобы оно оставалось на месте. Устройство может измерять уровень глюкозы в течение 2 недель и отправляет данные на ближайший приемник без необходимости обращаться с мышами. Приведены сценарии для анализа основных данных зарегистрированных уровней глюкозы. Этот метод, от хирургии до вычислительного анализа, является экономически эффективным и потенциально очень полезным в метаболических исследованиях.
Введение
Сахарный диабет (СД) – разрушительное заболевание, характеризующееся высоким уровнем глюкозы в крови. СД 1 типа может быть результатом аутоиммунной атаки на инсулин-продуцирующие бета-клетки поджелудочной железы. СД 2 типа и гестационный СД, с другой стороны, характеризуются неспособностью бета-клеток секретировать достаточное количество инсулина в ответ на повышение уровня глюкозы1. Мышь является распространенным модельным организмом, используемым для изучения СД, поскольку она имеет схожую физиологию, а ее нормальный уровень глюкозы близок к человеческому. Кроме того, у конкретных линий мышей может развиться СД из-за мутаций в ключевых сигнальных путях или после воздействия определенных диет, что позволяет моделировать заболевание 2,3,4.
Уровень глюкозы в крови обычно измеряется у мышей с помощью глюкометров, предназначенных для пациентов, путем извлечения небольшой капли крови (1-2 мкл) из кончика хвоста мыши. Этот метод вызывает стресс и требует обращения с мышью, что влияет на уровень глюкозы и запрещает измерение уровня глюкозы в крови у свободно ведущих себя мышей или когда исследователь не находится рядом на5. Кровотечение у мышей может вызвать стресс у ближайших мышей, особенно у мышей в той же клетке, гликемия которых еще не измерена, что влияет на результаты. Мыши реагируют по-разному в зависимости от обработчика, и человек, измеряющий глюкозу, может влиять на уровень глюкозы у мышей. Эти подводные камни требуют тщательного планирования экспериментов и лежат в основе некоторых несоответствий между экспериментами.
Можно измерить уровень глюкозы у свободно движущихся мышей без кровотечения путем имплантации датчиков глюкозы в дугу аорты мышей с использованием современной телеметрии6. Полученные измерения очень хороши и могут поддерживаться в течение длительного периода, но имплантировать эти датчики сложно, а система телеметрии стоит дорого, что приводит к умеренному принятию этой методологии и отсутствию ее принятия в неспециализированных лабораториях. В последние годы были разработаны подкожные или другие датчики глюкозы, адаптированные к размерам мышей и их физиологии, но они снова требуют высококвалифицированных специалистов и в некоторых случаях являются дорогостоящими 6,7,8,9,10.
Коммерческие непрерывные мониторы глюкозы (CGM), которые первоначально были разработаны для мониторинга уровня глюкозы у пациентов с СД, предлагают еще один вариант измерения глюкозы у свободно движущихся мышей с более низкой стоимостью и техническими требованиями, чем имплантированные зонды. Такие зонды использовались в фундаментальных исследованиях несколькими лабораториями 5,11,12,13,14,15, включая наших коллег, которые использовали этот протокол 16. Эти устройства обычно включают датчик, монтажное устройство, приемник и программное обеспечение. Датчик имеет канюлю, направляющую ферментативный глюкосенсор, клейкую ленту, источник энергии, кратковременную память и модуль беспроводной связи, который хранит и отправляет данные на приемник. Приемник может показывать текущие уровни глюкозы и отправляет данные на сервер; Этот приемник может быть мобильным телефоном. Программное приложение предоставляет данные для пациента и медицинской бригады о гликемии пациента. У пациентов датчик легко крепится с помощью крепежного устройства. Канюля вводится подкожно, прижимая крепежное устройство к коже, а датчик остается на месте с помощью клейкой ленты.
Это подробный протокол адаптации коммерческого устройства CGM для измерения уровня глюкозы у мышей. Этот протокол описывает, как хирургическим путем вставить датчик глюкозы и прикрепить его к мыши. Предусмотрены скрипты для базового анализа и визуализации данных. Приведены возможные подводные камни, устранение неполадок и примеры стандартных результатов. Приведенный ниже протокол специфичен для определенного CGM, но может быть легко адаптирован к другим типам коммерческих CGM по мере их появления.
Access restricted. Please log in or start a trial to view this content.
протокол
Эксперименты были одобрены Институциональным комитетом по уходу за животными и их использованию (IACUC) Еврейского университета.
ПРИМЕЧАНИЕ: Все инструменты должны быть стерилизованы, а обращение с канюлей должно выполняться с использованием стерильной техники. Приведенный ниже протокол точно настроен для конкретного CGM. Протокол может быть адаптирован к другим CGM.
1. Введение анальгетика перед процедурой
- Вводят 5% декстрозу и 0,45% физиологический раствор с мелоксикамом в дозе 5 мг / кг массы тела подкожно.
2. Введение анестезии
- Поместите мышь в индукционную камеру, плотно закрыв крышку. Установите индукцию анестезии в индукционной камере на 3% изофлурана при скорости потока 500 мл/мин.
- Как только мышь перестанет отвечать, извлеките мышь из камеры и прикрепите носовой конус к мыши. Подтвердите уровень анестезии межпальцевым щипцом. Установите концентрацию 1%-1,5% изофлурана и скорость потока 100 мл/мин у мыши весом 30 г.
- Нанесите офтальмологическую мазь на глаза, чтобы предотвратить сухость во время анестезии.
3. Подготовка датчика
- Установите датчик на устройство крепления датчика, чтобы обнажить ленту датчика и сторону канюли (рис. 1A). Будьте осторожны, так как игла вставляется в канюлю и обнажается.
- Наложите два конических шва 5-0 на ленту с обеих сторон канюли (рис. 1А).
4. Эпиляция и дезинфекция
- Побрейте область примерно 4 см х 4 см по средней линии спины мыши.
- Нанесите крем для депиляции на выбритую область, чтобы обеспечить полное удаление волос.
- Протрите кожу и продезинфицируйте ее с помощью антисептического раствора, содержащего 2% хлоргексидина глюконата и 70% изопропилового спирта.
5. Подготовка спинной кожи
- Сделайте разрез 2 мм в центре выбритого участка над позвоночником с помощью острых ножниц (рис. 1B).
- Вкратце, вставьте небольшие щипцы с тупым краем под кожу, чтобы сформировать небольшой подкожный карман, чтобы канюлю можно было легко вставить в подкожный карман (рис. 1B).
- Проведите шов, начиная с шага 3.2, через кожу с каждой стороны разреза (рис. 1C).
6. Вставка датчика
- Полностью извлеките датчик из устройства крепления датчика (канюля пуста от иглы) и удерживайте датчик щипцами, чтобы окружающая лента не прилипала к себе.
- Аккуратно вставьте канюлю в подкожный карман.
- Натяните швы с каждой стороны, затяните и завяжите их, чтобы надежно закрепить датчик на месте, тем самым предотвращая выскальзывание канюли из подкожного кармана после того, как клейкая лента со временем ослабнет.
7. Крепление и наложение швов на датчик
- Плотно прикрепите датчик к задней части, завязав внутренние швы и используя клейкую ленту, окружающую датчик.
- Наложите восемь прерывистых швов вокруг датчика, прикрепив границу ленты датчика к коже (рис. 1D).
8. Активация считывателя
- После того, как датчик будет вставлен, активируйте считыватель, включив считыватель, нажав « Начать новый датчик» и проведя пальцем по датчику в соответствии с инструкциями производителя.
- Первое чтение можно сделать только через несколько минут после установки CGM. В случае этого CGM первое чтение может быть снято через 60 минут.
9. Результаты считывания
- Поместите считыватель близко к мыши (прикасаться к нему не нужно). Все данные, хранящиеся в датчике, передаются на считыватель.
ПРИМЕЧАНИЕ: Различные устройства CGM могут отличаться по периоду исторической емкости сохранения данных. В случае этого CGM между двумя показаниями может храниться не более 8 часов.
10. Снятие датчика
- Обезболить мышь (см. раздел 2).
- Разрежьте швы, соединяющие датчик с задней частью мыши, с помощью острых ножниц.
- Снимите и разрежьте швы на разрезе, аккуратно извлекли датчик.
- При необходимости используйте один шов, чтобы закрыть разрез в задней части мыши.
11. Анализ данных
- Загрузка данных: Загрузите данные в соответствии с инструкциями, предоставленными производителем CGM.
ПРИМЕЧАНИЕ: Каждый CGM имеет свой формат, который может быть или не быть легко доступным для пользователя. Это важное соображение при выборе CGM. - Для анализа с помощью предоставленного программного обеспечения отформатируйте данные в соответствии с инструкциями в файле readme на Github (https://github.com/mika-littor/CGM-in-Mice-Analysis.git).
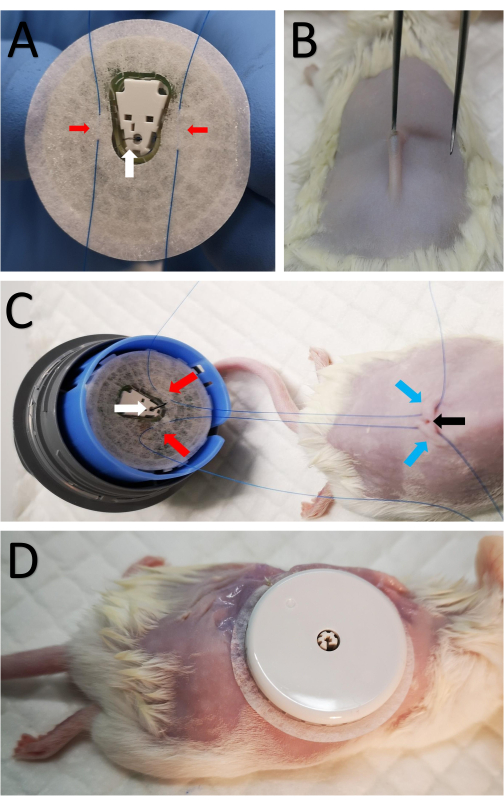
Рисунок 1: Крепление датчика к мыши . (A) Два шва, отмеченные красными стрелками, пропускаются через сенсорную ленту с обеих сторон канюли на нижней стороне датчика CGM, отмеченного белой стрелкой. (B) Острыми ножницами в центре бритой области вдоль позвоночника делается небольшой разрез толщиной 2 мм. Небольшие щипцы с тупым краем ненадолго вставляются под кожу, образуя небольшой подкожный карман, чтобы канюлю можно было вводить подкожно. (C) Те же швы из А накладываются подкожно с каждой стороны разреза. Красные стрелки отмечают швы, прикрепленные к датчику, как показано в A, синие стрелки отмечают место, где швы прошли через кожу в задней части мыши, а черная стрелка показывает разрез. (D) После того, как канюля вставлена, внутренние швы затягиваются и завязываются близко к разрезу, чтобы закрепить CGM. Затем датчик пришивается к коже. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Access restricted. Please log in or start a trial to view this content.
Результаты
Исход операции
Показаны результаты восьми мышей HSD: ICR (в возрасте 8 недель), которых кормили диетой с высоким содержанием жиров и высоким содержанием сахарозы (HFHS) в течение 18 недель, и пяти постных мышей HSD: ICR (в возрасте 12 недель). Устройство, которое мы использовали, хранит дан?...
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Этот протокол предлагает простой, недорогой метод мониторинга уровня глюкозы у мышей, который не требует сложной микрохирургии и не связан с кровотечением или обращением с мышами. Метод прост в применении в каждом учреждении и не вызывает смертности, боли или чрезмерного дискомфорта у...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
У авторов нет конфликтов интересов, которые необходимо раскрывать.
Благодарности
Мы благодарим Двир Минц DVM и ветеринарный и животноводческий персонал животноводческого комплекса, а также членов нашей группы за плодотворные обсуждения. Это исследование было поддержано грантом Израильского научного фонда 1541/21, присужденным D.B.Z. D.B.Z. является факультетом STEM Цукермана.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| 2% Chlorhexidine Gluconate and 70% Isopropyl Alcohol | 3M | ID 7000136290 | |
| 5% Dextrose and 0.45% Sodium Chloride Injection, USP | Braun | L6120 | |
| Castroviejo needle holder | FST | 12061-02 | |
| Extra Fine Bonn scissors | FST | 14084-08 | |
| FreeStyle Libre 1 reader | Abbott | ART27543 | |
| FreeStyle Libre sensor | Abbott | ART36687 | |
| FreeStyle Libre sensor applicator | Abbott | ART36787 | |
| Gauze pads | Sion medical | PC912017 | |
| Graefe Forceps | FST | 11052-10 | |
| Hair Removal Cream | Veet | 3116523 | |
| High-fat high-sucrose diet | Envigo Teklad diets | TD.08811 | |
| Isoflurane, USP Terrell | Piramal | 26675-46-7 | |
| Meloxicam 5 mg/mL | Chanelle Pharma | 08749/5024 | |
| MiniARCO Clipper kit | Moser | CL8787-KIT | |
| PROLENE Polypropylene Suture 5-0 | Ethicon | 8725H | |
| Puralube Opthalmic Ointment | Perrigo | 574402511 | |
| Q-tips | B.H.W | 271676 | |
| SomnoSuite Low-Flow Anesthesia System | Kent Scientific | SOMNO |
Ссылки
- Polonsky, K. S. The past 200 years in diabetes. New England Journal of Medicine. 367 (14), 1332-1340 (2012).
- Rees, D. A., Alcolado, J. C. Animal models of diabetes mellitus. Diabetic Medicine. 22 (4), 359-370 (2005).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the non-obese diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Heydemann, A. An overview of murine high fat diet as a model for Type 2 diabetes mellitus. Journal of Diabetes Research. 2016, 2902351(2016).
- Kennard, M. R., et al. The use of mice in diabetes research: The impact of experimental protocols. Diabetic Medicine. 38 (12), 14705(2021).
- Klueh, U., et al. Continuous glucose monitoring in normal mice and mice with prediabetes and diabetes. Diabetes Technology and Therapeutics. 8 (3), 402-412 (2006).
- Wuyts, C., Simoens, C., Pinto, S., Philippaert, K., Vennekens, R. Continuous glucose monitoring during pregnancy in healthy mice. Scientific Reports. 11, 4450(2021).
- Korstanje, R., et al. Continuous glucose monitoring in female NOD mice reveals daily rhythms and a negative correlation with body temperature. Endocrinology. 158 (9), 2707-2712 (2017).
- Han, B. G., et al. Markers of glycemic control in the mouse: Comparisons of 6-h-and overnight-fasted blood glucoses to Hb A1c. American Journal of Physiology - Endocrinology and Metabolism. 295 (4), 981-986 (2008).
- Xie, X., et al. Reduction of measurement noise in a continuous glucose monitor by coating the sensor with a zwitterionic polymer. Nature Biomedical Engineering. 2 (12), 894-906 (2018).
- Van Der Meulen, T., et al. Urocortin3 mediates somatostatin-dependent negative feedback control of insulin secretion. Nature Medicine. 21 (7), 769-776 (2015).
- Peterson, Q. P., et al. A method for the generation of human stem cell-derived alpha cells. Nature Communications. 11, 2241(2020).
- Klueh, U., Liu, Z., Feldman, B., Kreutzer, D. Interstitial fluid physiology as it relates to glucose monitoring technologies: Importance of Interleukin-1 and Interleukin-1 receptor antagonist in short-term glucose sensor function in vivo. Journal of Diabetes Science and Technology. 4 (5), 1073(2010).
- Klueh, U., Antar, O., Qiao, Y., Kreutzer, D. L. Role of interleukin-1/interleukin-1 receptor antagonist family of cytokines in long-term continuous glucose monitoring in vivo. Journal of Diabetes Science and Technology. 7 (6), 1538(2013).
- Klueh, U., Kaur, M., Qiao, Y., Kreutzer, D. L. Critical role of tissue mast cells in controlling long-term glucose sensor function in vivo. Biomaterials. 31 (16), 4540-4551 (2010).
- Kogot-Levin, A., et al. Mapping the metabolic reprogramming induced by sodium-glucose cotransporter 2 inhibition. JCI Insight. , 164296(2023).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены