JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
자유롭게 움직이는 마우스의 간단한 연속 포도당 모니터링
요약
여기에서는 환자를 위해 설계된 상업용 연속 포도당 모니터를 마우스에 이식하고 결과를 분석하기 위한 스크립트를 제공하는 간단한 방법을 설명합니다.
초록
마우스는 당뇨병과 같은 대사 질환을 연구하는 데 사용되는 일반적인 모델 유기체입니다. 포도당 수치는 전형적으로 꼬리 출혈에 의해 측정되며, 이는 마우스를 다루어야하고, 스트레스를 유발하며, 어두운주기 동안 자유롭게 행동하는 마우스에 대한 데이터를 제공하지 않습니다. 생쥐의 최첨단 연속 포도당 측정에는 생쥐의 대동맥궁에 프로브를 삽입하고 특수 원격 측정 시스템이 필요합니다. 이 까다롭고 비용이 많이 드는 방법은 대부분의 실험실에서 채택되지 않았습니다. 여기에서 우리는 기초 연구의 일환으로 마우스에서 포도당을 지속적으로 측정하기 위해 수백만 명의 환자가 사용하는 상업적으로 이용 가능한 연속 포도당 모니터의 활용과 관련된 간단한 프로토콜을 제시합니다. 포도당 감지 프로브는 피부에 작은 절개를 통해 마우스 뒤쪽의 피하 공간에 삽입되고 두 개의 봉합사를 사용하여 제자리에 단단히 고정됩니다. 장치는 마우스 피부에 봉합되어 제자리에 유지되도록 합니다. 이 장치는 최대 2주 동안 포도당 수치를 측정할 수 있으며 마우스를 다룰 필요 없이 데이터를 가까운 수신기로 보낼 수 있습니다. 기록된 글루코스 수준의 기본 데이터 분석을 위한 스크립트가 제공됩니다. 수술에서 전산 분석에 이르기까지이 방법은 비용 효율적이며 대사 연구에 매우 유용합니다.
서문
당뇨병(DM)은 고혈당을 특징으로 하는 치명적인 질병입니다. 제1형 DM은 췌장의 인슐린 생성 베타 세포에 대한 자가면역 공격의 결과일 수 있습니다. 한편, 제2형 DM과 임신성 DM은 베타 세포가 포도당 수치1의 상승에 반응하여 충분한 인슐린을 분비하지 못하는 것을 특징으로 한다. 마우스는 생리학이 비슷하고 정상 포도당 수치가 인간의 포도당 수치에 가깝기 때문에 DM을 연구하는 데 사용되는 일반적인 모델 유기체입니다. 또한, 특정 마우스 균주는 주요 신호 전달 경로의 돌연변이 또는 특정 식단에 대한 노출 후 DM이 발생할 수 있으며, 이는 질병 모델링을 가능하게 합니다 2,3,4.
혈당은 일반적으로 마우스 꼬리 끝에서 작은 방울의 혈액(1-2 μL)을 추출하여 환자를 위해 설계된 혈당계를 사용하여 마우스에서 측정됩니다. 이 방법은 스트레스를 유발하고 포도당 수치에 영향을 미치고 자유롭게 행동하는 마우스의 혈당 수치 측정을 금지하거나 연구원이5 시까 지 가까이 있지 않을 때 마우스를 다루어야합니다. 생쥐의 출혈은 근처의 생쥐, 특히 혈당이 아직 측정되지 않은 동일한 케이지의 생쥐에게 스트레스를 유발하여 결과에 영향을 미칠 수 있습니다. 마우스는 핸들러에 따라 다르게 반응하며 포도당을 측정하는 사람은 마우스의 포도당 수치에 영향을 미칠 수 있습니다. 이러한 함정은 신중한 실험 설계를 요구하며 실험 간의 불일치의 기초가됩니다.
출혈 없이 자유롭게 움직이는 마우스에서 포도당 센서를 마우스의 대동맥궁에 이식하여 최첨단 원격 측정6을 사용하여 글루코스를 측정할 수 있다. 결과 측정은 매우 우수하고 장기간에 걸쳐 지속될 수 있지만 이러한 센서를 이식하는 것은 어렵고 원격 측정 시스템은 비용이 많이 들기 때문에 이 방법론을 적당히 채택하고 비전문 실험실에서는 채택하지 않습니다. 마우스의 치수 및 이들의 생리학에 맞춰진 피하 또는 다른 글루코스 센서가 최근 몇 년 동안 개발되었지만, 이들은 다시 고도로 숙련된 전문가를 필요로 하며, 경우에 따라서는 비용이 많이 든다 6,7,8,9,10.
원래 DM 환자의 포도당 수치를 모니터링하기 위해 개발된 상업용 연속 포도당 모니터(CGM)는 이식된 프로브보다 저렴한 비용과 기술 전문 지식 요구 사항으로 자유롭게 움직이는 마우스에서 포도당을 측정할 수 있는 또 다른 옵션을 제공합니다. 이러한 프로브는 이 프로토콜을 사용한 동료를 포함하여 몇 개의 실험실(5,11,12,13,14,15)에서 기초 연구에 사용되었습니다(16). 이러한 장치에는 일반적으로 센서, 실장 장치, 수신기 및 소프트웨어 응용 제품이 포함됩니다. 센서에는 효소 글루코 센서를 안내하는 캐뉼라, 접착 테이프, 에너지원, 단기 기억 및 데이터를 저장하여 수신기로 보내는 무선 통신 모듈이 있습니다. 수신기는 현재 포도당 수준을 보여주고 데이터를 서버로 보낼 수 있습니다. 이 수신기는 휴대폰일 수 있습니다. 소프트웨어 응용 프로그램은 환자의 혈당에 대한 환자 및 의료 팀에 대한 데이터를 제공합니다. 환자의 경우 장착 장치를 사용하여 센서를 쉽게 부착할 수 있습니다. 캐뉼라는 장착 장치를 피부에 대고 눌러 피하로 삽입되고 센서는 접착 테이프를 사용하여 제자리에 고정됩니다.
이것은 마우스의 포도당 수준을 측정하기 위해 상업용 CGM 장치를 적용하기 위한 자세한 프로토콜입니다. 이 프로토콜은 포도당 센서를 외과적으로 삽입하고 마우스에 부착하는 방법을 설명합니다. 기본적인 데이터 분석 및 데이터 시각화를 위한 스크립트가 제공됩니다. 잠재적인 함정, 문제 해결 및 표준 결과의 예가 제공됩니다. 아래 프로토콜은 특정 CGM에만 해당되지만 다른 유형의 상용 CGM이 출시되면 쉽게 조정할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
실험은 히브리 대학의 기관 동물 관리 및 사용위원회 (IACUC)의 승인을 받았습니다.
알림: 모든 도구는 멸균되어야 하며 캐뉼라 취급은 멸균 기술을 사용하여 수행해야 합니다. 아래 프로토콜은 특정 CGM에 맞게 미세 조정됩니다. 이 프로토콜은 다른 CGM에 적용할 수 있습니다.
1. 시술 전 진통제 투여
- 5% 포도당과 0.45% 식염수를 멜록시캄과 함께 5mg/kg 체중의 피하 투여합니다.
2. 마취 투여
- 마우스를 유도실에 넣고 뚜껑을 단단히 닫습니다. 유도 챔버의 마취 유도를 3% 이소플루란에서 500mL/min의 유속으로 설정합니다.
- 마우스가 응답하지 않으면 챔버에서 마우스를 제거하고 노즈 콘을 마우스에 맞춥니다. interdigital 핀치로 마취 수준을 확인하십시오. 체중이 1g인 마우스에서 농도를 1%-1.5% 이소플루란으로 설정하고 유속을 100mL/min으로 설정합니다.
- 마취 중 건조를 방지하기 위해 눈에 안과 용 연고를 바르십시오.
3. 센서 준비
- 센서를 센서 장착 장치에 장착하여 센서의 테이프와 캐뉼라 쪽을 노출시킵니다(그림 1A). 바늘이 캐뉼라에 삽입되어 노출되므로 주의하십시오.
- 캐뉼라 양쪽의 테이프에 두 개의 5-0 테이퍼 포인트 봉합사를 봉합합니다(그림 1A).
4. 제모 및 소독
- 마우스 뒷면의 정중선에서 약 4cm x 4cm의 면적을 면도합니다.
- 면도한 부위에 제모 크림을 투여하여 제모를 완전히 제거합니다.
- 피부를 닦고 2 % 클로르헥시딘 글루 코 네이트와 70 % 이소 프로필 알코올을 함유 한 방부제를 사용하여 소독하십시오.
5. 등쪽 피부 준비
- 날카로운 가위를 사용하여 척추 위의 면도 부위 중앙을 2mm 절개합니다(그림 1B).
- 간단히 말해서, 캐뉼라가 피하 주머니에 쉽게 삽입 될 수 있도록 피부 아래에 뭉툭한 가장자리가있는 작은 집게를 삽입하여 작은 피하 주머니를 형성합니다 (그림 1B).
- 3.2단계의 봉합사를 절개 부위의 양쪽 피부를 통해 통과시킵니다(그림 1C).
6. 센서 삽입
- 센서 장착 장치에서 센서를 완전히 제거하고(캐뉼라가 바늘에서 비어 있음) 집게로 센서를 잡고 주변 테이프가 달라붙지 않도록 합니다.
- 캐뉼라를 피하 주머니에 조심스럽게 삽입하십시오.
- 양쪽의 봉합사를 당기고 조이고 묶어 센서를 제자리에 단단히 부착하여 시간이 지남에 따라 접착 테이프가 느슨해지면 캐뉼라가 피하 주머니에서 미끄러지는 것을 방지합니다.
7. 센서 부착 및 봉합
- 내부 봉합사를 묶고 센서를 둘러싼 접착 테이프를 사용하여 센서를 뒷면에 단단히 부착합니다.
- 센서 주위에 8개의 불연속 봉합사를 만들어 센서 테이프의 테두리를 피부에 부착합니다(그림 1D).
8. 리더의 활성화
- 센서가 삽입되면 리더를 켜고 새 센서 시작을 누른 다음 제조업체의 지침에 따라 센서를 스와이프하여 리더를 활성화합니다.
- 첫 번째 판독은 CGM을 설치한 후 몇 분 동안만 수행할 수 있습니다. 이 CGM의 경우 60분 후에 첫 번째 판독을 할 수 있습니다.
9. 결과 읽기
- 리더를 마우스 가까이에 놓습니다(만질 필요가 없음). 센서에 저장된 모든 데이터는 리더로 전송됩니다.
알림: CGM 장치마다 과거 데이터 저장 용량이 다를 수 있습니다. 이 CGM의 경우 두 판독값 사이에 최대 8시간을 저장할 수 있습니다.
10. 센서 제거
- 마우스를 마취합니다(섹션 2 참조).
- 날카로운 가위를 사용하여 센서를 마우스 뒷면에 연결하는 봉합사를 자릅니다.
- 센서를 부드럽게 제거하여 절개 부위의 봉합사를 제거하고 자릅니다.
- 필요한 경우 단일 봉합사를 사용하여 마우스 뒤쪽의 절개 부위를 닫습니다.
11. 데이터 분석
- 데이터 다운로드: CGM 제조업체에서 제공한 지침에 따라 데이터를 다운로드합니다.
참고: 각 CGM에는 사용자가 쉽게 액세스할 수도 있고 그렇지 않을 수도 있는 형식이 다릅니다. 이것은 CGM을 선택할 때 중요한 고려 사항입니다. - 제공된 소프트웨어로 분석하려면 Github(https://github.com/mika-littor/CGM-in-Mice-Analysis.git)의 readme 파일에 있는 지침에 따라 데이터 형식을 지정합니다.
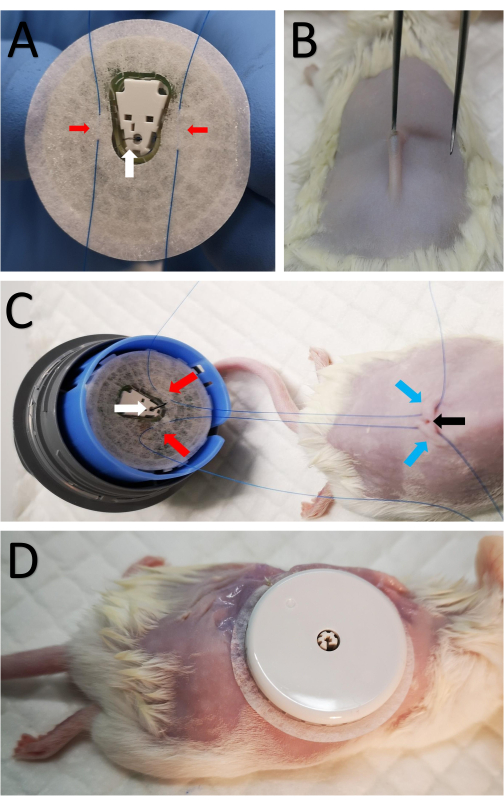
그림 1: 마우스에 센서 부착 (A) 빨간색 화살표로 표시된 두 개의 봉합사가 흰색 화살표로 표시된 CGM 센서 하단의 캐뉼라 양쪽에 있는 센서 테이프를 통과합니다. (B) 날카로운 가위를 사용하여 척추를 따라 면도한 부위의 중앙에 2mm의 작은 절개를 합니다. 뭉툭한 가장자리를 가진 작은 집게를 피부 아래에 잠깐 삽입하여 작은 피하 주머니를 형성하여 캐뉼라를 피하로 삽입 할 수 있습니다. (C) A 의 동일한 봉합사가 절개 부위의 양쪽에 피하로 전달됩니다. 빨간색 화살표는 A와 같이 센서에 부착된 봉합사를 표시하고, 파란색 화살표는 봉합사가 마우스 뒤쪽의 피부로 통과한 위치를 표시하고, 검은색 화살표는 절개를 나타냅니다. (D) 캐뉼라를 삽입한 후 내부 봉합사를 조이고 절개 부위에 가깝게 묶어 CGM을 고정합니다. 그런 다음 센서를 피부에 봉합합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Access restricted. Please log in or start a trial to view this content.
결과
수술 결과
18주 동안 고지방 고당식이(HFHS)를 먹인 8마리의 HSD:ICR 마우스(8주령)와 5마리의 마른 HSD:ICR 마우스(12주령)의 결과가 표시됩니다. 우리가 사용한 장치는 최대 8시간 동안 데이터를 저장합니다. 지역 동물 시설에 대한 접근은 07:00-19:00로 제한되어 생쥐가 활동하는 늦은 오후 시간에는 데이터 수집이 금지되었습니다. 따라서 마우스는 수술 전 7일 동안 8시 30분에서 20시 30분 사?...
Access restricted. Please log in or start a trial to view this content.
토론
이 프로토콜은 까다로운 미세 수술이 필요하지 않고 출혈이나 마우스 취급을 포함하지 않는 마우스의 포도당 수준을 모니터링하는 간단하고 저렴한 방법을 제공합니다. 이 방법은 모든 시설에서 구현하기 쉽고 생쥐에게 사망, 통증 또는 과도한 불편을 유발하지 않습니다. 프로토콜에서 가장 중요한 단계는 포도당 센서의 캐뉼라를 마우스 피부 아래에 삽입하는 것입니다. 몇 개의 봉합사를 추가?...
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
유익한 토론을 해주신 Dvir Mintz DVM과 동물 시설의 수의학 및 축산 직원, 그리고 우리 그룹 구성원들에게 감사드립니다. 이 연구는 DBZ에 수여된 이스라엘 과학 재단 보조금 1541/21의 지원을 받았습니다. DBZ는 Zuckerman STEM 교수입니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 2% Chlorhexidine Gluconate and 70% Isopropyl Alcohol | 3M | ID 7000136290 | |
| 5% Dextrose and 0.45% Sodium Chloride Injection, USP | Braun | L6120 | |
| Castroviejo needle holder | FST | 12061-02 | |
| Extra Fine Bonn scissors | FST | 14084-08 | |
| FreeStyle Libre 1 reader | Abbott | ART27543 | |
| FreeStyle Libre sensor | Abbott | ART36687 | |
| FreeStyle Libre sensor applicator | Abbott | ART36787 | |
| Gauze pads | Sion medical | PC912017 | |
| Graefe Forceps | FST | 11052-10 | |
| Hair Removal Cream | Veet | 3116523 | |
| High-fat high-sucrose diet | Envigo Teklad diets | TD.08811 | |
| Isoflurane, USP Terrell | Piramal | 26675-46-7 | |
| Meloxicam 5 mg/mL | Chanelle Pharma | 08749/5024 | |
| MiniARCO Clipper kit | Moser | CL8787-KIT | |
| PROLENE Polypropylene Suture 5-0 | Ethicon | 8725H | |
| Puralube Opthalmic Ointment | Perrigo | 574402511 | |
| Q-tips | B.H.W | 271676 | |
| SomnoSuite Low-Flow Anesthesia System | Kent Scientific | SOMNO |
참고문헌
- Polonsky, K. S. The past 200 years in diabetes. New England Journal of Medicine. 367 (14), 1332-1340 (2012).
- Rees, D. A., Alcolado, J. C. Animal models of diabetes mellitus. Diabetic Medicine. 22 (4), 359-370 (2005).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the non-obese diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Heydemann, A. An overview of murine high fat diet as a model for Type 2 diabetes mellitus. Journal of Diabetes Research. 2016, 2902351(2016).
- Kennard, M. R., et al. The use of mice in diabetes research: The impact of experimental protocols. Diabetic Medicine. 38 (12), 14705(2021).
- Klueh, U., et al. Continuous glucose monitoring in normal mice and mice with prediabetes and diabetes. Diabetes Technology and Therapeutics. 8 (3), 402-412 (2006).
- Wuyts, C., Simoens, C., Pinto, S., Philippaert, K., Vennekens, R. Continuous glucose monitoring during pregnancy in healthy mice. Scientific Reports. 11, 4450(2021).
- Korstanje, R., et al. Continuous glucose monitoring in female NOD mice reveals daily rhythms and a negative correlation with body temperature. Endocrinology. 158 (9), 2707-2712 (2017).
- Han, B. G., et al. Markers of glycemic control in the mouse: Comparisons of 6-h-and overnight-fasted blood glucoses to Hb A1c. American Journal of Physiology - Endocrinology and Metabolism. 295 (4), 981-986 (2008).
- Xie, X., et al. Reduction of measurement noise in a continuous glucose monitor by coating the sensor with a zwitterionic polymer. Nature Biomedical Engineering. 2 (12), 894-906 (2018).
- Van Der Meulen, T., et al. Urocortin3 mediates somatostatin-dependent negative feedback control of insulin secretion. Nature Medicine. 21 (7), 769-776 (2015).
- Peterson, Q. P., et al. A method for the generation of human stem cell-derived alpha cells. Nature Communications. 11, 2241(2020).
- Klueh, U., Liu, Z., Feldman, B., Kreutzer, D. Interstitial fluid physiology as it relates to glucose monitoring technologies: Importance of Interleukin-1 and Interleukin-1 receptor antagonist in short-term glucose sensor function in vivo. Journal of Diabetes Science and Technology. 4 (5), 1073(2010).
- Klueh, U., Antar, O., Qiao, Y., Kreutzer, D. L. Role of interleukin-1/interleukin-1 receptor antagonist family of cytokines in long-term continuous glucose monitoring in vivo. Journal of Diabetes Science and Technology. 7 (6), 1538(2013).
- Klueh, U., Kaur, M., Qiao, Y., Kreutzer, D. L. Critical role of tissue mast cells in controlling long-term glucose sensor function in vivo. Biomaterials. 31 (16), 4540-4551 (2010).
- Kogot-Levin, A., et al. Mapping the metabolic reprogramming induced by sodium-glucose cotransporter 2 inhibition. JCI Insight. , 164296(2023).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유