A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניטור סוכר רציף פשוט בעכברים הנעים בחופשיות
In This Article
Summary
כאן, אנו מתארים שיטה פשוטה להשתלת מוניטור סוכר רציף מסחרי המיועד לחולים על עכברים ומספקים את הסקריפטים לניתוח התוצאות.
Abstract
עכברים הם אורגניזם מודל נפוץ המשמש לחקר מחלות מטבוליות כגון סוכרת. רמות הגלוקוז נמדדות בדרך כלל על ידי דימום זנב, הדורש טיפול בעכברים, גורם ללחץ ואינו מספק נתונים על עכברים המתנהגים בחופשיות במהלך המחזור החשוך. מדידת גלוקוז רציפה מתקדמת בעכברים דורשת החדרת בדיקה לקשת אבי העורקים של העכבר, כמו גם מערכת טלמטריה מיוחדת. שיטה מאתגרת ויקרה זו לא אומצה על ידי רוב המעבדות. כאן, אנו מציגים פרוטוקול פשוט הכולל שימוש במוניטורים רציפים זמינים מסחרית המשמשים מיליוני חולים למדידת גלוקוז ברציפות בעכברים כחלק ממחקר בסיסי. הבדיקה לחישת גלוקוז מוחדרת לחלל התת עורי בחלק האחורי של העכבר דרך חתך קטן בעור ומוחזקת במקומה בחוזקה באמצעות כמה תפרים. המכשיר נתפר לעור העכבר כדי להבטיח שהוא יישאר במקומו. המכשיר יכול למדוד את רמות הסוכר עד שבועיים ושולח את הנתונים למקלט קרוב ללא צורך לטפל בעכברים. סקריפטים לניתוח נתונים בסיסיים של רמות גלוקוז שנרשמו מסופקים. שיטה זו, מניתוח ועד ניתוח חישובי, היא חסכונית ועשויה להיות שימושית מאוד במחקר מטבולי.
Introduction
סוכרת (DM) היא מחלה הרסנית המאופיינת ברמות גלוקוז גבוהות בדם. DM מסוג 1 יכול להיות תוצאה של התקפה אוטואימונית על תאי בטא מייצרי אינסולין בלבלב. DM מסוג 2 ו- DM הריונית, לעומת זאת, מאופיינים בכישלון של תאי הבטא להפריש מספיק אינסולין בתגובה לעלייה ברמות הגלוקוז1. העכבר הוא אורגניזם מודל נפוץ המשמש לחקר DM מכיוון שיש לו פיזיולוגיה דומה, ורמות הגלוקוז הרגילות שלו קרובות לאלה של בני אדם. יתר על כן, זני עכברים ספציפיים עלולים לפתח DM עקב מוטציות במסלולי איתות מרכזיים או בעקבות חשיפה לדיאטות ספציפיות, מה שמאפשר מידול מחלות 2,3,4.
גלוקוז בדם נמדד בדרך כלל בעכברים באמצעות גלוקומטרים המיועדים לחולים על ידי חילוץ טיפת דם קטנה (1-2 μL) מקצה זנב העכבר. שיטה זו גורמת ללחץ ודורשת טיפול בעכבר, המשפיע על רמות הגלוקוז ואוסר על מדידת רמות הגלוקוז בדם בעכברים המתנהגים בחופשיות או כאשר החוקר אינו קרוב עד5. דימום העכברים עלול לגרום לעקה לעכברים סמוכים, במיוחד לעכברים מאותו כלוב שהגליקמיה שלהם עדיין לא נמדדה, ובכך להשפיע על התוצאות. עכברים מגיבים באופן שונה בהתאם למטפל, והאדם המודד גלוקוז עשוי להשפיע על רמות הסוכר של העכברים. מלכודות אלה דורשות תכנון ניסויי זהיר ועומדות בבסיס כמה חוסר עקביות בין ניסויים.
ניתן למדוד גלוקוז בעכברים הנעים בחופשיות ללא דימום על ידי השתלת חיישני סוכר בקשת אבי העורקים של העכברים באמצעות טלמטריה חדישה6. המדידות המתקבלות טובות מאוד ויכולות להימשך לאורך תקופה ארוכה, אך מאתגר להשתיל חיישנים אלה, ומערכת הטלמטריה יקרה, מה שמוביל לאימוץ מתון של מתודולוגיה זו וללא אימוץ במעבדות שאינן מתמחות. חיישני סוכר תת עוריים או אחרים המותאמים למידות העכברים ולפיזיולוגיה שלהם פותחו בשנים האחרונות, אך אלה שוב דורשים מומחים מיומנים ובמקרים מסוימים יקרים 6,7,8,9,10.
מוניטורים מסחריים רציפים של סוכר (CGM) שפותחו במקור כדי לנטר את רמות הסוכר של חולי DM מציעים אפשרות נוספת למדוד גלוקוז בעכברים הנעים בחופשיות, עם דרישות עלות ומומחיות טכנית נמוכות יותר מאשר בדיקות מושתלות. בדיקות כאלה שימשו במחקר בסיסי על ידי כמה מעבדות 5,11,12,13,14,15 כולל עמיתינו שהשתמשו בפרוטוקול זה 16. התקנים אלה כוללים בדרך כלל חיישן, התקן הרכבה, מקלט ויישום תוכנה. לחיישן צינורית המנחה את הגלוקוחיישן האנזימטי, סרט הדבקה, מקור אנרגיה, זיכרון לטווח קצר ומודול תקשורת אלחוטית המאחסן ושולח את הנתונים למקלט. המקלט יכול להציג את רמות הסוכר הנוכחיות ושולח את הנתונים לשרת; מקלט זה יכול להיות טלפון סלולרי. יישום התוכנה מספק נתונים עבור המטופל והצוות הרפואי על הגליקמיה של המטופל. בחולים, החיישן מחובר בקלות באמצעות התקן ההרכבה. הצינורית מוחדרת תת עורית על ידי לחיצה על התקן ההרכבה כנגד העור, והחיישן נשאר במקומו בעזרת סרט הדבקה.
זהו פרוטוקול מפורט להתאמת מכשיר CGM מסחרי למדידת רמות הסוכר בעכברים. פרוטוקול זה מתאר כיצד להחדיר בניתוח את חיישן הסוכר ולחבר אותו לעכבר. סקריפטים לניתוח נתונים בסיסי והדמיית נתונים מסופקים. המלכודות האפשריות, פתרון בעיות ודוגמאות לתוצאות סטנדרטיות מסופקים. הפרוטוקול להלן הוא ספציפי עבור CGM מסוים, אך ניתן להתאים אותו בקלות לסוגים אחרים של CGM מסחריים כאשר הם הופכים לזמינים.
Access restricted. Please log in or start a trial to view this content.
Protocol
הניסויים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטה העברית (IACUC).
הערה: יש לעקר את כל הכלים, והטיפול בצינורית חייב להתבצע בטכניקה סטרילית. הפרוטוקול להלן מכוונן ל-CGM ספציפי. ניתן להתאים את הפרוטוקול ל-CGM אחרים.
1. משכך כאבים לפני ההליך
- מתן 5% דקסטרוז ו-0.45% מלוחים עם מלוקסיקם במשקל גוף של 5 מ"ג/ק"ג תת עורית.
2. מתן הרדמה
- הניחו את העכבר בתא האינדוקציה, וסגרו את המכסה בחוזקה. הגדר את השראת ההרדמה בתא האינדוקציה על 3% איזופלורן בקצב זרימה של 500 מ"ל/דקה.
- ברגע שהעכבר אינו מגיב, הסר את העכבר מהחדר והתאים את חרוט האף לעכבר. אשר את רמת ההרדמה עם צביטה בין-דיגיטלית. הגדר את הריכוז לאיזופלורן 1%-1.5% ואת קצב הזרימה ל- 100 מ"ל לדקה בעכבר במשקל 30 גרם.
- החל משחה אופתלמית על העיניים כדי למנוע יובש במהלך ההרדמה.
3. הכנת חיישנים
- הרכיבו את החיישן על התקן הרכבת החיישן כדי לחשוף את סרט הצילום ואת צד הצינורית של החיישן (איור 1A). היזהרו מכיוון שהמחט מוחדרת לצינורית ונחשפת.
- תפרו שני תפרים נקודתיים של 5-0 לסרט משני צידי הצינורית (איור 1A).
4. הסרת שיער וחיטוי
- יש לגלח שטח של כ-4X4 ס"מ בקו האמצע של גב העכבר.
- יש למרוח קרם מסיר שיער לאזור המגולח כדי להבטיח הסרת שיער מלאה.
- נגבו את העור וחיטאו אותו בתמיסת חיטוי המכילה 2% כלורהקסידין גלוקונאט ו-70% איזופרופיל אלכוהול.
5. הכנת העור הגבי
- בצעו חתך בקוטר 2 מ"מ במרכז האזור המגולח מעל עמוד השדרה באמצעות מספריים חדים (איור 1B).
- בקצרה, הכניסו מלקחיים קטנים עם קצה קהה מתחת לעור כדי ליצור כיס תת-עורי קטן כך שניתן יהיה להחדיר את הצינורית בקלות לכיס התת-עורי (איור 1B).
- העבירו תפר משלב 3.2 דרך העור בכל צד של החתך (איור 1C).
6. הכנסת חיישן
- הסר את החיישן לחלוטין מהתקן הרכבת החיישן (הצינורית ריקה מהמחט), והחזק את החיישן במלקחיים כדי למנוע מהסרט שמסביב להידבק לעצמו.
- מכניסים בזהירות את הצינורית לכיס התת עורי.
- משכו את התפרים מכל צד, הדקו וקשרו אותם כדי לחבר את החיישן בחוזקה למקומו, ובכך למנוע מהצינורית להחליק החוצה מהכיס התת עורי ברגע שסרט ההדבקה משתחרר עם הזמן.
7. חיבור חיישן ותפירה
- חבר את החיישן לגב בחוזקה על ידי קשירת התפרים הפנימיים ושימוש בסרט הדבקה המקיף את החיישן.
- בצעו שמונה תפרים לא רציפים מסביב לחיישן, והצמידו את גבול סרט החיישן לעור (איור 1D).
8. הפעלת הקורא
- לאחר הכנסת החיישן, הפעל את הקורא על-ידי הפעלת הקורא, לחיצה על Start New Sensor והחלקה מהירה של החיישן בהתאם להוראות היצרן.
- קריאה ראשונה ניתן לקחת רק כמה דקות לאחר התקנת CGM. במקרה של CGM זה, ניתן לבצע את הקריאה הראשונה לאחר 60 דקות.
9. קריאת תוצאות
- מקם את הקורא קרוב לעכבר (אין צורך לגעת בו). כל הנתונים המאוחסנים בחיישן מועברים לקורא.
הערה: התקני CGM שונים עשויים להיות שונים בתקופה של יכולת חיסכון היסטורית בנתונים. במקרה של CGM זה, מקסימום של 8 שעות ניתן לאחסן בין שתי קריאות.
10. הסרת החיישן
- להרדים את העכבר (ראה סעיף 2).
- חתכו את התפרים המחברים את החיישן לחלק האחורי של העכבר באמצעות מספריים חדים.
- הסר וחתך את התפרים בחתך על ידי הסרה עדינה של החיישן.
- במידת הצורך, השתמש בתפר יחיד כדי לסגור את החתך בחלק האחורי של העכבר.
11. ניתוח נתונים
- הורדת נתונים: הורד את הנתונים בהתאם להוראות שסופקו על-ידי יצרן CGM.
הערה: לכל CGM יש תבנית שונה, שעשויה להיות נגישה למשתמש בקלות או לא. זהו שיקול חשוב בבחירת CGM. - לניתוח עם התוכנה שסופקה, עצב את הנתונים בהתאם להוראות בקובץ readme ב- Github (https://github.com/mika-littor/CGM-in-Mice-Analysis.git).
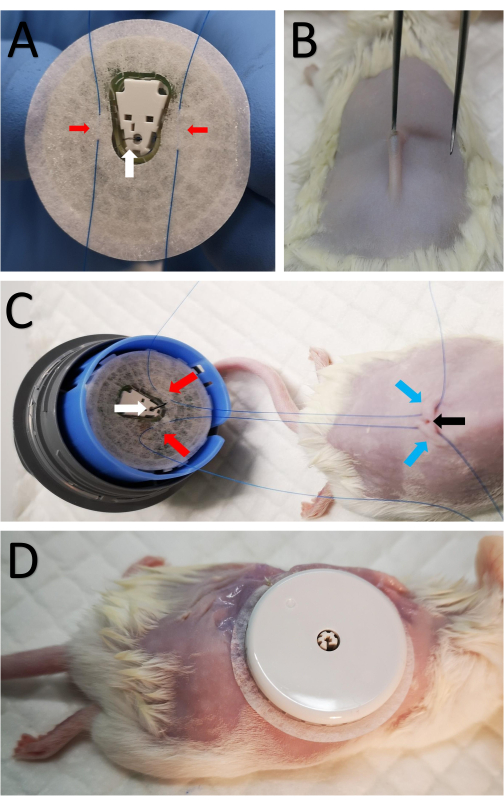
איור 1: חיבור החיישן לעכבר . (A) שני תפרים המסומנים בחצים אדומים מועברים דרך סרט החיישן משני צידי הצינורית בצד התחתון של חיישן CGM, מסומנים בחץ לבן. (B) חתך קטן בקוטר 2 מ"מ נעשה במרכז האזור המגולח לאורך עמוד השדרה באמצעות מספריים חדים. מלקחיים קטנים עם קצה קהה מוחדרים לזמן קצר מתחת לעור כדי ליצור כיס תת עורי קטן, כך שניתן להחדיר את הצינורית תת עורית. (C) אותם תפרים מ-A מועברים באופן תת-עורי בכל צד של החתך. החיצים האדומים מסמנים את התפרים המחוברים לחיישן כמו ב-A, החצים הכחולים מסמנים את מיקום התפרים שעברו דרך העור בגב העכבר, והחץ השחור מראה את החתך. (D) לאחר החדרת הצינורית, מהדקים את התפרים הפנימיים וקושרים אותם קרוב לחתך כדי לאבטח את ה-CGM. לאחר מכן החיישן נתפר לעור. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
Access restricted. Please log in or start a trial to view this content.
תוצאות
תוצאות הניתוח
תוצאות של שמונה עכברי HSD:ICR (בני 8 שבועות) שניזונו מתזונה עתירת שומן וסוכרוז (HFHS) במשך 18 שבועות וחמישה עכברי HSD:ICR רזים (בני 12 שבועות) מוצגות. המכשיר שבו השתמשנו מאחסן נתונים עד 8 שעות. הגישה למתקן בעלי החיים המקומי הוגבלה לשעות 07:00-19:00, ובכך נאסר על איסוף נתונים בשעות המא?...
Access restricted. Please log in or start a trial to view this content.
Discussion
פרוטוקול זה מציע שיטה פשוטה וזולה לניטור רמות הסוכר בעכברים שאינה דורשת מיקרו-כירורגיה מאתגרת ואינה כרוכה בדימום או בטיפול בעכברים. השיטה קלה ליישום בכל מתקן ואינה גורמת לתמותה, כאב או אי נוחות מוגזמת לעכברים. השלב הקריטי ביותר בפרוטוקול הוא החדרת הצינורית של חיישן הסוכר מתחת לעור העכבר. ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
למחברים אין ניגודי עניינים לחשוף.
Acknowledgements
אנו מודים לדביר מינץ DVM ולצוות הווטרינרי והגידול במתקן בעלי החיים, כמו גם לחברי הקבוצה שלנו, על דיונים פוריים. מחקר זה נתמך על ידי מענק 1541/21 של הקרן הלאומית למדע שהוענק ל-D.B.Z. D.B.Z. היא פקולטה ל-STEM של צוקרמן.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| 2% Chlorhexidine Gluconate and 70% Isopropyl Alcohol | 3M | ID 7000136290 | |
| 5% Dextrose and 0.45% Sodium Chloride Injection, USP | Braun | L6120 | |
| Castroviejo needle holder | FST | 12061-02 | |
| Extra Fine Bonn scissors | FST | 14084-08 | |
| FreeStyle Libre 1 reader | Abbott | ART27543 | |
| FreeStyle Libre sensor | Abbott | ART36687 | |
| FreeStyle Libre sensor applicator | Abbott | ART36787 | |
| Gauze pads | Sion medical | PC912017 | |
| Graefe Forceps | FST | 11052-10 | |
| Hair Removal Cream | Veet | 3116523 | |
| High-fat high-sucrose diet | Envigo Teklad diets | TD.08811 | |
| Isoflurane, USP Terrell | Piramal | 26675-46-7 | |
| Meloxicam 5 mg/mL | Chanelle Pharma | 08749/5024 | |
| MiniARCO Clipper kit | Moser | CL8787-KIT | |
| PROLENE Polypropylene Suture 5-0 | Ethicon | 8725H | |
| Puralube Opthalmic Ointment | Perrigo | 574402511 | |
| Q-tips | B.H.W | 271676 | |
| SomnoSuite Low-Flow Anesthesia System | Kent Scientific | SOMNO |
References
- Polonsky, K. S. The past 200 years in diabetes. New England Journal of Medicine. 367 (14), 1332-1340 (2012).
- Rees, D. A., Alcolado, J. C. Animal models of diabetes mellitus. Diabetic Medicine. 22 (4), 359-370 (2005).
- Pearson, J. A., Wong, F. S., Wen, L. The importance of the non-obese diabetic (NOD) mouse model in autoimmune diabetes. Journal of Autoimmunity. 66, 76-88 (2016).
- Heydemann, A. An overview of murine high fat diet as a model for Type 2 diabetes mellitus. Journal of Diabetes Research. 2016, 2902351(2016).
- Kennard, M. R., et al. The use of mice in diabetes research: The impact of experimental protocols. Diabetic Medicine. 38 (12), 14705(2021).
- Klueh, U., et al. Continuous glucose monitoring in normal mice and mice with prediabetes and diabetes. Diabetes Technology and Therapeutics. 8 (3), 402-412 (2006).
- Wuyts, C., Simoens, C., Pinto, S., Philippaert, K., Vennekens, R. Continuous glucose monitoring during pregnancy in healthy mice. Scientific Reports. 11, 4450(2021).
- Korstanje, R., et al. Continuous glucose monitoring in female NOD mice reveals daily rhythms and a negative correlation with body temperature. Endocrinology. 158 (9), 2707-2712 (2017).
- Han, B. G., et al. Markers of glycemic control in the mouse: Comparisons of 6-h-and overnight-fasted blood glucoses to Hb A1c. American Journal of Physiology - Endocrinology and Metabolism. 295 (4), 981-986 (2008).
- Xie, X., et al. Reduction of measurement noise in a continuous glucose monitor by coating the sensor with a zwitterionic polymer. Nature Biomedical Engineering. 2 (12), 894-906 (2018).
- Van Der Meulen, T., et al. Urocortin3 mediates somatostatin-dependent negative feedback control of insulin secretion. Nature Medicine. 21 (7), 769-776 (2015).
- Peterson, Q. P., et al. A method for the generation of human stem cell-derived alpha cells. Nature Communications. 11, 2241(2020).
- Klueh, U., Liu, Z., Feldman, B., Kreutzer, D. Interstitial fluid physiology as it relates to glucose monitoring technologies: Importance of Interleukin-1 and Interleukin-1 receptor antagonist in short-term glucose sensor function in vivo. Journal of Diabetes Science and Technology. 4 (5), 1073(2010).
- Klueh, U., Antar, O., Qiao, Y., Kreutzer, D. L. Role of interleukin-1/interleukin-1 receptor antagonist family of cytokines in long-term continuous glucose monitoring in vivo. Journal of Diabetes Science and Technology. 7 (6), 1538(2013).
- Klueh, U., Kaur, M., Qiao, Y., Kreutzer, D. L. Critical role of tissue mast cells in controlling long-term glucose sensor function in vivo. Biomaterials. 31 (16), 4540-4551 (2010).
- Kogot-Levin, A., et al. Mapping the metabolic reprogramming induced by sodium-glucose cotransporter 2 inhibition. JCI Insight. , 164296(2023).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved