Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Fabricación de células T con receptor de antígeno quimérico en un procesador celular automatizado
En este artículo
Resumen
En este artículo se detalla el proceso de fabricación de linfocitos T receptores de antígenos quiméricos para uso clínico, concretamente utilizando un procesador celular automatizado capaz de realizar la transducción viral y el cultivo de linfocitos T. Proporcionamos recomendaciones y describimos los escollos que deben tenerse en cuenta durante el desarrollo del proceso y la implementación de un ensayo clínico de fase inicial.
Resumen
Los linfocitos T con receptor de antígeno quimérico (CAR) representan un enfoque inmunoterapéutico prometedor para el tratamiento de diversas enfermedades malignas y no malignas. Las células CAR-T son células T modificadas genéticamente que expresan una proteína quimérica que reconoce y se une a una diana de la superficie celular, lo que provoca la muerte de la célula diana. Los métodos tradicionales de fabricación de células CAR-T requieren mucha mano de obra, son costosos y pueden conllevar el riesgo de contaminación. El CliniMACS Prodigy, un procesador celular automatizado, permite fabricar productos de terapia celular a escala clínica en un sistema cerrado, minimizando el riesgo de contaminación. El procesamiento se produce de forma semiautomática bajo el control de un ordenador y, por lo tanto, minimiza la participación humana en el proceso, lo que ahorra tiempo y reduce la variabilidad y los errores.
Este manuscrito y video describe el proceso de transducción de células T (TCT) para la fabricación de células CAR-T utilizando este procesador. El proceso TCT implica el enriquecimiento, la activación, la transducción con un vector viral, la expansión y la cosecha de células T CD4+/CD8+. Usando la Matriz de Actividades, una funcionalidad que permite ordenar y cronometrar estos pasos, el proceso TCT se puede personalizar ampliamente. Proporcionamos un recorrido por la fabricación de células CAR-T de conformidad con las Buenas Prácticas de Fabricación (cGMP) actuales y analizamos las pruebas de liberación requeridas y los experimentos preclínicos que respaldarán una solicitud de nuevo fármaco en investigación (IND). Demostramos la viabilidad y discutimos las ventajas y desventajas de utilizar un proceso semiautomático para la fabricación clínica de células CAR-T. Por último, describimos un ensayo clínico en curso iniciado por un investigador que se dirige a las neoplasias malignas de células B pediátricas [NCT05480449] como ejemplo de cómo se puede aplicar este proceso de fabricación en un entorno clínico.
Introducción
La transferencia adoptiva de linfocitos T modificados para expresar un receptor de antígeno quimérico (CAR) ha demostrado una eficacia notable en el tratamiento de pacientes con neoplasias malignas de linfocitos B refractarias 1,2,3,4,5. Sin embargo, los métodos tradicionales de fabricación de las células CAR-T requieren mucha mano de obra, mucho tiempo y técnicos altamente capacitados para llevar a cabo pasos altamente especializados. Por ejemplo, el proceso de fabricación tradicional de un producto autólogo de células CAR-T implica la centrifugación en gradiente de densidad, la elutriación o separación magnética para enriquecer las células T, la activación y transducción con un vector viral en un matraz estéril y la expansión en un biorreactor antes de la cosecha y la formulación. Recientemente han surgido varios sistemas que tienen como objetivo automatizar parcialmente este proceso. Por ejemplo, el Miltenyi CliniMACS Prodigy (en adelante, el "procesador") es un dispositivo de procesamiento celular automatizado que puede realizar muchos de estos pasos de forma automatizada 6,7,8,9. En un reciente artículo de revisión10 se presenta un análisis en profundidad de los métodos de fabricación de CAR-T tradicionales y automatizados.
El procesador se basa en la funcionalidad de CliniMACS Plus, un dispositivo médico aprobado por la Administración de Alimentos y Medicamentos de los Estados Unidos (FDA) para el procesamiento de células progenitoras hematopoyéticas. El procesador incluye una unidad de cultivo celular que permite el lavado, fraccionamiento y cultivo automatizado de células (Figura 1). El proceso de transducción de células T (TCT) es un programa preestablecido dentro del dispositivo procesador que replica en gran medida la fabricación manual de células CAR-T. TCT permite el procesamiento de celdas personalizable mediante una interfaz gráfica de usuario (la "Matriz de actividades", Figura 2). Debido a que el procesador automatiza muchos pasos y consolida la funcionalidad de varios dispositivos en una sola máquina, requiere menos capacitación y habilidades especializadas de resolución de problemas por parte de los tecnólogos. Debido a que todos los pasos se realizan dentro de un conjunto de tubos cerrados de un solo uso, el procesador puede operarse en instalaciones con una infraestructura de manejo de aire menos estricta de lo que se consideraría aceptable para un proceso de fabricación abierto. Por ejemplo, estamos operando el procesador en una instalación certificada como ISO clase 8 (comparable al grado C de la UE).
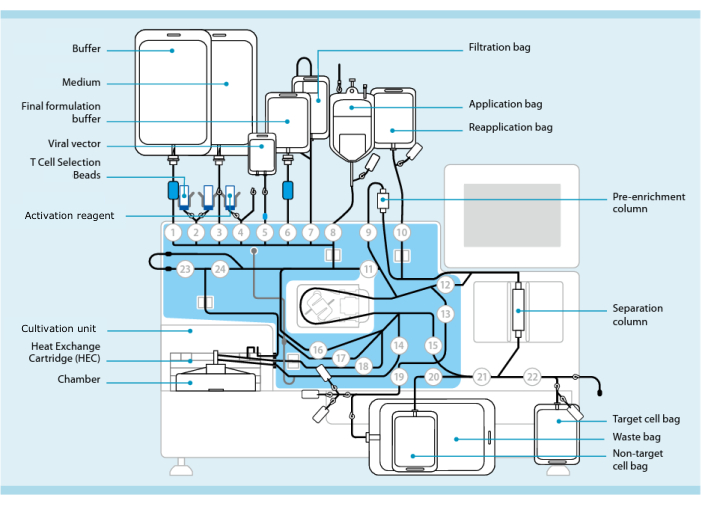
Figura 1: Fabricación de células CAR-T utilizando el sistema de transducción de células T. Se muestra el procesador con el juego de tubos instalado. El juego de tubos permite conectar otros componentes, como bolsas que contienen tampón de procesamiento, medio de cultivo y vector lentiviral mediante soldadura estéril. Una vez que el producto de leucoféresis se agrega a la bolsa de aplicación, se puede etiquetar con perlas de selección de células T, pasar a través de la columna de separación y luego transferirse a la bolsa de reaplicación. A continuación, las células seleccionadas se dirigen a la unidad de cultivo del instrumento para el cultivo y se activan con el reactivo de activación (véase la tabla de materiales). El producto final se recoge en la bolsa de células Target. A lo largo del proceso, es posible extraer muestras para el control de calidad de forma aséptica. Los números grises dentro de los círculos representan las válvulas numeradas en el procesador que dirigen la ruta del líquido a través del conjunto de tubos. Reproducido con permiso de 11. Haga clic aquí para ver una versión más grande de esta figura.
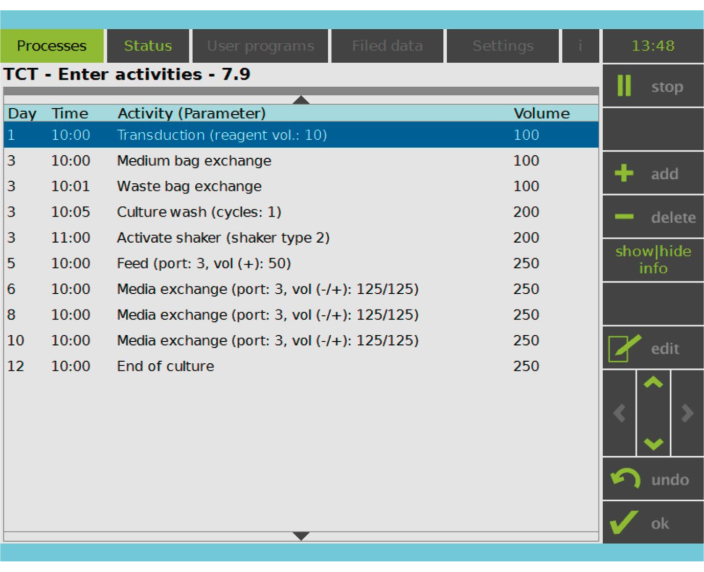
Figura 2: Matriz de actividades. Después de la selección y activación de las células T, el resto del proceso de fabricación de células CAR-T es totalmente personalizable. Las actividades se pueden agregar o eliminar y programar para el día y la hora adecuados, y se puede especificar el volumen de referencia cultural después de la actividad (Volumen). Por ejemplo, la actividad de transducción se configuró para comenzar a las 10:00 a.m. del día 1 y el volumen de cultivo al final de la actividad se estableció en 100 ml. La matriz de actividades se puede editar durante todo el período de cultivo. El estado del proceso se puede monitorear en la pantalla integrada del dispositivo de procesamiento. Haga clic aquí para ver una versión más grande de esta figura.
El objetivo de este manuscrito es proporcionar un recorrido detallado de la fabricación de células CAR-T utilizando el procesador y, además, proporcionar orientación sobre las pruebas en proceso y de liberación del producto que probablemente requerirán los reguladores para aprobar una solicitud de nuevo fármaco en investigación (IND). El protocolo presentado se mantiene cerca del enfoque recomendado por el proveedor y es el protocolo subyacente para IND 28617, que actualmente se está evaluando en un ensayo clínico de fase I/II iniciado por un investigador de un solo centro. Este ensayo tiene como objetivo determinar la seguridad y eficacia del uso de este procesador para fabricar células CAR-T autólogas humanizadas dirigidas a CD19 para pacientes con leucemia linfoblástica aguda de células B (LLA-B) o linfoma linfoblástico de linaje B (LLY-B) [NCT05480449]. El ensayo comenzó en septiembre de 2022 y está previsto que se inscriban hasta 89 pacientes de 0 a 29 años con LLA-B o B-Lly. En el manuscrito se presentan algunos resultados de fabricación del ensayo.
Nos gustaría señalar que, aunque el manuscrito se presenta como un protocolo con pasos a seguir, debe considerarse un punto de partida para que otros comiencen a optimizar su propio proceso de fabricación de células CAR-T. Una lista no exhaustiva de posibles variaciones del protocolo presentado incluye: el uso de células T frescas en lugar de criopreservadas como material de partida; usar un método diferente de enriquecimiento de células T u omitirlo por completo; el uso de diferentes medios y cócteles de citoquinas como IL7/IL15 en lugar de IL2; variar la concentración de suero AB humano u omitirla por completo; momento de la transducción; el uso de transducciones "multi-hit"; variación de la agitación, los volúmenes de cultivo y el programa de alimentación; el uso de diferentes métodos de transferencia genética, incluida la electroporación de ácidos nucleicos o vectores no lentivirales; utilizar un tampón de formulación final y/o crioprotector diferente; e infundir células CAR-T frescas en lugar de criopreservar para su infusión en un momento posterior. Estas variaciones pueden tener un impacto significativo en la composición celular y la potencia del producto terapéutico.
| Paso general del proceso | Día del Proceso | Técnicas | |||
| Enriquecimiento celular | Día 0 | Selección de linfocitos T CD4+/CD8+ | |||
| Activación celular | Siembra y activación de cultivos de células T | ||||
| Transducción celular | Día 1 | Transducción lentiviral (volumen de cultivo de 100 mL) | |||
| Expansión celular (seguida de formulación celular) | Día 2 | -- | |||
| Día 3 | Lavado de cultivo (1 ciclo); Agitador activado; El volumen de cultivo aumenta a 200 mL | ||||
| Día 4 | -- | ||||
| Día 5 | Alimentación (50 mL); El volumen de cultivo alcanza el volumen final de 250 mL | ||||
| Día 6 | Muestra en proceso; Intercambio de medios (-125 mL / +125 mL) | ||||
| Día 7 | Intercambio de medios (-150 mL / +150 mL) o Cosecha | ||||
| Día 8 | Muestra en proceso; Intercambio de medios (-150 mL / +150 mL) o Cosecha | ||||
| Día 9 | Intercambio de medios (-180 mL / +180 mL) o Cosecha | ||||
| Día 10 | Muestra en proceso; Intercambio de medios (-180 mL / +180 mL) o Cosecha | ||||
| Día 11 | Intercambio de medios (-180 mL / +180 mL) o Cosecha | ||||
| Día 12 | Intercambio de medios (-180 mL / +180 mL) o Cosecha | ||||
| Día 13 | Cosecha | ||||
Tabla 1: Cronograma y descripción general del proceso. Esta tabla resume los pasos del proceso de TCT empleados en un ensayo clínico actual [NCT05480449]. El proceso comienza con el enriquecimiento de las células T mediante la selección de CD4+/CD8+, la siembra del cultivo y la activación en el día 0, seguido de la transducción en el día 1. Las células descansan durante 48 h, seguidas de un lavado de cultivo, un aumento del volumen de cultivo a 200 ml y agitación mediante un mecanismo de agitación. El día 6, se toma la primera muestra en proceso. Las células se extraen una vez que se dispone de suficientes células para al menos tres dosis completas de células CAR-T (5 × 10 6 células CAR-T/kg si el paciente pesa <50 kg, de lo contrario, 2,5 × 108 células CAR-T) y pruebas de control de calidad (~2 × 106 células CAR-T); o una vez que el cultivo alcanza un total de 4-5 x 109 células. Abreviaturas: TCT = transducción de células T; CAR-T = linfocitos T receptores de antígenos quiméricos; MACS = clasificación de células activadas magnéticamente.
Protocolo
Toda la investigación se realizó de acuerdo con las directrices institucionales con la aprobación de la Junta de Revisión Institucional (IRB) del hospital, y todos los sujetos han dado su consentimiento informado para la publicación de los datos recopilados en el contexto del ensayo.
NOTA: La primera sección del Protocolo proporciona una visión general de alto nivel del proceso de fabricación de CAR-T. Las secciones restantes proporcionan las instrucciones paso a paso. El protocolo describe el flujo de trabajo utilizando la versión 1.4 del software TCT, que es la versión actual en el momento de escribir este artículo. La interfaz de usuario de otras versiones del software TCT puede variar.
1. Cronograma y descripción general del proceso (Tabla 1)
- Prepárese para el procedimiento un lunes (día -1) con controles previos al vuelo. Asegúrese de que el procesador y otros equipos funcionen según lo esperado y de que todos los reactivos y consumibles estén disponibles y actualizados durante todo el ciclo de fabricación.
- El día 0, instale el juego de tubos en la máquina. Descongele las células T previamente criopreservadas en un baño seco y conéctelas mediante soldadura estéril al conjunto de tubos instalado en el instrumento.
NOTA: Este protocolo asume que las células T autólogas se recolectaron mediante aféresis, se criopreservaron y se almacenaron hasta el inicio de la fabricación. Si bien es posible utilizar células T recién recolectadas, esto aumenta la carga logística, ya que requiere coordinar la recolección de aféresis con la fabricación de células CAR-T. Recomendamos encarecidamente utilizar un proceso de descongelación en seco en lugar de un baño de agua para minimizar el riesgo de contaminación bacteriana. - Marcar los linfocitos T con reactivos CD4 y CD8 (ver Tabla de Materiales) y enriquecer mediante selección magnética.
NOTA: Es posible omitir el enriquecimiento de células T o realizarlo antes de cargar las células en el procesador. Véase la sección 5 del Protocolo. - Después del enriquecimiento de las células CD4+/CD8+, tome una muestra para un recuento celular. Siembre el cultivo con 1-2 × 108 células en un volumen inicial de 70 mL de medio (ver Tabla de Materiales) suplementado con suero AB humano al 5% e IL2 humana recombinante (25 ng/mL).
- Añadir un vial de reactivo de activación (una nanomatriz polimérica coloidal conjugada con anticuerpos anti-CD3 y anti-CD28; ver Tabla de Materiales) para activar los linfocitos T e incubar el cultivo sin agitación durante 24 h a 37 ºC en una atmósfera de CO2 al 5%. Si lo desea, crioconserve las células CD4+/CD8+ sobrantes como respaldo.
NOTA: En caso de fallo de fabricación, las células seleccionadas CD4+/CD8+ sobrantes pueden utilizarse como material de partida. Si la falla es puramente técnica, como contaminación o error del operador, y quedan suficientes celdas, se puede considerar el uso de celdas sobrantes para realizar una ejecución de fabricación adicional. Si la calidad del material de partida es motivo de preocupación, entonces podría justificarse un nuevo procedimiento de aféresis; sin embargo, en última instancia, se trata de una decisión clínica. En cualquier caso, una falla de fabricación es un evento significativo que debe investigarse, y el patrocinador y, posiblemente, los reguladores deben ser informados. - Después de 24 h de activación, transducir linfocitos T con vector lentiviral a una multiplicidad de infección (MOI) adecuada.
NOTA: Es fundamental determinar el título del vector lentiviral y establecer un momento de inercia adecuado antes de comenzar a fabricar productos clínicos. El título del vector debe determinarse mediante la realización de un experimento a pequeña escala en el que se transducen células T primarias humanas a diversas concentraciones del vector. Las consideraciones para el MOI apropiado incluyen el costo del vector, la eficiencia de transducción deseada y un número de copia de vector aceptable. Este protocolo utiliza un MOI del 30-50% para minimizar el costo del vector y mantener el número promedio de copias del vector por debajo de 8 copias por celda transducida. - El día 3, activa la actividad Culture Wash y comienza la agitación de bajo nivel. Aumentar el volumen de cultivo a 200 mL.
- El día 5, agregue 50 ml de medio al cultivo, aumentando el volumen del cultivo a 250 ml.
- En el día 6 del cultivo, tome una muestra del cultivo y enumere las células CAR-T mediante citometría de flujo. Utilice esta medición para estimar la velocidad a la que crece el cultivo e identificar el momento óptimo de la cosecha.
NOTA: Cada muestreo durante el proceso produce 3 mL para la prueba y elimina 7 mL en total del volumen de cultivo. - Del día 7 al 13, si el cultivo no se ha terminado, tome hasta dos muestras adicionales en proceso en días alternos y realice intercambios diarios de medios para alimentar el cultivo en crecimiento. Cosechar el producto cuando el recuento total de células nucleadas (TNC) alcance 5 × 109 y/o cuando haya suficientes células disponibles para el número requerido de dosis y pruebas de liberación.
- El día de la cosecha, tome una muestra en proceso del cultivo en crecimiento. Utilice esta muestra para pruebas de micoplasma, endotoxinas, lentivirus competente para la replicación (RCL), pruebas de número de copias vectoriales (VCN), recuento celular, análisis de tamaño celular, citometría de flujo y tinción de Gram.
- Iniciar el programa de cosecha final, que desencadena la eliminación del medio de cultivo y un lavado celular con el tampón de formulación final (una solución cristaloide isotónica estéril suplementada con albúmina sérica humana al 4%; ver Tabla de Materiales). Una vez completada la cosecha, la bolsa de células objetivo contendrá 100 ml de producto celular en el tampón de formulación final. Agregue dimetilsulfóxido (DMSO) a una concentración del 10% (v/v), alícuota el producto en dosis individuales y criopreserva usando un congelador de velocidad controlada.
2. Día -1: Preparación y comprobaciones previas al vuelo
- Verifique que los niveles de gas CO2 y aire comprimido sean suficientes para producir una presión de entrada de al menos 20 psi en cada línea.
- Encienda el procesador y confirme que no haya errores en el inicio. Si es necesario, ajuste el reloj a la hora correcta. Apague el procesador.
- Asegúrese de que se conozcan el recuento de células, el volumen y el recuento total de CD4+ y CD8+ total del material de partida de las células T.
- Asegúrese de que haya cantidades suficientes del vector viral, los reactivos y los consumibles para todo el ciclo de fabricación.
- Coloque un frasco de suero AB humano en el refrigerador para descongelar durante la noche.
3. Día 0: Instalación del juego de tubos
- Preparar 3 L de tampón de procesamiento (0,5 % (p/v) de albúmina sérica humana (HSA) en solución salina tamponada con fosfato / tampón de ácido etilendiaminotetraacético (PBS/EDTA)).
- Preparar 2 L de medio de cultivo (2 L de medio suplementado con 100 mL de suero AB humano a una concentración final del 5% y dos viales de IL2 humana recombinante a 25 μg/vial; ver Tabla de Materiales para más información sobre estos reactivos). Transfiera 10 mL de medio de cultivo a una bolsa de reactivos de 20 mL y almacene a 4 ºC durante la noche.
- Encienda el instrumento y seleccione el proceso de transducción de células T (TCT) en la interfaz de la pantalla táctil. Haga clic en Ejecutar para iniciar el proceso TCT; Deje que el instrumento guíe al usuario a través del procedimiento utilizando instrucciones e indicaciones en pantalla.
- En la pantalla Entrada de parámetros , ingrese las iniciales del operador, el número de lote del juego de tubos y su fecha de vencimiento cuando se le solicite.
- La pantalla Configuración del proceso presenta cuatro procesos diferentes. Elija Proceso completo (1).
NOTA: Otros procesos disponibles incluyen el inicio de las células T seleccionadas CD4+/CD8+ (consulte la sección 5 a continuación) y el reinicio de una serie de fabricación previamente abortada. - Cuando se le solicite, elija dos viales de reactivo de selección para reflejar el método de selección CD4+/CD8+.
- Instale el juego de tubos según las instrucciones que aparecen en pantalla. Asegúrese de que todas las conexiones Luer estén apretadas y que no haya defectos en el juego de tubos.
- Siga las instrucciones en pantalla para iniciar las pruebas automatizadas de integridad superior e inferior.
NOTA: Una prueba de integridad puede fallar debido a un juego de tubos defectuoso, un juego de tubos instalado incorrectamente o un defecto en la bomba peristáltica de la máquina. Recomendamos encarecidamente tener al menos un juego de tubos adicional a mano para las tiradas de producción. También recomendamos que un segundo tecnólogo verifique la correcta instalación del juego de tubos. - Siga las instrucciones en pantalla para colocar el medio y procesar las bolsas de amortiguación.
- Comience el cebado automático del juego de tubos.
NOTA: El proceso de TCT debe continuar dentro de las 3 horas posteriores al cebado. Asegúrese de que el material de partida de las células T esté listo.
4. Enriquecimiento de células T
- Cuando aparezca la pantalla Transferir producto de células , comience a descongelar el producto de células T criopreservadas.
NOTA: El volumen aceptable de células T que se pueden agregar al juego de tubos oscila entre 50 y 280 ml. El número máximo de células diana (suma de CD4+ y CD8+) es de 3 × 109, y el recuento máximo de TNC es de 2 × 1010. - Transfiera las células descongeladas a una bolsa de transferencia de 150 ml. Suelde estérilmente la bolsa de transferencia a la bolsa de aplicación del juego de tubos.
- Retire una muestra de la bolsa de aplicación con la bolsa de control de calidad y realice un recuento de células.
- Conecte los viales de reactivos CD4 y CD8.
- Inicie el proceso de selección (enriquecimiento de células T).
- Después del enriquecimiento, extraiga una muestra de las células seleccionadas CD4+/CD8+ de la bolsa de control de calidad de la bolsa de reaplicación para el recuento de células, la citometría de flujo y el análisis del tamaño de las células.
NOTA: El resultado del recuento de células es necesario para continuar con el siguiente paso.
5. Alternativa: Comenzando con células seleccionadas CD4+/CD8+
- Prepare el medio como se describe en el paso 3.2. No se necesita ningún búfer de procesamiento.
- Encienda el procesador y seleccione Cultivo de células T con instalación de TS (3) en la pantalla Configuración del proceso . Siga las instrucciones e indicaciones que aparecen en pantalla.
- Siguiendo las instrucciones que aparecen en pantalla, cebe el juego de tubos con medio en lugar de tampón de procesamiento.
- Cuando aparezca la pantalla "Prepare cultivation-Connect cell product", comience a descongelar los linfocitos T CD4+/CD8+ seleccionados.
NOTA: El número mínimo de linfocitos T (suma de linfocitos T CD4+ y CD8+) para el proceso es 1,0 × 108. - Transfiera las células a una bolsa de transferencia de 150 ml y diluya con medio hasta un volumen final de 50 ml.
- Suelde estérilmente la suspensión celular a la bolsa de reaplicación del instrumento.
- Retire una muestra de las células seleccionadas CD4+/CD8+ de la bolsa de control de calidad de la bolsa de reaplicación para el recuento de células y el análisis del tamaño de las células.
6. Configuración de la cultura y programación de la Matriz de Actividades
- Introduzca la concentración de células y el número inicial deseado (1-2 × 108 células T).
NOTA: El instrumento bombeará automáticamente el volumen apropiado de la bolsa de reaplicación a la cámara de cultivo y ajustará el volumen final a 70 ml. - Coloque un vial del reactivo de activación según las instrucciones que aparecen en pantalla.
- Introduzca 5% para la concentración deCO2 y 39 °C para la temperatura de la cámara de cultivo.
NOTA: El fabricante recomienda introducir 39 °C o un valor calibrado específicamente para el instrumento. - Configure la matriz de actividades. Utilice el protocolo de alimentación mejorada como punto de partida y modifique los pasos individuales dentro del protocolo según las especificaciones definidas por el usuario (Figura 2).
- Asegúrese de que el tiempo de la actividad de transducción sea de 24 h después de la siembra (Día 1).
- Asegúrese de que el tiempo de la actividad de lavado de cultivo sea de 48 h después de la transducción (día 3).
- Establezca el tiempo de activación de la coctelera (tipo de coctelera 2) en 30 minutos después del inicio del lavado de cultivo.
- Elimine todas las actividades de intercambio de bolsas medianas e intercambio de bolsas de residuos.
- Toque ok en la pantalla para comenzar el cultivo.
- Crioconserve las células seleccionadas CD4+/CD8+ sobrantes en la bolsa de aplicación para su uso futuro, si es necesario.
7. Día 1: Transducción de células T
- Calcule el volumen del vector lentiviral que se va a utilizar en función del momento de inercia deseado.
- Recuperar la bolsa de reactivos de 20 ml que contiene 10 ml de medio de cultivo que se almacenó a 4 ºC durante la noche (paso 3.2). Descongele el vial vectorial y transfiera el volumen calculado en 7.1 a la bolsa de reactivos de 20 ml.
NOTA: Recomendamos congelar cualquier vector sobrante para su retención o para investigación y desarrollo. - Modifique la matriz de actividad para establecer el tiempo de transducción en 2 minutos en el futuro. Cuando se le solicite, toque Aceptar para iniciar la actividad de transducción.
- Suelde estérilmente la bolsa vectorial al conjunto de tubos siguiendo las instrucciones que aparecen en pantalla.
- Modifique la matriz de actividad en función de la hora real en que se inició la actividad de transducción.
NOTA: Sugerimos comenzar la transducción dentro de las 20-24 horas posteriores a la siembra para garantizar que las actividades prácticas se realicen durante las horas normales de trabajo.- Asegúrese de que el tiempo de lavado del cultivo sea de 48 h después de la transducción (día 3).
- Ajuste el tiempo de activación de la coctelera (tipo de coctelera 2) a 30 minutos después del lavado con cultivo (día 3).
- Asegúrese de que la hora de intercambio de medios sea por la tarde (1 p.m.) del día 6.
8. Día 6: Primera muestra en proceso
- Toque el botón Sample (Muestra ) y siga las instrucciones que aparecen en pantalla para obtener una muestra de control de calidad del cultivo activo.
- Realice análisis de recuento celular, citometría de flujo y tamaño celular. Envíe 1 ml de la muestra para una tinción de Gram.
NOTA: Los recuentos celulares deben repetirse aproximadamente cada dos días para monitorear el crecimiento del cultivo. - Preparar otros 2 L de medio de cultivo (ver paso 3.2).
- Agregue una actividad de intercambio de bolsas medianas a la matriz de actividades, programada para comenzar 2 minutos en el futuro. Ajuste la actividad de Media Exchange para que comience 20 minutos en el futuro. Siga las instrucciones que aparecen en pantalla.
NOTA: El intercambio de medios es el reemplazo del medio de cultivo en la cámara de cultivo. El intercambio de bolsas medianas es el reemplazo de la bolsa mediana de cultivo que se cuelga en el instrumento.
9. Día de cosecha (entre el día 7 y el 13): Cosecha y criopreservación
- Toque el botón Sample (Muestra ) y siga las instrucciones que aparecen en pantalla para obtener una muestra de control de calidad del cultivo activo.
- Separe la muestra de control de calidad en tres alícuotas de 1 ml cada una. Utilice 1 ml para la citometría de flujo, el recuento de células y los análisis del tamaño de las células. Use 1 ml para pruebas de micoplasma, número de copias de vectores, lentivirus competentes para la replicación y endotoxinas. Envíe el último 1 ml para la tinción de Gram.
- Preparar el tampón de formulación final (una solución cristaloide isotónica estéril suplementada con HSA al 4 % en una bolsa de 2 L, ver Tabla de Materiales). Guarde 100 ml de este tampón para preparar la solución crioprotectora en un paso posterior.
- Modifique la matriz de actividades para establecer el tiempo de fin de la cultura en 2 minutos en el futuro y elimine todas las demás actividades restantes. Siga las instrucciones en pantalla para conectar el tampón de formulación final al juego de tubos y comenzar la cosecha.
NOTA: El procesador transferirá automáticamente las celdas a la bolsa de celdas de destino. El volumen será de 100 mL. - Tome una muestra de 0,5 ml de la bolsa de control de calidad de la bolsa de células objetivo y realice un recuento de células.
- Selle la bolsa de celdas Target y retírela del juego de tubos. Divida el producto CAR-T en dosis adecuadas y criopártelas en un congelador de velocidad controlada. Almacenar las celdas en la fase de vapor del tanque de almacenamiento de nitrógeno líquido a ≤ -150 ºC.
NOTA: La formulación final y la alícuota de las dosis son específicas del protocolo. Proporcionamos aquí un ejemplo en el que se criopreservan tres dosis iguales de células CAR-T y viales de control de calidad. Consulte la sección 10 para obtener más detalles. - Descargue los datos de proceso del instrumento, retire y deseche el juego de tubos y realice un apagado.
10. Criopreservación de células CAR-T
NOTA: Este protocolo asume que las células CAR-T se criopreservan después de la fabricación y se almacenan hasta que el paciente esté listo para la infusión. Si bien es posible infundir células CAR-T recién fabricadas, esto aumenta la carga logística, ya que requiere coordinar la fabricación de células CAR-T con la infusión de células CAR-T. Esto puede ser problemático en caso de un fallo de fabricación. Especialmente si el protocolo clínico requiere quimioterapia de depleción linfológica antes de la infusión de CAR-T, recomendamos encarecidamente la criopreservación, ya que un fallo de fabricación puede exponer al paciente al riesgo de quimioterapia innecesaria. Los reguladores pueden exigir a los investigadores que demuestren que el producto pasa todas las pruebas de liberación antes de la infusión, lo que puede ser difícil de lograr sin criopreservación.
- A partir de los últimos 100 ml de producto cosechado, determine y elimine el volumen necesario para cumplir con las dosis deseadas de CAR-T y los viales de control de calidad (QC) para realizar pruebas de liberación adicionales (por ejemplo, viabilidad), retención y una muestra de esterilidad.
NOTA: Es fundamental desarrollar una estrategia completamente definida para la alícuota del producto final. Sugerimos fabricar varias dosis del producto para permitir las reinfusiones, dado que se dispone de suficiente material. Un volumen de producto de 10-20 ml en una bolsa permite una descongelación rápida y una fácil infusión mediante el empuje de la jeringa. Se recomienda llenar cada producto hasta la dosis deseada de células CAR-T (por ejemplo, 5 × 106 células CAR-T por kg o 2,5 × 108 células CAR-T), ya que esto evitará la necesidad de calcular la dosis el día de la perfusión. También se recomienda criopreservar al menos cuatro viales de control de calidad y tener en cuenta la posibilidad de que pueda haber material sobrante; Sugerimos guardar este material, ya que puede ser útil para fines de investigación y desarrollo. - Centrifugar las células para reducir el volumen.
- Aumente los productos a la mitad del volumen final deseado utilizando la porción de tampón de formulación final reservada en el paso 9.3.
- Prepare 2 veces el crioprotector creando una solución de DMSO al 20% en el tampón de formulación final.
NOTA: La formulación del crioprotector y la concentración de DMSO pueden modificarse. - Agregue 2 veces el crioprotector a las células al mismo volumen para obtener una concentración final de DMSO del 10%.
NOTA: Se debe minimizar la duración de la exposición del producto al crioprotector. - Llene las bolsas de dosis y los viales de control de calidad. Envíe 1 mL para esterilidad.
NOTA: Los reguladores suelen exigir que se realice un ensayo de esterilidad de 14 días en el producto final. Sin embargo, están surgiendo ensayos de esterilidad rápida; En este momento, el método compendio de 14 días es el más común. - Crioconserve los productos utilizando un congelador de velocidad controlada.
NOTA: El programa de congelación de velocidad controlada debe validarse para producir una velocidad de enfriamiento de ~ -1 ºC/min a ~ -45 ºC, con compensación por el punto eutéctico. - Almacenar el producto en la fase de vapor de un ultracongelador de nitrógeno líquido a ≤ -150 °C.
11. Examen de la ejecución del procedimiento
NOTA: A lo largo del proceso de TCT, se extraen varias muestras de control de calidad del cultivo activo. La Tabla 2 proporciona una cuadrícula que puede ayudar al lector a organizar los resultados como referencia y calcular las métricas de rendimiento del procedimiento. Los siguientes términos, que consisten en una letra y un número (por ejemplo, "B4") se refieren a las celdas de la cuadrícula de esta tabla. En los cálculos de rendimiento se utilizan los siguientes valores: B3 = preenriquecimiento de células nucleadas totales (TNC); B4 = TNC post-enriquecimiento; E2 = La suma de las células T CD4+ y CD8+ como porcentaje del total de células del producto de aféresis inicial; E4 = La suma de las células T CD4+ y CD8+ como porcentaje del total de células después del enriquecimiento; G2 = células CD19+ como porcentaje del total de células del producto inicial; G4 = células CD19+ como porcentaje del total de células después del enriquecimiento de CD4+/CD8+; B10 = TNC del Cultivo Activo el día de la cosecha.
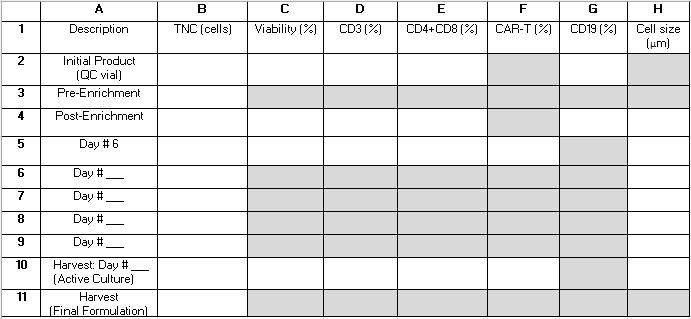
Tabla 2: Tabla de rendimiento del procedimiento. Proporcionamos esta cuadrícula para ayudar a organizar los resultados de prueba en proceso necesarios para calcular las estadísticas de rendimiento del procedimiento. Las filas representan muestras analizadas en varios momentos durante el procedimiento y están etiquetadas con números del 1 al 11. Las hileras 6-9 se pueden utilizar para capturar los resultados de las muestras tomadas después del día 6 de cultivo, pero antes del día de la cosecha. Las columnas representan los parámetros medidos y están etiquetadas con letras de la A a la H. Los campos sombreados en gris no se aplican. Es posible que algunos campos adicionales no se apliquen dependiendo de si el enriquecimiento de CD4+/CD8+ se realiza como parte del procedimiento y de la duración del cultivo. Sugerimos escribir "N/A" en esos campos. Abreviaturas: TNC = recuento total de células nucleadas; QC = control de calidad. Haga clic aquí para descargar esta tabla.
- Calcule la recuperación de las células CD4+/CD8+ después de la selección dividiendo el número total de células T CD4+ más CD8+ después del enriquecimiento por el número total de células T CD4+ más CD8+ antes del enriquecimiento utilizando la ecuación (1).
Recuperación de linfocitos T CD4+/CD8+ =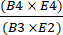 (1)
(1) - Calcule el agotamiento de las células CD19+ después del enriquecimiento dividiendo el número total de células CD19+ después del enriquecimiento CD4+/CD8+ por el número total de células CD19+ antes del enriquecimiento. Dado que se espera que este número sea muy pequeño, informe el logaritmo de esta fracción como se muestra en la ecuación (2):
Depleción logarítmica de células CD19 = logaritmo10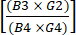 (2)
(2) - Calcule el crecimiento total del pliegue dividiendo el número total de células en cultivo activo en el momento de la cosecha por el número de células sembradas utilizando la ecuación (3):
Crecimiento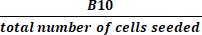 total = (3)
total = (3) - Calcule el crecimiento medio diario tomando la raíz del crecimiento total del pliegue con respecto al día de la cosecha utilizando la ecuación (4):
Crecimiento medio diario = día de cosecha √ (crecimiento total de pliegues) (4)
Resultados
Los resultados de las tres series iniciales de fabricación de CAR-T del ensayo de NCT05480449 se presentan a continuación en la Tabla 3. El material de partida, el vector, las citocinas de cultivo y las concentraciones séricas de AB se mantuvieron constantes para cada corrida. Los productos se cosecharon el día 7 u 8. El crecimiento celular diario promedio fue del 46% (aumento en el recuento total de células), lo que indica que el proceso TCT fue efectivo para promover la expansión celular. Estos r...
Discusión
La terapia de células CAR-T se ha convertido en un enfoque de tratamiento prometedor para las células B y otras neoplasias malignas. Sin embargo, los métodos tradicionales de fabricación de células CAR-T tienen varias limitaciones, como el alto costo, la producción intensiva en mano de obra y los pasos abiertos que aumentan el riesgo de contaminación. Recientemente, han surgido varias plataformas semiautomatizadas, incluida Miltenyi CliniMACS Prodigy (el "procesador"), para abordar estas limitaciones. El proceso d...
Divulgaciones
S.K., S.G. y Y.W. han recibido apoyo de investigación de Miltenyi Biotec.
Agradecimientos
Los autores desean reconocer las contribuciones de varias personas y organizaciones a este trabajo. El Laboratorio de Terapia Celular y Génica y el Laboratorio de Estudios Traslacionales y Correlativos de la Universidad de Pensilvania proporcionaron una valiosa asistencia en el desarrollo de procesos y la preparación para las presentaciones de IND. Melissa Varghese y Amanda DiNofia contribuyeron al proceso, desarrollo y preparación de las presentaciones de IND que subyacen a este manuscrito. Este trabajo fue apoyado por una Beca de Aceleración de la Colaboración de Terapia Celular y Génica del Hospital Infantil de Filadelfia. Los autores también quieren agradecer a Miltenyi Biotec su apoyo técnico y de investigación. La figura 1 está cubierta por los derechos de autor © 2023 Miltenyi Biotec B.V. & Co. KG; Todos los derechos reservados.
Materiales
| Name | Company | Catalog Number | Comments |
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
Referencias
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados