É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Fabricação de células T do receptor de antígeno quimérico em um processador de células automatizado
Neste Artigo
Resumo
Este artigo detalha o processo de fabricação de células T do receptor de antígeno quimérico para uso clínico, especificamente usando um processador de células automatizado capaz de realizar transdução viral e cultivo de células T. Fornecemos recomendações e descrevemos armadilhas que devem ser consideradas durante o processo de desenvolvimento e implementação de um ensaio clínico de fase inicial.
Resumo
As células T do receptor de antígeno quimérico (CAR) representam uma abordagem imunoterapêutica promissora para o tratamento de várias doenças malignas e não malignas. As células CAR-T são células T geneticamente modificadas que expressam uma proteína quimérica que reconhece e se liga a um alvo de superfície celular, resultando na morte da célula-alvo. Os métodos tradicionais de fabricação de células CAR-T são trabalhosos, caros e podem trazer o risco de contaminação. O CliniMACS Prodigy, um processador de células automatizado, permite a fabricação de produtos de terapia celular em escala clínica em um sistema fechado, minimizando o risco de contaminação. O processamento ocorre de forma semiautomática sob o controle de um computador e, assim, minimiza o envolvimento humano no processo, o que economiza tempo e reduz a variabilidade e os erros.
Este manuscrito e vídeo descrevem o processo de transdução de células T (TCT) para a fabricação de células CAR-T usando este processador. O processo de TCT envolve enriquecimento, ativação, transdução de células T CD4+/CD8+ com vetor viral, expansão e colheita. Usando a Matriz de Atividades, uma funcionalidade que permite ordenar e cronometrar essas etapas, o processo de TCT pode ser personalizado extensivamente. Fornecemos um passo a passo da fabricação de células CAR-T em conformidade com as Boas Práticas de Fabricação atuais (cGMP) e discutimos os testes de liberação necessários e os experimentos pré-clínicos que darão suporte a uma aplicação de Novo Medicamento Investigacional (IND). Demonstramos a viabilidade e discutimos as vantagens e desvantagens do uso de um processo semiautomático para a fabricação clínica de células CAR-T. Finalmente, descrevemos um ensaio clínico em andamento iniciado por pesquisadores que tem como alvo malignidades pediátricas de células B [NCT05480449] como um exemplo de como esse processo de fabricação pode ser aplicado em um ambiente clínico.
Introdução
A transferência adotiva de células T projetadas para expressar um receptor de antígeno quimérico (CAR) tem demonstrado notável eficácia no tratamento de pacientes com neoplasias malignas refratárias de células B 1,2,3,4,5. No entanto, os métodos tradicionais de fabricação de células CAR-T são trabalhosos, demorados e exigem técnicos altamente treinados para realizar etapas altamente especializadas. Por exemplo, o processo tradicional de fabricação de um produto autólogo de células CAR-T envolve centrifugação por gradiente de densidade, elutriação ou separação magnética para enriquecer células T, ativação e transdução com um vetor viral em um frasco estéril e expansão em um biorreator antes da colheita e formulação. Vários sistemas têm surgido recentemente que visam automatizar parcialmente esse processo. Por exemplo, o Miltenyi CliniMACS Prodigy (doravante denominado "processador") é um dispositivo de processamento celular automatizado que pode executar muitas dessas etapas de forma automatizada 6,7,8,9. Uma discussão aprofundada dos métodos de fabricação CAR-T tradicionais e automatizados é apresentada em um artigo de revisão recente10.
O processador se baseia na funcionalidade do CliniMACS Plus, um dispositivo médico aprovado pela Food and Drug Administration (FDA) dos EUA para o processamento de células progenitoras hematopoiéticas. O processador inclui uma unidade de cultivo de células que permite a lavagem, o fracionamento e o cultivo automatizados de células (Figura 1). O processo de transdução de células T (TCT) é um programa predefinido dentro do dispositivo do processador que replica amplamente a fabricação manual de células CAR-T. O TCT permite o processamento de células personalizáveis usando uma interface gráfica do usuário (a "Matriz de Atividade", Figura 2). Como o processador automatiza muitas etapas e consolida a funcionalidade de vários dispositivos em uma máquina, ele exige menos treinamento e habilidades especializadas de solução de problemas dos tecnólogos. Como todas as etapas são executadas dentro de um conjunto de tubos fechados e de uso único, o processador pode ser operado em instalações com infraestrutura de tratamento de ar menos rigorosa do que seria considerado aceitável para um processo de fabricação aberto. Por exemplo, estamos operando o processador em uma instalação certificada como classe ISO 8 (comparável à classe C da UE).
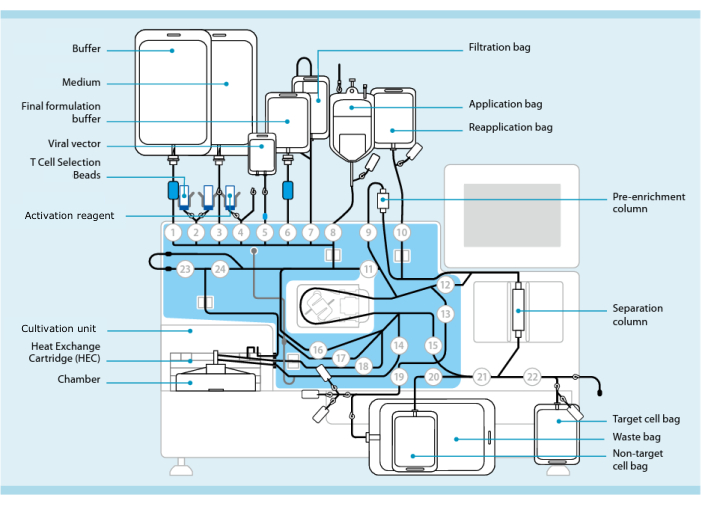
Figura 1: Fabricação de células CAR-T utilizando o sistema de transdução de células T. Mostrado é o processador com o conjunto de tubos instalado. O conjunto de tubos permite conectar outros componentes, como sacos contendo tampão de processamento, meio de cultura e vetor lentiviral via soldagem estéril. Uma vez que o produto de leucaferese é adicionado ao saco de aplicação, ele pode ser rotulado com contas de seleção de células T, passado através da coluna de separação e, em seguida, transferido para o saco de reaplicação. As células selecionadas são então direcionadas para a unidade de cultivo do instrumento para cultura e ativadas com o reagente de ativação (ver Tabela de Materiais). O produto final é coletado no saco de célula alvo. Durante todo o processo, é possível retirar amostras para controle de qualidade de forma asséptica. Números cinzas dentro de círculos representam as válvulas numeradas no processador que direcionam o caminho do líquido através do conjunto de tubos. Reproduzido com permissão de 11. Clique aqui para ver uma versão maior desta figura.
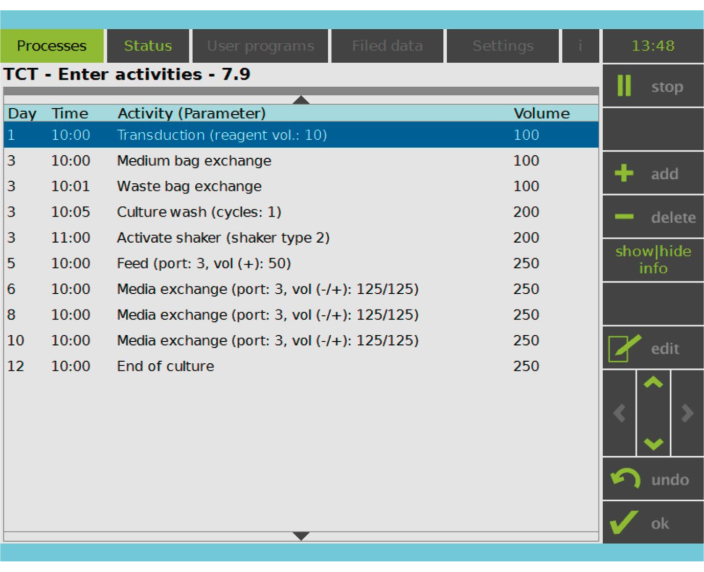
Figura 2: Matriz de atividades. Após a seleção e ativação da célula T, o restante do processo de fabricação da célula CAR-T é totalmente personalizável. As atividades podem ser adicionadas ou excluídas e agendadas para o dia e hora apropriados, e o volume de cultura após a atividade pode ser especificado (Volume). Por exemplo, a atividade de transdução foi configurada para começar às 10:00 AM no Dia 1, e o volume de cultura no final da atividade foi definido como 100 mL. A Matriz de Atividades pode ser editada durante todo o período de cultivo. O status do processo pode ser monitorado na tela integrada do dispositivo de processamento. Clique aqui para ver uma versão maior desta figura.
O objetivo deste manuscrito é fornecer um passo a passo detalhado da fabricação de células CAR-T usando o processador e, adicionalmente, fornecer orientação sobre os testes em processo e de liberação do produto que provavelmente serão exigidos pelos reguladores para aprovar uma aplicação experimental de novo medicamento (IND). O protocolo apresentado permanece próximo da abordagem recomendada pelo fornecedor e é o protocolo subjacente para o IND 28617, que está atualmente sendo avaliado em um ensaio clínico de fase I/II iniciado por um investigador de um único centro. Este estudo tem como objetivo determinar a segurança e eficácia do uso deste processador na fabricação de células CAR-T autólogas CD19-dirigidas humanizadas para pacientes com leucemia linfoblástica aguda de células B (LLA-B) ou linfoma linfoblástico de linhagem B (L-BLY) [NCT05480449]. O estudo começou em setembro de 2022 e está planejado para inscrever até 89 pacientes com idades entre 0 e 29 anos com LLA-B ou B-Lly. Relatamos alguns resultados de fabricação do ensaio no manuscrito.
Gostaríamos de ressaltar que, embora o manuscrito seja apresentado como um protocolo com etapas a serem seguidas, ele deve ser considerado um ponto de partida para que outros comecem a otimizar seu próprio processo de fabricação de células CAR-T. Uma lista não abrangente de possíveis variações do protocolo apresentado inclui: uso de células T frescas em vez de criopreservadas como material de partida; usar um método diferente de enriquecimento de células T ou omiti-lo completamente; usando diferentes meios e coquetéis de citocinas, como IL7/IL15 em vez de IL2; variar a concentração de soro AB humano ou omiti-la completamente; temporização da transdução; utilizando transduções "multi-hit"; variação da agitação, dos volumes das culturas e do horário de alimentação; utilizando diferentes métodos de transferência genética, incluindo a eletroporação de ácidos nucleicos ou vetores não lentivirais; utilizar outro tampão de formulação final e/ou crioprotetor; e infundir células CAR-T frescas em vez de criopreservando para infusão em um momento posterior. Essas variações podem ter um impacto significativo na composição celular e potência do produto terapêutico.
| Etapa geral do processo | Dia do Processo | Detalhes Técnicos | |||
| Enriquecimento Celular | Dia 0 | Seleção de células T CD4+/CD8+ | |||
| Ativação Celular | Semeadura e ativação de cultura de células T | ||||
| Transdução de células | Dia 1 | Transdução lentiviral (volume de cultura de 100 mL) | |||
| Expansão Celular (seguida de formulação celular) | Dia 2 | -- | |||
| Dia 3 | Lavagem de Cultura (1 ciclo); Agitador ativado; Volume de cultura aumenta para 200 mL | ||||
| Dia 4 | -- | ||||
| Dia 5 | Ração (50 mL); O volume de cultura atinge o volume final de 250 mL | ||||
| Dia 6 | Amostra em processo; Troca de mídia (-125 mL / +125 mL) | ||||
| Dia 7 | Troca de meios (-150 mL / +150 mL) ou Harvest | ||||
| Dia 8 | Amostra em processo; Troca de meios (-150 mL / +150 mL) ou Harvest | ||||
| Dia 9 | Troca de meios (-180 mL / +180 mL) ou Harvest | ||||
| Dia 10 | Amostra em processo; Troca de meios (-180 mL / +180 mL) ou Harvest | ||||
| Dia 11 | Troca de meios (-180 mL / +180 mL) ou Harvest | ||||
| Dia 12 | Troca de meios (-180 mL / +180 mL) ou Harvest | ||||
| Dia 13 | Colheita | ||||
Tabela 1: Cronograma e visão geral do processo. Esta tabela resume as etapas do processo de TCT empregadas em um ensaio clínico atual [NCT05480449]. O processo inicia-se com o enriquecimento de células T por seleção CD4+/CD8+, semeadura da cultura e ativação no Dia 0, seguido de transdução no Dia 1. As células descansam por 48 h, seguida de lavagem com cultura, aumento do volume de cultura para 200 mL e agitação com mecanismo de agitação. No dia 6, a primeira amostra em processo é coletada. As células são colhidas quando estão disponíveis células suficientes para pelo menos três doses completas de células CAR-T (5 × 10 6 células CAR-T/kg se o paciente tiver <50 kg, caso contrário, 2,5 × 108 células CAR-T) e testes de controle de qualidade (~2 × 106 células CAR-T); ou quando a cultura atinge um total de 4-5 x 109 células. Abreviações: TCT = transdução de células T; CAR-T = células T do receptor de antígeno quimérico; MACS = classificação de células ativadas por magnetismo.
Protocolo
Todas as pesquisas foram realizadas de acordo com as diretrizes institucionais com aprovação pelo Comitê de Ética em Pesquisa (CEP) do hospital, e todos os sujeitos forneceram consentimento informado para publicação dos dados coletados no contexto do estudo.
NOTA: A primeira seção do Protocolo fornece uma visão geral de alto nível do processo de fabricação do CAR-T. As seções restantes fornecem as instruções passo a passo. O protocolo descreve o fluxo de trabalho usando o software TCT versão 1.4, que é a versão atual até o momento em que este artigo foi escrito. A interface do usuário de outras versões do software TCT pode variar.
1. Cronograma e visão geral do processo (Tabela 1)
- Prepare-se para o procedimento em uma segunda-feira (Dia -1) com verificações de comprovação. Certifique-se de que o processador e outros equipamentos estejam funcionando conforme o esperado e que todos os reagentes e consumíveis estejam disponíveis e atualizados durante toda a execução de fabricação.
- No dia 0, instale o conjunto de tubos na máquina. Descongelar previamente as células T criopreservadas em banho seco e conectá-las por soldagem estéril ao conjunto de tubos instalado no instrumento.
NOTA: Este protocolo assume que as células T autólogas foram coletadas via aférese, criopreservadas e armazenadas até o início da fabricação. Embora seja possível usar células T recém-coletadas, isso aumenta a carga logística, pois requer a coordenação da coleta de aférese com a fabricação de células CAR-T. É altamente recomendável usar um processo de descongelamento seco em vez de banho-maria para minimizar o risco de contaminação bacteriana. - Rotular células T com reagentes CD4 e CD8 (ver Tabela de Materiais) e enriquecer por seleção magnética.
Observação : é possível omitir o enriquecimento de células T ou executá-lo antes de carregar células no processador. Ver secção 5 do protocolo. - Após o enriquecimento de células CD4+/CD8+, colher uma amostra para uma contagem celular. Semeando a cultura com 1-2 × 108 células em um volume inicial de 70 mL de meio (ver Tabela de Materiais) suplementado com 5% de soro AB humano e IL2 humana recombinante (25 ng/mL).
- Adicionar um frasco de reagente de ativação (uma nanomatriz polimérica coloidal conjugada a anticorpos anti-CD3 e anti-CD28; ver Tabela de Materiais) para ativar células T e incubar a cultura sem agitação por 24 h a 37 ºC em uma atmosfera de CO2 a 5%. Criopreservar quaisquer células CD4+/CD8+ remanescentes como backup, se desejado.
NOTA: Em caso de falha de fabricação, as células selecionadas CD4+/CD8+ remanescentes podem ser usadas como material de partida. Se a falha for puramente técnica, como contaminação ou erro do operador, e células suficientes permanecerem, então o uso de células remanescentes para realizar uma operação de fabricação adicional pode ser considerado. Se a qualidade das matérias-primas for preocupante, poderá justificar-se um novo procedimento de aférese; no entanto, esta é, em última análise, uma decisão clínica. Em ambos os casos, uma falha de fabricação é um evento significativo que deve ser investigado, e o patrocinador e, possivelmente, os reguladores devem ser informados. - Após 24 h de ativação, transduzir células T com vetor lentiviral em uma multiplicidade apropriada de infecção (MOI).
NOTA: É fundamental determinar o título do vetor lentiviral e estabelecer um MOI apropriado antes de começar a fabricar produtos clínicos. O título do vetor deve ser determinado através da realização de um experimento em pequena escala no qual células T primárias humanas são transduzidas em várias concentrações do vetor. As considerações para o MOI apropriado incluem o custo do vetor, a eficiência de transdução desejada e um número de cópia vetorial aceitável. Este protocolo usa um MOI de 30-50% para minimizar o custo do vetor e manter o número médio de cópias vetoriais abaixo de 8 cópias por célula transduzida. - No dia 3, acione a atividade de Lava Jato e inicie a agitação de baixo nível. Aumentar o volume de cultura para 200 mL.
- No dia 5, adicionar 50 mL de meio de cultura à cultura, aumentando o volume de cultura para 250 mL.
- No dia 6 de cultivo, colher uma amostra da cultura e enumerar as células CAR-T por citometria de fluxo. Use essa medida para estimar a taxa de crescimento da cultura e identificar o momento ideal de colheita.
NOTA: Cada amostragem em processo produz 3 mL para teste e remove 7 mL do volume total de cultura. - Do 7º ao 13º dia, se a cultura não tiver sido encerrada, pegue até duas amostras adicionais em processo em dias alternados e realize trocas diárias de mídia para alimentar a cultura em crescimento. Colher o produto quando a contagem total de células nucleadas (TNC) atingir 5 × 109 e/ou quando estiverem disponíveis células suficientes para o número necessário de doses e testes de liberação.
- No dia da colheita, pegue uma amostra em processo da cultura em crescimento ativo. Use esta amostra para testes de micoplasma, endotoxina, lentivírus competente para replicação (RCL), teste de número de cópia vetorial (VCN), contagem de células, análise de tamanho celular, citometria de fluxo e coloração de grama.
- Iniciar o programa de colheita final, que desencadeia a remoção do meio de cultura e uma lavagem celular com o tampão final da formulação (uma solução cristaloide isotônica estéril suplementada com albumina de soro humano a 4%; ver Tabela de Materiais). Após o término da colheita, a bolsa de células alvo conterá 100 mL do produto celular em tampão final de formulação. Adicionar dimetilsulfóxido (DMSO) a uma concentração de 10% (v/v), alicitar o produto em doses individuais e criopreservar usando um freezer de taxa controlada.
2. Dia -1: Verificações de preparação e comprovação
- Verifique se os níveis de gás CO2 e ar comprimido são suficientes para produzir uma pressão de entrada de pelo menos 20 psi em cada linha.
- Ligue o processador e confirme se não há erros na inicialização. Se necessário, ajuste o relógio para a hora correta. Desligue o processador.
- Certifique-se de que a contagem de células, o volume e a contagem total de CD4+ e CD8+ total do material de partida de células T sejam conhecidos.
- Certifique-se de que há quantidades suficientes do vetor viral, reagentes e consumíveis para toda a produção.
- Coloque um frasco de soro AB humano na geladeira para descongelar durante a noite.
3. Dia 0: Instalação do conjunto de tubos
- Preparar 3 L de tampão de processamento (0,5 % (p/v) de albumina sérica humana (HSA) em tampão fosfato salino / ácido etilenodiaminotetracético (PBS/EDTA)).
- Preparar 2 L de meio de cultura (2 L de meio suplementado com 100 mL de soro AB humano até uma concentração final de 5% e dois frascos de IL2 humana recombinante a 25 μg/frasco; consulte Tabela de Materiais para obter mais informações sobre esses reagentes). Transfira 10 mL de meio de cultura para uma bolsa de 20 mL de reagente e armazene a 4 ºC durante a noite.
- Ligue o instrumento e selecione o Processo de Transdução de Células T (TCT) na interface da tela sensível ao toque. Clique em Executar para iniciar o processo TCT; Deixe o instrumento guiar o usuário através do procedimento usando instruções e prompts na tela.
- Na tela Entrada de parâmetro , insira as iniciais do operador, o número do lote do conjunto de tubos e sua data de expiração quando solicitado.
- A tela Configuração do processo apresenta quatro processos diferentes. Escolha Processo completo (1).
NOTA: Outros processos disponíveis incluem iniciar a partir de células T CD4+/CD8+ selecionadas (ver secção 5 abaixo) e reiniciar uma execução de fabrico anteriormente anulada. - Quando solicitado, escolha dois frascos de reagente de seleção para refletir o método de seleção CD4+/CD8+.
- Instale o conjunto de tubos de acordo com as instruções na tela. Certifique-se de que todas as conexões Luer estejam firmes e que não haja defeitos no conjunto de tubulações.
- Siga as instruções na tela para iniciar os testes automatizados de integridade superior e inferior.
NOTA: Um teste de integridade pode falhar devido a um conjunto de tubos defeituoso, um conjunto de tubos instalado incorretamente ou um defeito na bomba peristáltica da máquina. É altamente recomendável ter pelo menos um conjunto de tubos adicional à mão para as corridas de produção. Também recomendamos que um segundo técnico verifique a instalação correta do conjunto de tubulações. - Siga as instruções na tela para conectar a mídia e processar os sacos de amortecimento.
- Inicie o escorvamento automático do conjunto de tubos.
NOTA: O processo de TCT deve continuar dentro de 3 h após o priming. Certifique-se de que o material de partida da célula T estará pronto.
4. Enriquecimento de células T
- Quando a tela do produto Transferir célula for exibida, comece a descongelar o produto de célula T criopreservado.
NOTA: O volume aceitável de células T que pode ser adicionado ao conjunto de tubos varia de 50 a 280 mL. O número máximo de células-alvo (soma de CD4+ e CD8+) é de 3 × 109, e a contagem máxima de TNC é de 2 × 1010. - Transfira as células descongeladas para uma bolsa de transferência de 150 mL. Solda estéril o saco de transferência para o saco de aplicação do conjunto de tubos.
- Remova uma amostra do saco de aplicação usando a bolsa QC e execute uma contagem de células.
- Conecte os frascos para injetáveis de reagente CD4 e CD8.
- Inicie o processo de seleção (enriquecimento de células T).
- Após o enriquecimento, remova uma amostra das células CD4+/CD8+ selecionadas da bolsa QC da bolsa de reaplicação para contagem de células, citometria de fluxo e análise do tamanho celular.
Observação : o resultado da contagem de células é necessário para prosseguir para a próxima etapa.
5. Alternativa: Começando com células CD4+/CD8+ selecionadas
- Prepare o meio conforme descrito na etapa 3.2. Nenhum buffer de processamento é necessário.
- Ligue o processador e selecione Cultivo de células T com instalação TS (3) na tela Configuração do processo . Siga as instruções e os prompts na tela.
- Seguindo as instruções na tela, prima o conjunto de tubos com o meio em vez do buffer de processamento.
- Quando a tela "Preparar produto celular de cultivo-Conectar" for exibida, comece a descongelar as células T CD4+/CD8+ selecionadas.
NOTA: O número mínimo de células T (soma das células T CD4+ e CD8+) para o processo é de 1,0 × 108. - Transfira as células para uma bolsa de transferência de 150 mL e dilua com meio para um volume final de 50 mL.
- Solda estéril da suspensão da célula ao saco de reaplicação do instrumento.
- Remova uma amostra das células CD4+/CD8+ selecionadas da bolsa de CQ da bolsa de reaplicação para contagem de células e análise do tamanho das células.
6. Configuração da cultura e programação da Matriz de Atividades
- Digite a concentração celular e o número inicial desejado (1-2 × 108 células T).
NOTA: O instrumento bombeará automaticamente o volume apropriado da bolsa de reaplicação para a câmara de cultura e ajustará o volume final para 70 mL. - Conecte um frasco para injetáveis do reagente de ativação de acordo com as instruções na tela.
- Indicar 5% para a concentração de CO2 e 39 °C para a temperatura da câmara de cultura.
NOTA: O fabricante recomenda introduzir 39 °C ou um valor especificamente calibrado para o instrumento. - Configure a Matriz de Atividades. Use o protocolo de alimentação avançada como ponto de partida e modifique etapas individuais dentro do protocolo de acordo com as especificações definidas pelo usuário (Figura 2).
- Certifique-se de que o tempo de atividade de transdução seja de 24 h após a semeadura (Dia 1).
- Certifique-se de que o tempo de atividade de Lava Cultura seja de 48 h após a Transdução (Dia 3).
- Defina o tempo de Activate Shaker (shaker tipo 2) para 30 min após o início da Lavagem Cultural.
- Exclua todas as atividades de Troca de Sacos Médios e Troca de Sacos de Lixo .
- Toque em ok na tela para iniciar o cultivo.
- Criopreservar todas as células selecionadas CD4+/CD8+ remanescentes na bolsa de aplicação para uso futuro, se necessário.
7. Dia 1: Transdução de células T
- Calcule o volume do vetor lentiviral a ser usado com base no MOI desejado.
- Recuperar a bolsa reagente de 20 mL contendo 10 mL de meio de cultura que foi armazenada a 4 ºC durante a noite (passo 3.2). Descongelar o frasco para injetáveis vector e transferir o volume calculado em 7,1 para o saco de reagente de 20 ml.
NOTA: Recomendamos o congelamento de qualquer vetor remanescente para retenção ou para pesquisa e desenvolvimento. - Modifique a matriz de atividade para definir o tempo de transdução para 2 min no futuro. Quando solicitado, toque em ok para iniciar a atividade Transdução.
- Solda estéril o saco vetorial ao conjunto de tubos seguindo as instruções na tela.
- Modifique a matriz de atividades com base na hora real em que a atividade de transdução foi iniciada.
NOTA: Sugerimos iniciar a transdução dentro de 20-24 h após a semeadura para garantir que as atividades práticas sejam realizadas durante o horário normal de trabalho.- Certifique-se de que o tempo de Lavagem da Cultura seja de 48 h após a Transdução (Dia 3).
- Defina o tempo de Activate Shaker (shaker tipo 2) para 30 min após a Lavagem da Cultura (Dia 3).
- Certifique-se de que o horário da Troca de Mídia seja na tarde (13h) do dia 6.
8. Dia 6: Primeira amostra em processo
- Toque no botão Amostra e siga as instruções na tela para obter uma amostra de CQ da cultura ativa.
- Realizar contagem de células, citometria de fluxo e análises de tamanho celular. Enviar 1 mL da amostra para uma coloração de Gram.
NOTA: As contagens de células devem ser repetidas aproximadamente a cada dois dias para monitorar o crescimento da cultura. - Preparar mais 2 L de meio de cultura (ver passo 3.2).
- Adicione uma atividade de troca de saco médio à matriz de atividades, programada para iniciar 2 minutos no futuro. Ajuste a atividade do Media Exchange para iniciar 20 minutos no futuro. Siga as instruções na tela.
NOTA: Media Exchange é a substituição do meio de cultura na câmara de cultivo. Troca de saco médio é a substituição da bolsa de meio de cultura pendurada no instrumento.
9. Dia da colheita (do 7º ao 13º dia): Colheita e criopreservação
- Toque no botão Amostra e siga as instruções na tela para obter uma amostra de CQ da cultura ativa.
- Separe a amostra de CQ em três alíquotas de 1 mL cada. Use 1 mL para citometria de fluxo, contagem de células e análises de tamanho celular. Use 1 mL para micoplasma, número de cópia vetorial, lentivírus competente em replicação e teste de endotoxinas. Enviar o 1 mL final para coloração de Gram.
- Preparar o tampão final da formulação (uma solução cristaloide isotónica estéril suplementada com HSA a 4 % num saco de 2 L, ver Tabela de Materiais). Conservar 100 ml deste tampão para preparar a solução crioprotetora numa fase posterior.
- Modifique a Matriz de Atividades para definir o tempo de Fim da Cultura para 2 min no futuro e exclua todas as outras atividades restantes. Siga as instruções na tela para anexar o tampão de formulação final ao conjunto de tubos e iniciar a colheita.
NOTA: O processador transferirá automaticamente as células para o saco da célula de destino. O volume será de 100 mL. - Pegue uma amostra de 0,5 mL da bolsa QC da bolsa de célula alvo e realize uma contagem de células.
- Sele o saco da célula alvo e remova-o do conjunto de tubos. Divida o produto CAR-T em doses adequadas e criopreservado-o em freezer de taxa controlada. Armazenar células na fase vapor do tanque de armazenamento de nitrogênio líquido a ≤ -150 ºC.
OBS: A formulação final e a alíquota das doses são específicas do protocolo. Apresentamos aqui um exemplo em que três doses iguais de células CAR-T e frascos de QC são criopreservados. Consulte a seção 10 para obter detalhes. - Baixe os dados do processo do instrumento, remova e descarte o conjunto de tubulação e execute um desligamento.
10. Criopreservação de células CAR-T
NOTA: Este protocolo assume que as células CAR-T são criopreservadas após a fabricação e armazenadas até que o paciente esteja pronto para infusão. Embora seja possível infundir células CAR-T recém-fabricadas, isso aumenta a carga logística, pois requer a coordenação da fabricação de células CAR-T com a infusão de células CAR-T. Isso pode ser problemático em caso de falha de fabricação. Especialmente se o protocolo clínico exigir quimioterapia linfodepletante antes da infusão de CAR-T, sugerimos fortemente a criopreservação, pois uma falha de fabricação pode expor o paciente ao risco de quimioterapia desnecessária. Os reguladores podem exigir que os investigadores demonstrem que o produto passa em todos os testes de liberação antes da infusão, o que pode ser difícil de alcançar sem criopreservação.
- A partir dos 100 mL finais do produto colhido, determine e remova o volume necessário para atender às doses desejadas de CAR-T e frascos de controle de qualidade (QC) para realizar testes adicionais de liberação (por exemplo, viabilidade), retenção e uma amostra de esterilidade.
NOTA: É fundamental desenvolver uma estratégia totalmente definida para aliquotar o produto final. Sugerimos a fabricação de múltiplas doses do produto para permitir reinfusões, desde que haja material suficiente disponível. Um volume de produto de 10-20 mL em um saco permite o descongelamento rápido e fácil infusão por empurrão de seringa. Recomenda-se encher cada produto com a dose desejada de células CAR-T (por exemplo, 5 × 106 células CAR-T por kg ou 2,5 × 108 células CAR-T), pois isso evitará a necessidade de cálculos de dose no dia da infusão. Também são recomendados a criopreservação de pelo menos quatro frascos de CQ e a possibilidade de haver sobra de material; Sugerimos salvar este material, pois ele pode ser útil para fins de pesquisa e desenvolvimento. - Centrifugar as células para reduzir o volume.
- Elevar o(s) produto(s) até metade do volume final desejado utilizando a porção de tampão de formulação final reservada na etapa 9.3.
- Prepare 2x crioprotetor criando uma solução de DMSO a 20% no tampão de formulação final.
NOTA: A formulação crioprotetora e a concentração de DMSO podem ser modificadas. - Adicionar 2x crioprotetor às células em volume igual para uma concentração final de DMSO de 10%.
NOTA: A duração da exposição do produto ao crioprotetor deve ser minimizada. - Encha os sacos dosposológicos e os frascos para injetáveis QC. Enviar 1 mL para esterilidade.
NOTA: Os reguladores geralmente exigem um ensaio de esterilidade de 14 dias realizado no produto final. No entanto, ensaios rápidos de esterilidade estão surgindo; Neste momento, o método Compendial de 14 dias é o mais comum. - Produtos criopreservados utilizando freezer de taxa controlada.
NOTA: O programa de congelamento de taxa controlada deve ser validado para produzir uma taxa de resfriamento de ~ -1 ºC/min a ~ -45 ºC, com compensação para o ponto eutético. - Conservar o produto na fase de vapor de um congelador ultrabaixo de azoto líquido a ≤ -150 °C.
11. Exame da execução do procedimento
NOTA: Ao longo do processo de TCT, várias amostras de CQ são retiradas da cultura ativa. A Tabela 2 fornece uma grade que pode ajudar o leitor a organizar os resultados para referência e calcular métricas de desempenho do procedimento. Os termos abaixo, que consistem em uma letra e um número (por exemplo, "B4") referem-se a células na grade desta tabela. Os seguintes valores são utilizados nos cálculos de desempenho: B3 = pré-enriquecimento de células nucleadas totais (TNC); B4 = TNC pós-enriquecimento; E2 = Soma das células T CD4+ e CD8+ em porcentagem do total de células do produto aférese inicial; E4 = Soma das células T CD4+ e CD8+ em porcentagem do total de células pós-enriquecimento; G2 = células CD19+ em porcentagem do total de células do produto inicial; G4 = células CD19+ em porcentagem do total de células após o enriquecimento de CD4+/CD8+; B10 = TNC da Cultura Ativa no dia da colheita.
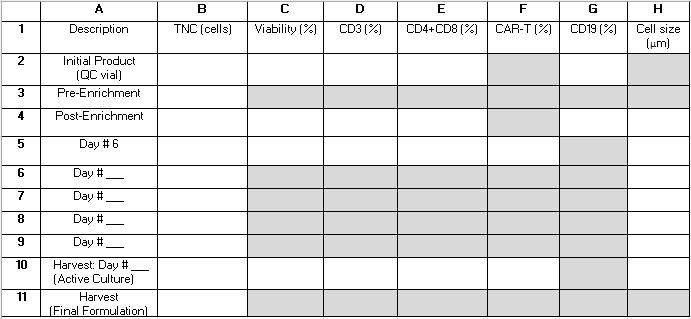
Tabela 2: Grade de desempenho do procedimento. Fornecemos essa grade para ajudar a organizar os testes em processo necessários para calcular as estatísticas de desempenho do procedimento. As linhas representam amostras analisadas em vários momentos durante o procedimento e são rotuladas com números de 1 a 11. As linhas 6-9 podem ser usadas para capturar resultados de amostras colhidas após o dia 6 de cultivo, mas antes do dia de colheita. As colunas representam os parâmetros medidos e são rotuladas com letras A-H. Os campos que são sombreados cinza não se aplicam. Alguns campos adicionais podem não se aplicar dependendo se o enriquecimento de CD4+/CD8+ é realizado como parte do procedimento e da duração do cultivo. Sugerimos escrever "N/A" nesses campos. Abreviações: TNC = contagem total de células nucleadas; CQ = controle de qualidade. Clique aqui para baixar esta tabela.
- Calcular a recuperação de células T CD4+/CD8+ após a seleção dividindo o número total de células T CD4+ mais CD8+ pós-enriquecimento pelo número total de células T CD4+ mais CD8+ antes do enriquecimento usando a equação (1).
Recuperação de células T CD4+/CD8+ =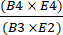 (1)
(1) - Calcular a depleção de células CD19+ após o enriquecimento dividindo o número total de células CD19+ pós-enriquecimento CD4+/CD8+ pelo número total de células CD19+ antes do enriquecimento. Como se espera que esse número seja muito pequeno, relate o logaritmo dessa fração, conforme mostrado na equação (2):
Log de depleção de células CD19 = log10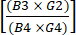 (2)
(2) - Calcular o crescimento total da dobra dividindo o número total de células em cultura ativa na colheita pelo número de células semeadas usando a equação (3):
Crescimento total da dobra =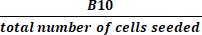 (3)
(3) - Calcule o crescimento médio diário tomando a raiz do crescimento total da dobra em relação ao dia da colheita usando a equação (4):
Crescimento médio diário = dia de colheita √ (crescimento total da dobra) (4)
Resultados
Os resultados das três primeiras séries de fabricação do CAR-T do ensaio NCT05480449 são apresentados a seguir na Tabela 3. O material de partida, o vetor, as citocinas de cultura e as concentrações séricas de AB foram mantidos consistentes para cada corrida. Os produtos foram colhidos no 7º ou 8º dia. O crescimento celular médio diário foi de 46% (aumento na contagem total de células), indicando que o processo de TCT foi efetivo em promover a expansão celular. Estes resultados sugerem que ...
Discussão
A terapia com células CAR-T tem emergido como uma abordagem de tratamento promissora para células B e outras neoplasias. No entanto, os métodos tradicionais de fabricação de células CAR-T têm várias limitações, como alto custo, produção intensiva em mão-de-obra e etapas abertas que aumentam o risco de contaminação. Recentemente, várias plataformas semi-automatizadas, incluindo o Miltenyi CliniMACS Prodigy (o "processador"), surgiram para resolver essas limitações. O processo de transdução de células ...
Divulgações
S.K., S.G. e Y.W. receberam apoio de pesquisa da Miltenyi Biotec.
Agradecimentos
Os autores gostariam de agradecer as contribuições de vários indivíduos e organizações para este trabalho. O Laboratório de Terapia Celular e Gênica e o Laboratório de Estudos Translacionais e Correlativos da Penn forneceram assistência valiosa com o desenvolvimento de processos e preparação para submissões de IND. Melissa Varghese e Amanda DiNofia contribuíram para o processo de desenvolvimento e preparação para as submissões de IND que fundamentam este manuscrito. Este trabalho foi apoiado por uma Bolsa de Aceleração da Terapia Celular e Gênica Colaborativa do Hospital Infantil da Filadélfia. Os autores também gostariam de agradecer à Miltenyi Biotec por seu apoio técnico e de pesquisa. A Figura 1 é coberta pelos direitos autorais © 2023 Miltenyi Biotec B.V. & Co. Todos os direitos reservados.
Materiais
| Name | Company | Catalog Number | Comments |
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
Referências
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados