このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
自動セルプロセッサーでのキメラ抗原受容体T細胞製造
要約
本稿では、臨床用のキメラ抗原受容体T細胞の製造プロセス、特にT細胞のウイルス形質導入および培養を行うことができる自動細胞プロセッサーの使用について詳述する。私たちは、初期段階の臨床試験のプロセス開発と実施中に考慮すべき推奨事項を提供し、落とし穴について説明します。
要約
キメラ抗原受容体(CAR)-T細胞は、さまざまな悪性および非悪性疾患の治療のための有望な免疫療法アプローチです。CAR-T細胞は遺伝子組み換えT細胞で、細胞表面の標的を認識して結合するキメラタンパク質を発現し、標的細胞を死滅させます。従来のCAR-T細胞の製造方法は、労働集約的で高価であり、汚染のリスクを伴う可能性があります。自動化された細胞プロセッサーであるCliniMACS Prodigyは、クローズドシステムで臨床スケールで細胞治療製品を製造することを可能にし、汚染のリスクを最小限に抑えます。処理はコンピュータの制御下で半自動的に行われるため、プロセスへの人間の関与が最小限に抑えられ、時間を節約し、ばらつきやエラーを減らします。
この原稿とビデオでは、このプロセッサーを使用してCAR-T細胞を製造するためのT細胞形質導入(TCT)プロセスについて説明します。TCTプロセスには、CD4+/CD8+ T細胞の濃縮、活性化、ウイルスベクターによる形質導入、増殖、および回収が含まれます。これらのステップの順序付けとタイミングを可能にする機能であるアクティビティマトリクスを使用して、TCTプロセスを広範囲にカスタマイズすることができます。現行の適正製造基準(cGMP)に準拠したCAR-T細胞製造のウォークスルーを提供し、治験薬(IND)申請をサポートするために必要なリリーステストと前臨床試験について説明します。臨床CAR-T細胞製造に半自動プロセスを使用することの実現可能性を実証し、長所と短所について説明します。最後に、小児B細胞悪性腫瘍を標的とする現在進行中の医師主導治験[NCT05480449]を、この製造プロセスを臨床現場でどのように適用できるかの例として説明します。
概要
キメラ抗原受容体(CAR)を発現するように操作されたT細胞の養子移植は、難治性B細胞悪性腫瘍患者の治療において顕著な有効性を示しています1,2,3,4,5。しかし、CAR-T細胞の従来の製造方法は、労働集約的で時間がかかり、高度に専門的な手順を実行するために高度な訓練を受けた技術者を必要とします。例えば、自家CAR-T細胞製剤の従来の製造プロセスでは、密度勾配遠心分離、水簸または磁気分離によるT細胞の濃縮、活性化、滅菌フラスコ内のウイルスベクターによる形質導入、回収および製剤化前のバイオリアクターでの増殖が含まれます。最近では、このプロセスを部分的に自動化することを目的としたさまざまなシステムが登場しています。例えば、Miltenyi CliniMACS Prodigy(以下、「プロセッサ」と呼ぶ)は、これらのステップの多くを自動化された方法で実行できる自動細胞処理デバイスである6,7,8,9。従来のCAR-T製造方法と自動化されたCAR-T製造方法の詳細な議論は、最近のレビュー記事10で紹介されています。
このプロセッサは、造血前駆細胞の処理用に米国食品医薬品局(FDA)が承認した医療機器であるCliniMACS Plusの機能に基づいて構築されています。プロセッサは、細胞の自動洗浄、分画、および培養を可能にする細胞培養ユニットを備えています(図1)。T細胞形質導入(TCT)プロセスは、手作業によるCAR-T細胞製造をほぼ再現するプロセッサデバイス内のプリセットプログラムです。TCTでは、グラフィカル・ユーザー・インターフェースを使用してカスタマイズ可能なセル処理が可能です(「アクティビティ・マトリックス」、 図2)。プロセッサは多くのステップを自動化し、複数のデバイスの機能を1台のマシンに統合するため、技術者によるトレーニングや専門的なトラブルシューティングスキルが少なくて済みます。すべてのステップは密閉されたシングルユースのチューブセット内で実行されるため、プロセッサは、オープンな製造プロセスで許容できると見なされるよりも厳格でない空気処理インフラストラクチャを備えた施設で操作できます。たとえば、ISOクラス8(EUグレードCに相当)として認定された施設でプロセッサを運用しています。
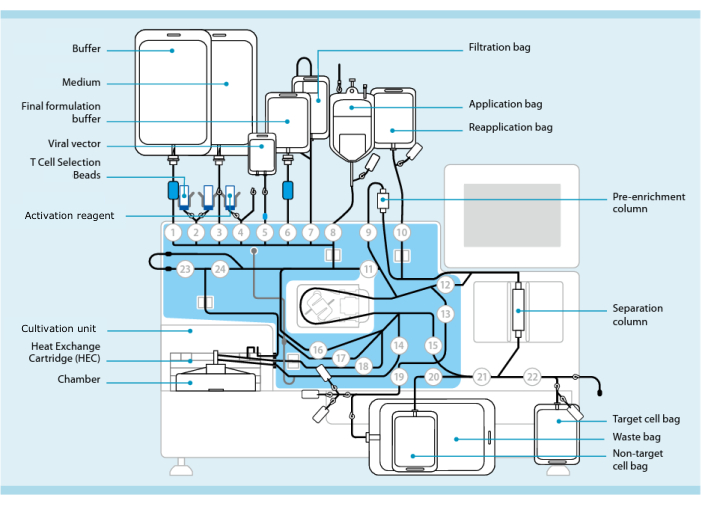
図1:T細胞形質導入システムを用いたCAR-T細胞の作製。 図は、チューブセットを取り付けたCPUです。チューブセットにより、処理バッファー、培地、レンチウイルスベクターを含むバッグなどの他のコンポーネントを滅菌溶接で接続できます。白血球アフェレーシス産物をアプリケーションバッグに加えると、T細胞選択ビーズで標識し、分離カラムに通してから、再アプリケーションバッグに移すことができます。次に、選択した細胞を培養用の機器の培養ユニットに向け、活性化試薬で活性化します( 材料表を参照)。最終産物はターゲットセルバッグに集められます。プロセス全体を通して、品質管理のためにサンプルを無菌的に除去することが可能です。円の内側の灰色の数字は、チューブセットに液体経路を通すプロセッサ上の番号付きバルブを表します。 11より許可を得て転載。この図の拡大版をご覧になるには、ここをクリックしてください。
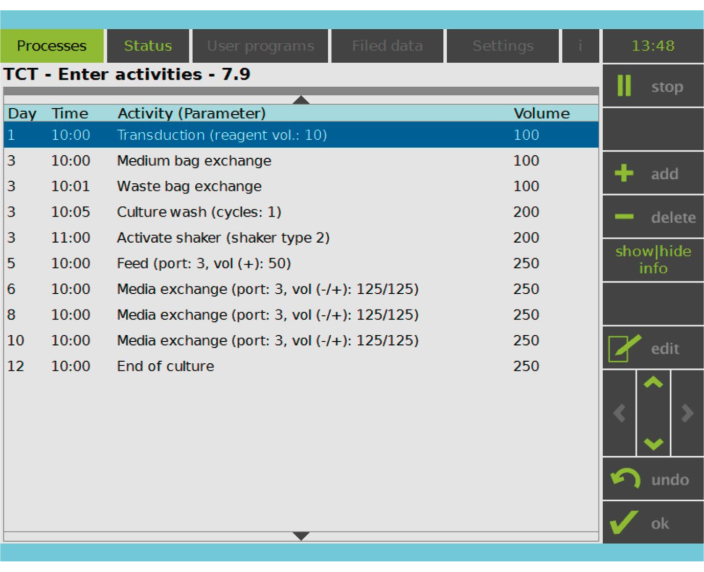
図2:アクティビティマトリクス T細胞の選択と活性化の後、CAR-T細胞製造プロセスの残りの部分は完全にカスタマイズ可能です。アクティビティの追加や削除、適切な日時のスケジュール設定が可能で、アクティビティ後の培養量(Volume)を指定できます。例えば、形質導入活性は、1日目の午前10:00に開始するように構成され、活性終了時の培養量は100mLとして設定されました。アクティビティマトリクスは、栽培期間中に編集することができます。プロセスの状態は、処理装置の統合画面で監視できます。 この図の拡大版をご覧になるには、ここをクリックしてください。
この原稿の目的は、プロセッサーを使用したCAR-T細胞の製造の詳細なウォークスルーを提供し、さらに、規制当局が治験薬(IND)申請を承認するために必要とする可能性のある工程内および製品リリース試験に関するガイダンスを提供することです。提示されたプロトコルは、ベンダーが推奨するアプローチに近いものであり、現在、単一施設の医師主導の第I/II相臨床試験で評価されているIND 28617の基礎となるプロトコルです。この試験は、このプロセッサを使用して、B細胞性急性リンパ芽球性白血病(B-ALL)またはB系統リンパ芽球性リンパ腫(B-Lly)の患者に対するヒト化CD19指向自家CAR-T細胞を製造することの安全性と有効性を判断することを目的としています[NCT05480449]。この試験は2022年9月に開始され、0歳から29歳のB-ALLまたはB-Llyの患者さん89人までを登録する予定です。試験の結果を原稿で報告します。
この原稿は、従うべき手順を含むプロトコルとして提示されていますが、他の人が独自のCAR-T細胞製造プロセスの最適化を開始するための出発点と見なされるべきであることを指摘したいと思います。提示されたプロトコルの可能なバリエーションの非包括的なリストには、次のものが含まれます:凍結保存されたT細胞の代わりに新鮮なT細胞を出発物質として使用する。T細胞濃縮の異なる方法を使用するか、またはそれを完全に省略する。IL2の代わりにIL7 / IL15などの異なる培地およびサイトカインカクテルを使用する。ヒトAB血清の濃度を変化させるか、またはそれを完全に省略する。形質導入のタイミング「マルチヒット」形質導入を使用する。さまざまな攪拌、培養量、および給餌スケジュール。核酸または非レンチウイルスベクターのエレクトロポレーションを含むさまざまな遺伝子導入方法を使用する。異なる最終製剤緩衝液および/または凍結保護剤を使用する。CAR-T細胞を凍結保存する代わりに、後で注入するために新鮮に注入します。これらの変動は、治療薬の細胞組成および効力に重大な影響を与える可能性がある。
| プロセス全体のステップ | プロセス日 | 製品仕様 | |||
| 細胞エンリッチメント | 0日目 | CD4+/CD8+ T細胞の選択 | |||
| 細胞の活性化 | T細胞培養の播種と活性化 | ||||
| 細胞形質導入 | 1日目 | レンチウイルス形質導入(培養量100 mL) | |||
| 細胞増殖(細胞の合成) | 2日目 | -- | |||
| 3日目 | 培養洗浄(1サイクル);シェーカーが作動しました。培養容量が200 mLに増加 | ||||
| 4日目 | -- | ||||
| 5日目 | フィード(50 mL);培養量が最終容量250 mLに達する | ||||
| 6日目 | インプロセスサンプル;培地交換 (-125 mL / +125 mL) | ||||
| 7日目 | 培地交換(-150 mL / +150 mL)またはハーベスト | ||||
| 8日目 | インプロセスサンプル;培地交換(-150 mL / +150 mL)またはハーベスト | ||||
| 9日目 | 培地交換(-180 mL / +180 mL)またはハーベスト | ||||
| 10日目 | インプロセスサンプル;培地交換(-180 mL / +180 mL)またはハーベスト | ||||
| 11日目 | 培地交換(-180 mL / +180 mL)またはハーベスト | ||||
| 12日目 | 培地交換(-180 mL / +180 mL)またはハーベスト | ||||
| 13日目 | 収穫 | ||||
表1:プロセスのタイムラインと概要。この表は、現在の臨床試験で採用されているTCTプロセスステップをまとめたものである[NCT05480449]。このプロセスは、CD4+/CD8+の選択、培養播種、および0日目の活性化によるT細胞濃縮から始まり、1日目に形質導入が続きます。細胞を48時間休ませた後、培養洗浄、培養容量を200mLに増やし、振とう機構を用いて撹拌します。6日目に、最初の工程内サンプルが採取されます。細胞は、少なくとも 3 回の全用量の CAR-T 細胞 (患者が < 50 kg の場合は 5 × 106 CAR-T 細胞/kg、それ以外の場合は 2.5 × 10 8 CAR-T 細胞) および品質管理試験 (~2 × 10 6 CAR-T 細胞) に十分な細胞が利用可能になったら回収します。または、培養物が合計4〜5 x 109細胞に達したら。略語:TCT = T細胞形質導入;CAR-T = キメラ抗原受容体T細胞;MACS = 磁気活性化セルソーティング。
プロトコル
すべての研究は、病院の治験審査委員会(IRB)の承認を得て、施設のガイドラインに準拠して実施され、すべての被験者は、試験のコンテキスト内で収集されたデータの公開についてインフォームドコンセントを提供しています。
注:プロトコルの最初のセクションでは、CAR-T製造プロセスの概要を説明します。残りのセクションでは、手順を追って説明します。このプロトコルでは、TCTソフトウェアバージョン1.4(この記事の執筆時点での現在のバージョン)を使用してワークフローを記述しています。TCTソフトウェアの他のバージョンのユーザーインターフェイスは異なる場合があります。
1. プロセスのタイムラインと概要(表1)
- 月曜日(-1日目)にプリフライトチェックで手順の準備をします。プロセッサーとその他の機器が期待どおりに稼働していること、およびすべての試薬と消耗品が製造工程全体にわたって利用可能で最新であることを確認してください。
- 0日目に、チューブセットを機械に取り付けます。凍結保存したT細胞をドライバスで融解し、滅菌溶接により装置に取り付けられたチューブセットに接続します。
注:このプロトコルは、自家T細胞がアフェレーシスによって収集され、凍結保存され、製造開始まで保存されたことを前提としています。新たに採取したT細胞を使用することは可能ですが、アフェレーシスの採取とCAR-T細胞の製造を調整する必要があるため、物流上の負担が増大します。細菌汚染のリスクを最小限に抑えるために、ウォーターバスの代わりに乾式解凍プロセスを使用することを強くお勧めします。 - CD4およびCD8試薬( 材料表を参照)でT細胞を標識し、磁気選択によって濃縮します。
注:T細胞の濃縮を省略したり、細胞をプロセッサにロードする前に実行したりすることができます。議定書のセクション5を参照してください。 - CD4+/CD8+細胞を濃縮した後、細胞カウント用のサンプルを採取します。5%ヒトAB血清および組換えヒトIL2(25 ng/mL)を添加した培地70 mLの初期容量(材料表を参照)に1〜×2〜108個の細胞を培養物に播種します。
- 活性化試薬(抗CD3抗体および抗CD28抗体に結合したコロイド状ポリマーナノマトリックス、 材料表を参照)のバイアルを添加してT細胞を活性化し、5%CO2 雰囲気中で37°Cで24時間撹拌せずに培養液をインキュベートします。必要に応じて、残ったCD4+/CD8+細胞をバックアップとして凍結保存します。
注:製造に失敗した場合、残ったCD4+/CD8+選択した細胞を出発物質として使用できます。故障が汚染やオペレーターのミスなど、純粋に技術的なものであり、十分なセルが残っている場合は、残ったセルを使用して追加の製造実行を実行することを検討できます。出発物質の品質が懸念される場合は、新しいアフェレーシス手順が正当化される可能性があります。ただし、これは最終的には臨床上の決定です。いずれの場合も、製造上の欠陥は調査すべき重大な事象であり、スポンサーと場合によっては規制当局に通知する必要があります。 - 活性化の24時間後、レンチウイルスベクターで適切な感染多重度(MOI)でT細胞を形質導入します。
注:臨床製品の製造を開始する前に、レンチウイルスベクター力価を決定し、適切なMOIを確立することが重要です。ベクター力価は、ヒト初代T細胞をさまざまな濃度のベクターで形質導入する小規模な実験を行うことによって決定する必要があります。適切なMOIに関する考慮事項には、ベクターのコスト、所望の形質導入効率、および許容可能なベクターコピー数が含まれます。このプロトコルは、30〜50%のMOIを使用して、ベクターのコストを最小限に抑え、形質導入された細胞あたり平均ベクターコピー数を8コピー未満に保ちます。 - 3日目に、Culture Washアクティビティをトリガーし、低レベルの撹拌を開始します。培養液を200mLに増やします。
- 5日目に、培養液に培地50mLを加え、培養液量を250mLに増やします。
- 培養6日目に、培養物からサンプルを採取し、フローサイトメトリーによりCAR-T細胞を列挙します。この測定値を使用して、培養物の成長速度を推定し、最適な収穫時期を特定します。
注:各インプロセスサンプリングでは、試験用に 3 mL が得られ、合計 7 mL の培養量が除去されます。 - 7日目から13日目まで、培養が終了していない場合は、隔日で最大2つの追加のプロセス内サンプルを採取し、毎日培地交換を行って、成長する培養物に餌を与えます。総有核細胞(TNC)数が5×10、9 に達したとき、および/または必要な投与回数と放出試験に十分な細胞が利用可能になったときに製品を回収します。
- 収穫の日に、活発に成長している培養物から仕掛品サンプルを採取します。このサンプルは、マイコプラズマ、エンドトキシン、複製コンピテントレンチウイルス(RCL)検査、ベクターコピー数(VCN)検査、細胞数、細胞サイズ分析、フローサイトメトリー、グラム染色にご使用ください。
- 最終回収プログラムを開始し、培地の除去と最終製剤バッファー(4%ヒト血清アルブミンを添加した滅菌等張晶質液、 材料表を参照)による細胞洗浄を開始します。回収が完了すると、標的細胞バッグは100 mLの細胞産物を最終製剤バッファーに保持します。ジメチルスルホキシド(DMSO)を10%(v/v)の濃度に添加し、製品を個々の用量に分注し、制御された速度の冷凍庫を使用して凍結保存します。
2. -1日目:準備と飛行前のチェック
- CO2ガスレベルと圧縮空気が、各ラインで少なくとも20psiの入口圧力を生成するのに十分であることを確認します。
- プロセッサの電源を入れ、起動時にエラーがないことを確認します。必要に応じて、時計を正しい時刻に設定します。プロセッサをシャットダウンします。
- T細胞出発物質の細胞数、体積、総CD4+および総CD8+数がわかっていることを確認します。
- 製造工程全体に対して十分な量のウイルスベクター、試薬、消耗品があることを確認してください。
- ヒトAB血清のボトルを冷蔵庫に入れて一晩解凍します。
3. 0日目:チューブセットの取り付け
- 3 Lの処理バッファー(リン酸緩衝生理食塩水/エチレンジアミン四酢酸(PBS/EDTA)バッファー中の0.5%(w/v)ヒト血清アルブミン(HSA)))を調製します。
- 2 Lの培地(2 Lの培地に100 mLのヒトAB血清を最終濃度5%まで添加し、25 μg/バイアルの組換えヒトIL2のバイアル2を添加したもの)を調製します。10 mLの培地を20 mLの試薬バッグに移し、4°Cで一晩保存します。
- 装置の電源を入れ、タッチスクリーンインターフェースから T細胞形質導入プロセス (TCT)を選択します。[ 実行 ]をクリックして、TCTプロセスを開始します。機器は、画面上の指示とプロンプトを使用して、手順をユーザーに案内します。
- [パラメータ入力]画面で、入力を求められたら、オペレータのイニシャル、チューブ セットのロット番号、および使用期限を入力します。
- 「プロセス設定」画面には、4 つの異なるプロセスが表示されます。 [フルプロセス] (1) を選択します。
注:その他の利用可能なプロセスには、CD4+/CD8+選択されたT細胞(以下のセクション5を参照)から開始し、以前に中止した製造実行を再開することが含まれます。 - プロンプトが表示されたら、CD4+/CD8+の選択方法を反映する選択試薬の バイアルを2つ 選択します。
- 画面の指示に従ってチューブセットを取り付けます。すべてのルアー接続がしっかり締まっており、チューブセットに欠陥がないことを確認してください。
- 画面の指示に従って、自動上下の整合性テストを開始します。
注意: 完全性テストは、チューブセットの不良、チューブセットの不適切な取り付け、または機械の蠕動ポンプの欠陥が原因で失敗する可能性があります。生産のために、少なくとも1つの追加チューブセットを手元に置いておくことを強くお勧めします。また、2人目の技術者にチューブセットの正しい取り付けを確認することをお勧めします。 - 画面の指示に従って、培地の取り付けとバッファーバッグの処理を行います。
- チューブセットの自動プライミングを開始します。
注意: TCTプロセスは、プライミング後3時間以内に続行する必要があります。T細胞の出発物質の準備が整っていることを確認します。
4. T細胞の濃縮
- Transfer cell product画面が表示されたら、凍結保存されたT細胞産物の融解を開始します。
注:チューブセットに添加できるT細胞の許容量は、50〜280 mLの範囲です。標的細胞(CD4+とCD8+の合計)細胞の最大数は3×109であり、最大TNC数は2×1010である。 - 融解した細胞を150 mLのトランスファーバッグに移します。トランスファーバッグをチューブセットのアプリケーションバッグに滅菌溶接します。
- QCパウチを使用してアプリケーションバッグからサンプルを取り出し、細胞カウントを行います。
- CD4およびCD8試薬バイアルを接続します。
- 選択(T細胞濃縮)プロセスを開始します。
- 濃縮後、細胞数、フローサイトメトリー、および細胞サイズ解析のために、再アプリケーションバッグのQCパウチからCD4+/CD8+選択した細胞のサンプルを取り出します。
注:次のステップに進むには、セルカウントの結果が必要です。
5.代替案:CD4 + / CD8 +選択細胞から開始
- ステップ3.2の説明に従って培地を準備します。処理バッファは必要ありません。
- プロセッサーの電源を入れ、Process Setup 画面で T cell Culture with TS installation (3) を選択します。画面の指示とプロンプトに従います。
- 画面の指示に従って、チューブセットをプロセッシングバッファーの代わりに培地でプライミングします。
- 「培養-細胞産物の調製」画面が表示されたら、CD4+/CD8+選択したT細胞の融解を開始します。
注:プロセスのT細胞(CD4 +とCD8 + T細胞の合計)の最小数は1.0×108です。 - 細胞を150 mLのトランスファーバッグに移し、培地で最終容量50 mLになるまで希釈します。
- 細胞懸濁液を装置の再塗布バッグに滅菌溶接します。
- CD4+/CD8+で選択した細胞のサンプルをReapplicationバッグのQCポーチから取り出し、細胞数と細胞サイズを分析します。
6. アクティビティマトリクスの培養設定とプログラミング
- 細胞濃度と希望の開始数(1-2×108 T細胞)を入力します。
注:装置は、再塗布バッグから培養チャンバーに適切な容量を自動的にポンプで送り込み、最終容量を70 mLに調整します。 - 画面の指示に従って活性化試薬のバイアルを取り付けます。
- CO2濃度は5%、培養チャンバー温度は39°Cです。
注意: メーカーは、39°Cまたは機器用に特別に校正された値を入力することを推奨しています。 - アクティビティマトリクスを設定します。拡張給餌プロトコルを出発点として使用し、プロトコル内の個々のステップをユーザー定義の仕様に変更します(図2)。
- 形質導入活動の時間は、播種後24時間(1日目)であることを確認してください。
- 培養洗浄活性の時間が形質導入後48時間(3日目)であることを確認してください。
- シェー カー(シェーカー タイプ2)のアクティブ化の時間を、培養洗浄の開始後30分に設定します。
- [中袋交換]と[ごみ袋交換]アクティビティをすべて削除します。
- 画面の [OK ]をタッチして栽培を開始します。
- 必要に応じて、将来の使用のために、残りのCD4+/CD8+選択した細胞をアプリケーションバッグに凍結保存します。
7. 1日目:T細胞形質導入
- 目的のMOIに基づいて、使用するレンチウイルスベクターの容量を計算します。
- 4°Cで一晩保存した10 mLの培地が入った20 mLの試薬バッグを取り出します(ステップ3.2)。ベクターバイアルを解凍し、7.1で計算した容量を20 mLの試薬バッグに移します。
注:残ったベクターは、保持または研究開発のために凍結することをお勧めします。 - アクティビティマトリクスを変更して、 形質導入 の時間を 2 分後に設定します。プロンプトが表示されたら、[OK]をタップして[形質導入 ] アクティビティを開始します。
- 画面の指示に従って、ベクターバッグをチューブセットに滅菌溶接します。
- Transductionアクティビティが開始された実際の時間に基づいて、アクティビティマトリックスを変更します。
注:播種後20〜24時間以内に形質導入を開始して、通常の勤務時間中に実践的な活動が行われるようにすることをお勧めします。- 培養洗浄の時間が形質導入後48時間(3日目)であることを確認してください。
- Activate Shaker(シェーカータイプ2)の時間を、培養洗浄(3日目)の30分後に設定します。
- メディア交換の時刻が 6 日目の午後 (午後 1 時) であることを確認します。
8. 6日目:最初の工程内サンプル
- [サンプル]ボタンをタッチし、画面の指示に従って、活性培養から QC サンプルを採取します。
- 細胞数解析、フローサイトメトリー解析、細胞サイズ解析を実施します。グラム染色用のサンプルを1 mL送付します。
注:培養増殖をモニターするために、細胞カウントを約1日おきに繰り返す必要があります。 - さらに2Lの培地を準備します(ステップ3.2を参照)。
- 「 ミディアムバッグ交換 」アクティビティをアクティビティマトリクスに追加し、2分後に開始するように設定します。 メディア エクスチェンジ アクティビティを調整して、20 分後に開始します。画面の指示に従います。
注: 培地 交換は、培養チャンバー内の培地の交換です。培地バッグ交換は、機器に吊るされた培 地バッグの交換 です。
9.収穫日(7日目から13日目まで):収穫と凍結保存
- [サンプル]ボタンをタッチし、画面の指示に従って、活性培養から QC サンプルを採取します。
- QC サンプルをそれぞれ 1 mL の 3 つのアリコートに分離します。フローサイトメトリー、細胞数、細胞サイズの解析には1 mLを使用してください。マイコプラズマ、ベクターコピー数、複製コンピテントレンチウイルス、およびエンドトキシン試験には1 mLを使用してください。最後の 1 mL をグラム染色用に送付します。
- 最終製剤バッファー(2 Lバッグに4%HSAを添加した滅菌等張晶質液、 材料表を参照)を調製します。この緩衝液を100 mL保存して、後のステップで凍結保護溶液を調製します。
- アクティビティ マトリックスを変更して、 培養終了 の時刻を 2 分後に設定し、残りのアクティビティをすべて削除します。画面の指示に従って、最終調合バッファーをチューブセットに付着させ、回収を開始します。
メモ: プロセッサは、セルをターゲットセルバッグに自動的に転送します。容量は100mLになります。 - Target cell bag QCパウチから0.5 mLのサンプルを採取し、細胞カウントを行います。
- ターゲットセルバッグを密封し、チューブセットから取り出します。CAR-T製品を適切な用量に分割し、制御された速度の冷凍庫で凍結保存します。細胞は液体窒素貯蔵タンクの気相で≤-150°Cで保管してください。
注:用量の最終的な処方と分注は、プロトコルに固有です。ここでは、3つの等用量のCAR-T細胞とQCバイアルを凍結保存する例を示します。詳細については、セクション 10 を参照してください。 - 装置からプロセスデータをダウンロードし、チューブセットを取り外して廃棄し、シャットダウンを実行します。
10. CAR-T細胞の凍結保存
注:このプロトコルは、CAR-T細胞が製造後に凍結保存され、患者が注入の準備ができるまで保存されることを前提としています。新たに製造されたCAR-T細胞を注入することは可能ですが、CAR-T細胞の製造とCAR-T細胞の注入を調整する必要があるため、物流上の負担が増加します。これは、製造上の障害が発生した場合に問題になる可能性があります。特に、臨床プロトコルでCAR-T注入前にリンパ球枯渇化学療法が必要な場合は、製造上の欠陥が患者を不必要な化学療法のリスクにさらす可能性があるため、凍結保存を強くお勧めします。規制当局は、輸液前に製品がすべての放出試験に合格していることを実証することを治験責任医師に要求する場合があり、凍結保存なしでは達成が困難な場合があります。
- 回収した製品の最終 100 mL から、追加の放出試験(生存率など)、保持、および無菌サンプルを実施するための所望の CAR-T 用量および品質管理(QC)バイアルを満たすために必要な容量を決定して除去します。
注:最終製品の分注については、完全に定義された戦略を策定することが重要です。十分な材料が利用可能であることを考えると、再注入を可能にするために、製品の複数回投与を製造することをお勧めします。.バッグ内の製品容量は10〜20mLで、迅速な解凍が可能で、シリンジプッシュによる注入が容易です。各製品を所望のCAR-T細胞用量(例:.、1kgあたり5×106 CAR-T細胞または2.5 × 108 CAR-T細胞)に充填することが推奨されます。また、少なくとも 4 つの QC バイアルを凍結保存し、材料が余っている可能性を考慮することも推奨されます。この資料は、研究開発目的に役立つ可能性があるため、保存することをお勧めします。 - 細胞を遠心分離して容量を減らします。
- ステップ9.3で脇に置いた最終製剤バッファーの部分を使用して、製品を目的の最終容量の半分まで上げます。
- 最終製剤バッファー中に20%DMSO溶液を調製して、2x凍結保護剤を調製します。
注:凍結保護剤の配合とDMSO濃度は変更できます。 - 2倍の凍結保護剤を細胞に等量で添加し、最終的なDMSO濃度を10%にします。
注意: 製品の凍結保護剤への曝露時間は最小限に抑える必要があります。 - 用量バッグとQCバイアルを満たします。無菌のために1 mLを送付します。
注:規制当局は通常、最終製品に対して14日間の無菌アッセイを実施することを要求しています。しかし、迅速な無菌アッセイが出現しています。現時点では、公定書の14日法が最も一般的です。 - 制御された速度の冷凍庫を使用して凍結保存製品。
注:制御された速度のフリーザープログラムは、共晶点を補正して、~-1ºC/分から~-45ºCの冷却速度を生成するように検証する必要があります。 - 液体窒素超低温冷凍庫の気相で≤-150°Cで保管してください。
11. 施術実績の検討
注:TCTプロセス全体を通して、活性培養物からいくつかのQCサンプルが採取されます。 表 2 は、読者が参照用に結果を整理し、手順のパフォーマンス指標を計算するのに役立つグリッドを提供します。文字と数字で構成される以下の用語(例:「B4」)は、この表のグリッド内のセルを指します。性能計算には、以下の値が使用されます: B3 = 全有核細胞(TNC)の事前濃縮;B4 = TNC ポストエンリッチメント。E2 = CD4+およびCD8+ T細胞の合計を、初期アフェレーシス産物の全細胞に対する割合として表したもの。E4 = 濃縮後の全細胞に対する割合としてのCD4+およびCD8+ T細胞の合計。G2 = CD19+細胞を初期産物の全細胞数に占める割合。G4 = CD4+/CD8+濃縮後の全細胞に対するCD19+細胞の割合。B10 = 収穫日の活性培養のTNC。
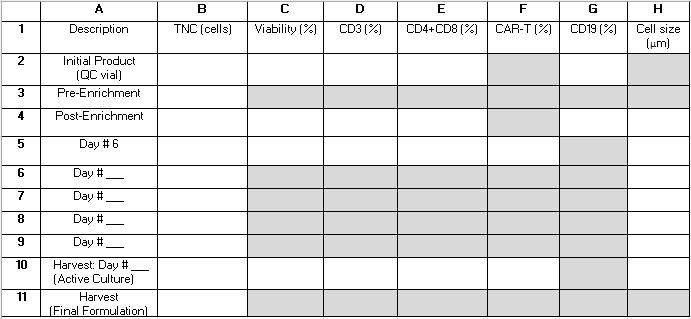
表 2: プロシージャのパフォーマンス グリッド。 このグリッドは、手順のパフォーマンス統計を計算するために必要なインプロセステストのリウルトを整理するのに役立ちます。行は、手順中のさまざまな時点で分析されたサンプルを表し、1〜11の番号でラベル付けされます。6〜9列目は、培養6日目以降、収穫日より前に採取したサンプルの結果を取得するために使用できます。列は測定されたパラメータを表し、A〜Hの文字でラベル付けされています。グレーの網掛けされたフィールドは適用されません。一部の追加分野は、CD4+/CD8+濃縮が手順の一部として行われるかどうか、および培養の長さに応じて適用されない場合があります。これらのフィールドには「N/A」と記述することをお勧めします。略語:TNC = 総有核細胞数;QC = 品質管理。 この表をダウンロードするには、ここをクリックしてください。
- 式(1)を使用して、濃縮後のCD4+とCD8+ T細胞の総数を濃縮前のCD4+とCD8+ T細胞の総数で割ることにより、選択後のCD4+/CD8+細胞の回収率を計算します。
CD4+/CD8+ T細胞の回復 =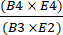 (1)
(1) - 濃縮後のCD19+細胞の総数を濃縮前のCD19+細胞の総数で割ることにより、濃縮後のCD19+細胞の枯渇を計算します。この数は非常に小さいことが予想されるため、式(2)に示すように、この分数の対数を報告します。
CD19細胞の枯渇を記録 =10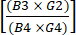 (2)
(2) - 式(3)を使用して、収穫時に活性培養された細胞の総数を播種した細胞の数で割ることにより、総倍数成長を計算します。
総倍率 =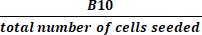 (3)
(3) - 式(4)を使用して、収穫日に対する総倍成長の根を取ることにより、1日の平均成長を計算します。
日平均成長率=収穫日√日(総倍成長) (4)
結果
NCT05480449試験の最初の3回のCAR-T製造実行の結果を 以下の表3に示します。出発物質、ベクター、培養サイトカイン、AB血清濃度は、各分析で一定に保たれました。収穫は7日目か8日目でした。1日平均細胞増殖率は46%(総細胞数の増加)であり、TCTプロセスが細胞増殖の促進に有効であることが示された。これらの結果は、プロセッサが一貫性のある再現性のあるCAR-T細胞製品を製造で?...
ディスカッション
CAR-T細胞療法は、B細胞やその他の悪性腫瘍に対する有望な治療アプローチとして浮上しています。しかし、従来のCAR-T細胞の製造方法には、高コスト、労働集約的な生産、汚染のリスクを高めるオープンステップなど、いくつかの制限があります。最近では、Miltenyi CliniMACS Prodigy(「プロセッサ」)を含むいくつかの半自動プラットフォームが登場し、これらの制限に対処しています。T細胞形質...
開示事項
S.K.、S.G.、およびY.W.は、Miltenyi Biotecから研究支援を受けています。
謝辞
著者らは、この研究に対するいくつかの個人および組織の貢献に感謝したいと思います。Cell and Gene Therapy LaboratoryとPenn Translational and Correlative Studies Laboratoryは、IND申請のためのプロセス開発と準備において貴重な支援を提供しました。Melissa Varghese と Amanda DiNofia は、この原稿の根底にある IND 提出のプロセス開発と準備に貢献しました。この研究は、フィラデルフィア小児病院の細胞・遺伝子治療共同の加速助成金の支援を受けました。また、Miltenyi Biotecの技術および研究支援にも感謝の意を表します。 図1 は、Copyright © 2023 Miltenyi Biotec B.V. & Co. KGによって保護されています。無断転載を禁じます。
資料
| Name | Company | Catalog Number | Comments |
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
参考文献
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved