Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Otomatik Hücre İşlemcisinde Kimerik Antijen Reseptörü T Hücresi Üretimi
Bu Makalede
Özet
Bu makale, klinik kullanım için kimerik antijen reseptörü T hücreleri için, özellikle viral transdüksiyon ve T hücrelerinin kültivasyonunu gerçekleştirebilen otomatik bir hücre işlemcisi kullanarak üretim sürecini detaylandırmaktadır. Erken aşama bir klinik araştırmanın süreç geliştirme ve uygulaması sırasında göz önünde bulundurulması gereken önerilerde bulunuyor ve tuzakları açıklıyoruz.
Özet
Kimerik antijen reseptörü (CAR)-T hücreleri, çeşitli malign ve malign olmayan hastalıkların tedavisi için umut verici bir immünoterapötik yaklaşımı temsil eder. CAR-T hücreleri, bir hücre yüzeyi hedefini tanıyan ve ona bağlanan ve hedef hücrenin öldürülmesiyle sonuçlanan kimerik bir proteini eksprese eden genetiği değiştirilmiş T hücreleridir. Geleneksel CAR-T hücre üretim yöntemleri emek yoğundur, pahalıdır ve kontaminasyon riski taşıyabilir. Otomatik bir hücre işlemcisi olan CliniMACS Prodigy, hücre tedavisi ürünlerinin kapalı bir sistemde klinik ölçekte üretilmesine olanak tanıyarak kontaminasyon riskini en aza indirir. İşleme, bir bilgisayarın kontrolü altında yarı otomatik olarak gerçekleşir ve böylece sürece insan katılımını en aza indirir, bu da zamandan tasarruf sağlar ve değişkenliği ve hataları azaltır.
Bu el yazması ve video, bu işlemciyi kullanarak CAR-T hücreleri üretmek için T hücresi transdüksiyon (TCT) sürecini açıklamaktadır. TCT işlemi, CD4 + / CD8 + T hücresi zenginleşmesini, aktivasyonunu, viral bir vektör ile transdüksiyonunu, genişlemesini ve hasadı içerir. Bu adımların sıralanmasına ve zamanlamasına izin veren bir işlevsellik olan Etkinlik Matrisi kullanılarak, TCT süreci kapsamlı bir şekilde özelleştirilebilir. Mevcut İyi Üretim Uygulamalarına (cGMP) uygun olarak CAR-T hücre üretiminin bir incelemesini sağlıyoruz ve bir Araştırma Amaçlı Yeni İlaç (IND) uygulamasını destekleyecek gerekli salım testlerini ve klinik öncesi deneyleri tartışıyoruz. Klinik CAR-T hücre üretimi için yarı otomatik bir süreç kullanmanın fizibilitesini gösteriyor ve avantaj ve dezavantajlarını tartışıyoruz. Son olarak, bu üretim sürecinin klinik bir ortamda nasıl uygulanabileceğinin bir örneği olarak pediatrik B hücreli maligniteleri [NCT05480449] hedefleyen, araştırmacı tarafından başlatılan devam eden bir klinik çalışmayı açıklıyoruz.
Giriş
Bir kimerik antijen reseptörünü (CAR) eksprese etmek üzere tasarlanmış T hücrelerinin evlat edinme transferi, refrakter B hücreli maligniteleriolan hastaların tedavisinde dikkate değer bir etkinlik göstermiştir 1,2,3,4,5. Bununla birlikte, CAR-T hücreleri için geleneksel üretim yöntemleri emek yoğundur, zaman alıcıdır ve son derece uzmanlaşmış adımları gerçekleştirmek için yüksek eğitimli teknisyenler gerektirir. Örneğin, otolog bir CAR-T hücre ürününün geleneksel üretim süreci, T hücrelerini zenginleştirmek için yoğunluk gradyanlı santrifüjleme, elütriasyon veya manyetik ayırma, steril bir şişede viral bir vektör ile aktivasyon ve transdüksiyon ve hasat ve formülasyondan önce bir biyoreaktörde genişlemeyi içerir. Son zamanlarda bu süreci kısmen otomatikleştirmeyi amaçlayan çeşitli sistemler ortaya çıkmıştır. Örneğin, Miltenyi CliniMACS Prodigy (bundan böyle "işlemci" olarak anılacaktır), bu adımların çoğunu otomatik bir şekildegerçekleştirebilen otomatik bir hücre işleme cihazıdır 6,7,8,9. Geleneksel ve otomatik CAR-T üretim yöntemlerinin derinlemesine bir tartışması, yakın tarihli bir inceleme makalesindesunulmuştur 10.
İşlemci, hematopoietik progenitör hücrelerin işlenmesi için ABD Gıda ve İlaç Dairesi (FDA) onaylı bir tıbbi cihaz olan CliniMACS Plus'ın işlevselliği üzerine kuruludur. İşlemci, hücrelerin otomatik olarak yıkanmasına, fraksiyonlanmasına ve yetiştirilmesine izin veren bir hücre yetiştirme ünitesi içerir (Şekil 1). T hücresi transdüksiyonu (TCT) işlemi, manuel CAR-T hücresi üretimini büyük ölçüde kopyalayan işlemci cihazı içinde önceden ayarlanmış bir programdır. TCT, grafiksel bir kullanıcı arayüzü ("Etkinlik Matrisi", Şekil 2) kullanarak özelleştirilebilir hücre işlemeye izin verir. İşlemci birçok adımı otomatikleştirdiğinden ve birden fazla cihazın işlevselliğini tek bir makinede birleştirdiğinden, teknoloji uzmanlarından daha az eğitim ve özel sorun giderme becerileri gerektirir. Tüm adımlar kapalı, tek kullanımlık bir boru seti içinde gerçekleştirildiğinden, işlemci, açık bir üretim süreci için kabul edilebilir olarak kabul edilenden daha az sıkı hava işleme altyapısına sahip tesislerde çalıştırılabilir. Örneğin, işlemciyi ISO sınıf 8 (AB sınıfı C ile karşılaştırılabilir) sertifikalı bir tesiste çalıştırıyoruz.
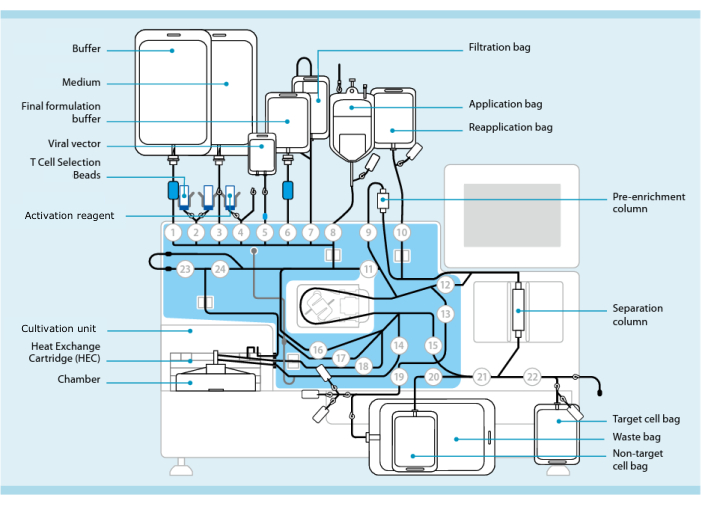
Şekil 1: T hücresi transdüksiyon sistemini kullanarak CAR-T hücresi üretimi. Gösterilen, boru setinin takılı olduğu işlemcidir. Boru seti, işleme tamponu, kültür ortamı ve lentiviral vektör içeren torbalar gibi diğer bileşenlerin steril kaynak yoluyla bağlanmasına izin verir. Lökoferez ürünü Uygulama torbasına eklendikten sonra, T Hücre Seçim Boncukları ile etiketlenebilir, Ayırma sütunundan geçirilebilir ve daha sonra Yeniden Uygulama torbasına aktarılabilir. Seçilen hücreler daha sonra kültür için aletin Yetiştirme ünitesine yönlendirilir ve Aktivasyon reaktifi ile aktive edilir (bkz. Nihai ürün, Hedef hücre torbasında toplanır. Proses boyunca, kalite kontrol için numuneleri aseptik olarak çıkarmak mümkündür. Dairelerin içindeki gri sayılar, sıvı yolunu boru setinden geçiren işlemci üzerindeki numaralı valfleri temsil eder. 11'in izniyle çoğaltılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
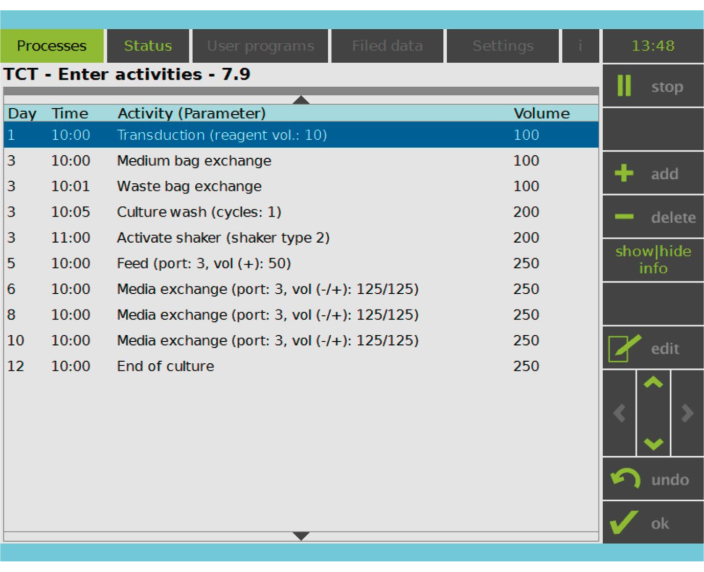
Şekil 2: Etkinlik Matrisi. T hücresi seçimi ve aktivasyonundan sonra, CAR-T hücresi üretim sürecinin geri kalanı tamamen özelleştirilebilir. Aktiviteler eklenebilir veya silinebilir ve uygun gün ve saat için planlanabilir ve aktivite sonrası kültür hacmi belirtilebilir (Hacim). Örneğin, Transdüksiyon aktivitesi 1. Gün saat 10:00'da başlayacak şekilde yapılandırıldı ve aktivitenin sonundaki kültür hacmi 100 mL olarak ayarlandı. Aktivite Matrisi, yetiştirme dönemi boyunca düzenlenebilir. İşlemin durumu, işleme cihazının entegre ekranından izlenebilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Bu makalenin amacı, işlemciyi kullanarak CAR-T hücrelerinin üretiminin ayrıntılı bir incelemesini sağlamak ve ayrıca düzenleyiciler tarafından bir araştırma amaçlı yeni ilaç (IND) başvurusunu onaylamak için muhtemelen gerekli olacak süreç içi ve ürün salım testleri hakkında rehberlik sağlamaktır. Sunulan protokol, satıcının önerdiği yaklaşıma yakın kalır ve şu anda tek merkezli bir araştırmacı tarafından başlatılan faz I/II klinik araştırmasında değerlendirilmekte olan IND 28617'nin altında yatan protokoldür. Bu çalışma, B hücreli akut lenfoblastik lösemi (B-ALL) veya B-soy lenfoblastik lenfoma (B-Lly) hastaları için insanlaştırılmış CD19'a yönelik otolog CAR-T hücreleri üretmek için bu işlemciyi kullanmanın güvenliğini ve etkinliğini belirlemeyi amaçlamaktadır [NCT05480449]. Deneme Eylül 2022'de başladı ve B-ALL veya B-Lly ile 0-29 yaş arası 89 hastaya kadar kaydedilmesi planlanıyor. Denemeden elde edilen bazı üretim sonuçlarını makalede bildiriyoruz.
Makale, izlenecek adımları içeren bir protokol olarak sunulsa da, başkalarının kendi CAR-T hücre üretim süreçlerini optimize etmeye başlaması için bir başlangıç noktası olarak düşünülmesi gerektiğini belirtmek isteriz. Sunulan protokoldeki olası varyasyonların kapsamlı olmayan bir listesi şunları içerir: başlangıç materyali olarak dondurularak saklanmış T hücreleri yerine taze kullanılması; farklı bir T hücresi zenginleştirme yöntemi kullanmak veya tamamen atlamak; IL2 yerine IL7/IL15 gibi farklı besiyerleri ve sitokin kokteylleri kullanarak; insan AB serumunun konsantrasyonunu değiştirmek veya tamamen atlamak; transdüksiyon zamanlaması; "çok isabetli" transdüksiyonların kullanılması; değişen ajitasyon, kültür hacimleri ve beslenme programı; nükleik asitlerin veya lentiviral olmayan vektörlerin elektroporasyonu dahil olmak üzere farklı genetik transfer yöntemlerinin kullanılması; farklı bir nihai formülasyon tamponu ve/veya kriyoprotektan kullanarak; ve daha sonra infüzyon için kriyoprezervasyon yerine CAR-T hücrelerini taze olarak infüze etmek. Bu varyasyonlar, terapötik ürünün hücresel bileşimi ve gücü üzerinde önemli bir etkiye sahip olabilir.
| Genel Süreç Adımı | İşlem Günü | Teknik Detaylar | |||
| Hücre Zenginleştirme | Gün 0 | CD4+/CD8+ T hücrelerinin seçimi | |||
| Hücre Aktivasyonu | T hücre kültürü tohumlama ve aktivasyonu | ||||
| Hücre İletimi | 1. Gün | Lentiviral transdüksiyon (100 mL kültür hacmi) | |||
| Hücre Genişlemesi (ardından hücre formülasyonu) | 2. Gün | -- | |||
| 3. Gün | Kültür Yıkama (1 döngü); Çalkalayıcı etkinleştirildi; Kültür hacmi 200 mL'ye yükselir | ||||
| 4. Gün | -- | ||||
| 5. Gün | Besleme (50 mL); Kültür hacmi 250 mL'lik son hacme ulaşır | ||||
| 6. Gün | Proses içi numune; Medya değişimi (-125 mL / +125 mL) | ||||
| 7. Gün | Medya değişimi (-150 mL / +150 mL) veya Hasat | ||||
| 8. Gün | Proses içi numune; Medya değişimi (-150 mL / +150 mL) veya Hasat | ||||
| 9. Gün | Medya değişimi (-180 mL / +180 mL) veya Hasat | ||||
| 10. Gün | Proses içi numune; Medya değişimi (-180 mL / +180 mL) veya Hasat | ||||
| 11. Gün | Medya değişimi (-180 mL / +180 mL) veya Hasat | ||||
| 12. Gün | Medya değişimi (-180 mL / +180 mL) veya Hasat | ||||
| 13. Gün | Hasat | ||||
Tablo 1: İşlem zaman çizelgesi ve genel bakış. Bu tablo, mevcut bir klinik araştırmada kullanılan TCT süreç adımlarını özetlemektedir [NCT05480449]. İşlem, 0. günde CD4+/CD8+ seçimi, kültür tohumlaması ve aktivasyonu ile T hücresi zenginleştirmesi ile başlar, ardından 1. günde transdüksiyon ile devam eder. Hücreler 48 saat dinlenir, ardından bir kültür yıkaması, kültür hacminin 200 mL'ye çıkarılması ve bir çalkalama mekanizması kullanılarak çalkalanması gelir. 6. Günde, ilk proses içi numune alınır. Hücreler, en az üç tam doz CAR-T hücresi (hasta <50 ×kg, aksi takdirde 2,5 × 10 8 CAR-T hücresi) ve kalite kontrol testi (~2 × 106 CAR-T hücresi) için yeterli hücre mevcut olduğunda toplanır; veya kültür toplam 4-5 x 109 hücreye ulaştığında. Kısaltmalar: TCT = T hücre transdüksiyonu; CAR-T = kimerik antijen reseptörü T hücreleri; MACS = manyetik olarak etkinleştirilen hücre sıralaması.
Protokol
Tüm araştırmalar, hastanenin Kurumsal İnceleme Kurulu (IRB) tarafından onaylanarak kurumsal yönergelere uygun olarak gerçekleştirildi ve tüm denekler, çalışma kapsamında toplanan verilerin yayınlanması için bilgilendirilmiş onam verdi.
NOT: Protokolün ilk bölümü, CAR-T üretim sürecine üst düzey bir genel bakış sağlar. Kalan bölümlerde adım adım yönergeler sağlanır. Protokol, bu yazı itibariyle geçerli sürüm olan TCT yazılım sürümü 1.4'ü kullanarak iş akışını açıklar. TCT yazılımının diğer sürümlerinin kullanıcı arayüzü değişiklik gösterebilir.
1. Süreç zaman çizelgesi ve genel bakış (Tablo 1)
- Ön kontrol kontrolleri ile Pazartesi günü (Gün -1) prosedüre hazırlanın. İşlemcinin ve diğer ekipmanların beklendiği gibi çalıştığından ve tüm reaktiflerin ve sarf malzemelerinin tüm üretim çalışması için kullanılabilir ve güncel olduğundan emin olun.
- 0. günde, boru setini makineye takın. Daha önce dondurularak saklanmış T hücrelerini kuru bir banyoda çözdürün ve bunları steril kaynakla cihaza monte edilen boru setine bağlayın.
NOT: Bu protokol, otolog T hücrelerinin aferez yoluyla toplandığını, dondurularak saklandığını ve üretimin başlangıcına kadar saklandığını varsayar. Yeni toplanan T hücrelerini kullanmak mümkün olsa da, bu, aferez toplamanın CAR-T hücresi üretimi ile koordine edilmesini gerektirdiğinden lojistik yükü artırır. Bakteriyel kontaminasyon riskini en aza indirmek için su banyosu yerine kuru çözdürme işlemi kullanmanızı şiddetle tavsiye ederiz. - T hücrelerini CD4 ve CD8 reaktifleri ile etiketleyin ( Malzeme Tablosuna bakınız) ve manyetik seleksiyonla zenginleştirin.
NOT: T hücresi zenginleştirmesini atlamak veya hücreleri işlemciye yüklemeden önce gerçekleştirmek mümkündür. Protokolün 5. bölümüne bakınız. - CD4 + / CD8 + hücrelerinin zenginleştirilmesinden sonra, hücre sayımı için bir örnek alın. Kültürü, %5 insan AB serumu × rekombinant insan IL2 (25 ng / mL) ile desteklenmiş 70 mL ortamın başlangıç hacminde (Malzeme Tablosuna bakınız) 1-2 ila 108 hücre ile tohumlayın.
- T hücrelerini aktive etmek için bir şişe aktivasyon reaktifi (anti-CD3 ve anti-CD28 antikorlarına konjuge edilmiş bir kolloidal polimerik nanomatriks; Malzeme Tablosuna bakınız) ekleyin ve kültürü% 5 CO2 atmosferinde 37 ºC'de 24 saat çalkalama olmadan inkübe edin. İstenirse, kalan CD4 + / CD8 + hücrelerini yedek olarak kriyoprezervasyon yapın.
NOT: Üretim hatası durumunda, artık CD4+/CD8+ seçilen hücreler başlangıç malzemesi olarak kullanılabilir. Arıza, kontaminasyon veya operatör hatası gibi tamamen teknikse ve yeterli hücre kalırsa, ek bir üretim çalışması gerçekleştirmek için artık hücrelerin kullanılması düşünülebilir. Başlangıç malzemesinin kalitesi söz konusuysa, yeni bir aferez prosedürü garanti edilebilir; Ancak, bu sonuçta klinik bir karardır. Her iki durumda da, bir üretim hatası araştırılması gereken önemli bir olaydır ve sponsor ve muhtemelen düzenleyiciler bilgilendirilmelidir. - 24 saatlik aktivasyondan sonra, T hücrelerini lentiviral vektör ile uygun bir enfeksiyon çokluğunda (MOI) transdüksiyon yapın.
NOT: Klinik ürünlerin üretimine başlamadan önce lentiviral vektör titresinin belirlenmesi ve uygun bir MOI oluşturulması çok önemlidir. Vektör titresi, insan birincil T hücrelerinin vektörün çeşitli konsantrasyonlarında dönüştürüldüğü küçük ölçekli bir deney yapılarak belirlenmelidir. Uygun MOI için dikkat edilmesi gereken hususlar arasında vektörün maliyeti, istenen iletim verimliliği ve kabul edilebilir bir vektör kopya numarası yer alır. Bu protokol, vektörün maliyetini en aza indirmek ve ortalama vektör kopya sayısını dönüştürülen hücre başına 8 kopyanın altında tutmak için %30-50'lik bir MOI kullanır. - 3. Günde, Kültür Yıkama aktivitesini tetikleyin ve düşük seviyeli ajitasyona başlayın. Kültür hacmini 200 mL'ye yükseltin.
- 5. Günde, kültüre 50 mL ortam ekleyin ve kültür hacmini 250 mL'ye çıkarın.
- Yetiştiriciliğin 6. gününde, kültürden bir örnek alın ve CAR-T hücrelerini akış sitometrisi ile sayın. Kültürün büyüme hızını tahmin etmek ve en uygun hasat zamanını belirlemek için bu ölçümü kullanın.
NOT: Her proses içi örnekleme, test için 3 mL verir ve toplam 7 mL kültür hacmini giderir. - 7. günden 13. güne kadar, kültür sonlandırılmadıysa, alternatif günlerde en fazla iki ek proses içi numune alın ve büyüyen kültürü beslemek için günlük medya alışverişleri gerçekleştirin. Toplam çekirdekli hücre (TNC) sayısı 5 × 109'a ulaştığında ve/veya gerekli sayıda doz ve salım testi için yeterli hücre mevcut olduğunda ürünü hasat edin.
- Hasat gününde, aktif olarak büyüyen kültürden proses içi bir numune alın. Bu örneği mikoplazma, endotoksin, replikasyona yetkin lentivirüs (RCL) testi, vektör kopya sayısı (VCN) testi, hücre sayımı, hücre boyutu analizi, akış sitometrisi ve gram boyama için kullanın.
- Kültür ortamının çıkarılmasını ve son formülasyon tamponu (% 4 insan serum albümini ile desteklenmiş steril bir izotonik kristalloid çözeltisi; bkz. Malzeme Tablosu) ile bir hücre yıkamasını tetikleyen son hasat programını başlatın. Hasat tamamlandıktan sonra, hedef hücre torbası, nihai formülasyon tamponunda 100 mL hücre ürünü tutacaktır. %10 (h/h) konsantrasyona kadar dimetil sülfoksit (DMSO) ekleyin, ürünü ayrı dozlara ayırın ve kontrollü oranlı bir dondurucu kullanarak kriyoprezervasyonu yapın.
2. Gün -1: Hazırlık ve ön kontrol kontrolleri
- CO2 gaz seviyelerinin ve basınçlı havanın her hatta en az 20 psi'lik bir giriş basıncı üretmek için yeterli olduğunu doğrulayın.
- İşlemciyi açın ve başlangıçta hata olmadığını onaylayın. Gerekirse, saati doğru zamana ayarlayın. İşlemciyi kapatın.
- T hücresi başlangıç materyalinin hücre sayısı, hacmi ve toplam CD4+ ve toplam CD8+ sayısının bilindiğinden emin olun.
- Tüm üretim çalışması için yeterli miktarda viral vektör, reaktif ve sarf malzemesi olduğundan emin olun.
- Gece boyunca çözülmesi için buzdolabına bir şişe insan AB serumu koyun.
3. Gün 0: Boru seti kurulumu
- 3 L işleme tamponu hazırlayın (fosfat tamponlu salin / etilendiamintetraasetik asit (PBS / EDTA) tamponunda% 0.5 (a / h) insan serum albümini (HSA)).
- 2 L kültür ortamı hazırlayın (% 5'lik bir nihai konsantrasyona kadar 100 mL insan AB serumu ile takviye edilmiş 2 L ortam ve 25 μg / şişede iki şişe rekombinant insan IL2; bu reaktifler hakkında daha fazla bilgi için Malzeme Tablosuna bakın). 10 mL kültür ortamını 20 mL'lik bir reaktif torbasına aktarın ve gece boyunca 4 ºC'de saklayın.
- Cihazı açın ve dokunmatik ekran arayüzünden T Hücresi Transdüksiyon İşlemini (TCT) seçin. TCT işlemini başlatmak için Çalıştır'a tıklayın; Cihazın, ekrandaki talimatları ve istemleri kullanarak kullanıcıyı prosedür boyunca yönlendirmesine izin verin.
- Üzerinde Parametre Girişi ekranında, istendiğinde operatörün baş harflerini, boru seti lot numarasını ve son kullanma tarihini girin.
- Süreç Kurulumu ekranı dört farklı işlem sunar. Tam işlem (1) öğesini seçin.
NOT: Diğer kullanılabilir işlemler, CD4+/CD8+ seçilen T hücrelerinden başlatmayı (aşağıdaki bölüm 5'e bakın) ve daha önce iptal edilmiş bir üretim çalışmasını yeniden başlatmayı içerir. - İstendiğinde, CD4 + / CD8 + seçim yöntemini yansıtmak için iki şişe seçim reaktifi seçin.
- Boru setini ekrandaki talimatlara göre takın. Tüm Luer bağlantılarının sıkı olduğundan ve boru setinde herhangi bir kusur olmadığından emin olun.
- Otomatik üst ve alt bütünlük testlerini başlatmak için ekrandaki talimatları izleyin.
NOT: Arızalı bir boru seti, yanlış takılmış bir boru seti veya makinenin peristaltik pompasındaki bir arıza nedeniyle bütünlük testi başarısız olabilir. Üretim çalışmaları için en az bir ek boru setinin hazır bulundurulmasını şiddetle tavsiye ederiz. Ayrıca ikinci bir teknoloji uzmanının boru setinin doğru kurulumunu doğrulamasını öneririz. - Ortamı takmak ve tampon torbaları işlemek için ekrandaki talimatları izleyin.
- Boru setinin otomatik astarlanmasına başlayın.
NOT: TCT işlemi, astarlamadan sonraki 3 saat içinde devam etmelidir. T hücresi başlangıç malzemesinin hazır olacağından emin olun.
4. T hücresi zenginleştirme
- Transfer hücresi ürün ekranı göründüğünde, dondurularak saklanmış T hücresi ürününü çözmeye başlayın.
NOT: Boru setine eklenebilecek kabul edilebilir T hücresi hacmi 50 ila 280 mL arasındadır. Maksimum hedef (CD4+ ve CD8+ toplamı) hücre sayısı 3 × 109 ve maksimum TNC sayısı 2 × 1010'dur. - Çözülmüş hücreleri 150 mL'lik bir transfer torbasına aktarın. Transfer torbasını boru setinin Uygulama torbasına steril olarak kaynaklayın.
- QC poşetini kullanarak Uygulama torbasından bir numune alın ve bir hücre sayımı yapın.
- CD4 ve CD8 reaktif şişelerini bağlayın.
- Seçim (T hücresi zenginleştirme) işlemini başlatın.
- Zenginleştirmeden sonra, hücre sayımı, akış sitometrisi ve hücre boyutu analizi için Yeniden Uygulama torbasının QC torbasından CD4 + / CD8 + seçilen hücrelerin bir örneğini çıkarın.
NOT: Bir sonraki adıma geçmek için hücre sayımı sonucu gereklidir.
5. Alternatif: CD4 + / CD8 + seçili hücrelerden başlayarak
- Ortamı adım 3.2'de açıklandığı gibi hazırlayın. İşlem arabelleğine gerek yoktur.
- İşlemciyi açın ve İşlem Kurulumu ekranında TS kurulumu (3) ile T hücresi ekimini seçin. Ekrandaki talimatları ve istemleri izleyin.
- Ekrandaki talimatları izleyerek, boru setini işleme tamponu yerine orta ile doldurun.
- "Yetiştirme-Bağlantı hücresi ürününü hazırla" ekranı göründüğünde, CD4+/CD8+ seçilen T hücrelerini çözmeye başlayın.
NOT: İşlem için minimum T hücresi sayısı (CD4+ ve CD8+ T hücrelerinin toplamı) 1.0 × 108'dir. - Hücreleri 150 mL'lik bir transfer torbasına aktarın ve 50 mL'lik bir nihai hacme kadar orta ile seyreltin.
- Hücre süspansiyonunu cihazın Yeniden Uygulama torbasına steril olarak kaynaklayın.
- Hücre sayımı ve hücre boyutu analizi için Yeniden Uygulama torbasının QC torbasından CD4 + / CD8 + seçilen hücrelerin bir örneğini çıkarın.
6. Aktivite Matrisi'nin kültür kurulumu ve programlanması
- Hücre konsantrasyonunu ve istenen başlangıç numarasını girin (1-2 × 108 T hücreler).
NOT: Cihaz, uygun hacmi Otomatik olarak Yeniden Uygulama torbasından kültür odasına pompalayacak ve son hacmi 70 mL'ye ayarlayacaktır. - Ekrandaki talimatlara göre bir aktivasyon reaktifi şişesi takın.
- CO2 konsantrasyonu için %5 ve kültür odası sıcaklığı için 39 °C girin.
NOT: Üretici, 39 °C veya cihaz için özel olarak kalibre edilmiş bir değer girilmesini önerir. - Etkinlik Matrisi'ni ayarlayın. Gelişmiş besleme protokolünü başlangıç noktası olarak kullanın ve protokol içindeki adımları kullanıcı tanımlı spesifikasyonlara göre değiştirin (Şekil 2).
- Transdüksiyon aktivitesinin zamanının tohumlamadan sonra 24 saat olduğundan emin olun (1. Gün).
- Kültür Yıkama aktivitesinin zamanının Transdüksiyondan sonra 48 saat olduğundan emin olun (Gün 3).
- Çalkalayıcıyı Etkinleştir (çalkalayıcı tip 2) süresini, Kültür Yıkamanın başlamasından 30 dakika sonrasına ayarlayın.
- Tüm Orta Boy Torba Değişimi ve Atık Torbası Değişimi etkinliklerini silin.
- Uygulamaya başlamak için ekranda Tamam'a dokunun.
- Uygulama çantasında kalan CD4+/CD8+ seçili hücreleri, gerekirse ileride kullanmak üzere kriyoprezervasyon yapın.
7. Gün 1: T hücresi transdüksiyonu
- İstenen MOI'ye göre kullanılacak lentiviral vektörün hacmini hesaplayın.
- Gece boyunca 4 ºC'de saklanan 10 mL kültür ortamı içeren 20 mL reaktif torbasını alın (adım 3.2). Vektör şişesini çözün ve 7.1'de hesaplanan hacmi 20 mL reaktif torbasına aktarın.
NOT: Saklama veya araştırma ve geliştirme için kalan vektörleri dondurmanızı öneririz. - Transdüksiyon zamanını 2 dakika sonrasına ayarlamak için Etkinlik matrisini değiştirin. İstendiğinde, Transdüksiyon etkinliğini başlatmak için Tamam'a dokunun.
- Ekrandaki talimatları izleyerek vektör torbasını boru setine steril olarak kaynaklayın.
- Etkinlik matrisini, Transdüksiyon etkinliğinin başlatıldığı gerçek zamana göre değiştirin.
NOT: Uygulamalı faaliyetlerin normal çalışma saatleri içinde gerçekleştirilmesini sağlamak için tohumlamadan sonraki 20-24 saat içinde transdüksiyona başlamanızı öneririz.- Kültür Yıkama süresinin Transdüksiyondan sonra 48 saat olduğundan emin olun (Gün 3).
- Activate Shaker'ın (çalkalayıcı tip 2) saatini Kültür Yıkamadan (Gün 3) sonra 30 dakikaya ayarlayın.
- Media Exchange saatinin 6. günün öğleden sonra (13:00) olduğundan emin olun.
8. Gün 6: İlk proses içi numune
- Numune düğmesine dokunun ve aktif kültürden bir QC örneği almak için ekrandaki talimatları izleyin.
- Hücre sayımı, akış sitometrisi ve hücre boyutu analizleri gerçekleştirin. Gram boyama için 1 mL numune gönderin.
NOT: Kültür büyümesini izlemek için hücre sayımları yaklaşık olarak iki günde bir tekrarlanmalıdır. - 2 L daha kültür ortamı hazırlayın (bkz. adım 3.2).
- Etkinlik Matrisi'ne, 2 dakika sonra başlayacak şekilde zamanlanmış bir Orta Boy Çanta Değiştirme etkinliği ekleyin. Medya Değişimi etkinliğini 20 dakika sonra başlayacak şekilde ayarlayın. Ekrandaki talimatları izleyin.
NOT: Medya Değişimi , yetiştirme odasındaki kültür ortamının değiştirilmesidir. Orta Torba Değişimi , cihaza asılan kültür ortamı torbasının değiştirilmesidir.
9. Hasat günü (7. günden 13. güne kadar herhangi bir yerde): Hasat ve kriyoprezervasyon
- Numune düğmesine dokunun ve aktif kültürden bir QC örneği almak için ekrandaki talimatları izleyin.
- QC örneğini her biri 1 mL'lik üç alikota ayırın. Akış sitometrisi, hücre sayısı ve hücre boyutu analizleri için 1 mL kullanın. Mikoplazma, vektör kopya sayısı, replikasyona yetkin lentivirüs ve endotoksin testi için 1 mL kullanın. Gram boyama için son 1 mL'yi gönderin.
- Nihai formülasyon tamponunu hazırlayın (2 L'lik bir torbada% 4 HSA ile desteklenmiş steril bir izotonik kristalloid çözelti, Malzeme Tablosuna bakınız). Daha sonraki bir adımda kriyoprotektan çözeltisini hazırlamak için bu tampondan 100 mL tasarruf edin.
- Kültürün Sonu zamanını 2 dakika sonrasına ayarlamak için Etkinlik Matrisi'ni değiştirin ve kalan tüm etkinlikleri silin. Son formülasyon tamponunu boru setine takmak ve hasada başlamak için ekrandaki talimatları izleyin.
NOT: İşlemci, hücreleri otomatik olarak Hedef hücre torbasına aktaracaktır. Hacim 100 mL olacaktır. - Hedef hücre torbası QC poşetinden 0,5 mL'lik bir numune alın ve bir hücre sayımı gerçekleştirin.
- Hedef hücre torbasını kapatın ve boru setinden çıkarın. CAR-T ürününü uygun dozlara bölün ve kontrollü oranlı bir dondurucuda dondurarak saklayın. Hücreleri sıvı nitrojen depolama tankının buhar fazında ≤ -150 ºC'de saklayın.
NOT: Nihai formülasyon ve dozların ayrılması protokole özgüdür. Burada, üç eşit dozda CAR-T hücresinin ve QC şişelerinin dondurularak saklandığı bir örnek sunuyoruz. Ayrıntılar için bölüm 10'a bakın. - Proses verilerini cihazdan indirin, boru setini çıkarıp atın ve bir kapatma gerçekleştirin.
10. CAR-T hücrelerinin dondurularak saklanması
NOT: Bu protokol, CAR-T hücrelerinin üretimden sonra dondurularak saklandığını ve hasta infüzyona hazır olana kadar saklandığını varsayar. Yeni üretilmiş CAR-T hücrelerini infüze etmek mümkün olsa da, bu, CAR-T hücre üretiminin CAR-T hücre infüzyonu ile koordine edilmesini gerektirdiğinden lojistik yükü artırır. Bu, bir üretim hatası durumunda sorunlu olabilir. Özellikle klinik protokol CAR-T infüzyonundan önce lenfodeplesyon kemoterapisi gerektiriyorsa, kriyopreservasyonu şiddetle öneriyoruz, çünkü bir üretim hatası hastayı gereksiz kemoterapi riskine maruz bırakabilir. Düzenleyiciler, araştırmacılardan ürünün infüzyondan önce tüm salım testlerini geçtiğini göstermelerini isteyebilir, bu da kriyoprezervasyon olmadan elde edilmesi zor olabilir.
- Hasat edilen ürünün son 100 mL'sinden, ek salım testi (örn. canlılık), tutma ve bir sterilite numunesi gerçekleştirmek için istenen CAR-T dozlarını ve kalite kontrol (QC) şişelerini karşılamak için gereken hacmi belirleyin ve çıkarın.
NOT: Nihai ürünü alıntılamak için tam olarak tanımlanmış bir strateji geliştirmek çok önemlidir. Yeterli materyalin mevcut olduğu göz önüne alındığında, reinfüzyonlara izin vermek için ürünün birden fazla dozunun üretilmesini öneririz. Bir torba içinde 10-20 mL'lik bir ürün hacmi, şırınga itme ile hızlı çözülme ve kolay infüzyon sağlar. Her ürünün istenen CAR-T hücre dozuna (örneğin, kg başına 5 × 106 CAR-T hücresi veya 2.5 × 108 CAR-T hücresi) doldurulması önerilir, çünkü bu, infüzyon gününde doz hesaplamalarına olan ihtiyacı ortadan kaldıracaktır. Ayrıca, en az dört QC şişesinin dondurularak saklanması ve artık malzeme olma olasılığının hesaba katılması önerilir; Araştırma ve geliştirme amaçları için yararlı olabileceği için bu materyali saklamanızı öneririz. - Hacmi azaltmak için hücreleri santrifüjleyin.
- Adım 9.3'te bir kenara bırakılan nihai formülasyon tamponunun bir kısmını kullanarak ürün(ler)i istenen nihai hacmin yarısına getirin.
- Son formülasyon tamponunda %20'lik bir DMSO çözeltisi oluşturarak 2x kriyoprotektan hazırlayın.
NOT: Kriyoprotektan formülasyonu ve DMSO konsantrasyonu değiştirilebilir. - %10'luk bir nihai DMSO konsantrasyonu için hücrelere eşit hacimde 2x kriyoprotektan ekleyin.
NOT: Ürünün kriyoprotektan maruz kalma süresi en aza indirilmelidir. - Doz torbalarını ve QC şişelerini doldurun. Sterilite için 1 mL gönderin.
NOT: Düzenleyiciler genellikle nihai ürün üzerinde 14 günlük bir sterilite testi yapılmasını gerektirir. Bununla birlikte, hızlı sterilite deneyleri ortaya çıkmaktadır; Şu anda, Compendial 14 günlük yöntem en yaygın olanıdır. - Cryopreserve ürünleri, kontrollü oranlı bir dondurucu kullanarak.
NOT: Kontrollü oranlı dondurucu programı, ötektik noktanın telafisi ile ~ -1 ºC/dak ila ~ -45 ºC arasında bir soğutma hızı üretecek şekilde doğrulanmalıdır. - Ürünü ≤ -150 °C'de sıvı nitrojen ultra düşük dondurucunun buhar fazında saklayın.
11. Prosedür performansının incelenmesi
NOT: TCT işlemi boyunca, aktif kültürden birkaç QC numunesi alınır. Tablo 2 , okuyucunun referans için sonuçları düzenlemesine ve prosedür performans ölçümlerini hesaplamasına yardımcı olabilecek bir ızgara sağlar. Bir harf ve bir sayıdan oluşan aşağıdaki terimler (örneğin, "B4") bu tablonun ızgarasındaki hücreleri ifade eder. Performans hesaplamalarında aşağıdaki değerler kullanılır: B3 = toplam çekirdekli hücreler (TNC) ön zenginleştirme; B4 = TNC zenginleştirme sonrası; E2 = İlk aferez ürününün toplam hücrelerinin yüzdesi olarak CD4+ ve CD8+ T hücrelerinin toplamı; E4 = CD4+ ve CD8+ T hücrelerinin zenginleştirme sonrası toplam hücrelerin yüzdesi olarak toplamı; G2 = CD19+ hücreleri, ilk ürünün toplam hücrelerinin yüzdesi olarak; G4 = CD4 + / CD8 + zenginleştirmesinden sonra toplam hücrelerin yüzdesi olarak CD19 + hücreleri; B10 = Hasat gününde Aktif Kültürün TNC'si.
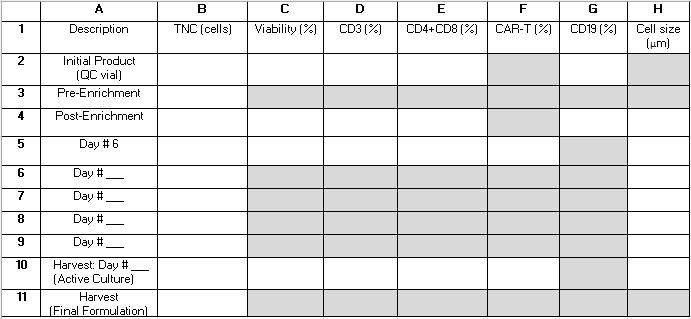
Tablo 2: Prosedür performans tablosu. Bu tabloyu, prosedür performans istatistiklerini hesaplamak için gereken süreç içi test sonuçlarını düzenlemeye yardımcı olmak için sağlıyoruz. Satırlar, prosedür sırasında çeşitli zaman noktalarında analiz edilen numuneleri temsil eder ve 1-11 arası sayılarla etiketlenir. 6-9. sıralar, ekimin 6. gününden sonra, ancak hasat gününden önce alınan numunelerden elde edilen sonuçları yakalamak için kullanılabilir. Sütunlar ölçülen parametreleri temsil eder ve AH harfleriyle etiketlenir. Gri gölgeli alanlar geçerli değildir. CD4+/CD8+ zenginleştirmenin prosedürün bir parçası olarak gerçekleştirilip gerçekleştirilmediğine ve yetiştirmenin uzunluğuna bağlı olarak bazı ek alanlar geçerli olmayabilir. Bu alanlara "N/A" yazmanızı öneririz. Kısaltmalar: TNC = toplam çekirdekli hücre sayısı; QC = kalite kontrol. Bu Tabloyu indirmek için lütfen buraya tıklayın.
- Denklem (1)'i kullanarak zenginleştirme sonrası toplam CD4+ artı CD8+ T hücresi sayısını, zenginleştirmeden önceki toplam CD4+ artı CD8+ T hücresi sayısına bölerek seçimden sonra CD4+/CD8+ hücrelerinin geri kazanımını hesaplayın.
CD4 + / CD8 + T hücresi kurtarma =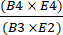 (1)
(1) - CD4+/CD8+ zenginleştirmesinden sonraki toplam CD19+ hücre sayısını, zenginleştirmeden önceki toplam CD19+ hücre sayısına bölerek zenginleştirmeden sonra CD19+ hücrelerinin tükenmesini hesaplayın. Bu sayının çok küçük olması beklendiğinden, bu kesrin logaritmasını denklem (2)'de gösterildiği gibi bildirin:
Günlük CD19 hücre tükenmesi = günlük10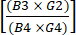 (2)
(2) - Hasatta aktif kültürdeki toplam hücre sayısını, denklem (3) kullanılarak ekilen hücre sayısına bölerek toplam kat büyümesini hesaplayın:
Toplam kat büyümesi =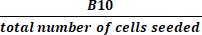 (3)
(3) - Denklem (4)'ü kullanarak hasat gününe göre toplam kat büyümesinin kökünü alarak ortalama günlük büyümeyi hesaplayın:
Ortalama günlük büyüme = hasat günü √ (toplam kat büyümesi) (4)
Sonuçlar
NCT05480449 denemesinin ilk üç CAR-T üretim çalışmasından elde edilen sonuçlar aşağıda Tablo 3'te sunulmuştur. Başlangıç materyali, vektör, kültür sitokinleri ve AB serum konsantrasyonları her çalışma için tutarlı tutuldu. Ürünler 7. veya 8. günde hasat edildi. Ortalama günlük hücre büyümesi %46 idi (toplam hücre sayısındaki artış), TCT işleminin hücre genişlemesini teşvik etmede etkili olduğunu gösteriyordu. Bu sonuçlar, işlemcinin tutarlı ve tekrarlanabilir...
Tartışmalar
CAR-T hücre tedavisi, B hücresi ve diğer maligniteler için umut verici bir tedavi yaklaşımı olarak ortaya çıkmıştır. Bununla birlikte, geleneksel CAR-T hücre üretim yöntemlerinin, yüksek maliyet, emek yoğun üretim ve kontaminasyon riskini artıran açık adımlar gibi çeşitli sınırlamaları vardır. Son zamanlarda, bu sınırlamaları ele almak için Miltenyi CliniMACS Prodigy ("işlemci") dahil olmak üzere birkaç yarı otomatik platform ortaya çıktı. Bu yazıda açıklanan işlemciye entegre e...
Açıklamalar
S.K., S.G. ve Y.W., Miltenyi Biotec'ten araştırma desteği aldı.
Teşekkürler
Yazarlar, çeşitli kişi ve kuruluşların bu çalışmaya katkılarını kabul eder. Hücre ve Gen Terapisi Laboratuvarı ve Penn Translasyonel ve İlişkili Çalışmalar Laboratuvarı, süreç geliştirme ve IND sunumlarına hazırlık konusunda değerli yardımlar sağladı. Melissa Varghese ve Amanda DiNofia, bu makalenin temelini oluşturan IND sunumları için süreç geliştirme ve hazırlığa katkıda bulundular. Bu çalışma, Philadelphia Çocuk Hastanesi Hücre ve Gen Terapisi İşbirliği'nin Hızlandırma Hibesi ile desteklenmiştir. Yazarlar ayrıca teknik ve araştırma destekleri için Miltenyi Biotec'e teşekkür eder. Şekil 1 , telif hakkı © 2023 Miltenyi Biotec B.V. & Co. KG kapsamındadır; Tüm hakları saklıdır.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
Referanslar
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır