A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ייצור תאי T של קולטן אנטיגן כימרי על מעבד תאים אוטומטי
In This Article
Summary
מאמר זה מפרט את תהליך הייצור של תאי T קולטני אנטיגן כימריים לשימוש קליני, במיוחד באמצעות מעבד תאים אוטומטי המסוגל לבצע התמרה נגיפית וטיפוח של תאי T. אנו מספקים המלצות ומתארים מלכודות שיש לקחת בחשבון במהלך תהליך הפיתוח והיישום של ניסוי קליני בשלב מוקדם.
Abstract
תאי קולטן אנטיגן כימרי (CAR)-T מייצגים גישה אימונותרפית מבטיחה לטיפול במחלות ממאירות ולא ממאירות שונות. תאי CAR-T הם תאי T מהונדסים גנטית המבטאים חלבון כימרי המזהה ונקשר למטרה על פני התא, וכתוצאה מכך הורג את תא המטרה. שיטות ייצור מסורתיות של תאי CAR-T הן עתירות עבודה, יקרות ועלולות לשאת סיכון לזיהום. CliniMACS Prodigy, מעבד תאים אוטומטי, מאפשר לייצר מוצרי תרפיה תאית בקנה מידה קליני במערכת סגורה, תוך מזעור הסיכון לזיהום. העיבוד מתבצע באופן חצי אוטומטי בשליטת המחשב ובכך ממזער את המעורבות האנושית בתהליך, מה שחוסך זמן ומפחית שונות ושגיאות.
כתב יד וסרטון זה מתאר את תהליך התמרת תאי T (TCT) לייצור תאי CAR-T באמצעות מעבד זה. תהליך ה-TCT כולל העשרה, הפעלה והעברה של תאי T מסוג CD4+/CD8+, התמרה באמצעות וקטור נגיפי, הרחבה וקציר. באמצעות מטריצת הפעילות, פונקציונליות המאפשרת הזמנה ותזמון של שלבים אלה, ניתן להתאים אישית את תהליך TCT באופן נרחב. אנו מספקים הדרכה על ייצור תאי CAR-T בהתאם לתנאי ייצור נאותים (cGMP) הנוכחיים ודנים בבדיקות שחרור נדרשות ובניסויים פרה-קליניים שיתמכו ביישום תרופה ניסיונית חדשה (IND). אנו מדגימים את ההיתכנות ודנים ביתרונות ובחסרונות של שימוש בתהליך חצי אוטומטי לייצור תאי CAR-T קליניים. לבסוף, אנו מתארים ניסוי קליני מתמשך ביוזמת חוקר המתמקד בממאירויות של תאי B בילדים [NCT05480449] כדוגמה לאופן שבו תהליך ייצור זה יכול להיות מיושם בסביבה קלינית.
Introduction
העברה מאומצת של תאי T שהונדסו לבטא קולטן אנטיגן כימרי (CAR) הראתה יעילות יוצאת דופן בטיפול בחולים עם ממאירויות עקשניות של תאי B 1,2,3,4,5. עם זאת, שיטות הייצור המסורתיות של תאי CAR-T הן עתירות עבודה, גוזלות זמן רב, ודורשות טכנאים מיומנים מאוד לביצוע צעדים מיוחדים ביותר. לדוגמה, תהליך הייצור המסורתי של מוצר תאי CAR-T אוטולוגי כולל צנטריפוגה הדרגתית של צפיפות, אלוטריזציה או הפרדה מגנטית להעשרת תאי T, הפעלה והתמרה עם וקטור נגיפי בצלוחית סטרילית, והתפשטות בביוריאקטור לפני הקציר והפורמולציה. לאחרונה צצו מערכות שונות שמטרתן להפוך תהליך זה לאוטומטי באופן חלקי. לדוגמה, Miltenyi CliniMACS Prodigy (להלן "המעבד") הוא מכשיר עיבוד תאים אוטומטי שיכול לבצע רבים מהשלבים הללו באופן אוטומטי 6,7,8,9. דיון מעמיק בשיטות ייצור CAR-T מסורתיות ואוטומטיות מוצג במאמר סקירה10 שפורסם לאחרונה.
המעבד מתבסס על הפונקציונליות של CliniMACS Plus, מכשיר רפואי מאושר על ידי מנהל המזון והתרופות האמריקאי (FDA) לעיבוד תאי אב המטופויטיים. המעבד כולל יחידת גידול תאים המאפשרת שטיפה, שבירה וטיפוח אוטומטיים של תאים (איור 1). תהליך התמרה של תאי T (TCT) הוא תוכנית מוגדרת מראש בתוך התקן המעבד המשחזרת במידה רבה ייצור ידני של תאי CAR-T. TCT מאפשר עיבוד תאים הניתן להתאמה אישית באמצעות ממשק משתמש גרפי ("מטריצת פעילות", איור 2). מכיוון שהמעבד הופך שלבים רבים לאוטומטיים ומאחד את הפונקציונליות של מכשירים מרובים למחשב אחד, הוא דורש פחות הכשרה ומיומנויות מיוחדות לפתרון בעיות מטכנולוגים. מכיוון שכל השלבים מבוצעים בתוך מערכת צינורות סגורה וחד-פעמית, ניתן להפעיל את המעבד במתקנים עם תשתית טיפול באוויר פחות מחמירה מזו שנחשבת מקובלת לתהליך ייצור פתוח. לדוגמה, אנו מפעילים את המעבד במתקן המאושר כ- ISO Class 8 (דומה ל- EU grade C).
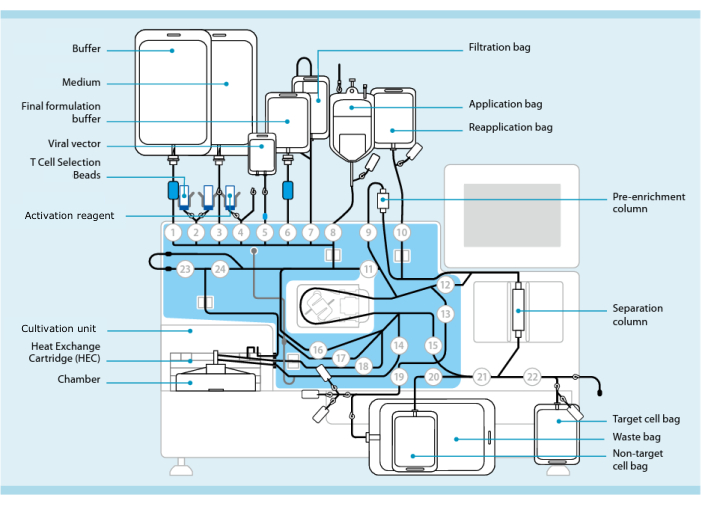
איור 1: ייצור תאי CAR-T באמצעות מערכת התמרה של תאי T. מוצג המעבד עם ערכת צינורות מותקנת. סט הצינורות מאפשר חיבור רכיבים נוספים כגון שקיות המכילות חיץ עיבוד, מדיום תרבית וקטור לנטיויראלי באמצעות ריתוך סטרילי. לאחר הוספת המוצר leukapheresis לשקית היישום, ניתן לתייג אותו בחרוזי בחירת תאי T, להעביר אותו דרך עמודת ההפרדה ולאחר מכן להעביר אותו לשקית היישום מחדש. תאים נבחרים מופנים לאחר מכן ליחידת הטיפוח של מכשיר התרבית ומופעלים באמצעות מגיב ההפעלה (ראו טבלת חומרים). המוצר הסופי נאסף בשקית תא היעד. לאורך כל התהליך ניתן להסיר דגימות לצורך בקרת איכות. מספרים אפורים בתוך עיגולים מייצגים את השסתומים הממוספרים במעבד המכוונים את נתיב הנוזל דרך מערכת הצינורות. הועתק באישור 11. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
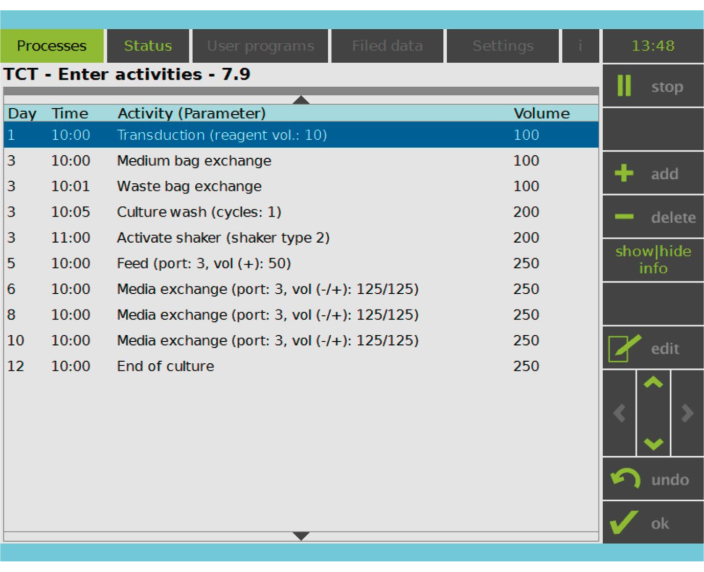
איור 2: מטריצת פעילות. לאחר הבחירה וההפעלה של תאי T, שאר תהליך הייצור של תאי CAR-T ניתן להתאמה אישית מלאה. ניתן להוסיף או למחוק פעילויות ולתזמן אותן ליום ולשעה המתאימים, וניתן לציין את נפח התרבות לאחר הפעילות (עוצמת קול). לדוגמה, פעילות הטרנסדוקציה הוגדרה להתחיל בשעה 10:00 בבוקר ביום הראשון, ונפח התרבית בסוף הפעילות הוגדר כ- 100 מ"ל. ניתן לערוך את מטריצת הפעילות לאורך כל תקופת הטיפוח. ניתן לפקח על מצב התהליך על המסך המשולב של מכשיר העיבוד. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
מטרת כתב היד הזה היא לספק הדרכה מפורטת על ייצור תאי CAR-T באמצעות המעבד, ובנוסף לספק הדרכה לגבי בדיקות בתהליך ושחרור המוצר, שככל הנראה יידרשו על ידי הרגולטורים כדי לאשר בקשה לתרופה ניסיונית חדשה (IND). הפרוטוקול המוצג נשאר קרוב לגישה המומלצת של הספק והוא הפרוטוקול הבסיסי עבור IND 28617, אשר נבחן כעת בניסוי קליני שלב I/II ביוזמת חוקר יחיד. ניסוי זה נועד לקבוע את הבטיחות והיעילות של השימוש במעבד זה לייצור תאי CAR-T אוטולוגיים אנושיים מכווני CD19 עבור חולים עם לוקמיה לימפובלסטית חריפה של תאי B (B-ALL) או לימפומה לימפובלסטית של שושלת B (B-Lly) [NCT05480449]. הניסוי החל בספטמבר 2022 ומתוכנן לגייס עד 89 חולים בגילאי 0-29 שנים עם B-ALL או B-Lly. אנו מדווחים על חלק מתוצאות הייצור מהניסוי בכתב היד.
ברצוננו לציין כי למרות שכתב היד מוצג כפרוטוקול עם שלבים שיש לבצע, יש לראות בו נקודת התחלה עבור אחרים להתחיל לייעל את תהליך ייצור תאי CAR-T שלהם. רשימה לא מקיפה של וריאציות אפשריות לפרוטוקול המוצג כוללת: שימוש בתאי T טריים במקום בהקפאה כחומר מוצא; שימוש בשיטה אחרת של העשרת תאי T או השמטתה לחלוטין; שימוש במדיה שונה וקוקטיילים ציטוקינים כגון IL7/IL15 במקום IL2; שינוי הריכוז של סרום AB אנושי או השמטתו לחלוטין; עיתוי ההתמרה; באמצעות תמלילים "מרובי להיטים"; תסיסה משתנה, נפחי תרבות ולוח זמנים להאכלה; שימוש בשיטות שונות של העברה גנטית כולל אלקטרופורציה של חומצות גרעין או וקטורים שאינם לנטיויראליים; שימוש במאגר פורמולציה סופית שונה ו/או בהגנה קריו-מגוננת; והחדרת תאי CAR-T טריים במקום שימור בהקפאה לעירוי במועד מאוחר יותר. לשינויים אלה עשויה להיות השפעה משמעותית על הרכב התאים ועוצמתו של המוצר הטיפולי.
| שלב התהליך הכולל | יום התהליך | פרטים טכניים | |||
| העשרת תאים | יום 0 | בחירת תאי T מסוג CD4+/CD8+ | |||
| הפעלת תאים | זריעה והפעלה של תרבית תאי T | ||||
| התמרה של תאים | יום 1 | התמרה לנטיויראלית (נפח תרבית של 100 מ"ל) | |||
| הרחבת תאים (ואחריה ניסוח תאים) | יום 2 | -- | |||
| יום 3 | תרחיץ תרחיץ (מחזור אחד); שייקר הופעל; נפח התרבית גדל ל -200 מ"ל | ||||
| יום 4 | -- | ||||
| יום 5 | הזנה (50 מ"ל); נפח התרבות מגיע לנפח הסופי של 250 מ"ל | ||||
| יום 6 | מדגם בתהליך; חילופי מדיה (-125 מ"ל / +125 מ"ל) | ||||
| יום 7 | החלפת מדיה (-150 מ"ל / +150 מ"ל) או קציר | ||||
| יום 8 | מדגם בתהליך; החלפת מדיה (-150 מ"ל / +150 מ"ל) או קציר | ||||
| יום 9 | החלפת מדיה (-180 מ"ל / +180 מ"ל) או קציר | ||||
| יום 10 | מדגם בתהליך; החלפת מדיה (-180 מ"ל / +180 מ"ל) או קציר | ||||
| יום 11 | החלפת מדיה (-180 מ"ל / +180 מ"ל) או קציר | ||||
| יום 12 | החלפת מדיה (-180 מ"ל / +180 מ"ל) או קציר | ||||
| יום 13 | קציר | ||||
טבלה 1: ציר הזמן של התהליך ומבט כולל. טבלה זו מסכמת את שלבי תהליך ה-TCT בהם נעשה שימוש בניסוי קליני נוכחי [NCT05480449]. התהליך מתחיל בהעשרת תאי T על ידי בחירת CD4+/CD8+, זריעת תרבית והפעלה ביום 0, ואחריו התמרה ביום 1. התאים נחים במשך 48 שעות, ולאחר מכן שטיפת תרבית, הגדלת נפח התרבית ל -200 מ"ל, ותסיסה באמצעות מנגנון טלטול. ביום 6 נלקחת הדגימה הראשונה בתהליך. תאים נקצרים ברגע שיש מספיק תאים זמינים לפחות לשלוש מנות מלאות של תאי CAR-T (5 × 106 תאי CAR-T לק"ג אם המטופל הוא <50 ק"ג, אחרת 2.5 × 108 תאי CAR-T) ובדיקות בקרת איכות (~ 2 × 106 תאי CAR-T); או ברגע שהתרבית מגיעה לסך של 4-5 x 109 תאים. קיצורים: TCT = טרנסדוקציה של תאי T; CAR-T = תאי T קולטן אנטיגן כימרי; MACS = מיון תאים המופעל באמצעות מגנטית.
Protocol
כל המחקר בוצע בהתאם להנחיות המוסדיות ובאישור ועדת הביקורת המוסדית של בית החולים (IRB), וכל הנבדקים נתנו הסכמה מדעת לפרסום הנתונים שנאספו במסגרת הניסוי.
הערה: החלק הראשון של הפרוטוקול מספק סקירה ברמה גבוהה של תהליך הייצור של CAR-T. שאר הסעיפים מספקים את ההוראות שלב אחר שלב. הפרוטוקול מתאר את זרימת העבודה באמצעות תוכנת TCT גרסה 1.4, שהיא הגרסה הנוכחית נכון לכתיבת שורות אלה. ממשק המשתמש של גרסאות אחרות של תוכנת TCT עשוי להשתנות.
1. ציר הזמן של התהליך וסקירה כללית (טבלה 1)
- התכוננו להליך ביום שני (יום -1) עם בדיקות טרום טיסה. ודא שהמעבד וציוד אחר פועלים כצפוי ושכל הריאגנטים והחומרים המתכלים זמינים ומעודכנים לכל תקופת הייצור.
- ביום 0, התקן את סט הצינוריות במכונה. הפשירו בעבר תאי T בהקפאה באמבטיה יבשה וחברו אותם על ידי ריתוך סטרילי לסט הצינוריות המותקן על המכשיר.
הערה: פרוטוקול זה מניח שתאי T אוטולוגיים נאספו באמצעות אפרזיס, נשמרו בהקפאה ואוחסנו עד תחילת הייצור. בעוד שניתן להשתמש בתאי T טריים שנאספו, זה מגדיל את הנטל הלוגיסטי מכיוון שהוא דורש תיאום איסוף אפרזיס עם ייצור תאי CAR-T. אנו ממליצים בחום להשתמש בתהליך הפשרה יבש במקום אמבט מים כדי למזער את הסיכון לזיהום חיידקי. - תייגו תאי T בריאגנטים CD4 ו-CD8 (ראו טבלת חומרים) והעשירו אותם באמצעות ברירה מגנטית.
הערה: ניתן להשמיט העשרת תאי T או לבצע אותה לפני טעינת תאים למעבד. ר' סעיף 5 לפרוטוקול. - לאחר העשרה של תאי CD4+/CD8+, קח דגימה לספירת תאים. זרעו את התרבית עם 1-2 × 108 תאים בנפח התחלתי של 70 מ"ל של מדיום (ראו טבלת חומרים) בתוספת סרום AB אנושי 5% ו- IL2 אנושי רקומביננטי (25 ננוגרם/מ"ל).
- הוסף בקבוקון של מגיב הפעלה (ננומטריצה פולימרית קולואידית מצומדת לנוגדנים נגד CD3 ונגד CD28; ראה טבלת חומרים) כדי להפעיל תאי T ולדגור על התרבית ללא תסיסה במשך 24 שעות ב 37 מעלות צלזיוס באטמוספירה של 5% CO2 . Cryopreserve כל שאריות תאי CD4+/CD8+ כגיבוי, אם תרצה בכך.
הערה: במקרה של כשל בייצור, תאים נבחרים מסוג CD4+/CD8+ עשויים לשמש כחומר מוצא. אם הכשל הוא טכני בלבד, כגון זיהום או שגיאת מפעיל, ונותרו מספיק תאים, ניתן לשקול שימוש בתאים שנותרו לביצוע ריצת ייצור נוספת. אם איכות החומר ההתחלתי מעוררת דאגה, אז הליך אפרזיס חדש יכול להיות מוצדק; עם זאת, בסופו של דבר מדובר בהחלטה קלינית. בכל מקרה, כשל בייצור הוא אירוע משמעותי שיש לחקור, ויש ליידע את נותן החסות ואולי גם את הרגולטורים. - לאחר 24 שעות של שפעול, התמירו תאי T עם וקטור לנטי-ויראלי בריבוי מתאים של זיהום (MOI).
הערה: קריטי לקבוע את הטיטר הווקטורי הלנטיוויראלי ולהקים MOI מתאים לפני תחילת ייצור מוצרים קליניים. הטיטר הווקטורי צריך להיקבע על ידי ביצוע ניסוי בקנה מידה קטן שבו תאי T ראשוניים אנושיים מומרים בריכוזים שונים של הווקטור. שיקולים עבור MOI המתאים כוללים את עלות הווקטור, יעילות ההמרה הרצויה, ומספר העתק וקטורי מקובל. פרוטוקול זה משתמש ב-MOI של 30-50% כדי למזער את עלות הווקטור ולשמור על מספר העתק וקטורי ממוצע מתחת ל-8 עותקים לכל תא מותמר. - ביום השלישי, הפעילו את פעילות Culture Wash, והתחילו תסיסה ברמה נמוכה. הגדל את נפח התרבית ל -200 מ"ל.
- ביום 5, להוסיף 50 מ"ל של מדיום לתרבית, להגדיל את נפח התרבות ל 250 מ"ל.
- ביום 6 של הטיפוח, קחו דגימה מהתרבית, וספרו תאי CAR-T לפי ציטומטריית זרימה. השתמש במדידה זו כדי להעריך את קצב הגידול של התרבית ולזהות את זמן הקציר האופטימלי.
הערה: כל דגימה בתהליך מניבה 3 מ"ל לבדיקה ומסירה 7 מ"ל מנפח התרבית הכולל. - מהיום השביעי עד ה-13, אם התרבית לא הופסקה, קחו עד שתי דגימות נוספות בתהליך בימים חלופיים, ובצעו חילופי מדיה יומיים כדי להזין את התרבות הגדלה. קצור את המוצר כאשר ספירת תאי הגרעין הכוללת (TNC) מגיעה ל- 5 × 10,9 ו / או כאשר מספיק תאים זמינים למספר המנות הנדרש ולבדיקות שחרור.
- ביום הקציר, קחו דגימה בתהליך מהתרבות הגדלה באופן פעיל. השתמש במדגם זה עבור מיקופלסמה, אנדוטוקסין, בדיקת לנטיוירוס (RCL) כשיר שכפול, בדיקת מספר העתקה וקטורית (VCN), ספירת תאים, ניתוח גודל תאים, ציטומטריית זרימה וכתם גרם.
- התחל את תוכנית הקציר הסופי, המפעילה את הסרת מדיום התרבית ושטיפת תאים עם חיץ הפורמולציה הסופי (תמיסה קריסטלואידית איזוטונית סטרילית בתוספת אלבומין 4% בסרום אנושי; ראה טבלת חומרים). לאחר השלמת הקציר, שקית תא היעד תכיל 100 מ"ל של תוצר התא במאגר הפורמולציה הסופי. הוסף dimethyl sulfoxide (DMSO) לריכוז של 10% (v/v), aliquot המוצר למינונים בודדים, ו cryopreserve באמצעות מקפיא בקצב מבוקר.
2. יום -1: בדיקות הכנה ובדיקת איכות
- ודא כי רמות גז CO2 ואוויר דחוס מספיקים כדי לייצר לחץ כניסה של לפחות 20 psi בכל קו.
- הפעל את המעבד וודא שאין שגיאות בעת ההפעלה. במידת הצורך, כוון את השעון לשעה הנכונה. כבה את המעבד.
- ודא שספירת התאים, עוצמת הקול וספירת CD4+ הכוללת וספירת CD8+ הכוללת של חומר ההתחלה של תא T ידועים.
- ודא שיש כמויות מספיקות של וקטור ויראלי, ריאגנטים, וחומרים מתכלים עבור כל הייצור לרוץ.
- הכניסו בקבוק של סרום AB אנושי למקרר כדי להפשיר למשך הלילה.
3. יום 0: התקנת סט אבובים
- הכן 3 ליטר של חיץ עיבוד (0.5% (w/v) אלבומין בסרום אנושי (HSA) במאגר מלח חוצץ פוספט / חומצה ethylenediaminetetraacetic (PBS / EDTA).
- הכינו 2 ליטר של מדיום תרבית (2 ליטר מדיום בתוספת 100 מ"ל של סרום AB אנושי לריכוז סופי של 5% ושני בקבוקונים של IL2 אנושי רקומביננטי ב 25 מיקרוגרם / בקבוקון; ראה טבלת חומרים למידע נוסף על ריאגנטים אלה). העבירו תרבית של 10 מ"ל לשקית מגיב של 20 מ"ל ואחסנו בטמפרטורה של 4 מעלות צלזיוס למשך הלילה.
- הפעל את המכשיר ובחר את תהליך התמרה של תאי T (TCT) מממשק מסך המגע. לחץ על הפעל כדי להתחיל את תהליך TCT; תן למכשיר להנחות את המשתמש לאורך ההליך באמצעות הוראות והנחיות על המסך.
- במסך קלט פרמטר , הזן את ראשי התיבות של המפעיל, את מספר הלוט של ערכת הצינור ואת תאריך התפוגה שלו כאשר תתבקש לעשות זאת.
- המסך הגדרת תהליך מציג ארבעה תהליכים שונים. בחר תהליך מלא (1).
הערה: תהליכים זמינים אחרים כוללים הפעלה מתאי T נבחרים מסוג CD4+/CD8+ (ראה סעיף 5 להלן) והפעלה מחדש של ריצת ייצור שבוטלה בעבר. - כשתתבקש, בחר שני בקבוקונים של מגיב בחירה כדי לשקף את שיטת הבחירה CD4+/CD8+ .
- התקן את ערכת הצינורות בהתאם להוראות שעל המסך. ודא שכל חיבורי Luer הדוקים ושאין פגמים במערכת הצינורות.
- בצע את ההוראות שעל המסך כדי להתחיל את בדיקות התקינות האוטומטיות העליונות והתחתונות.
הערה: בדיקת תקינות עלולה להיכשל עקב מערכת צינורות פגומה, מערכת צינורות שהותקנה באופן שגוי או פגם במשאבה הפריסטלטית של ההתקן. אנו ממליצים בחום להחזיק לפחות צינור אחד נוסף בהישג יד לריצות ייצור. אנו ממליצים גם לטכנאי שני לוודא את ההתקנה הנכונה של סט הצינורות. - בצע את ההוראות המופיעות על המסך לחיבור המדיום ולעיבוד שקיות החיץ.
- התחל את הפריימינג האוטומטי של ערכת הצינורות.
הערה: תהליך ה-TCT חייב להימשך תוך 3 שעות לאחר ההקדמה. ודא שחומר ההתחלה של תא T יהיה מוכן.
4. העשרת תאי T
- כאשר מסך המוצר Transfer cell מופיע, התחל להפשיר את מוצר תאי T השמור בהקפאה.
הערה: הנפח המקובל של תאי T שניתן להוסיף לערכת הצינור נע בין 50 ל -280 מ"ל. המספר המרבי של תאי יעד (סכום של CD4+ ו- CD8+) הוא 3 × 109, וספירת TNC המרבית היא 2 × 1010. - מעבירים את התאים המופשרים לשקית העברה של 150 מ"ל. ריתוך סטרילי של שקית ההעברה לשקית היישום של סט הצינורות.
- הסר דגימה משקית היישום באמצעות שקית QC ובצע ספירת תאים.
- חבר את בקבוקוני מגיב CD4 ו- CD8.
- התחל את תהליך הבחירה (העשרת תאי T).
- לאחר ההעשרה, הסר דגימה של התאים שנבחרו CD4+/CD8+ משקית ה- QC של שקית היישום מחדש לצורך ספירת תאים, ציטומטריית זרימה וניתוח גודל תא.
הערה: תוצאת ספירת התאים נדרשת כדי להמשיך לשלב הבא.
5. חלופה: החל מתאים נבחרים CD4+/CD8+
- הכן את המדיום כמתואר בשלב 3.2. אין צורך במאגר עיבוד.
- הפעל את המעבד ובחר טיפוח תאי T עם התקנת TS (3) במסך הגדרת תהליך . בצע את ההוראות וההנחיות המופיעות על המסך.
- בהתאם להוראות המופיעות על המסך, הגדירו את ערכת הצינורות במדיום במקום במאגר עיבוד.
- כאשר המסך "הכן מוצר תא Cultivation-Connect" מופיע, התחל להפשיר את תאי T שנבחרו CD4+/CD8+.
הערה: המספר המינימלי של תאי T (סכום תאי T CD4+ ו- CD8+) עבור התהליך הוא 1.0 × 108. - מעבירים תאים לשקית העברה של 150 מ"ל ומדללים בנפח בינוני עד סופי של 50 מ"ל.
- ריתוך סטרילי של מתלה התא לשקית היישום מחדש של המכשיר.
- הסר דגימה של התאים שנבחרו CD4+/CD8+ משקית ה- QC של שקית היישום מחדש לצורך ספירת תאים וניתוח גודל תאים.
6. הגדרת תרבות ותכנות של מטריצת הפעילות
- הזן את ריכוז התא ואת המספר ההתחלתי הרצוי (1-2 × 108 תאי T).
הערה: המכשיר ישאב באופן אוטומטי את עוצמת הקול המתאימה משקית היישום מחדש לתא התרבות ויכוונן את עוצמת הקול הסופית ל-70 מ"ל. - צרף בקבוקון של מגיב ההפעלה בהתאם להוראות שעל המסך.
- הזן 5% עבור ריכוז CO2 ו 39 ° C עבור טמפרטורת תא התרבית.
הערה: היצרן ממליץ להזין 39°C או ערך המכויל במיוחד עבור המכשיר. - הגדר את מטריצת הפעילות. השתמש בפרוטוקול הזנה משופרת כנקודת התחלה ושנה שלבים בודדים בתוך הפרוטוקול למפרטים המוגדרים על-ידי המשתמש (איור 2).
- ודא שזמן פעילות ההתמרה הוא 24 שעות לאחר הזריעה (יום 1).
- יש לוודא שזמן הפעילות של Culture Wash הוא 48 שעות לאחר הטרנסדוקציה (יום 3).
- הגדר את הזמן של Activate Shaker (סוג שייקר 2) ל- 30 דקות לאחר תחילת שטיפת התרביות.
- מחק כל פעילות של החלפת שקיות בינונית והחלפת שקיות אשפה .
- גע בסדר במסך כדי להתחיל לטפח.
- Cryopreserve כל שאריות CD4+/CD8+ תאים שנבחרו בשקית היישום לשימוש עתידי, במידת הצורך.
7. יום 1: התמרה של תאי T
- חשב את נפח הווקטור הלנטיויראלי לשימוש בהתבסס על MOI הרצוי.
- אחזר את שקית המגיב 20 מ"ל המכילה מדיום תרבית של 10 מ"ל שאוחסן ב -4 מעלות צלזיוס למשך הלילה (שלב 3.2). הפשיר את בקבוקון הווקטור והעבר את הנפח המחושב ב 7.1 לתוך שקית מגיב 20 מ"ל.
הערה: אנו ממליצים להקפיא כל וקטור שנותר לשמירה או למחקר ופיתוח. - שנה את מטריצת הפעילות כדי להגדיר את זמן ההמרה ל- 2 דקות בעתיד. כשתתבקש, גע בסדר כדי להתחיל את פעילות ההמרה.
- ריתוך סטרילי של השקית הווקטורית לסט הצינוריות בהתאם להוראות שעל המסך.
- שנה את מטריצת הפעילות בהתבסס על הזמן בפועל שבו פעילות ההמרה הופעלה.
הערה: אנו ממליצים להתחיל בהעברה תוך 20-24 שעות לאחר הזריעה כדי להבטיח ביצוע פעילויות מעשיות בשעות העבודה הרגילות.- ודא כי הזמן של תרבות לשטוף הוא 48 שעות לאחר טרנסדוקציה (יום 3).
- הגדר את הזמן של Activate Shaker (סוג שייקר 2) ל- 30 דקות לאחר Culture Wash (יום 3).
- ודא כי הזמן של חילופי מדיה הוא אחר הצהריים (13:00) של יום 6.
8. יום 6: דגימה ראשונה בתהליך
- גע בלחצן דוגמה ופעל בהתאם להוראות שעל המסך כדי לקבל דגימת QC מהתרבות הפעילה.
- בצע ספירת תאים, ציטומטריית זרימה וניתוח גודל תאים. שלח 1 מ"ל של הדגימה עבור כתם גרם.
הערה: יש לחזור על ספירת תאים בערך כל יומיים כדי לעקוב אחר צמיחת התרבית. - הכינו עוד 2 ליטר של מדיום תרבות (ראה שלב 3.2).
- הוסף פעילות החלפת תיקים בינונית למטריצת הפעילות, המתוזמנת להתחיל 2 דקות בעתיד. התאם את פעילות Media Exchange כך שתתחיל 20 דקות בעתיד. בצע את ההוראות המופיעות על המסך.
הערה: Media Exchange הוא התחליף של מדיום התרבות בתא הטיפוח. Medium Bag Exchange הוא תחליף לתיק התרבית הבינוני התלוי על המכשיר.
9. יום הקציר (בין יום 7 ל-13): קציר ושימור בהקפאה
- גע בלחצן דוגמה ופעל בהתאם להוראות שעל המסך כדי לקבל דגימת QC מהתרבות הפעילה.
- הפרד את דגימת QC לשלושה aliquots של 1 מ"ל כל אחד. השתמש ב- 1 מ"ל לניתוח ציטומטריית זרימה, ספירת תאים וגודל תא. השתמש 1 מ"ל עבור mycoplasma, מספר עותק וקטורי, lentivirus מוכשר שכפול, ובדיקת אנדוטוקסין. שלח את 1 מ"ל הסופי עבור כתם גרם.
- הכינו את חיץ הפורמולציה הסופי (תמיסה קריסטלואידית איזוטונית סטרילית בתוספת 4% HSA בשקית 2 ליטר, ראו טבלת חומרים). שמור 100 מ"ל של מאגר זה כדי להכין את הפתרון cryoprotectant בשלב מאוחר יותר.
- שנה את מטריצת הפעילות כדי להגדיר את זמן סיום התרבות ל- 2 דקות בעתיד ומחק את כל שאר הפעילויות הנותרות. בצע את ההוראות שעל המסך כדי לחבר את מאגר הפורמולציה הסופי לערכת הצינורות ולהתחיל בקטיף.
הערה: המעבד יעביר באופן אוטומטי את התאים לשקית תא היעד. נפח יהיה 100 מ"ל. - קח דגימה של 0.5 מ"ל משקית QC של שקית תא היעד ובצע ספירת תאים.
- אטמו את שקית תא היעד והוציאו אותה ממערכת הצינורות. חלקו את מוצר ה-CAR-T למינונים מתאימים ושמרו אותם בהקפאה במקפיא בקצב מבוקר. אחסן תאים בשלב האדים של מיכל אחסון חנקן נוזלי בטמפרטורה של ≤ -150 מעלות צלזיוס.
הערה: ניסוח סופי וציטוט של מינונים ספציפיים לפרוטוקול. אנו מספקים כאן דוגמה שבה שלוש מנות שוות של תאי CAR-T ובקבוקוני QC נשמרות בהקפאה. ראה סעיף 10 לפרטים. - הורד את נתוני התהליך מהמכשיר, הסר והשלך את ערכת הצינורות, ובצע כיבוי.
10. שימור בהקפאה של תאי CAR-T
הערה: פרוטוקול זה מניח שתאי CAR-T נשמרים בהקפאה לאחר הייצור ומאוחסנים עד שהמטופל מוכן לעירוי. בעוד שניתן להחדיר תאי CAR-T טריים, זה מגדיל את הנטל הלוגיסטי מכיוון שזה דורש תיאום ייצור תאי CAR-T עם עירוי תאי CAR-T. זה עלול להיות בעייתי במקרה של כשל בייצור. במיוחד אם הפרוטוקול הקליני דורש כימותרפיה מדלדלת לימפו לפני עירוי CAR-T, אנו ממליצים בחום לשמר בהקפאה, מכיוון שכשל בייצור עלול לחשוף את המטופל לסיכון של כימותרפיה מיותרת. רגולטורים עשויים לדרוש מהחוקרים להוכיח שהמוצר עובר את כל בדיקות השחרור לפני העירוי, דבר שעשוי להיות קשה להשגה ללא הקפאה.
- מתוך 100 מ"ל המוצר הסופי שנקטף, קבע והסר את הנפח הדרוש כדי לעמוד במינוני CAR-T הרצויים ובבקבוקוני בקרת איכות (QC) לביצוע בדיקות שחרור נוספות (למשל, כדאיות), שמירה ודגימת סטריליות.
הערה: זה קריטי לפתח אסטרטגיה מוגדרת לחלוטין עבור aliquoting המוצר הסופי. אנו ממליצים לייצר מנות מרובות של המוצר כדי לאפשר עירויים, בהתחשב בכך שיש מספיק חומר זמין. נפח מוצר של 10-20 מ"ל בשקית מאפשר הפשרה מהירה ועירוי קל בלחיצת מזרק. מומלץ למלא כל מוצר למינון הרצוי של תאי CAR-T (למשל, 5 × 10 6 תאי CAR-T לק"ג או 2.5 × 108 תאי CAR-T) מכיוון שהדבר ימנע את הצורך בחישובי מינון ביום העירוי. כמו כן מומלץ לשמור בהקפאה לפחות ארבעה בקבוקוני QC ולקחת בחשבון את האפשרות שיש שאריות חומר; אנו מציעים לשמור חומר זה מכיוון שהוא יכול להיות שימושי למטרות מחקר ופיתוח. - צנטריפוגה את התאים כדי להקטין את נפח.
- העלה את המוצר(ים) למחצית מהנפח הסופי הרצוי באמצעות החלק של מאגר הניסוח הסופי שהונח בצד בשלב 9.3.
- הכן 2x cryoprotectant על ידי יצירת פתרון DMSO 20% במאגר הנוסחה הסופי.
הערה: ניתן לשנות את נוסחת Cryoprotectant ואת ריכוז DMSO. - הוסף 2x cryoprotectant לתאים בנפח שווה עבור ריכוז DMSO סופי של 10%.
הערה: יש למזער את משך החשיפה של המוצר להגנה קריופרוטקטיבית. - מלאו את שקיות המינון ואת בקבוקוני ה-QC. שלח 1 מ"ל לסטריליות.
הערה: רגולטורים בדרך כלל דורשים בדיקת סטריליות של 14 יום המבוצעת על המוצר הסופי. עם זאת, בדיקות סטריליות מהירות מתעוררות; בשלב זה, שיטת 14 הימים היא הנפוצה ביותר. - מוצרי Cryopreserve באמצעות מקפיא בקצב מבוקר.
הערה: יש לאמת את תוכנית המקפיא בקצב מבוקר כדי להפיק קצב קירור של ~ -1 ºC לדקה עד ~ -45 ºC, עם פיצוי עבור הנקודה האוטקטית. - יש לאחסן את המוצר בשלב האדים של מקפיא אולטרה-נמוך עם חנקן נוזלי בטמפרטורה של ≤ -150°C.
11. בחינת ביצוע ההליך
הערה: לאורך כל תהליך ה-TCT, נלקחות מספר דגימות QC מהתרבית הפעילה. טבלה 2 מספקת רשת שיכולה לסייע לקורא לארגן את התוצאות לצורך עיון ולחשב מדדי ביצועים של פרוצדורות. המונחים שלהלן המורכבים מאות ומספר (לדוגמה, "B4") מתייחסים לתאים ברשת של טבלה זו. הערכים הבאים משמשים בחישובי הביצועים: B3 = סך כל התאים הגרעין (TNC) טרום העשרה; B4 = TNC לאחר העשרה; E2 = סכום תאי T CD4+ ו- CD8+ כאחוז מסך התאים של מכפלת האפרזיס הראשונית; E4 = סכום תאי T CD4+ ו- CD8+ כאחוז מסך התאים לאחר העשרה; G2 = תאי CD19+ כאחוז מסך התאים של המוצר הראשוני; G4 = תאי CD19+ כאחוז מסך התאים לאחר העשרת CD4+/CD8+; B10 = TNC של התרבות הפעילה ביום הקציר.
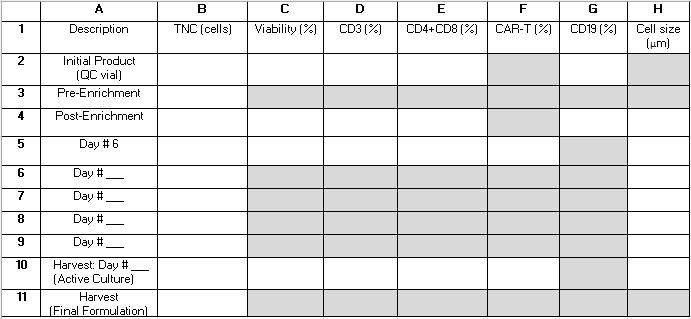
טבלה 2: רשת ביצוע פרוצדורות. אנו מספקים רשת זו כדי לסייע בארגון בדיקות בתהליך הדרושות לחישוב סטטיסטיקות ביצועי הליך. שורות מייצגות דגימות שנותחו בנקודות זמן שונות במהלך ההליך ומסומנות במספרים 1-11. ניתן להשתמש בשורות 6-9 כדי ללכוד תוצאות מדגימות שנלקחו לאחר יום 6 לגידול אך לפני יום הקציר. עמודות מייצגות פרמטרים שנמדדו ומסומנות באותיות A-H. שדות מוצללים באפור אינם חלים. שדות נוספים עשויים שלא לחול בהתאם להעשרת CD4+/CD8+ כחלק מההליך ומשך הגידול. אנו מציעים לכתוב "N/A" לתוך שדות אלה. קיצורים: TNC = ספירת תאים גרעין כוללת; QC = בקרת איכות. אנא לחץ כאן כדי להוריד טבלה זו.
- חישוב התאוששות של תאי CD4+/CD8+ לאחר הבחירה על ידי חלוקת המספר הכולל של תאי CD4+ בתוספת CD8+ T לאחר העשרה במספר הכולל של תאי CD4+ בתוספת CD8+ T לפני העשרה באמצעות משוואה (1).
CD4+/CD8+ שחזור תאי T =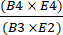 (1)
(1) - חישוב דלדול תאי CD19+ לאחר העשרה על ידי חלוקת המספר הכולל של תאי CD19+ לאחר העשרת CD4+/CD8+ במספר הכולל של תאי CD19+ לפני ההעשרה. מכיוון שמספר זה צפוי להיות קטן מאוד, דווח על הלוגריתם של שבר זה כפי שמוצג במשוואה (2):
יומן CD19 דלדול תאים = יומן10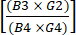 (2)
(2) - חישוב הגידול הכולל על ידי חלוקת המספר הכולל של תאים בתרבית פעילה בעת הקציר במספר התאים שנזרעו באמצעות משוואה (3):
גידול קיפול כולל =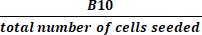 (3)
(3) - חשב את הגידול היומי הממוצע על ידי לקיחת שורש הגידול הכולל ביחס ליום הקציר באמצעות משוואה (4):
צמיחה יומית ממוצעת = יום הקציר √ (צמיחה כוללת כפולה) (4)
תוצאות
תוצאות משלוש ריצות הייצור הראשונות של CAR-T בניסוי NCT05480449 מוצגות להלן בטבלה 3. חומר המוצא, וקטור, ציטוקינים בתרבית וריכוזי AB בסרום נשמרו עקביים בכל ריצה. המוצרים נקטפו ביום 7 או 8. צמיחת התאים היומית הממוצעת הייתה 46% (עלייה בספירת התאים הכוללת), מה שמצביע על כך שתהליך ה-TCT היה יעיל בקידום...
Discussion
טיפול בתאי CAR-T התגלה כגישה טיפולית מבטיחה עבור תאי B וממאירויות אחרות. עם זאת, לשיטות ייצור מסורתיות של תאי CAR-T יש מספר מגבלות, כגון עלות גבוהה, ייצור עתיר עבודה וצעדים פתוחים המגבירים את הסיכון לזיהום. לאחרונה, מספר פלטפורמות אוטומטיות למחצה, כולל Miltenyi CliniMACS Prodigy ("המעבד"), צצו כדי להתמודד עם מ...
Disclosures
S.K., S.G. ו-Y.W. קיבלו תמיכה מחקרית מ-Miltenyi Biotec.
Acknowledgements
המחברים רוצים להכיר בתרומתם של מספר אנשים וארגונים לעבודה זו. המעבדה לתרפיה תאית וגנטית והמעבדה למחקרי תרגום וקורלציה של פן סיפקו סיוע רב ערך בפיתוח תהליכים ובהכנה להגשות IND. מליסה ורגזה ואמנדה דינופיה תרמו לתהליך, הפיתוח וההכנה להגשות IND העומדות בבסיס כתב היד הזה. עבודה זו נתמכה על ידי מענק האצה של התא ותרפיה גנטית שיתופית של בית החולים לילדים של פילדלפיה. המחברים רוצים גם להודות ל-Miltenyi Biotec על התמיכה הטכנית והמחקרית שלהם. איור 1 מכוסה על ידי זכויות יוצרים © 2023 Miltenyi Biotec B.V. &; Co. KG; כל הזכויות שמורות.
Materials
| Name | Company | Catalog Number | Comments |
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
References
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved