È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Produzione di cellule T del recettore dell'antigene chimerico su un processore cellulare automatizzato
In questo articolo
Riepilogo
Questo articolo descrive in dettaglio il processo di produzione delle cellule T del recettore dell'antigene chimerico per uso clinico, in particolare utilizzando un processore cellulare automatizzato in grado di eseguire la trasduzione virale e la coltivazione delle cellule T. Forniamo raccomandazioni e descriviamo le insidie che dovrebbero essere considerate durante lo sviluppo del processo e l'implementazione di uno studio clinico in fase iniziale.
Abstract
Le cellule T del recettore chimerico dell'antigene (CAR)-T rappresentano un promettente approccio immunoterapico per il trattamento di varie malattie maligne e non maligne. Le cellule CAR-T sono cellule T geneticamente modificate che esprimono una proteina chimerica che riconosce e si lega a un bersaglio della superficie cellulare, con conseguente uccisione della cellula bersaglio. I metodi tradizionali di produzione di celle CAR-T sono laboriosi, costosi e possono comportare il rischio di contaminazione. Il CliniMACS Prodigy, un processore cellulare automatizzato, consente di produrre prodotti per la terapia cellulare su scala clinica in un sistema chiuso, riducendo al minimo il rischio di contaminazione. L'elaborazione avviene in modo semiautomatico sotto il controllo di un computer e quindi riduce al minimo il coinvolgimento umano nel processo, risparmiando tempo e riducendo la variabilità e gli errori.
Questo manoscritto e video descrivono il processo di trasduzione delle cellule T (TCT) per la produzione di cellule CAR-T utilizzando questo processore. Il processo TCT prevede l'arricchimento, l'attivazione, la trasduzione con un vettore virale, l'espansione e la raccolta delle cellule T CD4+/CD8+. Utilizzando la Matrice delle Attività, una funzionalità che consente l'ordinamento e la tempistica di questi passaggi, il processo TCT può essere ampiamente personalizzato. Forniamo una panoramica della produzione di cellule CAR-T in conformità con le attuali buone pratiche di fabbricazione (cGMP) e discutiamo i test di rilascio richiesti e gli esperimenti preclinici che supporteranno una domanda di nuovo farmaco sperimentale (IND). Dimostriamo la fattibilità e discutiamo i vantaggi e gli svantaggi dell'utilizzo di un processo semiautomatico per la produzione clinica di cellule CAR-T. Infine, descriviamo uno studio clinico in corso avviato dallo sperimentatore che prende di mira le neoplasie pediatriche a cellule B [NCT05480449] come esempio di come questo processo di produzione possa essere applicato in un contesto clinico.
Introduzione
Il trasferimento adottivo di cellule T ingegnerizzate per esprimere un recettore chimerico dell'antigene (CAR) ha mostrato una notevole efficacia nel trattamento di pazienti con neoplasie refrattarie a cellule B 1,2,3,4,5. Tuttavia, i metodi di produzione tradizionali per le celle CAR-T sono laboriosi, richiedono molto tempo e tecnici altamente qualificati per eseguire passaggi altamente specializzati. Ad esempio, il processo di produzione tradizionale di un prodotto a base di cellule CAR-T autologhe prevede la centrifugazione a gradiente di densità, l'elutriazione o la separazione magnetica per arricchire le cellule T, l'attivazione e la trasduzione con un vettore virale in un matraccio sterile e l'espansione in un bioreattore prima della raccolta e della formulazione. Recentemente sono emersi vari sistemi che mirano ad automatizzare parzialmente questo processo. Ad esempio, il Miltenyi CliniMACS Prodigy (di seguito denominato "processore") è un dispositivo automatizzato per l'elaborazione delle cellule in grado di eseguire molti di questi passaggi in modo automatizzato 6,7,8,9. Una discussione approfondita dei metodi di produzione CAR-T tradizionali e automatizzati è presentata in un recente articolo di revisione10.
Il processore si basa sulla funzionalità di CliniMACS Plus, un dispositivo medico approvato dalla Food and Drug Administration (FDA) statunitense per l'elaborazione di cellule progenitrici ematopoietiche. Il processore include un'unità di coltivazione cellulare che consente il lavaggio, il frazionamento e la coltivazione automatizzati delle cellule (Figura 1). Il processo di trasduzione delle cellule T (TCT) è un programma preimpostato all'interno del dispositivo del processore che replica in gran parte la produzione manuale di celle CAR-T. TCT consente l'elaborazione personalizzabile delle celle utilizzando un'interfaccia utente grafica (la "Matrice delle attività", Figura 2). Poiché il processore automatizza molti passaggi e consolida la funzionalità di più dispositivi in un'unica macchina, richiede meno formazione e competenze specializzate per la risoluzione dei problemi da parte dei tecnici. Poiché tutte le fasi vengono eseguite all'interno di un set di tubi chiuso e monouso, il processore può essere utilizzato in strutture con infrastrutture di trattamento dell'aria meno rigorose di quelle che sarebbero considerate accettabili per un processo di produzione aperto. Ad esempio, stiamo gestendo il processore in uno stabilimento certificato come ISO classe 8 (paragonabile al grado C dell'UE).
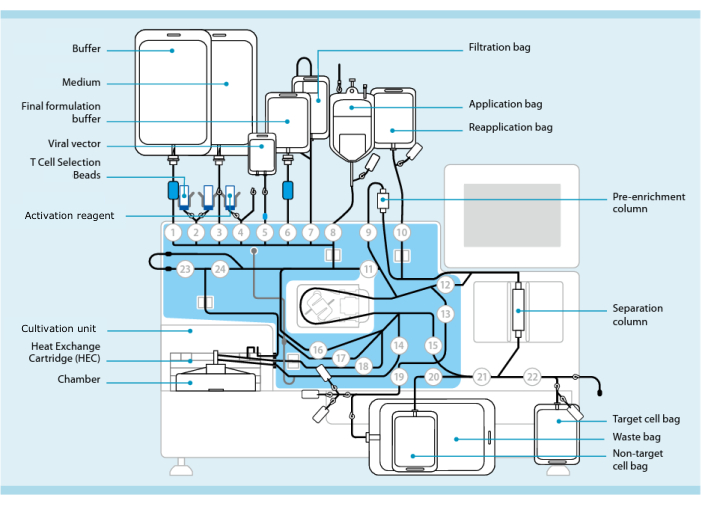
Figura 1: Produzione di cellule CAR-T utilizzando il sistema di trasduzione delle cellule T. Nell'immagine è mostrato il processore con il set di tubi installato. Il set di tubi consente di collegare altri componenti come sacche contenenti tampone di lavorazione, terreno di coltura e vettore lentivirale tramite saldatura sterile. Una volta che il prodotto per la leucoaferesi è stato aggiunto al sacchetto di applicazione, può essere etichettato con perline di selezione delle cellule T, fatto passare attraverso la colonna di separazione e quindi trasferito nel sacchetto di riapplicazione. Le cellule selezionate vengono quindi indirizzate all'unità di coltura dello strumento per la coltura e attivate con il reagente di attivazione (vedere la tabella dei materiali). Il prodotto finale viene raccolto nella sacca cellulare Target. Durante tutto il processo, è possibile prelevare i campioni per il controllo qualità in modo asettico. I numeri grigi all'interno dei cerchi rappresentano le valvole numerate sul processore che dirigono il percorso del liquido attraverso il set di tubi. Riprodotto con permesso da 11. Fare clic qui per visualizzare una versione più grande di questa figura.
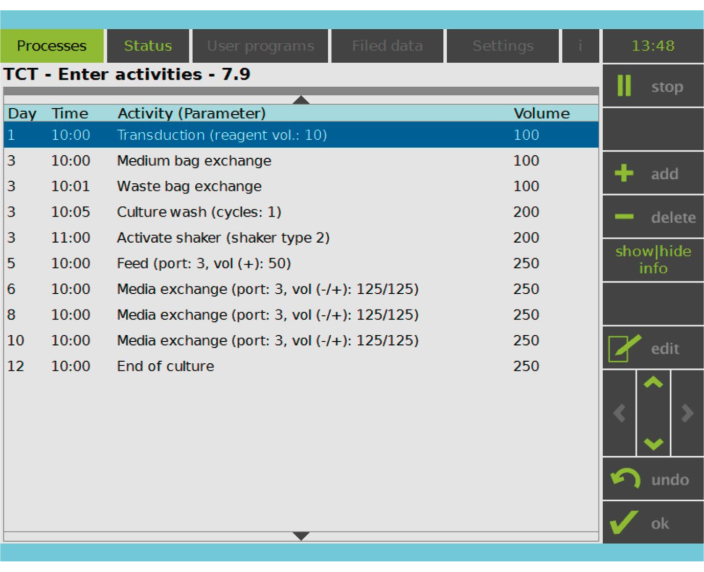
Figura 2: Matrice delle attività. Dopo la selezione e l'attivazione delle cellule T, il resto del processo di produzione delle cellule CAR-T è completamente personalizzabile. Le attività possono essere aggiunte o eliminate e pianificate per il giorno e l'ora appropriati ed è possibile specificare il volume delle impostazioni cultura dopo l'attività (Volume). Ad esempio, l'attività di trasduzione è stata configurata per iniziare alle 10:00 del giorno 1 e il volume di coltura alla fine dell'attività è stato impostato su 100 ml. La Matrice delle Attività può essere modificata durante tutto il periodo di coltivazione. Lo stato del processo può essere monitorato sullo schermo integrato del dispositivo di elaborazione. Fare clic qui per visualizzare una versione più grande di questa figura.
Lo scopo di questo manoscritto è quello di fornire una guida dettagliata alla produzione di cellule CAR-T utilizzando il processore e fornire inoltre indicazioni sui test in corso e di rilascio del prodotto che saranno probabilmente richiesti dalle autorità di regolamentazione per approvare una domanda di nuovo farmaco sperimentale (IND). Il protocollo presentato rimane vicino all'approccio raccomandato dal fornitore ed è il protocollo alla base di IND 28617, che è attualmente in fase di valutazione in uno studio clinico di fase I/II avviato da un singolo sperimentatore. Questo studio mira a determinare la sicurezza e l'efficacia dell'utilizzo di questo processore per produrre cellule CAR-T autologhe umanizzate dirette da CD19 per pazienti con leucemia linfoblastica acuta a cellule B (B-ALL) o linfoma linfoblastico di linea B (B-LLY) [NCT05480449]. Lo studio è iniziato a settembre 2022 e prevede di arruolare fino a 89 pazienti di età compresa tra 0 e 29 anni con B-ALL o B-Lly. Riportiamo nel manoscritto alcuni risultati di fabbricazione della prova.
Vorremmo sottolineare che, sebbene il manoscritto sia presentato come un protocollo con i passaggi da seguire, dovrebbe essere considerato un punto di partenza per altri per iniziare a ottimizzare il proprio processo di produzione di cellule CAR-T. Un elenco non esaustivo di possibili variazioni al protocollo presentato include: l'utilizzo di cellule T fresche invece di quelle crioconservate come materiale di partenza; l'utilizzo di un metodo diverso di arricchimento delle cellule T o l'omissione del tutto; l'utilizzo di diversi terreni e cocktail di citochine come IL7/IL15 invece di IL2; variare la concentrazione di AB sierico umano o ometterla del tutto; tempi di trasduzione; l'utilizzo di trasduzioni "multi-hit"; variare l'agitazione, i volumi di coltura e il programma di alimentazione; l'utilizzo di diversi metodi di trasferimento genetico, tra cui l'elettroporazione di acidi nucleici o vettori non lentivirali; utilizzando un tampone e/o crioprotettore di formulazione finale diverso; e l'infusione di cellule CAR-T fresche invece di crioconservarle per l'infusione in un secondo momento. Queste variazioni possono avere un impatto significativo sulla composizione cellulare e sulla potenza del prodotto terapeutico.
| Fase complessiva del processo | Giorno del processo | Dettagli tecnici | |||
| Arricchimento cellulare | Giorno 0 | Selezione di cellule T CD4+/CD8+ | |||
| Attivazione cellulare | Semina e attivazione di colture di cellule T | ||||
| Trasduzione cellulare | Giorno 1 | Trasduzione lentivirale (volume di coltura di 100 mL) | |||
| Espansione cellulare (seguita dalla formulazione cellulare) | Giorno 2 | -- | |||
| Giorno 3 | Lavaggio coltura (1 ciclo); Scuotitore attivato; Il volume di coltura aumenta a 200 mL | ||||
| Giorno 4 | -- | ||||
| Giorno 5 | Mangime (50 ml); Il volume di coltura raggiunge il volume finale di 250 mL | ||||
| Giorno 6 | Campione in corso di lavorazione; Scambio di terreni (-125 mL / +125 mL) | ||||
| Giorno 7 | Scambio di terreni (-150 mL / +150 mL) o Raccolta | ||||
| Giorno 8 | Campione in corso di lavorazione; Scambio di terreni (-150 mL / +150 mL) o Raccolta | ||||
| Giorno 9 | Scambio di terreni (-180 mL / +180 mL) o Raccolta | ||||
| Giorno 10 | Campione in corso di lavorazione; Scambio di terreni (-180 mL / +180 mL) o Raccolta | ||||
| Giorno 11 | Scambio di terreni (-180 mL / +180 mL) o Raccolta | ||||
| Giorno 12 | Scambio di terreni (-180 mL / +180 mL) o Raccolta | ||||
| Giorno 13 | Raccolto | ||||
Tabella 1: Sequenza temporale e panoramica del processo. Questa tabella riassume le fasi del processo TCT impiegate in uno studio clinico in corso [NCT05480449]. Il processo inizia con l'arricchimento delle cellule T mediante selezione CD4+/CD8+, semina e attivazione della coltura il giorno 0, seguito dalla trasduzione il giorno 1. Le cellule riposano per 48 ore, seguite da un lavaggio della coltura, un aumento del volume della coltura a 200 ml e agitazione mediante un meccanismo di agitazione. Il giorno 6 viene prelevato il primo campione in lavorazione. Le cellule vengono raccolte quando sono disponibili cellule sufficienti per almeno tre dosi complete di cellule CAR-T (5 × 106 cellule CAR-T/kg se il paziente pesa <50 kg, altrimenti 2,5 × 108 cellule CAR-T) e test di controllo qualità (~2 × 106 cellule CAR-T); o una volta che la coltura raggiunge un totale di 4-5 x 109 cellule. Abbreviazioni: TCT = trasduzione delle cellule T; CAR-T = cellule T chimeriche del recettore dell'antigene; MACS = selezione cellulare attivata magneticamente.
Protocollo
Tutta la ricerca è stata condotta in conformità con le linee guida istituzionali con l'approvazione dell'Institutional Review Board (IRB) dell'ospedale e tutti i soggetti hanno fornito il consenso informato per la pubblicazione dei dati raccolti nel contesto dello studio.
NOTA: La prima sezione del protocollo fornisce una panoramica generale del processo di produzione delle CAR-T. Le sezioni rimanenti forniscono le istruzioni dettagliate. Il protocollo descrive il flusso di lavoro utilizzando la versione 1.4 del software TCT, che è la versione corrente al momento della stesura di questo documento. L'interfaccia utente di altre versioni del software TCT può variare.
1. Tempistica e panoramica del processo (Tabella 1)
- Preparati per la procedura il lunedì (giorno -1) con controlli pre-volo. Assicurarsi che il processore e le altre apparecchiature funzionino come previsto e che tutti i reagenti e i materiali di consumo siano disponibili e aggiornati per l'intero ciclo di produzione.
- Il giorno 0, installare il set di tubi sulla macchina. Scongelare le cellule T precedentemente crioconservate in un bagno asciutto e collegarle mediante saldatura sterile al set di tubi installato sullo strumento.
NOTA: Questo protocollo presuppone che le cellule T autologhe siano state raccolte tramite aferesi, crioconservate e conservate fino all'inizio della produzione. Sebbene sia possibile utilizzare cellule T appena raccolte, ciò aumenta l'onere logistico in quanto richiede il coordinamento della raccolta dell'aferesi con la produzione di cellule CAR-T. Si consiglia vivamente di utilizzare un processo di scongelamento a secco invece di un bagno d'acqua per ridurre al minimo il rischio di contaminazione batterica. - Etichettare le cellule T con i reagenti CD4 e CD8 (vedere la tabella dei materiali) e arricchirle mediante selezione magnetica.
NOTA: È possibile omettere l'arricchimento delle cellule T o eseguirlo prima di caricare le celle sul processore. Cfr. la sezione 5 del protocollo. - Dopo l'arricchimento delle cellule CD4+/CD8+, prelevare un campione per la conta delle cellule. Seminare la coltura con 1-2 × 10-8 cellule in un volume iniziale di 70 mL di terreno (vedi Tabella dei materiali) integrato con il 5% di siero AB umano e IL2 umano ricombinante (25 ng/mL).
- Aggiungere una fiala di reagente di attivazione (una nanomatrice polimerica colloidale coniugata ad anticorpi anti-CD3 e anti-CD28; vedere la tabella dei materiali) per attivare le cellule T e incubare la coltura senza agitazione per 24 ore a 37 ºC in un'atmosfera di CO2 al 5%. Se lo si desidera, crioconservare eventuali cellule CD4+/CD8+ rimanenti come backup.
NOTA: In caso di errore di fabbricazione, le celle selezionate CD4+/CD8+ rimanenti possono essere utilizzate come materiale di partenza. Se il guasto è puramente tecnico, come la contaminazione o l'errore dell'operatore, e rimangono celle sufficienti, è possibile prendere in considerazione l'utilizzo di celle rimanenti per eseguire un ciclo di produzione aggiuntivo. Se la qualità del materiale di partenza è preoccupante, potrebbe essere giustificata una nuova procedura di aferesi; Tuttavia, questa è in definitiva una decisione clinica. In entrambi i casi, un errore di produzione è un evento significativo che dovrebbe essere indagato e lo sponsor e possibilmente le autorità di regolamentazione dovrebbero essere informati. - Dopo 24 ore dall'attivazione, trasdurre le cellule T con vettore lentivirale ad un'appropriata molteplicità di infezione (MOI).
NOTA: È fondamentale determinare il titolo del vettore lentivirale e stabilire un MOI appropriato prima di iniziare a produrre prodotti clinici. Il titolo del vettore deve essere determinato eseguendo un esperimento su piccola scala in cui le cellule T primarie umane vengono trasdotte a varie concentrazioni del vettore. Le considerazioni per il MOI appropriato includono il costo del vettore, l'efficienza di trasduzione desiderata e un numero di copie vettoriali accettabile. Questo protocollo utilizza un MOI del 30-50% per ridurre al minimo il costo del vettore e mantenere il numero medio di copie vettoriali al di sotto di 8 copie per cellula trasdotta. - Il giorno 3, attiva l'attività Culture Wash e inizia l'agitazione di basso livello. Aumentare il volume di coltura a 200 ml.
- Il giorno 5, aggiungere 50 ml di terreno alla coltura, aumentando il volume della coltura a 250 ml.
- Il 6° giorno di coltivazione, prelevare un campione dalla coltura ed enumerare le cellule CAR-T mediante citometria a flusso. Usa questa misurazione per stimare la velocità di crescita della coltura e identificare il momento ottimale del raccolto.
NOTA: Ogni campionamento durante il processo produce 3 mL per il test e rimuove 7 mL totali dal volume di coltura. - Dal giorno 7 al giorno 13, se la coltura non è stata interrotta, prelevare fino a due campioni aggiuntivi in corso a giorni alterni ed eseguire scambi quotidiani di media per nutrire la coltura in crescita. Raccogliere il prodotto quando la conta totale delle cellule nucleate (TNC) raggiunge 5 × 109 e/o quando sono disponibili cellule sufficienti per il numero richiesto di dosi e prove di rilascio.
- Il giorno del raccolto, prelevare un campione in corso dalla coltura in fase di crescita. Utilizzare questo campione per il test del micoplasma, dell'endotossina, del lentivirus competente per la replicazione (RCL), del test del numero di copie vettoriali (VCN), della conta cellulare, dell'analisi delle dimensioni cellulari, della citometria a flusso e della colorazione di Gram.
- Avviare il programma di raccolta finale, che innesca la rimozione del terreno di coltura e un lavaggio cellulare con il tampone di formulazione finale (una soluzione cristalloide isotonica sterile integrata con albumina sierica umana al 4%; vedere Tabella dei materiali). Al termine del raccolto, la sacca cellulare target conterrà 100 mL di prodotto cellulare nel tampone di formulazione finale. Aggiungere dimetilsolfossido (DMSO) a una concentrazione del 10% (v/v), aliquotare il prodotto in dosi singole e crioconservare utilizzando un congelatore a velocità controllata.
2° giorno: Preparazione e controlli pre-volo
- Verificare che i livelli di gas CO2 e l'aria compressa siano sufficienti a produrre una pressione di ingresso di almeno 20 psi su ciascuna linea.
- Accendere il processore e verificare che non vi siano errori all'avvio. Se necessario, impostare l'orologio sull'ora corretta. Spegnere il processore.
- Assicurarsi che la conta cellulare, il volume e la conta totale CD4+ e CD8+ totale del materiale di partenza delle cellule T siano noti.
- Assicurarsi che vi siano quantità sufficienti del vettore virale, dei reagenti e dei materiali di consumo per l'intero ciclo di produzione.
- Metti un flacone di siero AB umano in frigorifero per scongelare durante la notte.
3. Giorno 0: Installazione del set di tubi
- Preparare 3 L di tampone di processo (albumina sierica umana (HSA) allo 0,5 % (p/v) in soluzione salina tamponata con fosfato/tampone con acido etilendiamminotetraacetico (PBS/EDTA)).
- Preparare 2 L di terreno di coltura (2 L di terreno integrati con 100 mL di siero AB umano fino a una concentrazione finale del 5% e due flaconcini di IL2 umano ricombinante a 25 μg/flaconcino; vedere la Tabella dei materiali per maggiori informazioni su questi reagenti). Trasferire il terreno di coltura da 10 mL in una sacca per reagenti da 20 mL e conservare a 4 ºC per una notte.
- Accendere lo strumento e selezionare il processo di trasduzione delle cellule T (TCT) dall'interfaccia touch screen. Fare clic su Esegui per avviare il processo TCT; Lasciare che lo strumento guidi l'utente attraverso la procedura utilizzando le istruzioni e i prompt sullo schermo.
- Nella schermata Parameter Input (Immissione parametri ), immettere le iniziali dell'operatore, il numero di lotto del set di tubi e la relativa data di scadenza quando richiesto.
- La schermata Impostazione processo presenta quattro diversi processi. Scegliere Processo completo (1).
NOTA: Altri processi disponibili includono l'avvio da cellule T selezionate CD4+/CD8+ (vedere la sezione 5 di seguito) e il riavvio di un ciclo di produzione precedentemente interrotto. - Quando richiesto, scegliere due flaconcini di reagente di selezione in modo che riflettano il metodo di selezione CD4+/CD8+.
- Installare il set di tubi secondo le istruzioni sullo schermo. Assicurarsi che tutti i collegamenti Luer siano ben saldi e che non vi siano difetti nel set di tubi.
- Seguire le istruzioni sullo schermo per avviare i test di integrità superiori e inferiori automatizzati.
NOTA: Un test di integrità potrebbe fallire a causa di un set di tubi difettoso, di un set di tubi installato in modo errato o di un difetto nella pompa peristaltica della macchina. Si consiglia vivamente di avere a portata di mano almeno un set di tubi aggiuntivo per i cicli di produzione. Si consiglia inoltre a un secondo tecnico di verificare la corretta installazione del set di tubi. - Seguire le istruzioni sullo schermo per il fissaggio del supporto e la lavorazione dei sacchetti tampone.
- Iniziare l'adescamento automatico del set di tubi.
NOTA: Il processo TCT deve continuare entro 3 ore dall'adescamento. Assicurarsi che il materiale di partenza delle cellule T sia pronto.
4. Arricchimento delle cellule T
- Quando viene visualizzata la schermata del prodotto della cella di trasferimento , iniziare a scongelare il prodotto a base di cellule T crioconservate.
NOTA: Il volume accettabile di cellule T che possono essere aggiunte al set di tubi varia da 50 a 280 ml. Il numero massimo di cellule bersaglio (somma di CD4+ e CD8+) è 3 × 109 e il numero massimo di TNC è 2 × 1010. - Trasferire le cellule scongelate in una sacca di trasferimento da 150 ml. Saldare in modo sterile la sacca di trasferimento alla sacca di applicazione del set di tubi.
- Rimuovere un campione dalla sacca di applicazione utilizzando la sacca QC ed eseguire un conteggio delle cellule.
- Collegare le fiale di reagenti CD4 e CD8.
- Avviare il processo di selezione (arricchimento delle cellule T).
- Dopo l'arricchimento, rimuovere un campione delle cellule selezionate CD4+/CD8+ dalla sacca QC della sacca di riapplicazione per la conta cellulare, la citometria a flusso e l'analisi delle dimensioni delle cellule.
NOTA: il risultato del conteggio delle celle è necessario per procedere al passaggio successivo.
5. Alternativa: Iniziare con le cellule selezionate CD4+/CD8+
- Preparare il mezzo come descritto al punto 3.2. Non è necessario alcun buffer di elaborazione.
- Accendere il processore e selezionare Coltivazione di cellule T con installazione TS (3) nella schermata Process Setup (Impostazione processo ). Segui le istruzioni e le istruzioni sullo schermo.
- Seguendo le istruzioni sullo schermo, adescare il set di tubi con il mezzo invece del tampone di lavorazione.
- Quando viene visualizzata la schermata "Prepara il prodotto cellulare Coltivazione-Connect", iniziare a scongelare le cellule T selezionate CD4+/CD8+.
NOTA: Il numero minimo di cellule T (somma delle cellule T CD4+ e CD8+) per il processo è 1,0 × 108. - Trasferire le cellule in una sacca di trasferimento da 150 mL e diluire con un volume finale di 50 mL.
- Saldare sterile la sospensione cellulare alla sacca di riapplicazione dello strumento.
- Rimuovere un campione delle cellule selezionate CD4+/CD8+ dalla sacca QC della busta di riapplicazione per l'analisi della conta cellulare e delle dimensioni delle cellule.
6. Impostazione della cultura e programmazione della matrice delle attività
- Immettere la concentrazione cellulare e il numero iniziale desiderato (1-2 × 108 cellule T).
NOTA: Lo strumento pomperà automaticamente il volume appropriato dalla sacca di riapplicazione nella camera di coltura e regolerà il volume finale a 70 ml. - Collegare un flaconcino del reagente di attivazione seguendo le istruzioni sullo schermo.
- Immettere 5% per la concentrazione di CO2 e 39 °C per la temperatura della camera di coltura.
NOTA: Il produttore consiglia di inserire 39 °C o un valore specificamente calibrato per lo strumento. - Impostare la matrice delle attività. Utilizzare il protocollo di alimentazione avanzato come punto di partenza e modificare i singoli passaggi all'interno del protocollo in base alle specifiche definite dall'utente (Figura 2).
- Assicurarsi che il tempo di attività di trasduzione sia di 24 ore dopo la semina (Giorno 1).
- Assicurarsi che il tempo di attività di lavaggio colturale sia di 48 ore dopo la trasduzione (giorno 3).
- Impostare il tempo di attivazione dello shaker ( shaker tipo 2) a 30 minuti dopo l'inizio del lavaggio colturale.
- Elimina tutte le attività di Scambio Sacchi Medium e Scambio Sacchi Rifiuti .
- Tocca ok sullo schermo per iniziare la coltivazione.
- Crioconservare le cellule selezionate CD4+/CD8+ rimanenti nella sacca dell'applicazione per un uso futuro, se necessario.
7. Giorno 1: Trasduzione delle cellule T
- Calcolare il volume del vettore lentivirale da utilizzare in base al MOI desiderato.
- Recuperare la sacca di reagenti da 20 mL contenente 10 mL di terreno di coltura conservato a 4 ºC durante la notte (passaggio 3.2). Scongelare il flaconcino vettoriale e trasferire il volume calcolato in 7.1 nella sacca di reagenti da 20 mL.
NOTA: Si consiglia di congelare qualsiasi vettore residuo per la conservazione o per la ricerca e lo sviluppo. - Modificare la matrice Attività per impostare il tempo di trasduzione su 2 minuti nel futuro. Quando richiesto, toccare OK per avviare l'attività di trasduzione.
- Saldare sterile la sacca vettoriale al set di tubi seguendo le istruzioni sullo schermo.
- Modificare la matrice delle attività in base all'ora effettiva di avvio dell'attività di trasduzione.
NOTA: Si consiglia di iniziare la trasduzione entro 20-24 ore dalla semina per garantire che le attività pratiche vengano eseguite durante il normale orario di lavoro.- Assicurarsi che il tempo di lavaggio della coltura sia di 48 ore dopo la trasduzione (giorno 3).
- Impostare il tempo di attivazione dello shaker (shaker tipo 2) a 30 minuti dopo il lavaggio colturale (giorno 3).
- Assicurarsi che l'orario dello scambio multimediale sia nel pomeriggio (13:00) del giorno 6.
8. Giorno 6: Primo campione in corso di lavorazione
- Toccare il pulsante Campione e seguire le istruzioni sullo schermo per ottenere un campione QC dalla coltura attiva.
- Esegui analisi della conta cellulare, citometria a flusso e delle dimensioni delle cellule. Inviare 1 mL del campione per una colorazione di Gram.
NOTA: La conta cellulare deve essere ripetuta circa a giorni alterni per monitorare la crescita della coltura. - Preparare altri 2 L di terreno di coltura (vedere il punto 3.2).
- Aggiungi un'attività di Cambio Bagaglio Medio alla Matrice delle Attività, programmata per iniziare 2 minuti nel futuro. Modificare l'attività di Media Exchange in modo che inizi 20 minuti nel futuro. Seguire le istruzioni visualizzate sullo schermo.
NOTA: Lo scambio di terreni è la sostituzione del terreno di coltura nella camera di coltivazione. Medium Bag Exchange è la sostituzione della sacca media di coltura appesa allo strumento.
9. Giorno del raccolto (dal giorno 7 al giorno 13): raccolta e crioconservazione
- Toccare il pulsante Campione e seguire le istruzioni sullo schermo per ottenere un campione QC dalla coltura attiva.
- Separare il campione QC in tre aliquote da 1 mL ciascuna. Utilizzare 1 mL per la citometria a flusso, la conta cellulare e le analisi delle dimensioni cellulari. Utilizzare 1 mL per il micoplasma, il numero di copie del vettore, il lentivirus competente per la replicazione e il test delle endotossine. Inviare l'ultimo 1 ml per la colorazione di Gram.
- Preparare il tampone di formulazione finale (una soluzione cristalloide isotonica sterile integrata con HSA al 4 % in una sacca da 2 litri, vedere Tabella dei materiali). Conservare 100 mL di questo tampone per preparare la soluzione crioprotettiva in una fase successiva.
- Modificare la matrice delle attività per impostare l'ora di fine della cultura su 2 minuti nel futuro ed eliminare tutte le altre attività rimanenti. Seguire le istruzioni sullo schermo per collegare il tampone di formulazione finale al set di tubi e iniziare il raccolto.
NOTA: Il processore trasferirà automaticamente le celle nel sacchetto di celle di destinazione. Il volume sarà di 100 ml. - Prelevare un campione da 0,5 mL dalla busta QC della sacca per cellule Target ed eseguire un conteggio delle cellule.
- Sigillare la sacca di celle Target e rimuoverla dal set di tubi. Dividere il prodotto CAR-T in dosi appropriate e crioconservarle in un congelatore a velocità controllata. Conservare le celle nella fase vapore del serbatoio di stoccaggio dell'azoto liquido a ≤ -150 ºC.
NOTA: La formulazione finale e l'aliquota delle dosi sono specifiche del protocollo. Forniamo qui un esempio in cui tre dosi uguali di cellule CAR-T e fiale QC vengono crioconservate. Per ulteriori informazioni, vedere la sezione 10. - Scaricare i dati di processo dallo strumento, rimuovere e smaltire il set di tubi ed eseguire un arresto.
10. Crioconservazione di cellule CAR-T
NOTA: Questo protocollo presuppone che le cellule CAR-T siano crioconservate dopo la produzione e conservate fino a quando il paziente non è pronto per l'infusione. Sebbene sia possibile infondere cellule CAR-T appena prodotte, ciò aumenta l'onere logistico in quanto richiede il coordinamento della produzione di cellule CAR-T con l'infusione di cellule CAR-T. Questo può essere problematico in caso di errore di fabbricazione. Soprattutto se il protocollo clinico richiede la chemioterapia linfodepletiva prima dell'infusione di CAR-T, si consiglia vivamente la crioconservazione, perché un errore di fabbricazione può esporre il paziente al rischio di chemioterapia non necessaria. Le autorità di regolamentazione possono richiedere agli sperimentatori di dimostrare che il prodotto supera tutti i test di rilascio prima dell'infusione, il che può essere difficile da ottenere senza crioconservazione.
- Dai 100 ml finali di prodotto raccolto, determinare e rimuovere il volume necessario per soddisfare le dosi CAR-T desiderate e le fiale di controllo qualità (QC) per eseguire ulteriori test di rilascio (ad esempio, vitalità), ritenzione e un campione di sterilità.
NOTA: È fondamentale sviluppare una strategia completamente definita per l'aliquota del prodotto finale. Si consiglia di produrre più dosi del prodotto per consentire le reinfusioni, dato che è disponibile materiale sufficiente. Un volume di prodotto di 10-20 mL in una sacca consente un rapido scongelamento e una facile infusione con la pressione della siringa. Si raccomanda di riempire ciascun prodotto fino alla dose desiderata di cellule CAR-T (ad es. 5 × 106 cellule CAR-T per kg o 2,5 × 108 cellule CAR-T) in quanto ciò eviterà la necessità di calcolare la dose il giorno dell'infusione. Si raccomanda inoltre di crioconservare almeno quattro fiale di CQ e di tenere conto della possibilità che ci possa essere materiale residuo; Si consiglia di conservare questo materiale in quanto può essere utile per scopi di ricerca e sviluppo. - Centrifugare le celle per ridurne il volume.
- Portare il/i prodotto/i a metà del volume finale desiderato utilizzando la porzione di tampone di formulazione finale messa da parte nel passaggio 9.3.
- Preparare 2 crioprotettori creando una soluzione di DMSO al 20% nel tampone della formulazione finale.
NOTA: La formulazione del crioprotettore e la concentrazione di DMSO possono essere modificate. - Aggiungere 2x crioprotettore alle cellule allo stesso volume per una concentrazione finale di DMSO del 10%.
NOTA: La durata dell'esposizione del prodotto al crioprotettore deve essere ridotta al minimo. - Riempire le bustine dosatrici e i flaconcini QC. Inviare 1 ml per sterilità.
NOTA: I regolatori richiedono comunemente un test di sterilità di 14 giorni eseguito sul prodotto finale. Tuttavia, stanno emergendo test di sterilità rapidi; Al momento, il metodo compendiale di 14 giorni è il più comune. - Crioconservare i prodotti utilizzando un congelatore a velocità controllata.
NOTA: Il programma di congelamento a velocità controllata deve essere convalidato per produrre una velocità di raffreddamento da ~ -1 ºC/min a ~ -45 ºC, con compensazione del punto eutettico. - Conservare il prodotto in fase vapore di un ultracongelatore ad azoto liquido a ≤ -150 °C.
11. Esame dell'esecuzione della procedura
NOTA: Durante tutto il processo TCT, diversi campioni QC vengono prelevati dalla coltura attiva. La tabella 2 fornisce una griglia che può aiutare il lettore a organizzare i risultati come riferimento e a calcolare le metriche delle prestazioni della procedura. I termini seguenti, costituiti da una lettera e un numero (ad esempio, "B4") si riferiscono alle celle nella griglia di questa tabella. Nei calcoli delle prestazioni vengono utilizzati i seguenti valori: B3 = pre-arricchimento totale delle cellule nucleate (TNC); B4 = post-arricchimento TNC; E2 = La somma delle cellule T CD4+ e CD8+ come percentuale delle cellule totali del prodotto di aferesi iniziale; E4 = La somma delle cellule T CD4+ e CD8+ come percentuale delle cellule totali dopo l'arricchimento; G2 = cellule CD19+ come percentuale delle cellule totali del prodotto iniziale; G4 = cellule CD19+ come percentuale delle cellule totali dopo arricchimento CD4+/CD8+; B10 = TNC della coltura attiva il giorno del raccolto.
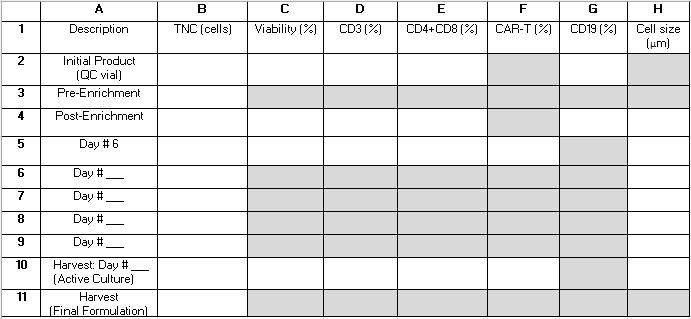
Tabella 2: Griglia delle prestazioni della procedura. Questa griglia viene fornita per aiutare a organizzare i risultati dei test in-process necessari per calcolare le statistiche sulle prestazioni della procedura. Le righe rappresentano i campioni analizzati in vari momenti durante la procedura e sono etichettate con i numeri da 1 a 11. Le righe 6-9 possono essere utilizzate per acquisire i risultati dei campioni prelevati dopo il 6° giorno di coltivazione, ma prima del giorno del raccolto. Le colonne rappresentano i parametri misurati e sono etichettate con le lettere A-H. I campi ombreggiati in grigio non vengono applicati. Alcuni campi aggiuntivi potrebbero non essere applicabili a seconda che l'arricchimento di CD4+/CD8+ venga eseguito come parte della procedura e della durata della coltivazione. Ti suggeriamo di scrivere "N/A" in questi campi. Abbreviazioni: TNC = conta totale delle cellule nucleate; QC = controllo di qualità. Clicca qui per scaricare questa tabella.
- Calcolare il recupero delle cellule CD4+/CD8+ dopo la selezione dividendo il numero totale di cellule T CD4+ più CD8+ dopo l'arricchimento per il numero totale di cellule T CD4+ più CD8+ prima dell'arricchimento utilizzando l'equazione (1).
Recupero delle cellule T CD4+/CD8+ =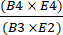 (1)
(1) - Calcolare la deplezione delle cellule CD19+ dopo l'arricchimento dividendo il numero totale di cellule CD19+ dopo l'arricchimento CD4+/CD8+ per il numero totale di cellule CD19+ prima dell'arricchimento. Poiché ci si aspetta che questo numero sia molto piccolo, riportare il logaritmo di questa frazione come mostrato nell'equazione (2):
Logaritmo deplezione delle cellule CD19 = logaritmo10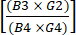 (2)
(2) - Calcolare la crescita totale della piega dividendo il numero totale di cellule in coltura attiva al momento del raccolto per il numero di cellule seminate utilizzando l'equazione (3):
Crescita totale della piega =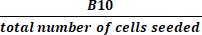 (3)
(3) - Calcolare la crescita media giornaliera prendendo la radice della crescita totale della piega rispetto al giorno del raccolto utilizzando l'equazione (4):
Crescita media giornaliera = giorno di raccolta √ (crescita totale delle pieghe) (4)
Risultati
I risultati dei primi tre cicli di produzione di CAR-T della prova NCT05480449 sono presentati di seguito nella Tabella 3. Il materiale di partenza, il vettore, le citochine di coltura e le concentrazioni sieriche AB sono state mantenute coerenti per ogni corsa. I prodotti sono stati raccolti il giorno 7 o 8. La crescita cellulare media giornaliera è stata del 46% (aumento del numero totale di cellule), indicando che il processo TCT è stato efficace nel promuovere l'espansione cellulare. Questi risulta...
Discussione
La terapia cellulare CAR-T è emersa come un approccio terapeutico promettente per le cellule B e altre neoplasie maligne. Tuttavia, i metodi tradizionali di produzione di celle CAR-T presentano diverse limitazioni, come i costi elevati, la produzione ad alta intensità di manodopera e le fasi aperte che aumentano il rischio di contaminazione. Recentemente, sono emerse diverse piattaforme semi-automatizzate, tra cui Miltenyi CliniMACS Prodigy (il "processore"), per affrontare queste limitazioni. Il processo di trasduzion...
Divulgazioni
S.K., S.G. e Y.W. hanno ricevuto supporto per la ricerca da Miltenyi Biotec.
Riconoscimenti
Gli autori desiderano riconoscere il contributo di diversi individui e organizzazioni a questo lavoro. Il Laboratorio di Terapia Cellulare e Genica e il Laboratorio di Studi Traslazionali e Correlativi della Penn hanno fornito una preziosa assistenza per lo sviluppo del processo e la preparazione per le richieste di IND. Melissa Varghese e Amanda DiNofia hanno contribuito allo sviluppo del processo e alla preparazione per le presentazioni IND che sono alla base di questo manoscritto. Questo lavoro è stato sostenuto da una sovvenzione di accelerazione della Cell and Gene Therapy Collaborative del Children's Hospital di Filadelfia. Gli autori desiderano inoltre ringraziare Miltenyi Biotec per il supporto tecnico e di ricerca. La Figura 1 è coperta da copyright © 2023 Miltenyi Biotec B.V. & Co. KG; Tutti i diritti riservati.
Materiali
| Name | Company | Catalog Number | Comments |
| 12 x 75 borosilicate tubes | Charles River | TL1000 | |
| 20 mL Reagent Bag | Miltenyi Biotec | 170-076-631 | |
| 50 mL Conical Tube | Fisher | 05-539-10 | |
| 150 mL Transfer Set | Fenwal | 4R2001 | |
| 2,000 mL Transfer Set | Fenwal | 4R2041 | |
| 7AAD | Fisher Scientific | BDB559925 | |
| Alcohol Prep | Tyco/Healthcare | ||
| Bag Access | Medline | 2300E-0500 | |
| CD19 APC-Vio770 REAfinity | Miltenyi Biotec | 130-113-643 | |
| CD19 CAR Detection Reagent Biotin | Miltenyi Biotec | 130-129-550 | |
| CD19 PE | BD | 555413 | |
| CD3 APC | BD | 340440 | |
| CD4 VioBright FITC REAfinity | Miltenyi Biotec | 130-113-229 | |
| CD45 VioBlue REAfinity | Miltenyi Biotec | 130-110-637 | |
| CD8 APC-Vio770 REAfinity | Miltenyi Biotec | 130-110-681 | |
| Cellometer Reference Beads 10um | Nexcelom | B10-02-020 | |
| Cellometer Reference Beads 15um | Nexcelom | B15-02-010 | |
| Cellometer Reference Beads 5um | Nexcelom | B05-02-050 | |
| Cellometer Slides | Nexcelom | CHT4-SD100-002 | |
| CliniMACS CD4 GMP MicroBeads | Miltenyi Biotec | 276-01 | The CD4 reagent |
| CliniMACS CD8 GMP MicroBeads | Miltenyi Biotec | 275-01 | The CD8 reagent |
| CliniMACS PBS/EDTA Buffer | Miltenyi Biotec | 130-021-201 | The buffer |
| DMSO | Origen | CP-10 | |
| Freezing Bag 50 mL | Miltenyi Biotec | 200-074-400 | |
| Freezing Vial, 1.8 mL | Nunc | 12565171N | |
| Freezing Vial, 4.5 mL | Nunc | 12565161N | |
| Human AB serum | Valley Biomedical | Sterile filtered, heat inactivated | |
| Human Serum Albumin 25% | Grifols | 68516-5216-1 | |
| Human Serum Albumin 5% | Grifols | 68516-5214-1 | |
| MACS GMP Recombinant Human IL-2 | Miltenyi Biotec | 170-076-148 | The cytokines |
| MACS GMP T Cell TransAct | Miltenyi Biotec | 200-076-202 | The activation reagent |
| MycoSeq Mycoplasma Detection Kit | Life Technologies | 4460623 | |
| Needles, Hypodermic 14G | Medline | SWD200573 | |
| Needles, SlideSafe 18G | BD | B-D305918 | |
| Pipet tips, 2-200 μL, individually wrapped | Eppendorf | 022492209 | |
| Pipet tips, 50-1000 μL, individually wrapped | Eppendorf | 022492225 | |
| Pipets 10 mL | Fisher | 13-678-27F | |
| Pipets 25 mL | Fisher | 13-675-30 | |
| Pipets 5 mL | Fisher | 13-678-27E | |
| Plasmalyte-A | Baxter | 2B2544X | The electrolyte solution |
| Prodigy TS520 Tubing Set | Miltenyi Biotec | 170-076- 600 | The tubing set |
| Sterile Field | Medline | NON21001 | |
| Streptavidin PE-Vio770 | Miltenyi Biotec | 130-106-793 | |
| Syringe 1 mL | BD | 309628 | |
| Syringe 10 mL | BD | 302995 | |
| Syringe 3 mL | BD | 309657 | |
| Syringe 30 mL | BD | 302832 | |
| Syringe 50 mL | BD | 309653 | |
| TexMACS GMP Medium | Miltenyi Biotec | 170-076-306 | The medium |
| Triple Sampling Adapter | Miltenyi Biotec | 170-076-609 | |
| Viral Vector | CHOP Clinical Vector Core | huCART19 | |
| Equipment | |||
| Biological Safety Cabinet | The Baker Co | ||
| Cellometer Auto 2000 | Nexcelom | ||
| CliniMACS Prodigy | Miltenyi Biotec | 200-075-301 | The processor |
| Controlled Rate Freezer | Planer/Kryosave | ||
| Endosafe nexgen-PTS150K | Charles River | ||
| Mettler Balance | Mettler | ||
| Refrigerated Centrifuge | Thermo Fisher | ||
| Refrigerated Centrifuge | Fisher Sci | ||
| SCD Sterile Tubing Welder | Terumo | ||
| Sebra Tube Sealer | Sebra | ||
| Varitherm | Barkey | The dry thaw device | |
| XN-330 Hematology Analyzer | Sysmex |
Riferimenti
- Maude, S. L., et al. Tisagenlecleucel in children and young adults with B-cell lymphoblastic leukemia. New England Journal of Medicine. 378 (5), 439-448 (2018).
- Shah, N. N., et al. Bispecific anti-CD20, anti-CD19 CAR T cells for relapsed B cell malignancies: A phase 1 dose escalation and expansion trial. Nature Medicine. 26 (10), 1569-1575 (2020).
- Maude, S. L., et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. New England Journal of Medicine. 371 (16), 1507-1517 (2014).
- Grupp, S. A., et al. Chimeric antigen receptor-modified T cells for acute lymphoid leukemia. New England Journal of Medicine. 368 (16), 1509-1518 (2013).
- Maude, S. L., et al. Efficacy of humanized CD19-targeted chimeric antigen receptor (CAR)-modified T cells in children and young adults with relapsed/refractory acute lymphoblastic leukemia. Blood. 128 (22), 217 (2016).
- Mock, U., et al. Automated manufacturing of CAR-T cells for adoptive immunotherapy using CliniMACS Prodigy. Cytotherapy. 18 (8), 1002-1011 (2016).
- Fernández, L., et al. GMP-compliant manufacturing of NKG2D CAR memory T cells using CliniMACS Prodigy. Frontiers in Immunology. 10 (10), 2361 (2019).
- Zhu, F., et al. Closed-system manufacturing of CD19 and dual-targeted CD20/19 chimeric antigen receptor T Cells using CliniMACS Prodigy device at an academic medical center. Cytotherapy. 20 (3), 394-406 (2018).
- Zhang, W., Jordan, K. R., Schulte, B., Purev, E. Characterization of clinical grade CD19 chimeric antigen receptor T cells produced using automated CliniMACS prodigy system. Drug Design, Development and Therapy. 12 (12), 3343-3356 (2018).
- Abou-El-Enein, M., et al. Scalable manufacturing of CAR T cells for cancer immunotherapy. Blood Cancer Discovery. 2 (5), 408-422 (2021).
- Miltenyi Biotec. . CliniMACS Prodigy User Manual. , (2021).
- Ghassemi, S., et al. Rapid manufacturing of non-activated potent CAR T cells. Nature Biomedical Engineering. 6 (2), 118-128 (2022).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Chemistry, manufacturing, and control (CMC) information for human gene therapy investigational new drug applications (INDs) guidance for industry. , (2020).
- U.S. Department of Health and Human Services, Food and Drug Administration. . Considerations for the development of chimeric antigen receptor (CAR) T cell products draft guidance for industry. , (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon